线粒体自噬影响巨噬细胞极化在脓毒症免疫调节中的作用及中医药干预研究进展
2024-01-01齐璐瑶邢基祥欧阳冰清李芸峰雷鸣

摘要:脓毒症是一种由感染引起的器官功能障碍综合征,具有高发病率、高致死率的特点,发病机制复杂,可触发连锁的免疫反应,且暂无特效药物。其治疗多采用抗生素、血流动力学管理、机械通气等西医支持治疗,但随着免疫连锁反应的出现,患者对继发感染的易感性显著增加,极易发展为脓毒症休克,预后较差。国际共识提出,在脓毒症确诊后的48 h内启动对患者免疫功能的动态监测可有效减缓脓毒症进程。大量研究指出,巨噬细胞作为先天免疫系统抵御病原体的第一道防线,可通过调控巨噬细胞极化与细胞因子的激活比例,在多种免疫系统疾病的治疗中发挥重要作用。而线粒体自噬作为近年来的研究热点,越来越多的证据表明,其在炎症信号传导的调节中起着关键作用。一方面,在炎症风暴期,促进线粒体自噬可减轻脓毒症难以控制的感染和过度炎症;另一方面,在免疫抑制期,抑制线粒体自噬可提高机体免疫力,促进清除细菌并提高患者存活率。中医作为祖国传统医学,其“治未病”的思想传承与现行脓毒症专家共识中“预防与阻断”的理念不谋而合。中药饮片提取物、中药复方及针灸等中医药治疗手段,从清热解毒、活血化瘀、扶正固本、通里攻下的治法入手,双向调节线粒体自噬相关蛋白磷酸酶及张力蛋白同源基因诱导激酶1、帕金森-E3泛素连接酶、轻链3、p62等的水平,动态调节巨噬细胞M1与M2的比例,达到预防、阻断甚至逆转脓毒症病情进展的效果,为脓毒症治疗提供一个未病先防、既病防变的新思路。
关键词:脓毒症;线粒体自噬;巨噬细胞极化;免疫调节;中医药
中图分类号: R278;R392;R-1" 文献标识码: A" 文章编号:1000-503X(2024)05-0720-12
DOI:10.3881/j.issn.1000-503X.15849
Role of Mitophagy Affecting Macrophage Polarization in Immunomodulationin Sepsis and Traditional Chinese Medicine Intervention:A Review
QI Luyao XING Jixiang OUYANG Bingqing LI Yunfeng LEI Ming1
1Intensive Care Unit,Shanghai Seventh People’s Hospital of Shanghai University of Traditional Chinese Medicine,Shanghai 200137,China
2Graduate School,Tianjin University of Traditional Chinese Medicine,Tianjin 301617,China
Corresponding author:LEI Ming Tel:13764950647,E-mail:leiming6891@163.com
ABSTRACT:Sepsis,a syndrome characterized by organ dysfunction caused by infection,exhibits high incidence and mortality.The pathogenesis of sepsis is complex and involves a cascade of immune reactions,with no specific drugs currently available.Sepsis is mainly treated with Western medical supportive therapies such as antibiotics,hemodynamic management,and mechanical ventilation.However,the occurrence of immune cascades significantly increases patients’ vulnerability to secondary infections,leading to septic shock and unfavorable prognoses.International consensus indicates that initiating dynamic monitoring of patients’ immune function within 48 h post-sepsis diagnosis can effectively decelerate sepsis progression.Extensive studies have indicated that macrophages,serving as the first line of defense in the innate immune system against pathogens,play a vital role in treating immune system disorders by regulating macrophage polarization and the ratio of cytokines activated.Mitophagy,a hot topic in recent years,has increasingly been shown to play a crucial role in regulating inflammatory signal transduction.Promoting mitophagy during the stage of cytokine storm can mitigate uncontrolled infection and excessive inflammation in sepsis,and inhibiting mitophagy during immunosuppression can enhance host immunity,facilitate bacterial clearance,and improve the survival rate of patients.The idea of treating disease before its onset in traditional Chinese medicine (TCM) coincides with the current consensus among sepsis experts on prevention and interception.The TCM therapies such as extracts of Chinese medicine decoction pieces,TCM compound prescriptions,and acupuncture and moxibustion have the effects of clearing heat and detoxifying,activating blood and resolving stasis,reinforcing healthy qi and consolidating root,and purging.These approaches dynamically regulate the levels of mitophagy-related proteins,such as phosphatase and tension homology-induced putative kinase" Parkin-E3 ubiquitin protein ligase,light chain" and p6 while maintaining a suitable ratio between M1 and M2 macrophages.Consequently,they effectively prevent,halt,or even reverse the progression of sepsis,offering a novel perspective on sepsis management by emphasizing prevention before disease onset and controlling development of existing disease.
Key words:sepsis;mitophagy;polarization of macrophages;immunomodulation;traditional Chinese medicine
Acta Acad Med Sin,2024,46(5):720-731
脓毒症是一种宿主对感染的反应失调,引起危及生命的器官功能障碍综合征,发病机制极其复杂,包括炎症反应失衡、免疫功能障碍、线粒体损伤、凝血障碍、神经内分泌传导异常、自噬等病理生理过程,涉及体内多个器官功能的变化[1]。机体在此期间会触发复杂的免疫反应,由免疫亢进的细胞因子风暴到后期免疫抑制、免疫缺陷[2],若管控不佳,极易合并循环和细胞代谢紊乱,发展为脓毒症休克,显著增加患者死亡率[3]。2020年发表的研究显示,因脓毒症致死的病例约占全球死亡人数的19.7%[4]。我国脓毒症的住院年标准化发病率也呈逐年递增态势,国民和财政负担进一步增加[5]。最新脓毒症免疫检测与治疗专家共识推荐,在脓毒症确诊48 h内即开始对患者免疫功能进行动态监测,早期识别免疫功能紊乱,对免疫状态尽早评估、管控,可有效减缓脓毒症进程,改善患者预后[6]。近年来针对脓毒症的研究也越来越多地关注其免疫功能障碍的调节[7]。但西医对于脓毒症免疫功能障碍并没有很好的解决办法,指南中提及到的胸腺法新与免疫球蛋白都仅仅是弱推荐或不推荐[6]。中医药作为祖国传统医学,其“治未病”的理论基础与我国现行的脓毒症专家共识中“预防与阻断”[8]的理念不谋而合。因此,探索行之有效的中医药干预措施,及早调节脓毒症患者的免疫功能,使其在免疫抑制发生之前即被有效阻断,是全球范围内亟待解决的公共卫生问题。
1 线粒体自噬与巨噬细胞极化概况
1.1 线粒体自噬
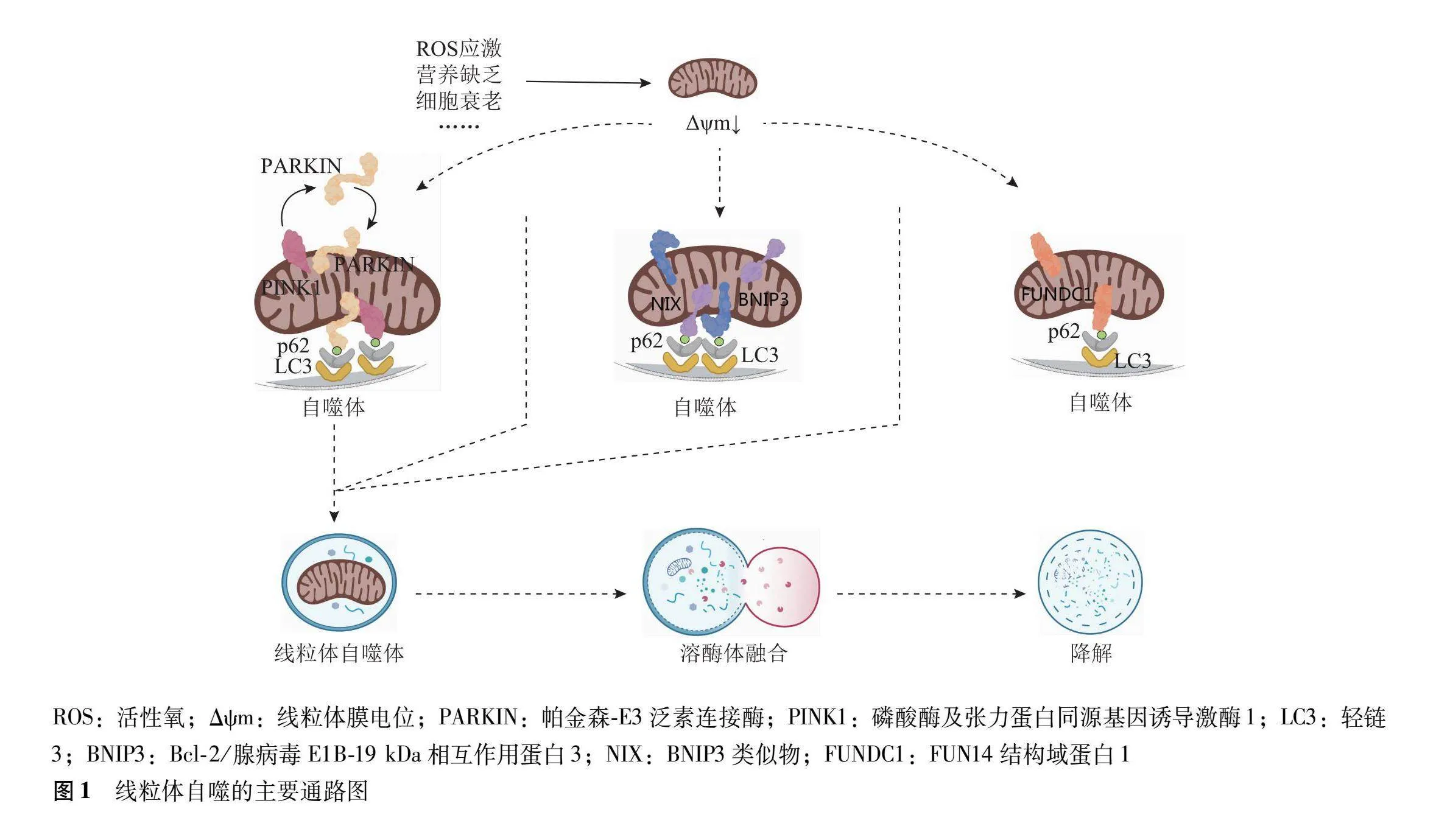
线粒体是活细胞有氧呼吸的主要场所,线粒体功能正常是维持机体代谢能量供应的基础,是免疫信号传导不可或缺的一部分,而其自噬的稳态则是维持线粒体功能正常的基石[9]。线粒体自噬是指在活性氧(reactive oxygen species,ROS)应激、营养缺乏、细胞衰老等外界刺激的作用下[10],诱导膜内吞噬泡的分离、封闭和溶酶体途径降解的选择性自噬过程,可清除受损或多余的线粒体,维持线粒体数目和质量的平衡,是线粒体质量控制的重要一环,与神经退行性病变、癌症、心血管疾病等多种疾病的发生发展密切相关[11]。有文献证实,线粒体自噬是一种具有双重作用的过程,其机制复杂,既存在潜在的益处,也伴随一定的风险,因此,未来的研究应着重于如何最大化其正面效应[12]。Bcl-2/腺病毒E1B-19 kDa相互作用蛋白3(Bcl-2/adenovirus E1B-19 kDa interacting protein" BNIP3)及其类似物(BNIP3-like protein X,NIX)和含FUN14结构域蛋白1(functional domain containing protein" FUNDC1)是介导哺乳动物生理和病理条件下线粒体自噬最主要的两组受体,磷酸酶及张力蛋白同源基因诱导激酶1(phosphate and tension homology induced putative kinase" PINK1)/帕金森-E3泛素连接酶(Parkin-E3 ubiquitin protein ligase,PARKIN)是目前公认的介导线粒体自噬体形成、自噬衔接子募集、TANK结合激酶1驱动自噬受体磷酸化等过程的相关通路[13](图1)。
1.2 巨噬细胞极化
巨噬细胞作为先天免疫系统抵御病原体暴露的第一道防线,能通过吞噬作用发挥关键的宿主防御机制,募集其他免疫细胞到感染部位,激活血清补体系统和适应性免疫反应,吞噬和消灭外来病原体,从而发挥免疫调控的作用[14-15]。有观点认为,未极化的巨噬细胞(M0型)极化后主要表现为介导促炎反应的经典活化巨噬细胞(M1型)和介导抗炎反应的替代活化巨噬细胞(M2型),其中,M1型巨噬细胞主要受脂多糖(lipopolysaccharide,LPS)诱导,分泌肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β、IL-6、IL-8、IL-12等细胞因子,以CD80、CD86、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)为主要表面标志物,引起炎症反应,吞噬和杀灭病原体;M2型巨噬细胞主要受IL-4等诱导,分泌IL-10、转化生长因子(transforming growth factor,TGF)-β、血管内皮生长因子(vascular endothelial growth factor,VEGF)等细胞因子,以CD206、CD163、精氨酸酶(arginase,Arg)-1为主要表面标志物,减轻炎症反应,促进组织修复和再生[16](图2)。研究表明巨噬细胞可分为3种功能亚群:宿主防御巨噬细胞(类似M1型)、伤口愈合巨噬细胞(类似M2型)和免疫调节巨噬细胞(由调节性T细胞、记忆性CD4+ T细胞等细胞分泌的因子介导,主要表现为免疫调节、免疫耐受和免疫抑制),同一巨噬细胞可能存在两种亚群特征,且不同功能亚群之间可以相互转化,巨噬细胞极化状态的转变在病原体感染、肿瘤、自身免疫性疾病等多种疾病的免疫应答中具有重要作用[17]。目前个性化巨噬细胞靶向策略在疾病治疗中的研究较多[18]。
2 线粒体自噬调控巨噬细胞极化在脓毒症中的作用
2.1 巨噬细胞极化在脓毒症中的作用
巨噬细胞作为先天免疫系统的哨兵细胞,起源于造血干细胞,由单核细胞进入受损组织后转变而成,随外周血分布于肝脏、心脏、肺脏、脾脏、肾脏、脑、皮肤和血管内皮等各个靶器官,负责IL-1β、IL-6、IL-8、IL-12、IL-18、IL-33、TNF-α、粒细胞-巨噬细胞集落刺激因子、巨噬细胞迁移抑制因子、单核细胞趋化蛋白-1(monocyte chemoattractant protein- MCP-1)、IL-1ra、TGF-β、前列腺素E2等多种细胞炎症因子[19]及干扰素、补体等活性物质的释放,其活化失调可直接影响脓毒症的结局[20-21]。
脓毒症早期,机体内的γ-干扰素(interferon-γ,IFN-γ)和LPS等促炎因子诱导巨噬细胞向M1型极化,释放大量炎症因子,如IL-1、TNF-α、IL-6、ROS、iNOS等,引起全身严重的炎症因子风暴,损伤脓毒症靶器官,造成连锁的脏器功能障碍[22]。研究发现,脓毒症巨噬细胞受到刺激时,细胞因子基质金属蛋白酶-9的表达水平显著增加,与疾病严重程度呈正相关[23];巨噬细胞产生的TNF-α和IL-1β可在脓毒症期间激活中性粒细胞,其中,多形核中性粒细胞可分泌外泌体miR-30d-5p,通过激活核因子κB(nuclear factor-κB,NF-κB)信号通路诱导细胞焦亡,发生组织病理性改变,促进脓毒症相关急性肺损伤[24]。此外,巨噬细胞表面的Toll样受体4(Toll-like receptor 4,TLR4)可通过介导NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路调节巨噬细胞从M1型向M2型的极化,维持组织中的线粒体动力学平衡,减少氧化应激和细胞凋亡,减轻脓毒症诱导的心肌损伤[25]。在治疗方面,前期研究显示,靶向巨噬细胞递送miR-21使其重编程(减少M1型且激活M2型),减轻巨噬细胞表型的炎症调节,可逆转心肌重塑,防止血管缺血再灌注损伤[26];通过Krüppel样转录因子14抑制己糖激酶2调节巨噬细胞糖酵解,也可显著降低小鼠体内的炎症水平,提高脓毒症小鼠的存活率[27]。
相反,脓毒症晚期,M1型巨噬细胞分泌减少,M2型巨噬细胞分泌过剩,或M1、M2型巨噬细胞分泌均受抑制,诱导宿主进入免疫抑制状态,此时,机体对机会性和院内继发感染的易感性显著增加[28]。采用盲肠结扎穿孔术构建的脓毒症小鼠模型从剧烈炎症到免疫抑制的转折点出现在结扎后24 h内[29-30]。临床观察发现,与未出现免疫麻痹的患儿相比,存在免疫麻痹的脓毒症患儿外周血单核细胞线粒体呼吸更低,且表现出更高水平的全身炎症反应[31]。在一项双盲、随机对照的临床研究中,因肺部感染、菌血症或急性胆管炎引起脓毒症的240例患者接受了血清铁蛋白和人类白细胞抗原-DR(human leukocyte antigen-DR,HLA-DR)/CD14的检测,结果发现,与未出现免疫麻痹的患者相比,出现免疫麻痹患者的死亡率更高[32]。
2.2 线粒体自噬调控巨噬细胞极化的作用
线粒体作为巨噬细胞极化能量的主要提供者,在其功能正常时,产生细胞代谢所需的ATP;当其被损伤破坏时,产生ROS,启动线粒体自噬。线粒体自噬本是一种自身保护措施,细胞可以通过清除受损线粒体,阻止蛋白堆积,抑制ROS生成,维持线粒体的数量和质量稳态,维持细胞的正常生理功能[33]。然而,当线粒体自噬程度过高时,会导致线粒体消除过多,引起线粒体缺乏和机体行为障碍,如表现出焦虑样和抑郁样行为等[34]。线粒体的自噬作用在巨噬细胞极化调控机制方面的研究较多[35-36]。越来越多的证据表明,线粒体自噬在炎症信号传导的调节中起着关键作用,有望作为脓毒症感染先天免疫的治疗靶点[37]。
有研究表明,内体衔接蛋白APPL1缺失抑制线粒体自噬,会导致受损线粒体累积,产生ROS和氧化的细胞膜线粒体脱氧核糖核酸,引发巨噬细胞中核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein" NLRP3)炎性小体的过度激活,使全身性半胱氨酸天冬氨酸特异性蛋白酶(cysteinyl aspartate specific protease,Caspase)-1活性增强,IL-1β产生和分泌增加,是内毒素诱导产生脓毒症细胞炎症因子风暴的重要机制[35]。在LPS诱导的脓毒症小鼠模型中,自噬关键调控蛋白复合物Beclin-1特异性过表达,可通过抑制线粒体损伤相关分子模式的释放和激活PINK1/PARKIN信号通路促进线粒体自噬,减轻LPS诱导的M1型巨噬细胞极化引起的难以控制的感染和过度炎症,改善脓毒症小鼠的心肌纤维化及心脏功能,而抑制线粒体自噬则会产生相反的效果[38-39]。泛素特异性蛋白酶19可以通过增加自噬通量和减少线粒体ROS的产生来抑制NLRP3炎症小体活化,进而促进M2型巨噬细胞极化,是炎症干预的潜在治疗靶点[40]。
另有研究表明,抑制线粒体自噬是一种有助于激活髓系细胞并改善脓毒症预后的生理机制,采用PINK1缺失的骨髓或药物抑制线粒体自噬促进巨噬细胞活化,有利于清除细菌并提高存活率;若改用促进线粒体自噬的线粒体解偶联剂,则会逆转LPS/IFN-γ介导的巨噬细胞活化,导致免疫麻痹,使细菌清除能力受损,存活率降低[36]。
由此可见,调控线粒体自噬与巨噬细胞极化的关系对脓毒症治疗至关重要,但西医在介入时机上存在争议,因这两者之间可能存在动态的正负双向调控。而中医药的“治未病”理念与“双向调控”的作用机制在此时显得尤为关键。
3 中医药调控线粒体自噬影响巨噬细胞极化在脓毒症免疫调节中的应用
传统中医古籍中并未见对脓毒症病名的描述,但其症状可归为“外感热病”“伤寒”“温病”的范畴,且脓毒症免疫力低下通常与脾气不足有关,脾胃功能障碍,水谷精微不能输布,加之先天不足,气血失调,“邪之所凑,其气必虚”。近现代中医学家认为“毒”“瘀”“虚”是脓毒症进展的三部曲,正气亏虚一直贯穿疾病始终,毒热炽盛证、瘀血阻滞证、急性虚证与腑气不通证及其各自治法为代表的“四证四法”理论是脓毒症中医辨证治疗的基本理论体系[41-42]。中医药在疾病发展的不同阶段,均能起到“防、控、治、康”四大作用[43-44],且中药及针灸在疾病治疗中常能“损其有余、补其不足”,在疾病变化过程中起到双向调控的作用[45],既能清热解毒纠正炎症反应[46],又能补益正气缓解免疫抑制[47]。
3.1 中药饮片提取物
随着中医药研究的深入,中药分离、提取技术得到了长足发展,实现了有效、无毒、一致、稳定的中药单体成分的制备和分析,研究者对中药饮片成分中各种提取物的关注日渐提高[48]。
在促进线粒体自噬和巨噬细胞向M2型极化发挥抗炎功能方面,雷公藤内酯通过自噬与凋亡的相互作用,增加酸性空泡、轻链3(light chain" LC3)和自噬相关基因(autophagy-related gene,ATG)蛋白的表达,刺激ROS产生,激活Caspase酶家族与细胞程序性死亡(特别是凋亡),提高线粒体膜电位(mitochondrial membrane potential,MMP),增强T细胞、B细胞、单核细胞和巨噬细胞群的吞噬作用,发挥抗炎、抗增殖、促凋亡和增强免疫的功能[49]。槲皮素作为一种天然多酚类黄酮,可通过促进线粒体自噬抑制过量ROS介导的小胶质细胞NLRP3炎症小体活化,预防神经元损伤[50];同样,黄芩苷可以显著下调LC3 Ⅱ/Ⅰ、p62和外膜转位酶20的水平,上调NIX、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)和过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor gamma coactivator 1-alpha,PGC-1α)的水平,改善海马神经元线粒体自噬,减轻小鼠抑郁样行为[51]。人参根提取物通过蛋白激酶B(protein kinase B,Akt)-哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路诱导自噬,缓解过度氧化、线粒体功能障碍和炎症,增强Beclin-1、LC3 Ⅱ和ATG7蛋白的表达,显著抑制LPS诱导结肠炎的损伤程度,发挥与NF-κB和氨基末端激酶抑制剂类似的作用[52]。
在抑制线粒体自噬维持M1型巨噬细胞分泌增强机体免疫力方面,有研究指出,C21甾体苷是大戟的主要活性成分,通过诱导线粒体功能障碍和ROS积累,启动线粒体自噬依赖性细胞凋亡,抑制ATP1A1-Akt/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路,调节炎性细胞因子的释放,促进M2型巨噬细胞极化,增强吞噬作用,杀灭病原体,在病毒感染、癌症、白血病、惊厥等方面疗效显著[53-54]。此外,隐丹参酮作为丹参的主要脂溶性提取物,其抗肿瘤、抗氧化、抗炎、抗菌等活性同样不容小觑[55],可作为抗肿瘤免疫调节剂,通过细胞凋亡信号调节激酶1(apoptosis signal-regulated kinase" ASK1)途径抑制线粒体氧化磷酸化和融合,抑制M2型巨噬细胞分化,同时触发ASK1的TNF受体相关因子6的自泛素化依赖性激活,促进ASK1的泛素化和降解,有助于将肿瘤相关巨噬细胞向M1型转变,导致肿瘤消退[47]。
在线粒体自噬与巨噬细胞极化的双向调控方面,诸多中药提取物也展示出较好的效果。芍药苷作为水溶性单萜甙,具有浓度和功能依赖性的双向免疫调节作用,一方面,通过提高MMP和减少ROS积累,修复受损线粒体;另一方面,通过上调PINK1、PARKIN、BNIP3、p62和Krüppel样转录因子4的表达,抑制M1型巨噬细胞标志物(CD68、iNOS、IL-6、IL-1β、TNF-α、MCP-1等)的浸润,增加M2型巨噬细胞标志物(CD206、Arg1、FIZZ1、IL-10和Ym-1等)的比例,保护肾脏组织免受炎症损伤[46]。葛根素对线粒体自噬亦可以起到双向调控作用,一方面,通过调节动态相关蛋白1(dynamin-related protein" Drp1)和丝裂霉素 逆转LPS导致的线粒体酶活性、一磷酸腺苷、二磷酸腺苷和ATP水平的降低,介导p62、LC3B、PINK1和PARKIN促进H9C2细胞的线粒体自噬,防止脓毒症对心血管系统产生不利影响[56];同时,其通过激活PI3K-Akt-mTOR信号通路,逆转MMP水平和ATP含量,抑制FUNDC1介导的线粒体自噬,与线粒体分裂抑制剂Mdivi作用类似,可保护细胞免受氧化损伤[57]。
另外,近年研究发现青蒿叶提取物[58]、绞股蓝苷[59]、三七皂苷R1[60]、漆黄素[61]、伪麻黄碱及大黄素[62]等众多中药提取物均可通过调控自噬途径显著改善线粒体代谢功能,调节巨噬细胞极化状态,清除细胞毒性物质,缓解脓毒症引起的炎症反应和免疫抑制,保护神经、血管内皮和组织,有效拮抗脓毒症的免疫失调,抑制脓毒症对脏器的损伤。
3.2 中药复方
中药复方以“君臣佐使”为主要配伍原则,根据患者的个体病情,从整体视角出发达到同病异治、异病同治的效果[63]。
针对脓毒症毒热炽盛证,葛根芩连汤(葛根、黄芩、黄连、甘草)可发挥其作为外感表证未解、热陷阳明经典方的作用,解表清里、抗炎抑菌、降糖降脂、抗氧化等[64];Wang等[65]观察到非酒精性脂肪肝小鼠在服用葛根芩连汤后,线粒体自噬蛋白(如PINK、PARKIN、LC3B、p62、BNIP3、FUNDC1、Beclin-1、抑制素2和线粒体融合蛋白1等)的表达显著增加,而磷酸化Drp1的表达显著降低;此外,巨噬细胞浸润标志物(F4/80、CD11b)和M1型巨噬细胞极化标志物(CD11c、CCR7)的表达减少,M2型巨噬细胞极化标志物(CD163、CD206)的表达增加,且M2/M1的比值增高,促炎细胞因子和NLRP3炎症小体显着减少。若合并阳明腑实,凉膈散(大黄、连翘、黄芩、薄荷、栀子、朴硝、甘草)则是最佳选择,其尤擅清上、中焦之郁热,泻火解毒通便,能通过下调炎症趋化通路相关的特征基因糖原合成酶激酶(glycogen synthase kinase,GSK)-3β mRNA的表达,促进GSK-3β磷酸化失活,诱导M1型巨噬细胞极化为M2型,减轻中性粒细胞浸润和机体的炎症损伤,是治疗脓毒症的一种有前途的候选药物[66]。
大明胶囊(大黄、决明子、丹参、陈皮、人参、茯苓)和桃红四物汤(桃仁、红花、熟地、当归、川芎、芍药)常用于应对脓毒症瘀血阻滞证。大明胶囊具有清热降浊、活血化瘀之功效,可增加线粒体自噬受体核苷酸结合寡聚化结构域样受体X1的表达,降低线粒体和溶酶体共定位以及MMP,增加线粒体ROS的积累,激活沉寂信息调节因子/AMPK信号通路,抑制心肌细胞的炎症反应和氧化应激,减少心肌细胞凋亡,改善心脏功能[67]。桃红四物汤则可通过增强线粒体自噬和抑制NLRP3炎症小体的活化,保护PC12细胞免受氧糖剥夺再灌注损伤,提高细胞的存活率[68]。
对于脓毒症后期免疫抑制引起的急性虚证,补阳还五汤(黄芪、当归、赤芍、川芎、桃仁、红花、地龙)具有补气、活血、通络之功效,采用高剂量(20 mg/kg)可以通过抑制CD45免疫细胞浸润,显著减少心肌细胞凋亡,缓解炎症微环境,提高脓毒症小鼠的存活率;其关键分子芍药甙和毛蕊异黄酮苷可抑制NF-κB信号通路,上调TGF-β通路,抑制局部巨噬细胞聚集与免疫细胞浸润,促进M2型巨噬细胞极化,缓解脓毒症心肌损伤[69]。与之相辅相成,益气健脾方(黄芪、太子参、当归、女贞子、茯苓、白术、陈皮、黄芩、甘草)专注补脾益气、滋养气血,可改善急慢性肝衰竭大鼠模型外周血淋巴细胞数量和CD8+ T淋巴细胞比例,增加促炎因子(IL-2、IFN-λ和TNF-α),减少抗炎因子(IL-10和TGF-β1),改善CD8+ T淋巴细胞的新陈代谢和线粒体平衡,通过促进自噬缓解淋巴细胞免疫功能障碍,促进PGC-1α、核呼吸转录因子1和线粒体转录因子A的表达,调节自噬和线粒体生物发生之间的关系,改善免疫抑制,促进免疫应答平衡[70]。
腑气不通证常伴随其余三证出现,大承气汤(大黄、枳实、厚朴、芒硝)可作为首选[41],其主要成分木犀草素、芦荟大黄素、柚皮素等[71],通过促进维生素D受体表达,减轻LPS诱导的脓毒症相关急性肺损伤小鼠肺组织或肺泡巨噬细胞的焦亡与NLRP3炎症小体的激活,提高ATG16L1、Beclin1等自噬蛋白的表达,增强其自噬反应,降低肺泡巨噬细胞的炎症水平[72]。对于肠源性脓毒症小鼠多器官功能损伤,大承气汤可通过抑制全身炎症与凋亡、下调TLR4/髓样分化因子88(myeloid differentiation factor 88,MyD88)信号通路等,明显降低小鼠脓毒症评分与TNF-α、IL-6的水平[73],提高7 d生存率[74]。
3.3 针灸
针灸以其“简、便、廉、验”的特点,广泛应用于多种疾病的治疗,包括改善血液循环、促进新陈代谢、调节免疫功能和缓解疼痛等[75-77]。其经络理论的科学性不断得到证实[78],穴位的选择性、区域特异性、神经解剖学基础、刺激强度和针刺深度等成为研究热点[79]。研究表明,电针刺激(electrical stimulation,ES)通过体细胞和强度依赖性方式驱动交感神经通路,低强度ES在后肢区域激活迷走神经-肾上腺轴,产生依赖于神经肽Y+肾上腺嗜铬细胞的抗炎作用;高强度ES在腹部通过脊髓交感轴激活神经肽Y+脾脏去甲肾上腺素能神经元,参与前馈调节环路,产生抗炎或促炎效应[80]。
在脓毒症免疫调节方面,三阴交和吲哚美辛联合治疗可降低LPS暴露大鼠的炎症细胞浸润、血管通透性和髓过氧化物酶活性[81]。本课题组前期研究也发现,包括足三里、天枢、上巨虚穴在内的“肠三针”可通过调控瞬时受体电位香草酸亚型1/降钙素基因相关肽信号通路,显著增加脓毒症大鼠肠道菌群多样性及有益菌群含量,减少肠道细菌移位,降低炎症反应[82]。足三里是提高脓毒症免疫功能的经验效穴,具有抗炎、增强免疫、抗氧化、加速胃肠道疾病恢复等作用,能显著降低TLR4和NF-κB的表达,上调CD3+、CD4+和CD8+淋巴细胞的浸润,恢复CD4+/CD8+比值,通过迷走神经激活控制全身炎症,对脓毒症心脏、肺脏、肾脏、颅脑等脏器损伤有明显疗效,显著提高脓毒症动物生存率[83]。合谷穴电针预处理通过激活中枢神经系统中的毒蕈碱型受体,显著减弱致死性脓毒症大鼠的全身炎症反应,将存活率从20%提升至80%,有望成为脓毒症或与过度炎症相关围手术期疾病的预防性治疗手段[84]。天枢穴在改善脓毒症患者胃肠功能方面效果显著[85],而肠道免疫屏障在调节先天性和适应性免疫反应中发挥着关键作用[86],由此推测,天枢穴的整体免疫调节作用可能是通过改善胃肠功能从而增强肠道免疫屏障实现的。膈俞穴能通过ES抑制TLR4/MyD88信号通路,减轻与免疫炎症相关的认知障碍[87]。ES还能提高脓毒症患者单核细胞HLA-DR和T细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)的水平[88],并产生镇痛作用,其镇痛机制可能与中性粒细胞募集释放β内啡肽[89],或与脂肪素/脂肪素受体2介导的AMPK通路抑制脊髓中脂肪素受体干扰RNA的表达有关[90]。此外,ES对焦虑[91]和抑郁[92]情绪有良好的靶向作用,对多发性硬化症[93]、免疫性肠炎[94]等自身免疫性疾病也有显著疗效,可减少复发、调节免疫屏障、改善生活质量。
在线粒体自噬方面,电针显著增加脑缺血再灌注患者的MMP和ATP,改善线粒体功能,减少神经元损伤,通过PINK1/PARKIN介导的线粒体自噬清除硝基或氧化应激诱导的线粒体功能损伤,减少受损线粒体的积累,保护神经元免受脑缺血再灌注损伤[95]。电针能通过增加精神分裂症相关基因1的表达,促进线粒体自噬,增强β淀粉样蛋白的清除率,减轻海马神经元细胞的细胞毒性,改善糖尿病大鼠的学习和记忆功能[96]。电针预处理还能通过抑制mTORC1/Unc-51样激酶1/FUNDC1信号通路介导的细胞凋亡和线粒体自噬,保护心肌免受心肌缺血再灌注损伤,降低室性心律失常评分和肌酸激酶同工酶MB型、乳酸脱氢酶和心肌特异性肌钙蛋白T的水平[97]。
4 总结及展望
巨噬细胞极化是巨噬细胞在不同刺激因素下发生的形态与功能的改变,M1型巨噬细胞分泌TNF-α、IL-6等炎性因子,增强吞噬作用与抗菌活性;M2型巨噬细胞分泌IL-10、TGF-β等抗炎因子,介导机体细胞修复与组织重塑。线粒体自噬作为巨噬细胞极化的重要影响因素,其调控失常可能是脓毒症的潜在诱因。针对线粒体自噬失常的干预具有治疗潜力[98],激活或抑制线粒体自噬对巨噬细胞极化的正负双向调节在脓毒症治疗的不同阶段均能起到积极作用。
中医药治疗手段,如中药单体、复方及针灸,基于补虚泻实、清热温寒、标本兼治的原则,通过清热解毒、活血化瘀、扶正固本、通里攻下等方法,达到扶正祛邪、调和阴阳、疏通经络、调理脏腑的作用。这些方法通过调节MMP与线粒体自噬相关蛋白(如PINK1、PARKIN、LC3、p62)的水平,调控巨噬细胞的吞噬作用,动态平衡M1与M2的比例,影响细胞因子和细胞标志物的表达,缓解过度氧化、炎症和器官功能障碍。在脓毒症前期,中医药可抑制细胞炎症风暴;在脓毒症后期,可提高机体免疫力,这种双向调控机制使人体机能处于动态平衡状态,防止病情从毒热炽盛证向瘀血阻滞及急性虚证转化,提前阻断脓毒症的进展,提供了一个未病先防、既病防变的新思路。
然而,目前针对中医药防治脓毒症免疫功能紊乱的临床及基础研究较少,存在一定的局限性,如临床指标多局限于某一时间点的变化、缺乏对中医药免疫调节的动态监测、临床检测手段难以观测线粒体层面指标的波动。未来研究需加快中医药在调控线粒体自噬影响巨噬细胞极化进而调节脓毒症免疫功能方面的临床与基础研究进度,开展网络大数据与中医经典结合的数据挖掘,探索有效的治疗手段。同时,结合大样本、多中心的临床动态监测随访和体内外基础实验,探索更多样化、精准化的信号通路及其上下游分子机制。此外,需与单细胞测序、多组学分析等新技术相结合,实现中医药手段临床治疗机制的可视化,为脓毒症治疗提供新的视角和科学依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 齐璐瑶:负责论文的选题、设计、写作及质量控制;邢基祥:负责论文初稿图片的绘制、并协助稿件的修改;欧阳冰清、李芸峰:查阅并整理相关文献;雷鸣:负责解答学术问题、协助稿件的返修、确保最终版本的质量、并同意対研究工作诚信负责
参 考 文 献
[1]Huang M,Cai S,Su J.The pathogenesis of sepsis and potential therapeutic targets[J].Int J Mol Sci,2019,20(21):5376.DOI:10.3390/ijms20215376.
[2]Zhang H,Jie Z,Gao P,et al.Editorial:immune regulation in sepsis[J].Front Immunol,202 14:1298777.DOI:10.3389/fimmu.2023.1298777.
[3]Singer M,Deutschman CS,Seymour CW,et al.The third international consensus definitions for sepsis and septic shock (sepsis-3)[J].JAMA,2016,315(8):801-810.DOI:10.1001/jama.2016.0287.
[4]Rudd KE,Johnson SC,Agesa KM,et al.Global,regional,and national sepsis incidence and mortality,1990-2017:analysis for the global burden of disease study[J].Lancet,2020,395(10219):200-211.DOI:10.1016/S0140-6736(19)32989-7.
[5]Weng L,Xu Y,Yin P,et al.National incidence and mortality of hospitalized sepsis in China[J].Crit Care,202 27(1):84.DOI:10.1186/s13054-023-04385-x.
[6]Pei F,Yao RQ,Ren C,et al.Expert consensus on the monitoring and treatment of sepsis-induced immunosuppression[J].Mil Med Res,202 9(1):74.DOI:10.1186/s40779-022-00430-y.
[7]Gotts JE,Matthay MA.Sepsis:pathophysiology and clinical management[J].BMJ,2016,353:i1585.DOI:10.1136/bmj.i1585.
[8]中国医疗保健国际交流促进会急诊医学分会,中华医学会急诊医学分会,中国医师协会急诊医师分会,等.中国脓毒症早期预防与阻断急诊专家共识[J].中华急诊医学杂志,2020,29(7):885-895.DOI:10.3760/cma.j.issn.1671-0282.2020.07.001.
[9]Harrington JS,Ryter SW,Plataki M,et al.Mitochondria in health,disease,and aging[J].Physiol Rev,202 103(4):2349-2422.DOI:10.1152/physrev.00058.2021.
[10]Cho DH,Kim JK,Jo EK.Mitophagy and innate immunity in infection[J].Mol Cells,2020,43(1):10-22.DOI:10.14348/molcells.2020.2329.
[11]Doblado L,Lueck C,Rey C,et al.Mitophagy in human diseases[J].Int J Mol Sci,202 2(8):3903.DOI:10.3390/ijms22083903.
[12]Zhang L,Dai L,Li D.Mitophagy in neurological disorders[J].J Neuroinflammation,202 18(1):297.DOI:10.1186/s12974-021-02334-5.
[13]Onishi M,Yamano K,Sato M,et al.Molecular mechanisms and physiological functions of mitophagy[J].EMBO J,202 40(3):e104705.DOI:10.15252/embj.2020104705.
[14]Underhill DM,Gordon S,Imhof BA,et al.lie Metchnikoff (1845-1916):celebrating 100 years of cellular immunology and beyond[J].Nat Rev Immunol,2016,16(10):651-656.DOI:10.1038/nri.2016.89.
[15]Dunkelberger JR,Song WC.Complement and its role in innate and adaptive immune responses[J].Cell Res,2010,20(1):34-50.DOI:10.1038/cr.2009.139.
[16]Shivshankar P,Halade GV,Calhoun C,et al.Caveolin-1 deletion exacerbates cardiac interstitial fibrosis by promoting M2 macrophage activation in mice after myocardial infarction[J].J Mol Cell Cardiol,2014,76:84-93.DOI:10.1016/j.yjmcc.2014.07.020.
[17]Mosser DM,Edwards JP.Exploring the full spectrum of macrophage activation[J].Nat Rev Immunol,2008,8(12):958-969.DOI:10.1038/nri2448.
[18]Kielbassa K,Vegna S,Ramirez C,et al.Understanding the origin and diversity of macrophages to tailor their targeting in solid cancers[J].Front Immunol,2019,10:2215.DOI:10.3389/fimmu.2019.02215.
[19]Conway-Morris A,Wilson J,Shankar-Hari M.Immune activation in sepsis[J].Crit Care Clin,2018,34(1):29-42.DOI:10.1016/j.ccc.2017.08.002.
[20]Murray PJ.Macrophage polarization[J].Annu Rev Physiol,2017,79:541-566.DOI:10.1146/annurev-physiol-022516-034339.
[21]Kumar V.Targeting macrophage immunometabolism:dawn in the darkness of sepsis[J].Int Immunopharmacol,2018,58:173-185.DOI:10.1016/j.intimp.2018.03.005.
[22]Li Z,Feng Y,Zhang S,et al.A multifunctional nanoparticle mitigating cytokine storm by scavenging multiple inflammatory mediators of sepsis[J].ACS Nano,202 17(9):8551-8563.DOI:10.1021/acsnano.3c00906.
[23]Ariyoshi W,Okinaga T,Chaweewannakorn W,et al.Mechanisms involved in enhancement of matrix metalloproteinase-9 expression in macrophages by interleukin-33[J].J Cell Physiol,2017,232(12):3481-3495.DOI:10.1002/jcp.25809.
[24]Jiao Y,Zhang T,Zhang C,et al.Exosomal miR-30d-5p of neutrophils induces M1 macrophage polarization and primes macrophage pyroptosis in sepsis-related acute lung injury[J].Crit Care,202 5(1):356.DOI:10.1186/s13054-021-03775-3.
[25]Chen XS,Wang SH,Liu CY,et al.Losartan attenuates sepsis-induced cardiomyopathy by regulating macrophage polarization via TLR4-mediated NF-κB and MAPK signaling[J].Pharmacol Res,202 185:106473.DOI:10.1016/j.phrs.2022.106473.
[26]Tan H,Song Y,Chen J,et al.Platelet-like fusogenic liposome-mediated targeting delivery of miR-21 improves myocardial remodeling by reprogramming macrophages post myocardial ischemia-reperfusion injury[J].Adv Sci (Weinh),202 8(15):e2100787.DOI:10.1002/advs.202100787.
[27]Yuan Y,Fan G,Liu Y,et al.The transcription factor KLF14 regulates macrophage glycolysis and immune function by inhibiting HK2 in sepsis[J].Cell Mol Immunol,202 19(4):504-515.DOI:10.1038/s41423-021-00806-5.
[28]Williams DL,Li C,Sherwood ER.Loss of monocyte metabolic plasticity in endotoxin tolerance:a model for understanding sepsis-induced immune paralysis[J].J Leukoc Biol,2019,106(1):7-9.DOI:10.1002/JLB.4CE0319-100R.
[29]Fink MP.Animal models of sepsis and its complications[J].Kidney Int,2008,74(8):991-993.DOI:10.1038/ki.2008.442.
[30]Deng D,Li X,Liu C,et al.Systematic investigation on the turning point of over-inflammation to immunosuppression in CLP mice model and their characteristics[J].Int Immunopharmacol,2017,42:49-58.DOI:10.1016/j.intimp.2016.11.011.
[31]Weiss SL,Zhang D,Bush J,et al.Mitochondrial dysfunction is associated with an immune paralysis phenotype in pediatric sepsis[J].Shock,2020,54(3):285-293.DOI:10.1097/SHK.0000000000001486.
[32]Leventogiannis K,Kyriazopoulou E,Antonakos N,et al.Toward personalized immunotherapy in sepsis:the PROVIDE randomized clinical trial[J].Cell Rep Med,202 3(11):100817.DOI:10.1016/j.xcrm.2022.100817.
[33]Yao RQ,Ren C,Xia ZF,et al.Organelle-specific autophagy in inflammatory diseases:a potential therapeutic target underlying the quality control of multiple organelles[J].Autophagy,202 17(2):385-401.DOI:10.1080/15548627.2020.1725377.
[34]Duan K,Gu Q,Petralia RS,et al.Mitophagy in the basolateral amygdala mediates increased anxiety induced by aversive social experience[J].Neuron,202 109(23):3793-3809.DOI:10.1016/j.neuron.2021.09.008.
[35]Wu KKL,Long K,Lin H,et al.The APPL1-Rab5 axis restricts NLRP3 inflammasome activation through early endosomal-dependent mitophagy in macrophages[J].Nat Commun,202 12(1):6637.DOI:10.1038/s41467-021-26987-1.
[36]Patoli D,Mignotte F,Deckert V,et al.Inhibition of mitophagy drives macrophage activation and antibacterial defense during sepsis[J].J Clin Invest,2020,130(11):5858-5874.DOI:10.1172/JCI130996.
[37]Liu F,Yang Y,Peng W,et al.Mitophagy-promoting miR-138-5p promoter demethylation inhibits pyroptosis in sepsis-associated acute lung injury[J].Inflamm Res,202 72(2):329-346.DOI:10.1007/s00011-022-01675-y.
[38]Zhong Z,Sanchez-Lopez E,Karin M.Autophagy,inflammation,and immunity:a troika governing cancer and its treatment[J].Cell,2016,166(2):288-298.DOI:10.1016/j.cell.2016.05.051.
[39]Sun Y,Yao X,Zhang QJ,et al.Beclin-1-dependent autophagy protects the heart during sepsis[J].Circulation,2018,138(20):2247-2262.DOI:10.1161/CIRCULATIONAHA.117.032821.
[40]Liu T,Wang L,Liang P,et al.USP19 suppresses inflammation and promotes M2-like macrophage polarization by manipulating NLRP3 function via autophagy[J].Cell Mol Immunol,202 18(10):2431-2442.DOI:10.1038/s41423-020-00567-7.
[41]中国中西医结合学会急救医学专业委员会,《中国中西医结合急救杂志》编辑委员会.脓毒性休克中西医结合诊治专家共识[J].中华危重病急救医学,2019,31(11):1317-1323.DOI:10.3760/cma.j.issn.2095-4352.2019.11.002.
[42]刘清泉.实用中医急诊学[M].北京:中国中医药出版社,2020:311-321.
[43]侯昕玥.中医适宜技术耳穴压丸联合揿针防控不同阶段近视的疗效评价研究[D].北京:中国中医科学院,2022.
[44]胡梦玲,任小巧,范佳佳,等.基于中风病不同阶段热毒与炎症反应相关性探讨中医药防治中风思路[J].环球中医药,202 14(10):1846-1849.DOI:10.3969/j.issn.1674-1749.2021.10.026.
[45]陈玄,陈娟,谢丽华,等.骨碎补-续断药对对成骨/破骨代谢的双向调控作用及其对Hif1a基因的影响[J].中国骨质疏松杂志,202 29(1):64-69.DOI:10.3969/j.issn.1006-7108.2023.01.012.
[46]Cao Y,Xiong J,Guan X,et al.Paeoniflorin suppresses kidney inflammation by regulating macrophage polarization via KLF4-mediated mitophagy[J].Phytomedicine,202 116:154901.DOI:10.1016/j.phymed.2023.154901.
[47]Yen JH,Huang WC,Lin SC,et al.Metabolic remodeling in tumor-associated macrophages contributing to antitumor activity of cryptotanshinone by regulating TRAF6-ASK1 axis[J].Mol Ther Oncolytics,202 26:158-174.DOI:10.1016/j.omto.2022.06.008.
[48]王霞蓉,王毅,程翼宇,等.中药单体成分局部给药及其促进吸收方法的研究进展[J].中国药科大学学报,2016,47(3):368-376.DOI:10.11665/j.issn.1000-5048.20160321.
[49]Chan SF,Chen YY,Lin JJ,et al.Triptolide induced cell death through apoptosis and autophagy in murine leukemia WEHI-3 cells in vitro and promoting immune responses in WEHI-3 generated leukemia mice in vivo[J].Environ Toxicol,2017,32(2):550-568.DOI:10.1002/tox.22259.
[50]Han X,Xu T,Fang Q,et al.Quercetin hinders microglial activation to alleviate neurotoxicity via the interplay between NLRP3 inflammasome and mitophagy[J].Redox Biol,202 44:102010.DOI:10.1016/j.redox.2021.102010.
[51]Jin X,Zhu L,Lu S,et al.Baicalin ameliorates CUMS-induced depression-like behaviors through activating AMPK/PGC-1α pathway and enhancing NIX-mediated mitophagy in mice[J].Eur J Pharmacol,202 938:175435.DOI:10.1016/j.ejphar.2022.175435.
[52]Yang S,Li F,Lu S,et al.Ginseng root extract attenuates inflammation by inhibiting the MAPK/NF-κB signaling pathway and activating autophagy and p62-Nrf2-Keap1 signaling in vitro and in vivo[J].J Ethnopharmacol,202 283:114739.DOI:10.1016/j.jep.2021.114739.
[53]林世翼,贾景明,王安华.狼毒二萜类化学成分及其药理作用研究进展[J].中草药,2020,51(1):256-264.DOI:10.7501/j.issn.0253-2670.2020.01.033.
[54]Feng X,Li J,Li H,et al.Bioactive C21 steroidal glycosides from euphorbia kansui promoted HepG2 cell apoptosis via the degradation of ATP1A1 and inhibited macrophage polarization under co-cultivation[J].Molecules,202 28(6):2830.DOI:10.3390/molecules28062830.
[55]曾金,张志荣,缪萍,等.隐丹参酮的药理作用研究进展[J].中成药,2015,37(6):1309-1313.DOI:10.3969/j.issn.1001-1528.2015.06.033.
[56]Chang X,He Y,Wang L,et al.Puerarin alleviates LPS-induced H9C2 cell injury by inducing mitochondrial autophagy[J].J Cardiovasc Pharmacol,202 80(4):600-608.DOI:10.1097/FJC.0000000000001315.
[57]Wang L,Jiang W,Wang J,et al.Puerarin inhibits FUNDC1-mediated mitochondrial autophagy and CSE-induced apoptosis of human bronchial epithelial cells by activating the PI3K/AKT/mTOR signaling pathway[J].Aging (Albany NY),202 14(3):1253-1264.DOI:10.18632/aging.203317.
[58]Wu LK,Agarwal S,Kuo CH,et al.Artemisia leaf extract protects against neuron toxicity by TRPML1 activation and promoting autophagy/mitophagy clearance in both in vitro and in vivo models of MPP+/MPTP-induced Parkinson’s disease[J].Phytomedicine,202 104:154250.DOI:10.1016/j.phymed.2022.154250.
[59]Xie W,Zhu T,Zhang S,et al.Protective effects of gypenoside ⅩⅦ against cerebral ischemia/reperfusion injury via SIRT1-FOXO3A-and Hif1a-BNIP3-mediated mitochondrial autophagy[J].J Transl Med,202 20(1):622.DOI:10.1186/s12967-022-03830-9.
[60]Zhou P,Xie W,Meng X,et al.Notoginsenoside R1 ameliorates diabetic retinopathy through PINK1-dependent activation of mitophagy[J].Cells,2019,8(3):213.DOI:10.3390/cells8030213.
[61]Ding H,Li Y,Chen S,et al.Fisetin ameliorates cognitive impairment by activating mitophagy and suppressing neuroinflammation in rats with sepsis-associated encephalopathy[J].CNS Neurosci Ther,202 28(2):247-258.DOI:10.1111/cns.13765.
[62]Wang WB,Li JT,Hui Y,et al.Combination of pseudoephedrine and emodin ameliorates LPS-induced acute lung injury by regulating macrophage M1/M2 polarization through the VIP/cAMP/PKA pathway[J].Chin Med,202 17(1):19.DOI:10.1186/s13020-021-00562-8.
[63]王小强,杨思进,白雪,等.基于玄府理论整合中药复方加中药单体的配伍思想[J].中医杂志,2019,60(9):804-807.DOI:10.13288/j.11-2166/r.2019.09.020.
[64]路立峰,张媛媛,李振兴,等.葛根芩连汤药效物质基础及质量控制研究进展[J].中成药,202 44(10):3239-3243.DOI:10.3969/j.issn.1001-1528.2022.10.029.
[65]Wang CH,Liu HM,Chang ZY,et al.Antioxidants rich herbal formula Ger-Gen-Chyn-Lian-Tang protects lipotoxicity and ameliorates inflammation signaling through regulation of mitochondrial biogenesis and mitophagy in nonalcoholic fatty liver disease mice[J].Front Biosci (Landmark Ed),202 27(8):242.DOI:10.31083/j.fbl2708242.
[66]Yang L,Yan L,Tan W,et al.Liang-Ge-San:a classic traditional Chinese medicine formula,attenuates acute inflammation via targeting GSK3β[J].Front Pharmacol,202 14:1181319.DOI:10.3389/fphar.2023.1181319.
[67]Sun X,Han Y,Dong C,et al.Daming capsule protects against myocardial infarction by promoting mitophagy via the SIRT1/AMPK signaling pathway[J].Biomed Pharmacother,202 151:113162.DOI:10.1016/j.biopha.2022.113162.
[68]Shi Y,Liu Q,Chen W,et al.Protection of Taohong Siwu Decoction on PC12 cells injured by oxygen glucose deprivation/reperfusion via mitophagy-NLRP3 inflammasome pathway in vitro[J].J Ethnopharmacol,202 301:115784.DOI:10.1016/j.jep.2022.115784.
[69]Xiao L,Xi X,Zhao M,et al.Buyang huanwu decoction (BYHWD) alleviates sepsis-induced myocardial injury by suppressing local immune cell infiltration and skewing M2-macrophage polarization[J].Am J Transl Res,202 15(4):2389-2406.
[70]Tang L,Wang X,Zhao R,et al.Yi-Qi-Jian-Pi formula ameliorates immune function in acute-on-chronic liver failure by upregulating autophagy and mitochondrial biogenesis in CD8+ T lymphocytes[J].J Ethnopharmacol,202 308:116276.DOI:10.1016/j.jep.2023.116276.
[71]王蕴涵,杜群,李燕舞,等.大承气汤治疗急性肺损伤的主要活性成分及潜在靶点研究[J].广州中医药大学学报,202 38(12):2757-2764.DOI:10.13359/j.cnki.gzxbtcm.2021.12.034.
[72]刘宇寒.大承气汤通过VDR调节细胞焦亡与自噬减轻脓毒症肺损伤的机制研究[D].武汉:华中科技大学,2022.
[73]Karbian N,Abutbul A,El-Amore R,et al.Apoptotic cell therapy for cytokine storm associated with acute severe sepsis[J].Cell Death Dis,2020,11(7):535.DOI:10.1038/s41419-020-02748-8.
[74]钟旋,李袁袁,林荣锋,等.大承气汤对肠源性脓毒症小鼠的保护作用及机制[J].中国药房,202 34(17):2101-2106.DOI:10.6039/j.issn.1001-0408.2023.17.10.
[75]Mao JJ,Liou KT,Baser RE,et al.Effectiveness of electroacupuncture or auricular acupuncture vs usual care for chronic musculoskeletal pain among cancer survivors:the PEACE randomized clinical trial[J].JAMA Oncol,202 7(5):720-727.DOI:10.1001/jamaoncol.2021.0310.
[76]Liu B,Wu J,Yan S,et al.Electroacupuncture vs prucalopride for severe chronic constipation:a multicenter,randomized,controlled,noninferiority trial[J].Am J Gastroenterol,202 116(5):1024-1035.DOI:10.14309/ajg.0000000000001050.
[77]Shi JT,Cao WY,Zhang XN,et al.Local analgesia of electroacupuncture is mediated by the recruitment of neutrophils and released β-endorphins[J].Pain,202 164(9):1965-1975.DOI:10.1097/j.pain.0000000000002892.
[78]Jin W,Tao Y,Wang C,et al.Infrared imageries of human body activated by tea match the hypothesis of meridian system[J].Phenomics,202 3(5):502-518.DOI:10.1007/s43657-022-00090-x.
[79]Liu S,Wang Z,Su Y,et al.A neuroanatomical basis for electroacupuncture to drive the vagal-adrenal axis[J].Nature,202 598(7882):641-645.DOI:10.1038/s41586-021-04001-4.
[80]Liu S,Wang ZF,Su YS,et al.Somatotopic organization and intensity dependence in driving distinct NPY-expressing sympathetic pathways by electroacupuncture[J].Neuron,2020,108(3):436-450.e7.DOI:10.1016/j.neuron.2020.07.015.
[81]Ramires CC,Balbinot DT,Cidral-Filho FJ,et al.Acupuncture reduces peripheral and brainstem cytokines in rats subjected to lipopolysaccharide-induced inflammation[J].Acupunct Med,202 39(4):376-384.DOI:10.1177/0964528420938379.
[82]耿欢,孙芳园,卢明,等.肠三针介导TRPV1/CGRP信号通路对脓毒症肠道菌群紊乱影响[J].辽宁中医药大学学报,202 24(4):80-83.DOI:10.13194/j.issn.1673-842x.2022.04.018.
[83]Lai F,Ren Y,Lai C,et al.Acupuncture at Zusanli (ST36) for experimental sepsis:a systematic review[J].Evid Based Complement Alternat Med,2020,2020:3620741.DOI:10.1155/2020/3620741.
[84]Song JG,Li HH,Cao YF,et al.Electroacupuncture improves survival in rats with lethal endotoxemia via the autonomic nervous system[J].Anesthesiology,201 116(2):406-414.DOI:10.1097/ALN.0b013e3182426ebd.
[85]Li P,Luo Y,Wang Q,et al.Efficacy and safety of acupuncture at Tianshu (ST25) for functional constipation:evidence from 10 randomized controlled trials[J].Evid Based Complement Alternat Med,2020,2020:2171587.DOI:10.1155/2020/2171587.
[86]Haak BW,Wiersinga WJ.The role of the gut microbiota in sepsis[J].Lancet Gastroenterol Hepatol,2017,2(2):135-143.DOI:10.1016/S2468-1253(16)30119-4.
[87]Bu Y,Li WS,Lin J,et al.Electroacupuncture attenuates immune-inflammatory response in hippocampus of rats with vascular dementia by inhibiting TLR4/MyD88 signaling pathway[J].Chin J Integr Med,202 28(2):153-161.DOI:10.1007/s11655-021-3350-5.
[88]Yang G,Hu RY,Deng AJ,et al.Effects of electro-acupuncture at Zusanli,Guanyuan for sepsis patients and its mechanism through immune regulation[J].Chin J Integr Med,2016,22(3):219-224.DOI:10.1007/s11655-016-2462-9.
[89]Pan WX,Fan AY,Chen S,et al.Acupuncture modulates immunity in sepsis:toward a science-based protocol[J].Auton Neurosci,202 32:102793.DOI:10.1016/j.autneu.2021.102793.
[90]Ning Z,Gu P,Zhang J,et al.Adiponectin regulates electroacupuncture-produced analgesic effects in association with a crosstalk between the peripheral circulation and the spinal cord[J].Brain Behav Immun,202 99:43-52.DOI:10.1016/j.bbi.2021.09.010.
[91]Chen L,Liu Z,Zhao Z,et al.Dopamine receptor 1 on CaMKII-positive neurons within claustrum mediates adolescent cocaine exposure-induced anxiety-like behaviors and electro-acupuncture therapy[J].Theranostics,202 13(10):3149-3164.DOI:10.7150/thno.83079.
[92]Lin YW,Chou AIW,Su H,et al.Transient receptor potential V1 (TRPV1) modulates the therapeutic effects for comorbidity of pain and depression:The common molecular implication for electroacupuncture and omega-3 polyunsaturated fatty acids[J].Brain Behav Immun,2020,89:604-614.DOI:10.1016/j.bbi.2020.06.033.
[93]Khodaie F,Abbasi N,Kazemi Motlagh AH,et al.Acupuncture for multiple sclerosis:a literature review[J].Mult Scler Relat Disord,202 60:103715.DOI:10.1016/j.msard.2022.103715.
[94]Song G,Fiocchi C,Achkar JP.Acupuncture in inflammatory bowel disease[J].Inflamm Bowel Dis,2019,25(7):1129-1139.DOI:10.1093/ibd/izy371.
[95]Wang H,Chen S,Zhang Y,et al.Electroacupuncture ameliorates neuronal injury by Pink1/Parkin-mediated mitophagy clearance in cerebral ischemia-reperfusion[J].Nitric Oxide,2019,91:23-34.DOI:10.1016/j.niox.2019.07.004.
[96]Zhang Z,Yu Q,Zhang X,et al.Electroacupuncture regulates inflammatory cytokines by activating the vagus nerve to enhance antitumor immunity in mice with breast tumors[J].Life Sci,202 72:119259.DOI:10.1016/j.lfs.2021.119259.
[97]Xiao Y,Chen W,Zhong Z,et al.Electroacupuncture preconditioning attenuates myocardial ischemia-reperfusion injury by inhibiting mitophagy mediated by the mTORC1-ULK1-FUNDC1 pathway[J].Biomed Pharmacother,2020,127:110148.DOI:10.1016/j.biopha.2020.110148.
[98]Georgakopoulos ND,Wells G,Campanella M.The pharmacological regulation of cellular mitophagy[J].Nat Chem Biol,2017,13(2):136-146.DOI:10.1038/nchembio.2287.
(收稿日期:2023-09-15)
