蛋白酶体20S亚基β8调控丝裂原活化蛋白激酶激酶/细胞外信号调节激酶通路对肾透明细胞癌细胞增殖、迁移和侵袭的影响
2024-01-01郝宇菲石宇郑锦秀赵雪婷刘盛露杨利军



摘要:目的 探究蛋白酶体20S亚基β8(PSMB8)对肾透明细胞癌(ccRCC)细胞增殖、迁移和侵袭的影响,以及是否通过调控丝裂原活化蛋白激酶激酶(MEK)/细胞外信号调节激酶(ERK)信号通路发挥其作用。方法 采用癌症基因组图谱数据库分析ccRCC与正常组织PSMB8 mRNA的表达水平,并通过实时荧光定量PCR、Western blot和免疫组织化学染色等方法进一步检测PSMB8在ccRCC组织和细胞中的表达情况。构建稳定过表达和敲减PSMB8的细胞株,分别采用CCK-8法和平板克隆实验检测细胞的增殖能力,划痕愈合实验和Transwell实验检测细胞迁移和侵袭的能力。对PSMB8共表达基因进行京都基因与基因组百科全书通路富集分析,Western blot检测MEK/ERK通路相关蛋白的磷酸化水平,并加用ERK激动剂C16-PAF处理进行细胞功能学挽救实验。结果 与正常组织比较,PSMB8 mRNA和蛋白在ccRCC组织中呈高表达(P均<0.001),且与临床患者的TNM分期显著相关(P<0.001);与阴性对照组比较,过表达PSMB8可以促进786-O、ACHN细胞的增殖(P=0.02 P=0.039)、迁移和侵袭(P均<0.001),敲减PSMB8可以抑制786-O、ACHN细胞的增殖(P=0.02 P=0.005)、迁移和侵袭(P均<0.001);PSMB8共表达基因通路富集分析提示其可能与丝裂原活化蛋白激酶通路相关(P<0.001);敲减PSMB8后786-O和ACHN细胞MEK1/2(P=0.017,P=0.016)、ERK1/2(P=0.010,P=0.040)蛋白磷酸化水平及ERK下游因子c-Myc(P=0.04 P=0.038)、c-Fos(P=0.025,P=0.008)和CyclinD1(P=0.006,P=0.047)转录水平均下调;与ERK激动剂C16-PAF处理组比较,敲减PSMB8 + C16-PAF组明显抑制786-O、ACHN细胞的增殖(P=0.00 P=0.002)、迁移和侵袭能力(P均<0.001)。结论 PSMB8通过激活MEK/ERK信号通路从而促进ccRCC细胞的增殖、迁移及侵袭。
关键词:肾透明细胞癌;蛋白酶体20S亚基β8;丝裂原活化蛋白激酶激酶/细胞外信号调节激酶信号通路
中图分类号: R737.11" 文献标识码: A" 文章编号:1000-503X(2024)05-0641-12
DOI:10.3881/j.issn.1000-503X.16003
Effects of Proteasome 20S Subunit Beta 8 on Proliferation,Migration,and Invasion of "Clear Cell Renal Cell Carcinoma Cells via Mitogen-Activated Protein Kinase Kinase/Extracellular Signal-Regulated Kinase Signaling Pathway
HAO Yufei SHI Yu ZHENG Jinxiu ZHAO Xueting LIU Shenglu YANG Lijun
1Department of Pharmacology,2Key Laboratory of Tumor Immunology and Targeted Drug Development of Shanxi Province,3Department of Biochemistry and Molecular Biology,School of Basic Medical Sciences,Shanxi Medical University,Taiyuan 03000 China
Corresponding author:YANG Lijun Tel:0351-398533 E-mail:yanglijunmm@sxmu.edu.cn
ABSTRACT:Objective To explore the effects of proteasome 20S subunit beta 8 (PSMB8) on the proliferation,migration,and invasion of clear cell renal cell carcinoma (ccRCC) cells and whether PSMB8 promotes tumor progression by activating the mitogen-activated protein kinase kinase (MEK)/extracellular signal-regulated kinase (ERK) signaling pathway.Methods The Cancer Genome Atlas was employed to analyze the mRNA levels of PSMB8 in ccRCC and normal tissue,and the expression levels of PSMB8 in ccRCC tissue and cells were determined by real-time quantitative PCR,Western blotting,and immunohistochemistry.Furthermore,the cell lines with stable overexpression and knockdown of PSMB8 were constructed.The CCK-8 assay and colony formation assay were employed to examine the cell proliferation,and the wound healing assay and Transwell assay were employed to examine the invasion and migration of cells.Kyoto Encyclopedia of Genes and Genomes pathway enrichment was performed to analyze the co-expressed genes of PSMB8.Western blotting was used to measure the phosphorylation levels of the proteins in the MEK/ERK signaling pathway.Finally,the rescue experiment was carried out with the ERK agonist C16-PAF.Results Compared with the normal tissue,the ccRCC tissue showed up-regulated mRNA and protein levels of PSMB8 (both Plt;0.001),which were associated with the TNM stage of patients with ccRCC (Plt;0.001).Compared with the negative control group,overexpression of PSMB8 promoted the proliferation (P=0.02 P=0.039),migration and invasion (all Plt;0.001) of 786-O and ACHN cells,and the knockdown of PSMB8 inhibited the proliferation (P=0.02 P=0.005),migration and invasion (all Plt;0.001) of 786-O and ACHN cells.The pathway enrichment analysis of co-expressed genes of PSMB8 predicted the mitogen-activated protein kinase signaling pathway (Plt;0.001).After the knockdown of PSMB8,786-O and ACHN cells showed lowered phosphorylation levels of MEK1/2 (P=0.017,P=0.016) and ERK1/2 (P=0.010,P=0.040) and down-regulated transcription levels of ERK downstream factors c-Myc (P=0.04 P=0.038),c-Fos (P=0.025,P=0.008),and CyclinD1 (P=0.006,P=0.047).Compared with the ERK agonist C16-PAF group,the PSMB8 knockdown + C16-PAF group showed inhibited proliferation (P=0.00 P=0.002),migration and invasion (all Plt;0.001) of 786-O and ACHN cells.Conclusion PSMB8 may promote the proliferation,migration,and invasion of ccRCC cells by activating the MEK/ERK signaling pathway.
Key words:clear cell renal cell carcinoma;proteasome 20S subunit beta 8;mitogen-activated protein kinase kinase/extracellular signal-regulated kinase signaling pathway
Acta Acad Med Sin,2024,46(5):641-652
肾细胞癌是最常见的泌尿系统恶性肿瘤之一,占所有原发性肾脏恶性肿瘤的90%以上[1],其中肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)最为常见,约占肾细胞癌病例的80%[2]。近年来,ccRCC发病率呈上升趋势,尽管大部分早期患者可通过手术切除使病情好转,但由于其早期症状隐匿,发现时往往已出现转移,导致预后效果较差,大大降低了患者的生存率[3]。因此,迫切需要寻找有助于ccRCC临床诊治的新型标志物,并揭示其在ccRCC中的潜在作用机制,这已成为当前重要的研究方向之一。蛋白酶体20S亚基β8(proteasome 20S subunit beta 8,PSMB8)是免疫蛋白酶体的一个重要亚基[4],具有糜蛋白酶样活性,在调控细胞周期、细胞内蛋白质稳态、细胞信号传导、抗原提呈、炎症反应以及肿瘤进展中发挥着重要作用[5-6]。既往研究证实PSMB8参与调控胶质瘤细胞的增殖、迁移和凋亡[7];在甲状腺癌中PSMB8呈高表达,且与甲状腺乳头状癌细胞的增殖、凋亡密切相关[8];PSMB8还可以促进非小细胞肺癌的侵袭和进展[9];此外,抑制PSMB8可通过下调促炎性细胞因子白细胞介素(interleukin,IL)-6、IL-17和IL-23的表达影响类风湿关节炎的进展[10]。然而,PSMB8在ccRCC中的作用目前尚不清楚。本研究通过细胞学功能实验及机制分析探究PSMB8对ccRCC细胞增殖、迁移和侵袭的影响,为ccRCC靶向药物的研发提供实验依据。
1 材料和方法
1.1 材料
人胚肾细胞293T和ccRCC细胞系(786-O、ACHN、A498、OS-RC-2、769-P)购自中国科学院典型培养物保藏委员会细胞库。RPMI-1640培养基、MEM培养基、DMEM培养基购自美国Hyclone公司。β-actin、GAPDH抗体购自北京全式金生物技术有限公司,细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2、磷酸化ERK(phosphorylated-ERK,p-ERK)1/2、丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)1/2、磷酸化MEK(phosphorylated-MEK,p-MEK)1/2、PSMB8抗体均购自美国Cell Signaling Technology公司。
1.2 细胞培养
786-O、OS-RC-2和769-P细胞采用RPMI-1640培养基培养,ACHN和A498细胞采用MEM培养基培养,293T细胞采用DMEM培养基培养,所有培养基中均含100 mL/L胎牛血清和100 U/mL青霉素、100 mg/mL链霉素。将细胞置于37 ℃、5% CO2的常规培养箱中培养。
1.3 组织芯片制备
收集2021年12月至2022年8月山西省肿瘤医院手术后制备的ccRCC及癌旁正常组织的石蜡包埋样本59对,并制备组织芯片。本研究通过山西医科大学伦理委员会批准(伦理审批编号:2022007),所有患者均签署知情同意书。
1.4 质粒构建及筛选
从美国国家生物技术信息中心下载人类PSMB8编码序列,采用无缝克隆的方法构建PSMB8过表达质粒,质粒载体为pEGFP-C1-3×Flag载体。采用Invitrogen在线工具设计短发夹RNA(short hairpin RNA,shRNA),将其连接到慢病毒pLVX-Zsgreen载体中,构建PSMB8敲减质粒。采用Lipo8000脂质体转染786-O和ACHN细胞株,同时以空白质粒作为阴性对照组,分别加入2 μg/mL G418处理细胞2周,以获得稳定的转染细胞。采用实时荧光定量PCR和Western blot方法检测PSMB8基因过表达和敲减的效率,并将细胞分为PSMB8过表达组(oePSMB8)和PSMB8敲减组(shPSMB8)。shRNA序列:5’-GTTGGGTGAAAGTAGAAAGTA-3’。
1.5 Western blot检测蛋白表达水平
PBS清洗细胞后,收集细胞沉淀,RIPA缓冲液裂解细胞,BCA蛋白检测试剂盒测定蛋白的浓度。根据目标蛋白的分子量制备不同浓度的分离胶,每孔上样30 μg总蛋白,经SDS-PAGE凝胶分离后,配制5%脱脂牛奶封闭液,室温封闭1 h,加入ERK1/2(1∶1000)、MEK1/2(1∶1000)、p-ERK1/2(1∶1000)、p-MEK1/2(1∶1000)、PSMB8(1∶1000)、β-actin(1∶4000)、GAPDH(1∶1000)抗体4 ℃孵育过夜,TBST洗涤3次,加入辣根过氧化物酶标记的二抗稀释液孵育1 h,采用蛋白凝胶成像系统进行显影。
1.6 实时荧光定量PCR检测mRNA表达水平
采用TRIzol法提取细胞总RNA,并逆转录为cDNA,根据QuantiNova SYBR Green PCR Kit试剂盒说明书配置反应体系。反应总体系为20 μL/管,反应条件:95 ℃预变性2 min;95 ℃ 5 s,60 ℃ 10 s,重复40个循环。每个反应设置3个复孔,以GAPDH为内参,采用2-△△Ct法计算相对表达量。PCR引物序列见表1。
1.7 CCK-8法检测细胞增殖
采用CCK-8法检测PSMB8对ccRCC细胞增殖能力的影响。将处理后的细胞以每孔1000~3000个细胞密度接种于96孔板中,分别在0、24、48、72 h向每孔加入10 μL CCK-8试剂反应1 h,采用酶标仪在450 nm处测定吸光度值。
1.8 平板克隆实验检测细胞增殖
将稳定过表达或敲减PSMB8的786-O和ACHN细胞按5000个/孔的密度接种于6孔板中,每3 d更换1次培养基,培养2周。甲醇固定细胞15 min,0.1%结晶紫染色30 min,倒扣静置晾干水分,对细胞克隆进行拍照并计数。
1.9 划痕愈合实验检测细胞迁移
将各组细胞接种于6孔板中,培养至细胞完全融合,用200 μL无菌枪头尖端在孔内做“井”字划痕,并用PBS将脱落细胞清洗干净,每孔加入无血清培养基继续培养,分别在0、12 h拍照记录。采用Image J软件分析计算细胞划痕面积。
1.10 Transwell迁移和侵袭实验检测细胞迁移和侵袭
将各组细胞按2×104个/孔的密度分别接种于无基质胶和涂有Matrigel基质胶的上室,另将含10%胎牛血清的培养基加入下室,37 ℃培养24 h后取出上室,用棉签轻轻擦去上层未穿透膜的细胞,PBS清洗后,甲醇固定细胞15 min,0.1%结晶紫染色30 min,随机选取3个视野,使用显微镜拍照并计数。
1.11 免疫组织化学染色检测PSMB8的表达
将组织芯片经常规脱蜡水化、柠檬酸钠抗原修复后,冷却至室温。加入300 mL/L过氧化氢溶液阻断内源性过氧化物酶,5%的牛血清白蛋白进行封闭,滴加PSMB8单克隆抗体4 ℃孵育过夜,PBS清洗3次,每次2 min,加入辣根过氧化物酶标记的二抗溶液,室温孵育30 min,DAB显色,苏木素复染,脱水,中性树胶封片。按照染色阳性率评分(1分0~25%、2分26%~50%、3分gt;50%)与染色强度评分(0分阴性着色、1分淡黄色、2分浅褐色、3分深褐色)的乘积作为总评分进行分组。根据患者所得评分中位值分为低表达组与高表达组。所有染色结果均由两名病理科医生经双盲法独立评分。
1.12 生物信息学分析PSMB8的表达
利用肿瘤免疫浸润评估(Tumor Immune Estimation Resource,TIMER)数据库(https://cistrome.shinyapps.io/timer/)分析PSMB8在泛癌中的转录组水平。从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov/)下载ccRCC患者mRNA表达谱数据及相关临床数据,筛选出533例肿瘤样本及72例正常样本,绘制PSMB8在ccRCC中表达情况的箱线图,并分析PSMB8与临床TNM分期的关系。
1.13 统计学处理
采用SPSS 22.0软件,计量资料以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 ccRCC中PSMB8的表达水平
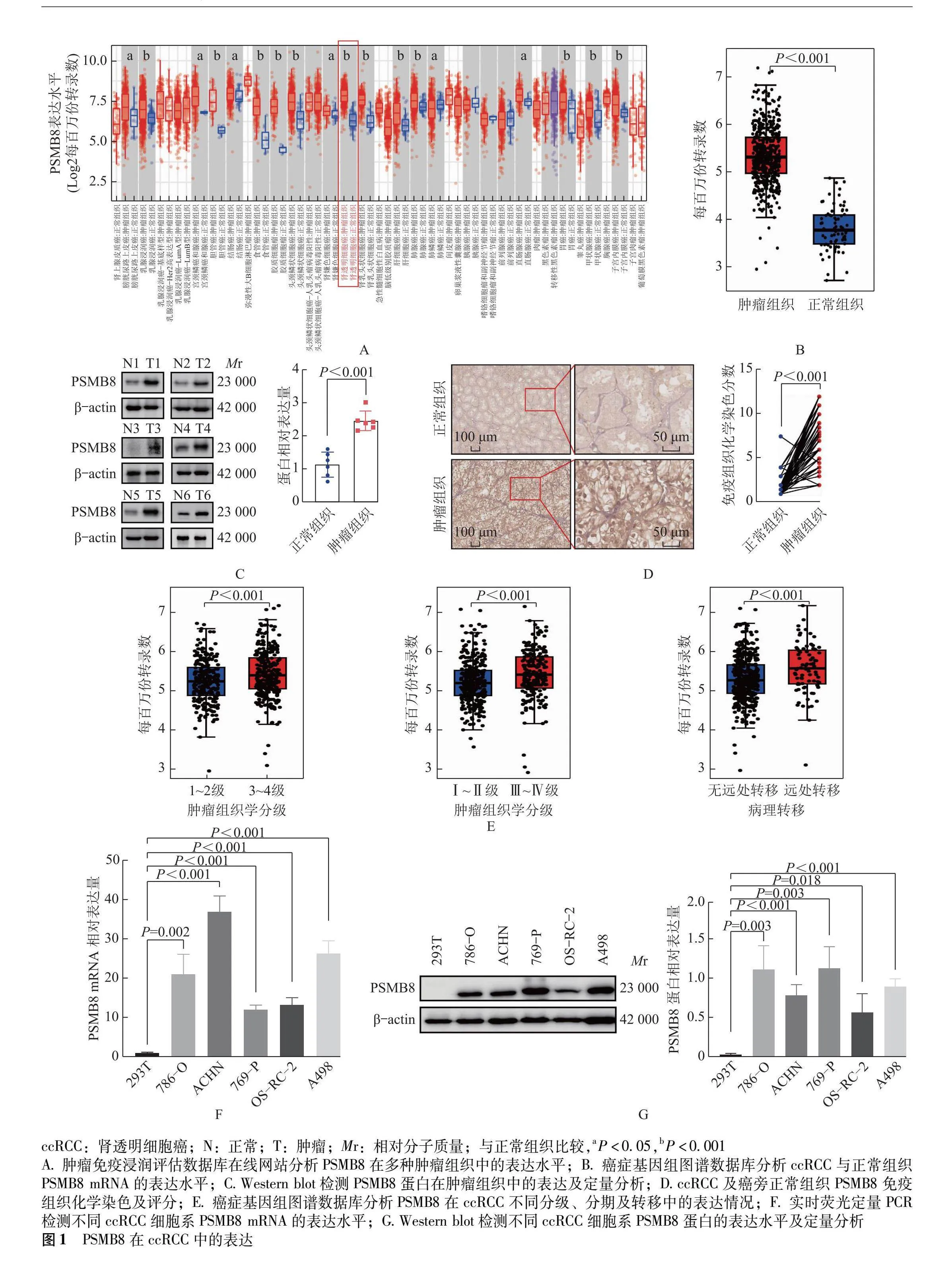
通过TIMER数据库分析PSMB8在不同类型恶性肿瘤组织和正常对照组织中的表达情况,发现PSMB8在包括ccRCC(Plt;0.001)在内的多种肿瘤组织中呈高表达(图1A)。TCGA数据库分析显示ccRCC组织中PSMB8 mRNA和蛋白表达均显著高于正常组织(P均lt;0.001)(图1B、1C);ccRCC组织芯片显示PSMB8表达上调(Plt;0.001)(图1D);PSMB8表达水平越高ccRCC患者的分期、分级越高,且更易发生远处转移(P均<0.001)(图1E)。与人胚肾细胞239T比较,786-O、ACHN、A498、OS-RC-2、769-P细胞PSMB8 mRNA(P=0.00 P<0.00 P<0.00 P<0.00 P<0.001)和蛋白表达(P=0.00 P<0.00 P<0.00 P=0.018,P=0.003)均显著增加(图1F、1G)。
2.2 过表达PSMB8对ccRCC细胞增殖、迁移和侵袭能力的影响
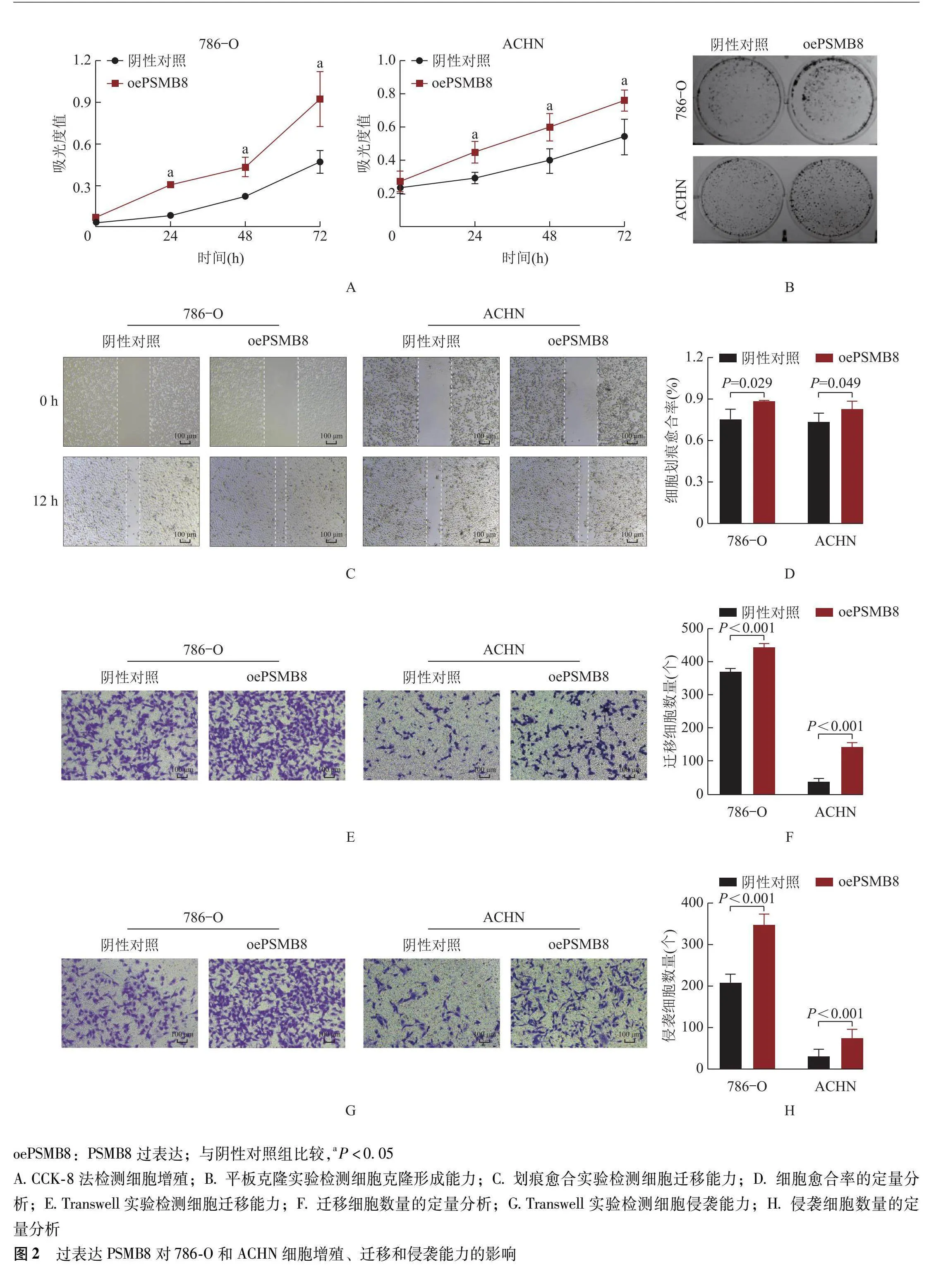
与阴性对照组比较,oePSMB8组786-O和ACHN细胞PSMB8 mRNA(1.56±0.36比0.99±0.0 P=0.020;2.82±1.11比0.97±0.06,P=0.045)和蛋白表达(2.12±0.48比1.01±0.0 P=0.006;1.40±0.13比1.00±0.0 P=0.015)显著增加。CCK-8和平板克隆实验检测结果显示,过表达PSMB8促进786-O和ACHN细胞的增殖能力(P=0.02 P=0.039)(图2A、2B);划痕愈合实验结果显示,与阴性对照组比较,oePSMB8组786-O[(0.89±0.01)%比(0.76±0.07)%,P=0.029]和ACHN细胞[(0.83±0.06)%比(0.74±0.06)%,P=0.049]伤口愈合速率明显加快(图2C、2D);Transwell迁移和侵袭实验检测结果显示,过表达PSMB8后,穿过小室的786-O[(442.70±11.93)个比(369.30±10.97)个,P<0.001]和ACHN细胞[(143.90±12.32)个比(38.20±10.81)个,P<0.001]数量显著增加(图2E、2F),786-O[(347.70±50.5)个比(208.70±19.86)个,P<0.001]和ACHN细胞[(74.05±21.08)个比(30.12±16.88)个,P<0.001]的侵袭能力也显著增强(图2G、2H)。
2.3 敲减PSMB8对ccRCC细胞增殖、迁移和侵袭能力的影响
与阴性对照组比较,shPSMB8组786-O和ACHN细胞PSMB8 mRNA(0.42±0.08比1.01±0.0 P<0.001;0.45±0.15比1.02±0.0 P<0.001)和蛋白表达(0.59±0.11比1.01±0.0 P=0.003;0.64±1.14比1.00±0.0 P=0.012)显著减少。CCK-8和平板克隆实验检测结果显示,敲减PSMB8抑制786-O和ACHN细胞的增殖能力(P=0.02 P=0.005)(图3A、3B);划痕愈合实验结果显示,与阴性对照组比较,shPSMB8组786-O[(0.45±0.12)%比(0.68±0.01)%,P=0.029]和ACHN细胞[(0.40±0.07)%比(0.70±0.07)%,P=0.006]伤口愈合速率明显减慢(图3C、3D);Transwell迁移和侵袭实验检测结果显示,敲减PSMB8后,穿过小室的786-O[(341.70±57.01)个比(441.30±5.69)个,P<0.001]和ACHN细胞[(164.60±63.44)个比(262.6±76.97)个,P<0.001]数量显著减少(图3E、3F),786-O[(235.00±15.52)个比(381.30±6.66)个,P<0.001]和ACHN细胞[(76.18±25.53)个比(217.30±82.63)个,P<0.001]的侵袭能力也显著减弱(图3G、3H)。
2.4 PSMB8基因功能富集分析结果
京都基因与基因组百科全书富集分析结果显示,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的基因富集率最高(图4A)。敲减PSMB8后,786-O和ACHN细胞MEK1/2(P=0.017,P=0.016)、ERK1/2(P=0.010,P=0.040)磷酸化水平显著降低(图4B、4C),且ERK下游调控关键因子c-Myc(P=0.04 P=0.038)、c-Fos(P=0.025,P=0.008)和CyclinD1 mRNA(P=0.006,P=0.047)表达量均显著降低(图4D)。
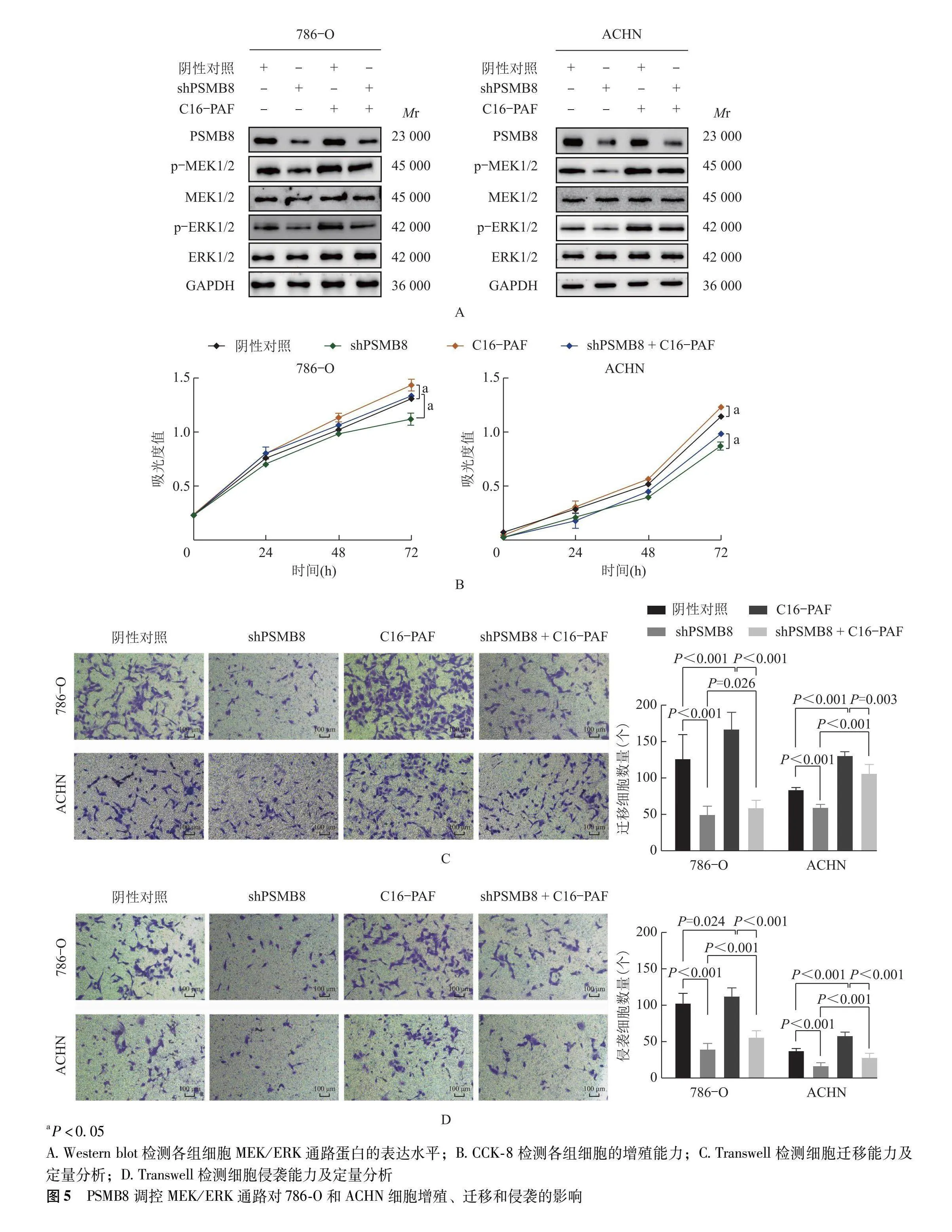
2.5 敲减PSMB8抑制MEK/ERK通路对ccRCC细胞增殖、迁移和侵袭能力的影响
ERK激动剂C16-PAF处理敲减PSMB8的786-O和ACHN细胞3 h后,MEK1/2和ERK1/2磷酸化水平在一定程度上得到恢复(P均lt;0.001)(图5A)。与阴性对照组比较,C16-PAF组786-O和ACHN细胞吸光度值显著增加(P=0.00 P=0.003),与shPSMB8组比较,shPSMB8+C16-PAF组吸光度值显著增加(P=0.00 P=0.002)(图5B)。与阴性对照组比较,C16-PAF组786-O和ACHN细胞迁移[(166.90±23.68)个比(126.30±34.21)个,P=0.024;(131.00±4.85)个比(84.00±2.74)个,Plt;0.001]和侵袭[(112.80±12.84)个比(101.30±12.37)个,Plt;0.001;(58.42±7.18)个比(37.22±5.24)]个,Plt;0.001)数量显著增加;与shPSMB8组比较,shPSMB8+C16-PAF组786-O和ACHN细胞迁移((49.71±11.73)个比(59.00±10.37)个,P=0.026;(59.6±3.78)个比(105.8±12.79)个,Plt;0.001)和侵袭[(40.53±8.07)个比(57.00±8.93)个,Plt;0.001;(16.75±4.79)个比(28.63±5.39)个,Plt;0.001]数量显著增加(图5C、5D)。
3 讨论
ccRCC是肾细胞癌的主要类型,具有高度侵袭性和异质性[11],极易发生转移[12],术后复发率高,高危患者仍需要接受长期全身治疗[13-14],但仅少数患者获益[15-16]。因此,探索新的治疗靶点或许能改善ccRCC患者的预后。PSMB8作为免疫蛋白酶体中最重要的活性亚基,其编码基因位于主要组织相容性复合体(major histocompatibility complex,MHC)基因区域,在MHCⅠ类分子抗原提呈过程中发挥着重要作用,可以促进T细胞成熟分化,促进炎症反应。有研究发现PSMB8的下调可抑制血管内皮生长因子A的表达,继而减少胶质母细胞瘤的血管生成[17]。PSMB8抑制剂ONX-0914同样可以通过p53通路来诱导胶质母细胞瘤的凋亡和自噬[18],然而,目前关于PSMB8的相关机制研究报道较少,且PSMB8在ccRCC肿瘤进展中的作用尚不明确。本研究通过生物信息学分析和细胞学功能实验发现,PSMB8在ccRCC中异常高表达,并显著促进了ccRCC细胞的增殖、迁移和侵袭过程。这与Zhong等[19]报道PSMB8对甲状腺未分化癌的促癌作用是相似的。但课题组前期研究发现,PSMB8的表达与CD8+ T细胞的浸润水平呈正相关,提示PSMB8可能增强抗肿瘤免疫,与本研究的促癌结论相悖,这可能是由于PSMB8不同亚型在蛋白酶体20S形成过程中的作用不同,非功能性E1亚型的表达上调及E2亚型表达下调,可导致蛋白酶体20S形成障碍,肿瘤特异性抗原难以有效产生[20-22],从而使得PSMB8协助ccRCC细胞逃避免疫监视,促进癌细胞的增殖、迁移和侵袭。
MAPK是信号从细胞表面传导到细胞核内部的重要传递者[23],几乎所有真核生物都能表达MAPK,MAPK通路的基本组成是一种保守的三级激酶级联模式,共同调控细胞的生长、分化、对环境的应激适应、炎症反应等多种重要生物学过程[24-26]。经典的MAPK通路主要包括ERK、p38和c-Jun氨基末端激酶、ERK5等信号转导途径[27]。其中,ERK1和ERK2可被MEK1和MEK2双特异性激酶磷酸化激活,从而调控细胞周期,促进细胞增殖、分化及凋亡。一旦ERK1/2发生异常激活,可导致ERK1/2各个级联反应的下游底物持续激活,破坏细胞的正常调节机制,促进细胞的异常增殖和恶性转化,继而引起与基因表达异常有关的疾病发生[28-29]。本研究显示PSMB8共表达基因富集到MAPK信号通路。Yang等[7]研究表明PSMB8可通过上调ERK1/2的磷酸化水平,促进脑胶质瘤细胞的迁移、增殖和凋亡,但其在ccRCC中是否也通过参与ERK1/2的级联反应来发挥作用还有待进一步验证。本研究发现敲减PSMB8后,MEK1/2和ERK1/2的磷酸化水平下调,加入ERK1/2激动剂C16-PAF后,敲低PSMB8对ccRCC细胞的抑制作用明显被逆转,因此,PSMB8通过调控MEK/ERK信号通路促进ccRCC细胞的增殖、迁移和侵袭过程。
综上,本研究结果表明,PSMB8在ccRCC中呈高表达,其可能通过调控MEK/ERK信号通路促进肿瘤细胞的增殖、迁移和侵袭,这有望为ccRCC的临床治疗提供新的线索,并为肿瘤诊断和预后预测提供潜在的生物标志物和治疗靶点。但本研究仅通过体外实验初步验证了PSMB8的作用机制,考虑到PSMB8生物学功能的多样性以及分子调控机制的复杂性,不排除其他信号通路共同参与调节的可能性,后期将利用动物模型和原代ccRCC细胞深入探讨PSMB8的作用机制。
利益冲突 所有作者声明无利益冲突
作者贡献声明 郝宇菲:研究设计及论文撰写;石宇、郑锦秀:资料搜集整理;赵雪婷、刘盛露:数据整理与统计分析;杨利军:论文修改与审核
参 考 文 献
[1]Oto J,Plana E,Sánchez-González JV,et al.Urinary microRNAs:looking for a new tool in diagnosis,prognosis,and monitoring of renal cancer[J].Curr Urol Rep,2020,21(2):11.DOI:10.1007/s11934-020-0962-9.
[2]Zhu S,Wu T,Ji Z,et al.Construction of an epithelial-mesenchymal transition-related model for clear cell renal cell carcinoma prognosis prediction[J].Dis Markers,202 2022:3780391.DOI:10.1155/2022/3780391.
[3]Cai Q,Christie A,Rajaram S,et al.Ontological analyses reveal clinically-significant clear cell renal cell carcinoma subtypes with convergent evolutionary trajectories into an aggressive type[J].EBioMedicine,2020,51:102526.DOI:10.1016/j.ebiom.2019.10.052.
[4]Rivett AJ,Hearn AR.Proteasome function in antigen presentation:immunoproteasome complexes,peptide production,and interactions with viral proteins[J].Curr Protein Pept Sci,2004,5(3):153-161.DOI:10.2174/1389203043379774.
[5]Li N,Zhan X.Integrated genomic analysis of proteasome alterations across 11 057 patients with 33 cancer types:clinically relevant outcomes in framework of 3P medicine[J].Epma J,202 12(4):605-627.DOI:10.1007/s13167-021-00256-z.
[6]Jiao QH,Wang Y,Zhang AN,et al.PSMA7 promotes the malignant proliferation of esophageal cancer[J].Heliyon,2024,10(1):e23173.DOI:10.1016/j.heliyon.2023.e23173.
[7]Yang BY,Song JW,Sun HZ,et al.PSMB8 regulates glioma cell migration,proliferation,and apoptosis through modulating ERK1/2 and PI3K/AKT signaling pathways[J].Biomed Pharmacother,2018,100:205-212.DOI:10.1016/j.biopha.2018.01.170.
[8]Fan X,Zhao Y.miR-451a inhibits cancer growth,epithelial-mesenchymal transition andinduces apoptosis in papillary thyroid cancer by targeting PSMB8[J].J Cell Mol Med,2019,23(12):8067-8075.DOI:10.1111/jcmm.14673.
[9]Liu R,Liu R,Guo Z,et al.shRNA-mediated knockdown of KNTC1 inhibits non-small-cell lung cancer through regulating PSMB8[J].Cell Death Dis,202 13(8):685.DOI:10.1038/s41419-022-05140-w.
[10]Muchamuel T,Basler M,Aujay MA,et al.A selective inhibitor of the immunoproteasome subunit LMP7 blocks cytokine production and attenuates progression of experimental arthritis[J].Nat Med,2009,15(7):781-787.DOI:10.1038/nm.1978.
[11]Powles T,ESMO Guidelines Committee.Recent eUpdate to the ESMO Clinical Practice Guidelines on renal cell carcinoma on cabozantinib and nivolumab for first-line clear cell renal cancer:renal cell carcinoma:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,202 32(3):422-423.DOI:10.1016/j.annonc.2020.11.016.
[12]Yang J,Luo L,Zhao C,et al.A positive feedback loop between inactive VHL-Triggered histone lactylation and PDGFRβ signaling drives clear cell renal cell carcinoma progression[J].Int J Biol Sci,202 18(8):3470-3483.DOI:10.7150/ijbs.73398.
[13]Larroquette M,Peyraud F,Domblides C,et al.Adjuvant therapy in renal cell carcinoma:current knowledges and future perspectives[J].Cancer Treat Rev,202 97:102207.DOI:10.1016/j.ctrv.2021.102207.
[14]Ingels A,Campi R,Capitanio U,et al.Complementary roles of surgery and systemic treatment in clear cell renal cell carcinoma[J].Nat Rev Urol,202 19(7):391-418.DOI:10.1038/s41585-022-00592-3.
[15]Rosellini M,Marchetti A,Mollica V,et al.Prognostic and predictive biomarkers for immunotherapy in advanced renal cell carcinoma[J].Nat Rev Urol,202 20(3):133-157.DOI:10.1038/s41585-022-00676-0.
[16]Deleuze A,Saout J,Dugay F,et al.Immunotherapy in renal cell carcinoma:the future is now[J].Int J Mol Sci,2020,21(7):2532.DOI:10.3390/ijms21072532.
[17]Chang HH,Cheng YC,Tsai WC,et al.PSMB8 inhibition decreases tumor angiogenesis in glioblastoma through vascular endothelial growth factor A reduction[J].Cancer Sci,2020,111(11):4142-4153.DOI:10.1111/cas.14625.
[18]Chang HH,Lin YH,Chen TM,et al.ONX-0914 Induces apoptosis and autophagy with p53 regulation in human glioblastoma cells[J].Cancers (Basel),202 14(22):5712.DOI:10.3390/cancers14225712.
[19]Zhong Y,Yu F,Yang L,et al.HOXD9/miR-451a/PSMB8 axis is implicated in the regulation of cell proliferation and metastasis via PI3K/AKT signaling pathway in human anaplastic thyroid carcinoma[J].J Transl Med,202 21(1):817.DOI:10.1186/s12967-023-04538-0.
[20]Heink S,Fricke B,Ludwig D,et al.Tumor cell lines expressing the proteasome subunit isoform LMP7E1 exhibit immunoproteasome deficiency[J].Cancer Res,2006,66(2):649-652.DOI:10.1158/0008-5472.Can-05-2872.
[21]Fehling HJ,Swat W,Laplace C,et al.MHC class Ⅰ expression in mice lacking the proteasome subunit LMP-7[J].Science,1994,265(5176):1234-1237.DOI:10.1126/science.8066463.
[22]De M,Jayarapu K,Elenich L,et al.Beta 2 subunit propeptides influence cooperative proteasome assembly[J].J Biol Chem,200 278(8):6153-6159.DOI:10.1074/jbc.M209292200.
[23]Guo YJ,Pan WW,Liu SB,et al.ERK/MAPK signalling pathway and tumorigenesis[J].Exp Ther Med,2020,19(3):1997-2007.DOI:10.3892/etm.2020.8454.
[24]Moon H,Ro SW.MAPK/ERK signaling pathway in hepatocellular carcinoma[J].Cancers (Basel),202 13(12):3026.DOI:10.3390/cancers13123026.
[25]Barbosa R,Acevedo LA,Marmorstein R.The MEK/ERK network as a therapeutic target in human cancer[J].Mol Cancer Res,202 19(3):361-374.DOI:10.1158/1541-7786.Mcr-20-0687.
[26]Anjum J,Mitra S,Das R,et al.A renewed concept on the MAPK signaling pathway in cancers:polyphenols as a choice of therapeutics[J].Pharmacol Res,202 184:106398.DOI:10.1016/j.phrs.2022.106398.
[27]Kciuk M,Gielecińska A,Budzinska A,et al.Metastasis and MAPK pathways[J].Int J Mol Sci,202 23(7):3847.DOI:10.3390/ijms23073847.
[28]Lake D,Corrêa SA,Müller J.Negative feedback regulation of the ERK1/2 MAPK pathway[J].Cell Mol Life Sci,2016,73(23):4397-4413.DOI:10.1007/s00018-016-2297-8.
[29]Chang L,Karin M.Mammalian MAP kinase signalling cascades[J].Nature,200 410(6824):37-40.DOI:10.1038/35065000.
(收稿日期:2024-01-15)
