固本解毒方调控肺腺癌免疫微环境的分子机制研究及实验验证
2023-12-30郭宵飞白建琦李静静欧阳琴邓晓曦郭家敏朱冬菊
郭宵飞 张 平 白建琦 杨 晨 李静静 欧阳琴 邓晓曦 郭家敏 朱冬菊 王 源
(1 中国中医科学院望京医院病理科,北京,100102; 2 北京市海淀医院中医科,北京,100080)
肿瘤微环境(Tumor Microenvironment,TME)的概念部分来源于Steven Paget的“种子和土壤”假说,它指的是肿瘤或肿瘤干细胞所存在的细胞环境等[1-2],在肿瘤发生、进展以及转移的过程中起着重要作用。肿瘤免疫微环境(Tumor Immune Microenvironment,TIME)是肿瘤微环境里的重要部分。肿瘤细胞是TIME的主要细胞成分,它可通过分泌肿瘤抗原或影响免疫细胞的代谢环境,从而影响免疫细胞的功能[3],促进肿瘤的进展。据统计,2018年全球有209.4万例新增肺癌病例,这使肺癌成为全球发病率最高的癌病,而肺腺癌是肺癌中最主要的类型,约占所有肺癌的40%[4],研究TIME的干预途径对于肺癌的治疗有着重要意义。
中药在疾病的治疗中有着多靶点多通路的特点,在激活免疫细胞,介导信号转导从而发挥对肿瘤免疫微环境的整体调节作用的同时[5],还可减少放化疗及免疫治疗等传统治疗的不良反应。目前关于中药作用于TIME的分子机制研究尚不足。固本解毒方为中国中医科学院朴炳奎教授治疗肺癌的经验方,在肺腺癌的临床治疗中有着良好效果,方中的北沙参、黄芪等均与免疫细胞的激活与抑制有着密切联系[6-7]。前期研究发现,固本解毒方对肺腺癌A549细胞的增殖和转移均有较好的抑制作用[8],但其对肺腺癌免疫微环境的作用通路和机制等尚缺乏进一步探讨。网络药理学是信息化时代中药研究的前沿学科,随着网络药理学的使用日益规范化,其影响力及应用价值不断升高[9]。本研究通过网络药理学方法的方法初步筛选固本解毒方作用于肺腺癌免疫微环境的候选活性成分、潜在作用靶点及相关通路等,并通过分子对接及动物实验初步验证,为固本解毒方调节肺腺癌免疫微环境的临床应用及后续研究提供参考。
1 材料与方法
1.1 材料
1.1.1 动物 本研究所需小鼠购自北京唯尚立德生物科技有限公司,共购入40只6~8周龄雌性免疫缺陷小鼠(NOD/SCID/IL2 Rγ-/-,NSG),体质量(18±2)g[许可证号为SCXK(京)2021-0010],并于北京唯尚立德生物科技有限公司饲养[许可证号SYXK(京)2021-0056],自由食水,温度(22±3)℃,湿度40%~80%,昼夜明暗交替12 h。动物实验方案已通过该公司伦理委员会审核(伦理审批号:VS212600907)。
1.1.2 药物 固本解毒方中药饮片购自中国中医科学院望京医院,由王景红主任药师鉴定为正品。中药饮片:北沙参(批号:2107012)、桔梗(批号:20210514)、黄芪(批号:21062512)、当归(批号:2107020)、续断(批号:c4111511)、骨碎补(批号:2103075)、牛膝(批号:2105034)、补骨脂(批号:c5091411)、太子参(批号:21020301)、半枝莲(批号:c3161341)、土茯苓(批号:c21031401)、白花蛇舌草(批号:20210720)、甘草(批号:2112068)。固本解毒方药物组成为北沙参20 g、桔梗9 g、黄芪30 g、当归10 g、续断10 g、骨碎补10 g、牛膝10 g、补骨脂10 g、太子参15 g、半枝莲20 g、土茯苓20 g、白花蛇舌草15 g、甘草6 g。将中药饮片加水浸泡2 h后煎煮至含生药量0.7 g/mL(低剂量组)、1.4 g/mL(中剂量组)、2.8 g/mL(高剂量组),并于4 ℃冰箱分别保存。
1.1.3 试剂与仪器 洛斯维·帕克纪念研究所1640(Roswell Park Memorial Institute 1640,RPMI-1640)培养基、细胞冻存液、无菌磷酸缓冲盐溶液(Phosphate Buffer Saline,PBS)(北京索莱宝公司,货号分别为31800、24800、P1020-500),0.25%胰蛋白酶、胎牛血(Hyclone公司,美国,货号分别为SH30042.01、SH30070.03),二喹啉甲酸(Bicinchoninic Acid,BCA)蛋白浓度测定试剂盒(北京索莱宝公司,货号:PC0020),信号转导及转录激活因子3(Signal Transducer and Activator of Transcription 3,STAT3)抗体、促分裂原活化的蛋白激酶P38(Mitogen-activated Protein Kinase P38,P38 MAPK)抗体、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate Dehydrogenase,GAPDH)抗体(武汉三鹰生物技术有限公司,货号分别为10253-2-AP、14064-1-AP、10494-1-AP)、胞外信号调节激酶1/2(Extracellular Regulated Kinase1/2,ERK1/2)抗体(武汉博士德生物工程有限公司,货号:BM4326),磷酸化胞外信号调节激酶1/2(Phosphorylated Extracellular Regulated Kinase1 1/2,p-ERK1/2)抗体(北京博奥森生物技术有限公司,货号:bs-3016R),羊抗兔二抗、羊抗鼠二抗(北京博奥森生物技术有限公司,货号分别为bs-0295G-HRP、bs-0296G-HRP),乙二胺四乙酸(Ethylenediaminetetraacetic Acid,EDTA)抗原修复液(北京中杉金桥生物技术有限公司,货号:21110203),人肺腺癌A549细胞由美国克利夫兰州立大学Aimin Zhou实验室提供,电泳仪、电转仪(Bio-rad,美国,货号分别为1645070、BE6085)。
1.2 方法
1.2.1 固本解毒方的候选活性成分与靶点预测 通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)检索固本解毒方中除补骨脂外各味中药的化学成分,以口服生物利用度(Oral Bioavailability,OB)≥30%且类药性(Drug Likeness,DL)≥0.18为条件进行筛选[10],获得各味中药的候选活性成分。利用中药分子机制生物信息学分析工具平台(Bioinformatics Analysis Tool for Molecular mechANism of Traditional Chinese Medicine,BATMAN-TCM)以Score cutoff=20,P-value=0.05为条件筛选补骨脂的主要候选活性成分,将其候选活性成分输入Swiss ADME平台(http://www.swissadme.ch/),设置潜在核心化合物的标准为:1)肠胃吸收显示为“High”;2)5类药性预测结果中有2个及2个以上显示为“Yes”,保留符合以上条件的成分[11]。将中药候选活性成分的2D结构输入Swiss Target Prediction平台(http://www.swisstargetprediction.ch/),初步预测固本解毒方的潜在作用靶点。
1.2.2 肺腺癌和肿瘤免疫微环境相关靶点的筛选 分别以“lung adenocarcinoma”“tumor immune microenviroment”为关键词在GeneCards(https://www.genecards.org/)数据库以及DisGeNET(https://www.disgenet.org/)数据库中进行疾病相关靶点的筛选。GeneCards数据库收集多个数据库以及科学文献、组学数据,数据整合度好,在GeneCards中分别检索肺腺癌和TIME的相关靶点,并以相关性分数(Relevance score)排序,分别以大于3倍中位数、2倍中位数为筛选条件[12],去除重复项后得到肺腺癌和TIME候选疾病靶点。DisGeNET数据库根据多个数据库整合了人类基因-疾病关联。在DisGeNET数据库中检索疾病靶点,并以Score_gda值大于0.1的靶点为候选疾病靶点。通过Uniprot(https://www.uniprot.org/)数据库规范疾病相关靶点的名称后取交集获得肺腺癌免疫微环境的相关靶点。
1.2.3 蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络的构建 将固本解毒方、肺腺癌以及TIME的相关靶点取交集,获得固本解毒方干预肺腺癌免疫微环境的潜在作用靶点,输入PPI数据库(Search Tool for the Retrieval of Interaction Gene/Proteins,STRING)(https://string-db.org)数据库,将物种选择为“Homo sapiens”,最小互相作用阈值调至为Highest confidence(0.9),并隐藏游离节点,获得潜在作用靶点的PPI网络,最后利用Cytoscape 3.7.1软件对获得的PPI网络进行可视化。用CytoNCA插件分析节点交互关系,计算中心性(Degree Centrality,DC)、介度中心性(Betweenness Centrality,BC)、接近中心性(Closeness Centrality,CC)等值,并计算上述所有值的中位数,移除低于中位数的目标获得核心潜在作用靶点。将获取的药物候选活性成分、潜在作用靶点等数据导入Cytoscape软件,构建中药-候选活性成分-潜在靶点网络并进行拓扑分析,得出核心候选活性成分。
1.2.4 富集分析 通过DAVID数据库(https://david.ncifcrf.gov/)对固本解毒方与肺腺癌、TIME的交集靶点进行基因本体(Gene Ontology,GO)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析,分析潜在作用靶点所涉及的生物学功能以及相关联的通路。
1.2.5 固本解毒方药理作用特点分析 将固本解毒方干预肺腺癌免疫微环境的潜在作用靶点进一步通过马尔可夫聚类算法进行聚类分析,根据各分组对应的通路及病理环节研究固本解毒方的具体药理作用特点。
1.2.6 候选活性成分-核心潜在作用靶点分子对接验证 利用蛋白数据库(Protein Data Bank,PDB)(https://www.rcsb.org)及PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)分别下载核心靶点的晶体结构、核心候选活性成分的2D结构,应用Autodock Vina及AutoDockTools 1.5.6软件对其进行分子对接,分子对接结果用PyMOL软件进行可视化。
1.3 实验验证
1.3.1 分组与模型制备 将小鼠按随机数字表法随机均分为空白组、模型组、中药低剂量组、中药中剂量组、中药高剂量组,每组8只。将人肺腺癌A549细胞悬液推注入小鼠尾部静脉造模[13]。
1.3.2 给药方法 根据人与动物体表面积换算比值计算灌注剂量,中药低、中、高剂量组小鼠灌注剂量分别为13.875 g/(kg·d)、27.75 g/(kg·d)、高55.5 g/(kg·d),2次/d,持续3周,模型组以生理盐水灌胃。在禁食不禁水12 h后将各组小鼠腹腔注射1%戊巴比妥(50 mg/kg)麻醉,仰卧固定开胸,快速游离出小鼠的肺脏组织放入冻存管,迅速置于液氮罐内,后转移至-80 ℃冰箱冻存用于蛋白质印迹法检测,部分用4%的多聚甲醛液进行固定,常规脱水后石蜡包埋。
1.3.3 免疫组织化学检测 将各组小鼠的石蜡包埋组织以2.5 μm为标准切片,用二甲苯及乙醇脱蜡、脱水,柠檬酸抗原缓冲液抗原修复后根据SP法对石蜡标本进行一抗P38MAPK(1∶150)、STAT3(1∶200)、ERK1/2(1∶50)、p-ERK1/2(1∶200)37 ℃孵育过夜,最后显色及封片后在光学显微镜下观察。用Image J软件对各组小鼠切片的染色强度进行半定量分析,结果以平均光密度值表示。
1.3.4 蛋白质印迹法检测 将各组冻存的样本取出置于冰上裂解,离心后测定蛋白质浓度,95 ℃煮5 min后上样,行十二烷基硫酸钠聚丙烯酰胺电泳(Sodium Dodecylsulfate Polyacrylamide Gel Electrophoresis,SDS-PAGE)电泳,在4 ℃下以200 mA 90 min为条件转膜,室温摇床封闭2 h后加一抗P38MAPK及STAT3(1∶2 000)4 ℃孵育过夜,洗膜,加入二抗(1∶5 000)室温孵育1 h。显色曝光后使用Image J软件分析灰度值。

2 结果
2.1 固本解毒方的候选活性成分及其相关靶点 通过筛选共获得固本解毒方候选活性成分251种,经初步预测共获得895个固本解毒方的候选作用靶点。
2.2 疾病的相关靶点 经合并去重后分别得到肺腺癌及TIME相关靶点1 785个、1 736个,交集靶点共884个,将其与固本解毒方的候选作用靶点取交集之后得到固本解毒方作用于肺腺癌免疫微环境的潜在作用靶点217个。见图1。

图1 固本解毒方和肺腺癌、肿瘤免疫微环境的交集靶点
2.3 PPI网络的构建及核心靶点的筛选 所获取的潜在作用靶点构建PPI网络,网络节点大小、颜色透明度与度值的高低正相关,将度值≥20的潜在作用靶点进行可视化展示。见图2。利用CytoNCA插件筛选后获得核心潜在作用靶点STAT3、MAPK14、MAPK1、MAPK3等,核心候选活性成分主要包括槲皮素(Quercetin)、山柰酚(Kaempferol)、β-谷甾醇(Beta-sitosterol)、柚皮素(Naringenin)等。
2.4 潜在作用靶点基因的富集分析 GO富集分析结果涉及232个生物过程、130个细胞组分、152个分子功能,其中生物过程主要涉及信号转导、凋亡过程负向调控、细胞增殖正向调控、RNA聚合酶Ⅱ启动子的转录正调控等。细胞组分主要涉及细胞溶质、细胞质、细胞核、质膜等。分子功能主要涉及蛋白质结合、ATP结合、相同的蛋白质结合、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性等。KEGG通路富集共获取相关通路169条,涉及到的通路主要为癌症相关通路、磷脂酰肌醇-3-激酶-蛋白激酶B(Phosphatidylinositol-3-kinase/Protein Kinase B,PI3K-AKT)信号通路、MAPK信号通路、癌症中的蛋白聚糖等。

图2 潜在作用靶点的PPI网络
2.5 固本解毒方药理作用特点分析 通过马尔可夫聚类算法聚类分析后可将固本解毒方干预肺腺癌免疫微环境的潜在作用靶点主要分为4个靶点网络。见图3。分别与信号转导失常、内分泌代谢紊乱、细胞周期异常、病毒感染及免疫功能异常等相关。
2.6 药物主要候选活性成分与潜在的核心作用靶点分子对接 分子对接结果显示,各组结合能均<-5.0 kcal/mol(1 cal=4.184 J)。Beta-sitosterol与MAPK14的结合能最高,结合能<-9.0 kcal/mol,并且其与STAT3、MAPK1、MAPK3的结合能均<-7.0 kcal/mol,将此4组分子对接结果进行可视化分析。见表1,图4。

图3 固本解毒方药理作用特点分析

表1 主要候选活性成分结合能(kcal/mol)
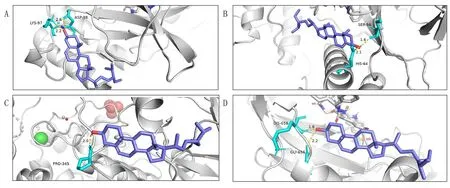
图4 分子对接3D模式图
2.7 固本解毒方对肺腺癌小鼠组织中ERK1/2、p-ERK1/2、P38 MAPK、STAT3蛋白表达的影响 与模型组比较,固本解毒方低、中剂量组ERK1/2、p-ERK1/2、STAT3蛋白表达均有所下降(P<0.05),固本解毒方低、中、高剂量组P38 MAPK蛋白表达均有所上升(P<0.05),低剂量固本解毒方影响最为显著。见图5,表2。
与模型组比较,固本解毒方低剂量组中STAT3蛋白表达水平显著下降(P<0.01),固本解毒方低、中、高剂量组中P38 MAPK的蛋白表达量均显著提高(P<0.001)。见图6,表3。
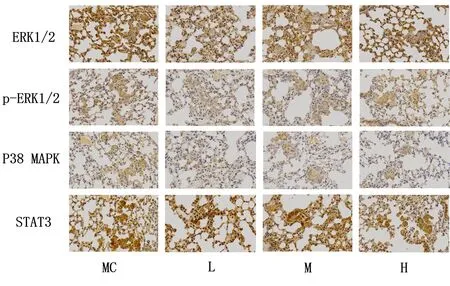
图5 各组核心蛋白的表达情况(免疫组织化学染色法,×400)
表2 各组核心蛋白表达情况的平均光密度值分析

图6 STAT3;MAPK14蛋白表达电泳

表3 各组中STAT3、P38 MAPK蛋白表达电泳的灰度值分析
3 讨论
研究发现,TIME与免疫治疗效果相关,提高免疫治疗的疗效需要更好地理解TME中免疫细胞的免疫调节作用[14]。在中医理论体系中,肺癌属“肺积”“积聚”等范畴。在《医宗必读》中对积聚的成因描述为“积之成者,正气不足,而后邪气踞之”。由此可见在中医的治疗理念中,肺癌的治疗应着眼于“正气不足”,也就是现在的免疫抑制[15-16]。中药在肿瘤的治疗中具有调节改善机体的免疫水平以及细胞功能,重塑其免疫表型,逆转TIME的作用[17],但是关于中药调节肺腺癌免疫微环境的分子机制和信号通路等方面的研究尚且不足。
本研究发现,固本解毒方干预肺腺癌免疫微环境的主要候选活性成分为槲皮素、山柰酚、β-谷甾醇、柚皮素等。现代研究发现,槲皮素、山柰酚等活性成分与多种肿瘤疾病相关,如刘鑫等[18]在研究当归补血汤治疗肺癌筛选出的主要活性成分也包含槲皮素、山柰酚,而马雪等[19]在研究大泻心汤治疗肺癌的作用机制时,也发现槲皮素、β-谷甾醇、山柰酚、柚皮素等与肺癌的发生发展密切相关,本研究进一步说明了槲皮素、β-谷甾醇、山柰酚、柚皮素等活性成分在肺癌治疗中的核心价值。槲皮素为黄酮醇之一,能有效阻止肿瘤细胞周期,促进其细胞凋亡,抑制其血管生成和转移,另外,它还能通过增加免疫细胞数量或调节免疫细胞内的胞内信号通路从而发挥免疫调节的作用[20]。山柰素可见用于化疗,有着抗菌、抗炎、抗肿瘤等多种药理活性,部分研究表明山柰酚可以增强T细胞的抑制功能,这说明山柰素可作用于人类自身的免疫性疾病[21]。β-谷甾醇有着较强的免疫调节功能,实验发现,β-谷甾醇可以增强巨噬细胞的免疫作用[22]。柚皮素有着多种药理活性,如抗癌、降糖、保肝等,柚皮素可以提高免疫力,修复DNA损伤,清除自由基[23]。由此可见,在肺癌等肿瘤疾病的治疗中,调节免疫细胞功能以及免疫细胞内的胞内信号通路等可能是槲皮素、山柰酚、β-谷甾醇、柚皮素等活性成发挥作用的重要方式。
固本解毒方干预肺腺癌免疫微环境的核心潜在作用靶点包括STAT3、MAPK14、MAPK1、MAPK3等。STAT3参与细胞增殖、存活、分化、血管生成等多种生物过程[24],大量的临床研究发现,STAT3的过度激活会降低免疫刺激因子的表达,同时增加某些细胞因子和生长因子的表达,从而产生深远的免疫效应[25]。MAPK1(ERK2)、MAPK3(ERK1)和MAPK14均是MAPK家族转导信号的重要环节[26-28]。ERKs是肿瘤免疫抵抗和免疫逃逸的多效调节因子[29],其中ERK1/2的激活主要与免疫抑制特性相关,涉及几乎所有已知的决定免疫抵抗或免疫逃逸的成分,通过抑制肿瘤细胞中的ERK1/2可以逆转化疗耐药和肿瘤诱导的免疫抑制。抑制ERK/STAT3信号通路还可阻断乳酸诱导M2巨噬细胞极化推动肿瘤的生长和血管生成的进程[30]。MAPK14在正常免疫和炎症反应中都发挥着重要作用。现有研究认为MAPK14的高表达促进了肿瘤的发生,但也有研究表明,MAPK14在人肺肿瘤中的表达比正常人肺组织低3倍以上,Mapk14的缺失会影响其对肺干和祖细胞功能的调控,诱发肺肿瘤的发生[31]。通过免疫组织化学以及蛋白质印迹法检测部分潜在核心靶点,研究发现固本解毒方可显著抑制或上调STAT3、ERK1/2、p-ERK1/2、MAPK14等蛋白的表达,这进一步证明了STAT3等靶点在固本解毒方干预肺腺癌免疫微环境中发挥了重要作用。
根据KEGG通路富集分析结果,固本解毒方干预肺腺癌免疫微环境涉及到的主要通路有PI3K-AKT信号通路、MAPK信号通路等。既往研究发现,PI3K-AKT信号通路、MAPK信号通路与癌症以及自身免疫系统疾病均有密切的关联。PI3K/AKT信号通路在肿瘤的发生、增殖、侵袭、转移以及免疫微环境等均存在着密切的关联[32],研究发现,多种药物免疫功能的发挥均与PI3K/AKT通路的激活相关[33]。朱冬菊等[8]研究发现固本解毒方肺癌抑制A549细胞迁移与调控PI3K/AKT信号通路密切相关。MAPK信号通路的异常是多种肿瘤发生的诱因之一,它与细胞分化、增殖、侵袭、血管生成、凋亡和转移等肿瘤发生的多个方面相关[34]。
根据马尔可夫聚类算法对潜在作用靶点聚类分析的结果,固本解毒方在调节肺腺癌免疫微环境的过程中,或许是通过促进信号转导、调节内分泌代谢、稳定细胞周期、抗病毒感染等改善免疫微环境,激活免疫功能,从而发挥了抗肿瘤的作用,这进一步揭示了固本解毒方在调节肺腺癌免疫微环境中的作用机制。
本研究通过网络药理学的方法,初步探索了固本解毒方干预肺腺癌免疫微环境的作用机制,并通过分子对接及动物实验进行了初步验证。研究结果表明,固本解毒方调节肺腺癌免疫微环境的主要是通过槲皮素、山柰酚、β-谷甾醇、柚皮素等核心候选有效成分作用于STAT3、MAPK14、MAPK1、MAPK3等核心潜在作用靶点从而促进信号转导、调节内分泌代谢、稳定细胞周期、抗病毒感染发生的,这一过程与PI3K-AKT信号通路、MAPK信号通路密切相关。本研究初步揭示了固本解毒方调节肺腺癌免疫微环境的作用机制,为肺腺癌的临床治疗提供了一定的依据,同时也为固本解毒方的进一步研究奠定了基础。但是本研究仅对固本解毒方干预肺腺癌免疫微环境的核心靶点进行了验证,今后还需要更多实验进一步完善固本解毒方的理论研究,为临床用药提供依据。
利益冲突声明:无。
