不同乳酸菌发酵对迟菜心副产物品质及风味的影响
2023-12-29罗文珊杜晓仪徐玉娟吴继军余元善李璐
罗文珊,杜晓仪,徐玉娟*,吴继军,余元善,李璐*
1(广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室, 广东省农产品加工重点实验室,广东 广州, 510610)2(江西农业大学 食品科学与工程学院,江西 南昌,330000)
迟菜心是以花薹为主食部分的叶菜,是菜心的一种,属于十字花科芸薹属,产自中国广州。迟菜心含有丰富的维生素、矿物质、氨基酸等多种营养成分,具有“菜心之冠”的美誉,长期食用迟菜心可起到清除肠道毒素、改善便秘、预防肠癌、增强身体免疫力等功效[1-2]。但目前迟菜心只取花薹部位食用,菜叶、菜梗和菜头等副产物则被废弃,不仅会造成资源的浪费,还会污染环境[3-4]。微生物发酵是果蔬副产物加工最常用的方法之一。将迟菜心副产物经微生物发酵,研制健康安全型发酵蔬菜,在保留迟菜心副产物本身所含有的丰富营养成分的基础上,为迟菜心副产物发酵制品增添多种功能因子并赋予其更丰富的风味,既能提高迟菜心副产物的附加值,又能减少资源浪费和环境污染。
泡菜是我国传统食品之一,历史悠久,含有丰富的有机酸、维生素、氨基酸等生物活性成分,因其口感爽脆、风味独特、营养价值高而深受消费者喜爱[5-6]。利用蔬菜表面的微生物进行自然发酵是制作泡菜的传统方法,至今仍被广泛使用[7]。然而,在自然发酵过程中,各种微生物的生长容易导致产品的质量差异,进而影响泡菜产业的发展[8-9]。目前,某些乳酸菌作为发酵剂在泡菜中的应用已引起人们的关注,使用发酵剂可以缩短发酵周期,控制产品质量并改善风味[10]。
乳酸菌是泡菜发酵中的主导微生物,对泡菜的质量、风味和口感起着关键作用[11]。有研究表明,不同发酵原料适宜的乳酸菌发酵剂具有差异性,LEE 等[12]发现PK08短乳杆菌可以作为发酵剂来提高Napa卷心菜的安全性。WANG等[13]研究显示经植物乳杆菌发酵的芥菜块茎具有更好的风味、质地和安全性。卢宏皓等[14]认为柠檬明串珠菌可以快速启动竹笋发酵,发酵产品的亚硝酸盐含量更低。为了生产高品质的发酵产品,有必要选择适宜的菌种作为发酵剂。然而目前尚未有关于迟菜心副产物发酵菌株的研究报道。因此,本研究以肠膜明串珠菌、干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌和发酵乳杆菌作为发酵剂,综合比较不同乳酸菌发酵迟菜心副产物过程中活菌数、理化性质和挥发性成分的差异,挖掘出适宜迟菜心副产物发酵的乳酸菌,旨在为高品质迟菜心副产物泡菜的开发提供科学依据。
1 材料和方法
1.1 材料与菌株
迟菜心副产物来自于广东广州市增城区迟菜心种植基地;食盐、白糖,市售;肠膜明串珠菌(Leuconostocmesenteroides)Z3、干酪乳杆菌(Lactobacilluscasei)M25、嗜酸乳杆菌(Lactobacillusacidophilus)F11、植物乳杆菌(Lactobacillusplantarum) S1、发酵乳杆菌(Lactobacillusfermentum)G9为实验室自有菌株。其中,肠膜明串珠菌Z3、嗜酸乳杆菌F11、植物乳杆菌S1、发酵乳杆菌G9均从泡菜中分离获取,干酪乳杆菌M25从发酵乳制品中分离获取。
1.2 主要试剂
葡萄糖、乳酸、乙酸、癸酸乙酯,上海源叶生物有限公司;MRS肉汤和MRS琼脂培养基,广东环凯有限公司;亚硝酸钠,福晨(天津)化学试剂有限公司;其他试剂均为国产分析纯。
1.3 仪器与设备
SPX-250B-Z生化培养箱,上海博讯实业有限公司;SW-CJ-2FD无菌操作台,苏州安康空气技术有限公司;PB-10型pH计,德国Sartorius公司;WF-A2000榨汁机,美的集团公司;Biofuge Stratos Sorvall高速冷冻离心机,美国Thermo Fisher Scientific公司;高效液相色谱仪和UV1800紫外分光光度计,日本岛津公司;HH-2数显恒温水浴锅,常州金坛精达仪器制造有限公司;7890-5977B气相色谱-质谱联用仪,美国Agilent科技公司;DF-101S集热式磁力搅拌器,上海力辰邦西仪器有限公司。
1.4 乳酸菌发酵剂的制备
取-80 ℃冰箱保藏的5株乳酸菌(肠膜明串珠菌Z3、干酪乳杆菌M25、嗜酸乳杆菌F11、植物乳杆菌S1、发酵乳杆菌G9)分别于MRS固体培养基中划线,然后于37 ℃培养48 h,挑取各乳酸菌的单菌落分别接种于MRS液体培养基,于37 ℃培养16 h,再按0.5%(体积分数)的接种量加到MRS液体培养基进行二次活化,作为各乳酸菌发酵剂的活化种子液。
1.5 泡菜的制备
准备含有3%(质量分数)盐和2%(质量分数)糖的无菌水,迟菜心副产物清洗干净后切成小段(5~7 cm),放入沸水中热烫1 min,取出后沥干水分,将迟菜心副产物和盐水以1∶2(质量比)的比例浸泡在泡菜罐中。将活化好的5种乳酸菌分别接入泡菜中,使各实验组的初始乳酸菌数为7.00 lg CFU/mL左右,并以自然发酵为对照组,30 ℃密封发酵15 d。在迟菜心副产物发酵的第0、1、2、3、6、9、12、15天取样后打浆,并保存在-20 ℃进行后续分析。
1.6 泡菜发酵过程中各指标的测定
乳酸菌数:取发酵液,参照GB 4789.35—2016《食品微生物学检验 乳酸菌检验测定》中平板计数法测定。
pH值和总酸:pH值用pH计法直接测定发酵液,总酸则参照GB 12456—2021《食品中总酸的测定》。
还原糖:参照GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》的3,5-二硝基水杨酸法。
亚硝酸盐:参照GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》的分光光度法。
有机酸的测定:参照YU 等[15]的方法略作修改。取0.5 g泡菜浆,加入1.5 mL 3%(质量分数)的偏磷酸溶液,超声提取20 min,以12 000 r/min离心10 min,取上清液过0.22 μm水相滤膜后,采用HPLC分析,色谱条件如下:C18(WondaSil 4.6 mm×250 mm)色谱柱,柱温30 ℃,检测波长210 nm,流动相0.1 mol/L的磷酸氢二铵溶液(pH=2.7),流速为1 mL/min,进样量10 μL;检测器为二极管阵列检测器。
挥发性风味物质的测定:1)顶空固相微萃取:取5 g泡菜匀浆于20 mL顶空瓶中,加入10 μL 100 mg/L的癸酸乙酯作为内标物,用螺旋盖密封顶空瓶并置于50 ℃水浴锅中平衡10 min后,将老化完全的萃取头插入顶空瓶内萃取40 min,随后取出萃取头插至GC-MS进样口,解析5 min并同时采集数据;2)GC-MS条件:采用罗文珊等[16]的方法测定。
1.7 数据分析
每个实验3组平行,结果采用平均值±标准差表示。实验数据运用Excel 2021整理,IBM SPSS Statistics 20的Duncan’s multiple range tests进行方差分析,Origin2021作图;GC-MS定性定量通过NIST谱库检索和解析,以匹配度>85%的物质进行定性分析,采用内标法对各挥发性物质定量。
2 结果与分析
2.1 迟菜心副产物发酵过程中乳酸菌数的变化
如图1所示,5种乳酸菌均能在迟菜心副产物泡菜体系中较好的生长。自然发酵组的初始乳酸菌数为2.96 lg CFU/mL,而其他实验组由于接种乳酸菌所以初始活菌数较高(6.58 lg CFU/mL~7.03 lg CFU/mL)。在0~1 d内所有实验组乳酸菌处于对数期,活菌数急剧增加,接种组发酵1 d后乳酸菌数出现轻微的下降后在第6天进入一个维持波动但相对稳定的阶段,而自然发酵组在发酵第2天后才开始下降,第9天进入稳定期,与先前的研究一致[17-18]。这可能是由于乳酸菌的急剧增加导致pH值快速降低,进而抑制乳酸菌的生长[19]。从图1还可发现植物乳杆菌S1组和发酵乳杆菌G9组在整个发酵过程中乳酸菌数均处于较高水平,而其发酵体系的pH值均维持在较低水平,表明这两株菌较其他乳酸菌具有更强的耐酸能力[20]。
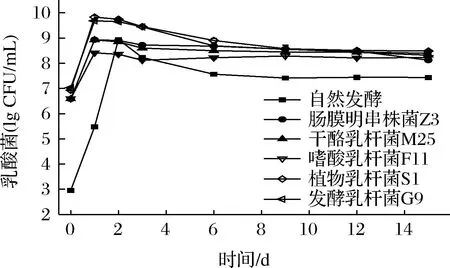
图1 迟菜心副产物发酵过程乳酸菌数的变化Fig.1 Changes in the number of lactic acid bacteria during the fermentation of Chicaixin by-products
2.2 迟菜心副产物发酵过程中pH和总酸的变化
pH值和总酸会影响微生物的生长和代谢,是泡菜发酵过程中的重要指标[21]。迟菜心副产物发酵过程中pH和总酸的变化情况如图2所示。由图2-a可知,随着发酵的进行,自然发酵组和嗜酸乳杆菌F11组的pH值均呈先快速下降后缓慢下降的趋势,其他发酵组的pH值在第1天快速下降后趋向于稳定,但自然发酵组的pH值始终高于接种组;由图2-b可知,各发酵组的总酸含量随着发酵的进行均逐渐升高。其中,自然发酵组的总酸含量在发酵过程中一直低于接菌组,可能是由于发酵前期自然发酵组乳酸菌数较少,产酸能力弱,这与李俊健等[22]的研究结果一致。由图2可知所有实验组中,植物乳杆菌S1组的pH值在发酵过程中均维持在较低水平,而其总酸处于较高水平,两者呈现负相关关系。以上结果表明不同乳酸菌对发酵迟菜心副产物pH和总酸的影响存在显著差异,其中植物乳杆菌S1在该体系中生长代谢较好。
2.3 迟菜心副产物发酵过程中还原糖含量的变化
还原糖的变化可以反应发酵过程中微生物的生长代谢情况[23]。如图3所示,所有实验组的还原糖含量在发酵过程中均呈先上升后下降的趋势,这可能是由于发酵前期微生物数量少,对还原糖的消耗较少,且迟菜心副产物自身还原糖溶解出来进而导致还原糖含量上升;而随着还原糖溶解速度变慢,微生物数量增多,对还原糖的消耗也随之增多而导致还原糖含量逐渐下降,这与陈大鹏等[24]的研究结果一致。其中,自然发酵组峰值最小(5.57 mg/100 g),结束时其残糖量最高(2.79 mg/100 g),这可能是由于自然发酵组的初始乳酸菌数少,需要消耗更多的还原糖用于生长繁殖,而随着发酵的进行,自然发酵组的乳酸菌数始终低于接种组,导致发酵结束时其残糖量高于自然发酵组[21]。不同乳酸菌发酵组的峰值和残糖量相近,但存在显著性差异,其中发酵乳杆菌G9组和植物乳杆菌S1组的变化量最大(5.26~5.46 mg/100 g),表明这两种乳酸菌能够在迟菜心副产物泡菜中较好的生长。

a-发酵过程pH值的变化;b-发酵过程总酸含量的变化图2 迟菜心副产物发酵过程pH和总酸的变化Fig.2 Changes in pH and total acid during fermentation of Chicaixin by-products

图3 迟菜心副产物发酵过程还原糖含量的变化Fig.3 Changes in reducing sugar content during fermentation of Chicaixin by-products
2.4 迟菜心副产物发酵过程中主要有机酸的变化
有机酸是构成酸味的主要物质,是评价泡菜品质的重要指标之一[21]。已有研究表明,乳酸和乙酸是泡菜发酵过程中乳酸菌代谢产生的主要有机酸[25]。迟菜心副产物发酵过程中乙酸和乳酸的变化如表1所示。发酵结束时各发酵组中乳酸含量均为最高,表明乳酸是迟菜心副产物发酵产生的主要有机酸,其在发酵过程中呈上升的趋势,且接菌组的乳酸含量始终高于自然发酵组。发酵结束时,所有发酵组中植物乳杆菌S1发酵的迟菜心副产物乳酸含量最高,其次是干酪乳杆菌M25和嗜酸乳杆菌F11,这与同型发酵产乳酸能力高于异型发酵的结论一致[26]。自然发酵是多种菌协同发酵,且前期多为异型发酵[27],其乙酸含量比同型发酵的3个实验组高,而接菌组中作为异型发酵代表的肠膜明串珠菌Z3和发酵乳杆菌G9在第3天就达最大值,乙酸的峰值和最终含量均高于自然发酵组且提高了20%以上。总体而言,接菌组中乳酸和乙酸产生的速率较快,可有效缩短迟菜心泡菜的发酵周期。

表1 迟菜心副产物发酵过程主要有机酸含量的变化 单位:mg/100 g
2.5 迟菜心副产物发酵过程中亚硝酸盐含量的变化
亚硝酸盐一直是阻碍酱腌菜发展的食品安全问题,我国对其在酱腌菜中的含量进行了规定(≤20 mg/kg)[28]。泡菜发酵过程会形成“亚硝峰”,其主要是由蔬菜原料表面的微生物通过硝酸还原酶作用将蔬菜中的硝酸盐还原成亚硝酸盐而形成的[29]。如图4所示,在整个发酵过程中,不同发酵组的亚硝酸盐含量均呈先升高后下降的趋势;自然发酵组在第2天出现“亚硝峰”(57.39 mg/kg),而接菌组均在第1~2天陆续出现,且峰值较低(1.23~6.72 mg/kg),这可能是由于自然发酵组在发酵开始时乳酸菌还未主导发酵,泡菜表面杂菌将硝酸盐还原成亚硝酸盐[30]。接菌组在发酵开始时就由乳酸菌主导发酵,能抑制迟菜心副产物表面杂菌的生长,并分泌亚硝酸盐还原酶,分解亚硝酸盐,从而降低泡菜中亚硝酸盐的含量,改变“亚硝峰”的出现时间和峰值[7]。在所有发酵组中,植物乳杆菌S1发酵组的亚硝酸盐含量始终保持在最低状态,说明植物乳杆菌S1具有较好的降解亚硝酸盐的能力,可提升迟菜心副产物泡菜的安全性。

图4 迟菜心副产物发酵过程亚硝酸盐含量的变化Fig.4 Changes in nitrite content during fermentation of Chicaixin by-products
2.6 不同乳酸菌对发酵迟菜心副产物挥发性风味物质的影响
采用GC-MS检测不同乳酸菌发酵15 d时迟菜心副产物的挥发性风味物质,如表2所示,共检测到69种主要化合物。不同实验组检测到的挥发性风味物质的种类存在差异,自然发酵组、肠膜明串珠菌Z3组、干酪乳杆菌M25组、嗜酸乳杆菌F11组、植物乳杆菌S1组和发酵乳杆菌G9组中分别检测到30、35、49、28、42、36种主要化合物。按化学结构可分为酸类(3种),腈类(3种),醇类(10种),烯烃类(22种),醛类(10种),酮类(9种),酯类(6种),烷烃类(4种)和其他(2种)。其中,烯烃类和酮类物质占所有发酵组总挥发性风味物质的66.02%。有研究表明,烯烃类的香味物质阈值较低,对香气有重要贡献;而酮类多伴果香,对风味也有一定贡献[31]。
挥发性风味物质的分析中常用香气活度值(odor activity value,OAV)≥1的物质表示为样品的特征风味物质,OAV越高表明该物质对整体香味的贡献越多[32]。由表2可知,15种挥发性化合物存在于所有发酵组中,但其OAV差异较大。其中,OAV≥1的挥发性化合物有苯丙腈、4-异硫氰酸丁烯、D-柠檬烯、γ-松油烯、萘、1,2,3,4-四氢-1,1,6-三甲基萘、壬醛、癸醛、β-环柠檬醛、2-壬酮和香叶基丙酮,这些物质可认为是迟菜心副产物泡菜的特征风味物质。其中具有甜橙香味的D-柠檬烯、柑橘花香的癸醛以及黄瓜香味的壬醛OAV均大于100,表明这3种对发酵迟菜心副产物整体风味贡献最大。与自然发酵组相比,接种组中这3种物质的OAV均较高,尤其是肠膜明串珠菌Z3组、植物乳杆菌S1组和发酵乳杆菌G9组,说明肠膜明串珠菌Z3组、植物乳杆菌S1组和发酵乳杆菌G9组的风味更佳。除了以上3种风味物质,β-紫罗兰酮也是发酵蔬菜中常见的特征风味物质[33],其在自然发酵组中的OAV也超过100,但低于植物乳杆菌S1组。此外,不同发酵组总挥发性成分的含量存在较大差异。与自然发酵组相比,肠膜明串珠菌Z3组总挥发性成分的含量最高(10 194.76 μg/kg),植物乳杆菌S1组次之(9 730.51 μg/kg),嗜酸乳杆菌F11组含量最低(3 884.81 μg/kg)且低于自然发酵组,说明嗜酸乳杆菌F11对迟菜心副产物泡菜的风味无促进作用。除此之外,接种组的共有特征风味物质(OAV≥1)总含量(1 828.63~3 562.77 μg/kg)均比自然发酵组(1 599.28 μg/kg)高。肠膜明串珠菌Z3组、干酪乳杆菌M25组和植物乳杆菌S1组还含有较高浓度的2-十一烷酮和2-十三烷酮,两种物质分别呈鸢尾花香和椰子清香,其中植物乳杆菌S1组中这两种物质的含量最高,分别为2 358.32 μg/kg和1 338.96 μg/kg。综上,接菌发酵组的风味优于自然发酵,其中肠明膜串珠菌Z3和植物乳杆菌S1发酵组的风味最为浓郁。

表2 迟菜心副产物泡菜的挥发性物质的种类及含量 单位:μg/kg
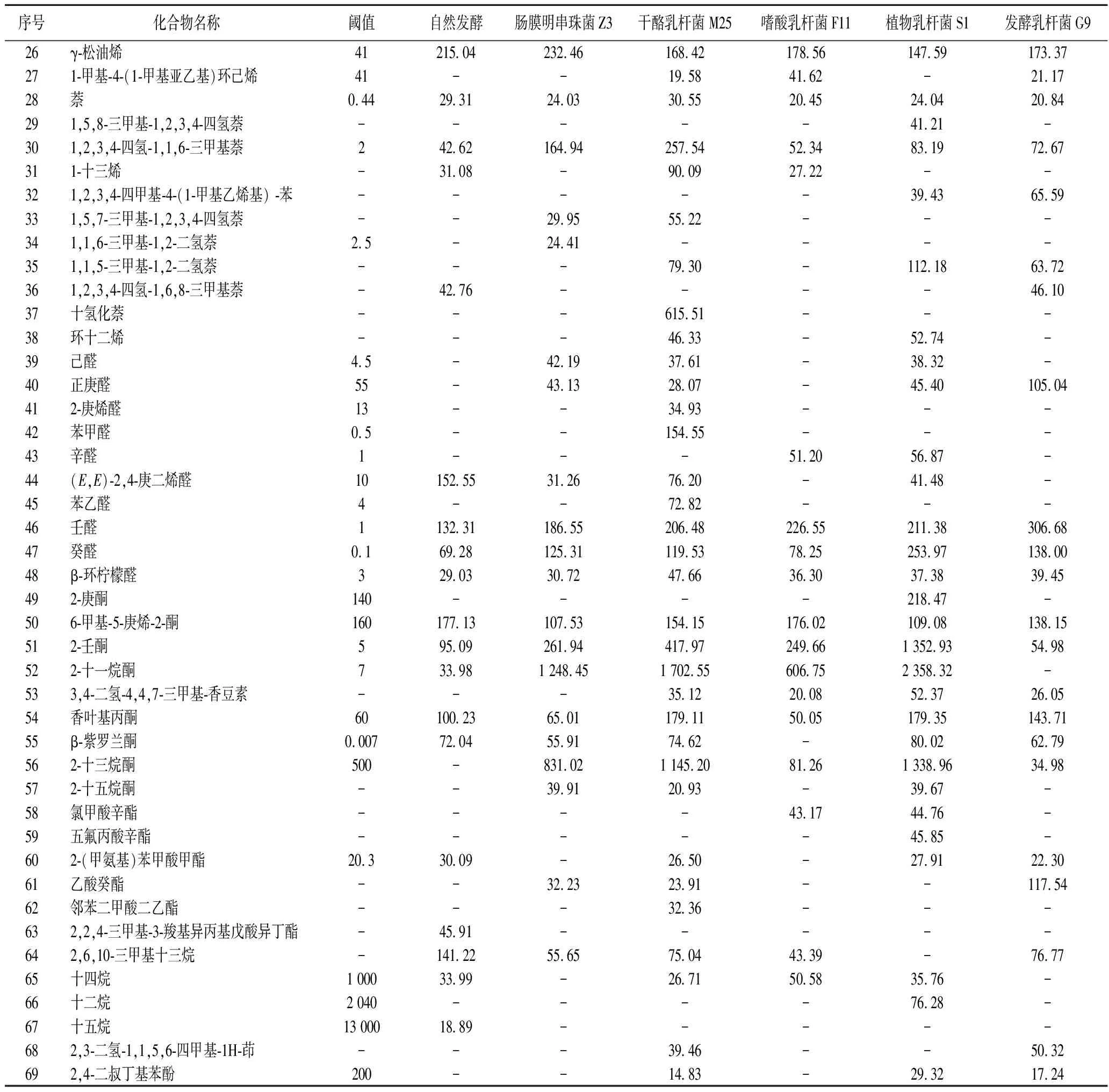
续表2
3 结论
本研究以迟菜心副产物为原料,肠膜明串珠菌Z3、干酪乳杆菌M25、嗜酸乳杆菌F11、植物乳杆菌S1、发酵乳杆菌G9为发酵菌剂,对比分析不同乳酸菌与自然发酵对迟菜心副产物泡菜品质的影响。结果表明,不同发酵组的乳酸菌数、pH值、总酸、还原糖、亚硝酸盐、乙酸、乳酸和挥发性风味成分均表现出显著差异。与自然发酵组相比,接种组的乳酸菌数高于自然发酵组,pH值迅速降低,总酸上升,可以快速启动发酵;发酵后期接种组的乳酸菌数、总酸以及主要有机酸含量均优于自然发酵组,且其pH值、还原糖含量和亚硝酸盐含量均低于自然发酵组,其中植物乳杆菌S1的发酵性能最佳。通过GC-MS分析迟菜心副产物泡菜的挥发性风味成分,结果显示,发酵结束时经肠膜明串珠菌Z3和植物乳杆菌S1发酵的迟菜心副产物挥发性风味物质的种类和含量均优于其他发酵组,整体风味比其他发酵组更为浓郁。总而言之,植物乳杆菌S1具有作为迟菜心副产物发酵泡菜专用菌株的潜在优势,一方面可以显著提高泡菜主要有机酸含量,降低亚硝酸盐含量,进而提升泡菜的品质;另一方面还可以丰富迟菜心副产物泡菜的风味,为迟菜心副产物的综合利用提供理论依据。
