加工工序对苦杏仁球蛋白免疫反应性及消化稳定性的影响
2023-12-28龙斐斐张清安张志华
龙斐斐,张清安,张志华,2
加工工序对苦杏仁球蛋白免疫反应性及消化稳定性的影响

1陕西师范大学食品工程与营养科学学院,西安 710119;2内蒙古高原杏仁露有限公司,内蒙古准格尔旗 017100
【背景】近年来,过敏已经成为全球关注的健康问题,过敏人群数量持续上升。坚果是常见的过敏诱因之一,苦杏仁为常见的坚果,因其含有致敏的苦杏仁球蛋白(amandin),成为最易引起过敏的坚果之一,因此,脱敏已成为其研究热点。苦杏仁加工一般要经过去皮、脱苦和干制等工序,而在这些加工过程中,其致敏性是否会受到影响尚未见到相关报道。【目的】探究加工工序对苦杏仁致敏性的影响,并以苦杏仁致敏性、品质和营养特性为评价指标,优化加工工序使苦杏仁产品致敏性最低,为低致敏性苦杏仁产品加工提供理论依据和技术支撑。【方法】采用Western blotting和ELISA试验研究不同去皮、脱苦和干制方法对苦杏仁中amandin免疫反应性的影响;采用圆二色光谱、外源荧光光谱、表面疏水性和zeta电位测定以研究各加工工序对amandin结构和表面性质的影响,分析致敏蛋白免疫反应性变化的机理;最后采用体外模拟消化试验探究加工前后苦杏仁中amandin的消化稳定性,并对消化产物进行Western blotting分析,进一步探究苦杏仁潜在致敏性的变化情况。【结果】就致敏性而言,苦杏仁经饱和热空气去皮和热烫去皮后的amandin免疫反应性分别降低了8.41%和13.15%,再经超声快速脱苦后amandin的免疫反应性又降低6.79%,热水脱苦对其免疫反应性无显著影响;脱苦杏仁经自然干燥和热风干燥后amandin的免疫反应性分别显著上升4.58%和2.81%(<0.05)。结合加工工序对苦杏仁品质和营养特性的影响,最终优化得到低致敏性苦杏仁的加工工序为饱和热空气去皮、超声快速脱苦和热风干制,经此工序加工后苦杏仁免疫反应性降低15.03%。就致敏蛋白结构而言,致敏蛋白的二级结构组成、三级结构、表面疏水性以及zeta电位在加工过程中都发生了一定程度变化,其中超声快速脱苦显著改变了amandin的三级结构并使其表面疏水性显著增强(<0.05),从而使其免疫反应性降低最显著。就消化稳定性而言,加工后的amandin消化稳定性明显降低,致敏蛋白中与特异性抗原抗体反应相关结构降解速度加快,导致苦杏仁的潜在致敏性进一步降低。【结论】不同加工工序处理可通过改变amandin的结构而对苦杏仁致敏性产生影响,生产中可以通过合理的加工方式来降低苦杏仁的致敏性。
苦杏仁;苦杏仁球蛋白;加工;免疫反应性;消化稳定性
0 引言
【研究意义】苦杏仁作为常见的坚果,除含有大量的功能性成分,如酚类化合物、黑色素、膳食纤维和苦杏仁苷等外;还含有很高的营养成分,含油量约为45%—50%、粗纤维9.4%、蛋白质23.6%—26.2%、总糖9%,因此,苦杏仁常用作药食两用资源[1-3]。但由于苦杏仁含有致敏的苦杏仁球蛋白(amandin),也让其成为最易引发过敏反应的坚果之一[4],易引发食品安全问题。脱敏已成为该领域的研究热点,目前对苦杏仁致敏性在加工过程中的变化及机制研究少有报道,有必要探究加工方法对苦杏仁致敏蛋白的影响,以便为低致敏性苦杏仁及其相关产品的开发提供参考。【前人研究进展】苦杏仁含有与美国大扁杏仁(almond)相同的主要过敏原苦杏仁球蛋白(amandin)[5]。amandin是一种11S球蛋白,分子量约360 kDa,由6个单体聚合而成,每个单体由一个酸性亚基(42—46 kDa)和一个碱性亚基(20—22 kDa)通过二硫键连接[6]。其具有高度水溶性,是主要的储藏蛋白,约占almond水溶性蛋白的60%[7],包含过敏患者血清IgE识别的主要反应多肽[8],与摄入杏仁引发的过敏反应有关[9]。Willison等[10]用小鼠单克隆抗体(mAb)4C10对amandin的构象表位进行了研究,并对amandin亚基进行测序、克隆和筛选,从而用于对杏仁过敏患者血清中IgE的结合研究。结果显示,相较于构象表位,amandin亚基上的线性表位对其免疫反应性起着更为重要的作用[11]。amandin还具有一定的热稳定性,无论是烫漂、烘烤或高压灭菌处理都不能显著降低其在苦杏仁中的含量[9]。Venkatachalam等[12]研究了焙烤、烫漂、高压灭菌和微波处理对amandin免疫反应性的影响,结果显示amandin的免疫活性相对稳定。ALBILLOS等[6]对amandin及其酸性和碱性多肽的热稳定性进行了分析,并对尿素处理后amandin的化学变性状态进行研究,结果显示,amandin在还原剂作用下发生不可逆变形,且由热和化学变性产生的碱性和酸性多肽的热稳定性低于多聚体蛋白。Kshirsagar等[13]研究发现SDS、-巯基乙醇使amandin的免疫反应性显著降低。由此可见,关于amandin的研究大多都是甜杏仁,缺乏苦杏仁免疫反应性尤其加工对免疫反应性影响的研究,因此有必要结合苦杏仁加工过程中不同工序及技术,来探究苦杏仁免疫反应性变化。【本研究切入点】由于苦杏仁含有苦杏仁苷,其加工一般要经过去皮、脱苦和干制等过程,而这些加工工序对苦杏仁致敏蛋白免疫特性影响及机制有待研究。【拟解决的关键问题】通过Western blotting和ELISA分析,研究不同去皮、脱苦和干制方法处理对苦杏仁amandin免疫反应性的影响;采用圆二色谱、外源荧光光谱、表面疏水性测定和zata电位测定探究加工方法对amandin结构的影响进而明确变化机制;采用体外模拟消化试验,分析加工对amandin消化稳定性的影响。
1 材料与方法
1.1 材料与试剂
苦杏仁,陕西省思源药材行;8-苯胺-1-萘磺酸,上海麦克林生化科技有限公司;BCA蛋白定量试剂盒,北京博奥森生物技术有限公司;SDS-PAGE凝胶配制试剂盒及电泳液、蛋白上样缓冲液(5×)、彩色预染蛋白分子量标准、转印滤纸、PVDF摸QuickBlockTMWestern溶液套装、辣根过氧化物酶标记山羊抗兔IgE、超敏ECL化学发光试剂盒、Tween-20、QuickBlock封闭液(PBS)、TMB显色液和TMB显色终止液,上海碧云天生物技术有限公司;兔源amandin多克隆抗体,武汉优越达生物科技有限公司;丽春红染液,陕西中辉赫彩生物医药科技有限公司;96孔不可拆酶标板(高结合力),北京兰杰柯科技有限公司;人工模拟唾液、人工模拟胃消化液、人工模拟十二指肠液和人工模拟胆汁,北京雷根生物技术有限公司。
1.2 苦杏仁加工工序
1.2.1 苦杏仁去皮方法 饱和热空气去皮[14]:准确称取300.00 g苦杏仁,按料液比1﹕2(g·mL-1)加入去离子水600 mL浸渍23 min,捞出苦杏仁后平铺于烤盘,放入蒸汽烤箱中,设置蒸汽温度65 ℃,时间6 min。处理完成后取出苦杏仁揉搓去皮。去皮后样品置于-20 ℃,用于后续提取amandin和脱苦加工。
热烫去皮[15]:准确称取300.00 g苦杏仁,加入1 200 mL沸水热烫4 min后捞出,揉搓去皮。去皮后样品用于后续提取amandin和脱苦加工。
1.2.2 苦杏仁脱苦方法 超声快速脱苦[16]:将去皮后的苦杏仁与去离子水按照料液比1﹕12(g·mL-1)装入烧杯中,放入超声池内,设置超声参数为温度55 ℃、功率300 W、频率59 kHz,时间60 min。脱苦后样品用于后续提取amandin和干制加工。
热水脱苦[17]:将去皮苦杏仁按料液比1﹕12(g·mL-1)浸泡于70 ℃热水中,每2 h换一次热水,经8 h即可完成脱苦。脱苦后的样品用于后续提取amandin和干制加工。
1.2.3 苦杏仁干制方法 热风干燥[18]:去除脱苦杏仁表面水分,均匀平铺于烘盘并放入烘箱,设置烘箱温度为80 ℃,3 h后取出,得到干燥的苦杏仁,用于后续提取amandin。
自然干燥[18]:去除脱苦杏仁表面水分,均匀平铺于烘盘中,放在通风处自然晾干,36 h后得到干燥的苦杏仁,用于后续提取amandin。
1.3 amandin的提取
制备脱脂苦杏仁粉:将上述加工后的苦杏仁用高速粉碎机打磨成粉。苦杏仁粉与正己烷以1﹕10(w/v)的比例混合进行脱脂。脱脂苦杏仁粉与去离子水以1﹕30(w/v)的比例混合,磁力搅拌提取1 h后6 000 ×离心20 min,收集上清液,重复提取两次,合并两次浸提液,经0.45 µm纤维素滤膜过滤,收集滤液置于4 ℃过夜,在4 ℃ 12 000 ×条件下离心40 min,收集沉淀,其主要物质即为致敏蛋白amandin(约65%)。将收集的沉淀溶于PBS(0.01 mol∙L-1,pH 7.4)缓冲液中,用去离子水透析9 h,每3 h更换一次去离子水,最后冻干得到蛋白粉末于-20 ℃保存备用[19]。
1.4 amandin免疫反应性测定
1.4.1 BCA蛋白含量测定 将标准品BSA用PBS(0.01 mol∙L-1,pH 7.4)溶液稀释至0.5 mg∙mL-1。根据标准品和样品数量,按照体积比A﹕B=50﹕1配置适量BCA工作液,充分混匀。再将0.5 mg∙mL-1的标准品按0、1、2、4、8、16和20 µL加到96孔板的样品孔中,再加PBS补足至20 μL,即得到0—0.5 mg∙mL-1的标准品溶液。取苦杏仁致敏蛋白冻干粉0.2 mg溶解于1 mL PBS中,再分别稀释2倍、4倍、8倍加到样品孔中。然后在各样品孔中加入200 μL BCA工作液,37 ℃孵育30 min,用酶标仪测定562 nm的OD值,根据标准曲线计算蛋白浓度。
1.4.2 SDS-PAGE 取0.2 mg∙mL-1蛋白溶液40 µL与10 µL 5×上样缓冲液混合均匀,沸水浴10 min,得到还原性蛋白样品;取0.2 mg∙mL-1蛋白溶液40 µL与10 µL 5×非还原上样缓冲液(不含DDT或-巯基乙醇)混合均匀,得到非还原性蛋白样品。配置12%的分离胶和5%的浓缩胶。上样后,设置电泳程序为80 V、35 min后120 V、50 min。电泳完成后,取出胶板在考马斯亮蓝R-250染色液中浸泡2 h,然后在脱色液中浸泡,每30 min换一次脱色液,直至呈现清晰的蛋白条带[6]。
1.4.3 Western blotting 通过SDS-PAGE分离的致敏蛋白,通过湿法转印至0.2 μm PVDF膜上,用洗涤液洗去蛋白膜表面的转膜液后,在4 ℃下用封闭液将膜封闭过夜,用洗涤液清洗3次,每次清洗5 min。然后,将膜放入装有适量一抗(1﹕1 500体积比稀释的兔抗amandin)的孵育盒中,在4 ℃下孵育1 h后,用洗涤液清洗3次,每次清洗5 min。再将其放入装有适量二抗(1﹕1 000体积比稀释的HRP标记的山羊抗兔IgG)的孵育盒中,在室温下孵育2 h,用洗涤液清洗3次,每次清洗5 min。将超敏ECL化学发光试剂盒中显色液A和显色液B等体积混合,立即滴在PVDF膜上,通过化学发光图像分析系统采集图片[20]。
1.4.4 间接竞争ELISA 用包被液配制浓度为50 μg∙mL-1的amandin溶液,按100 μL/孔加至96孔板,4 ℃孵育过夜。弃去板内包被液,按200 μL/孔加入PBST清洗96孔板,清洗3次,每次3 min。按200 μL/孔加入QuickBlock封闭液,37 ℃封闭30 min。封闭完成后洗板3次,每次3 min,将抗amandin抗体(anti-amandin antibody)以1﹕5 000(v/v)比例稀释,按100 μL/孔加入96孔板,37 ℃孵育一抗60 min。再次洗板,每次3 min,将辣根标记山羊抗兔IgE以1﹕8 000(v/v)比例稀释,按100 μL/孔加入96孔板,37 ℃孵育二抗60 min。洗板3次,每次3 min,按100 μL/孔加入TMB显色液,室温避光孵育10 min,加入100 μL/孔TMB显色终止液终止反应;用酶标仪在450 nm波长下测定OD值[21]。
1.5 amandin结构特性测定
1.5.1 圆二色谱分析 圆二色光谱是用于分析推断非对称分子构型和构象的一种旋光光谱,被广泛用于测定蛋白质的二级结构[22]。将从不同加工处理后苦杏仁中提取的致敏蛋白冻干粉溶解于PBS(0.01 mol∙L-1,pH 7.4)溶液中制得1 mg∙mL-1样品溶液,再稀释溶液至0.1 mg∙mL-1,并于1 mm石英比色皿中进行圆二色光谱测定。扫描波长范围为190—260 nm,采集时间为1 s,带宽为2 nm,平行测定3次取平均值并扣除空气与PBS的背景值[6]。二级结构组成通过圆二色光谱在线分析软件Dichroweb进行分析。
1.5.2 外源荧光分析 将从不同加工处理后苦杏仁中提取的致敏蛋白冻干粉溶解于PBS(0.01 mol∙L-1,pH 7.4),得到0.2 mg∙mL-1样品溶液,加入40 μL 8 mmol∙L-1的ANS溶液于4 mL样品溶液中并混合均匀,避光静置30 min。用荧光分光光度计在发射波长385—720 nm,激发波长372 nm,狭缝5 nm条件下扫描荧光光谱[23]。
1.5.3 表面疏水性测定 将从不同加工处理后苦杏仁中提取的致敏蛋白冻干粉溶解于PBS(0.01 mol∙L-1,pH 7.4),得到0.2 mg∙mL-1的样品溶液,再分别稀释至0.005、0.01、0.02、0.1和0.2 mg∙mL-1。分别加入40 μL 8 mmol∙mL-1ANS于4 mL样品溶液中并混合均匀,避光静置30 min。使用荧光分光光度计在激发波长372 nm,发射波长385—720 nm,狭缝5 nm条件下扫描荧光光谱,通过线性回归分析最大荧光强度对蛋白浓度的初始斜率,即为表面疏水性系数H0[24]。
1.5.4 Zeta电位测定 用PBS(0.01 mol∙L-1,pH 7.4)溶液配置1 mg∙mL-1的苦杏仁致敏蛋白溶液,用激光粒度Zeta电位仪测量电位。将约1.3 mL的蛋白溶液装入样品池,插入干净电极片,使溶液完全浸没电极片,连接电极线,放入样品槽进行测定。
1.6 amandin消化稳定性测定
1.6.1 Tricine-SDS-PAGE 将消化产物稀释3倍后,与上样缓冲液(5×)按4﹕1比例混合均匀。配置16.5%的分离胶、10%的夹层胶和4%的浓缩胶。上样后,设置电泳条件为:程序一为30 V、1 h,程序二为100 V、2 h,待溴酚蓝指示剂到达玻璃板底部时结束电泳。电泳完成后,取出胶板在考马斯亮蓝R-250染色液中浸泡2 h,再在脱色液中浸泡,每30 min换一次脱色液,直至呈现清晰的蛋白条带。
1.6.2 体外静态模拟消化 按照胡雪洁[25]的方法并稍作修改。分别制备两份致敏蛋白溶液,标记为A和B,每份取90 mg致敏蛋白冻干粉与2.5 mL蒸馏水混合均匀。将致敏蛋白溶液与其他体外模拟消化所需的各种溶液预热至37 ℃。
模拟口腔消化:分别在装有致敏蛋白溶液的锥形瓶A、B中加入2.5 mL口腔消化液,置于37 ℃恒温培养摇床中,60 r/min消化 2 min。
模拟胃消化:口腔消化结束后,分别向A、B中加入4 mL胃消化液,用1 mol∙L-1HCl调节pH至2.5,最后用去离子水补充体积至10 mL,再放入37 ℃恒温培养摇床中,60 r/min消化60 min。分别在消化0、5、10、30和60 min后,从A中取出1.5 mL消化产物,并用1 mol∙L-1NaHCO3调节pH至中性,并在沸水浴中灭酶活5 min。
模拟肠消化:胃消化过程结束后,分别向B中依次加入5 mL人工模拟十二指肠消化液,2 mL人工模拟胆汁,用1 mol∙L-1NaOH调节pH至7,最后用去离子水补充体积至20 mL。在37 ℃下分别在消化0、5、15、30、60、90和120 min后取出2 mL消化产物,在沸水浴中灭酶5 min。
将得到的消化产物于-20 ℃保存备用。
1.7 数据分析
采用SPSS软件(16.0版)比较不同加工处理后蛋白质结构特性的统计学差异,差异分析采用Duncan多重比较,<0.05视为样品间差异显著。数据分析及处理主要采用SPSS(16.0版)和Origin 2018。
2 结果
2.1 苦杏仁加工工序对amandin免疫反应性的影响
2.1.1 不同去皮方法对amandin免疫反应性的影响
还原条件和非还原条件下,amandin的特征条带均没发生显著变化。在非还原条件下,amandin主要由61—63 kDa的多肽条带组成;而还原条件下,主要由分子量大小为35—41 kDa及23—28 kDa的条带组成。与未处理苦杏仁中提取的amandin(UA)相比,非还原条件下,经饱和热空气去皮苦杏仁中提取的amandin(SHAP)和经热烫去皮苦杏仁中提取的amandin(BIBW)低分子量条带均增强,且BIBW的增强更为明显。还原条件下,BIBW的蛋白条带出现弥散现象(图1-A)。
免疫反应性是指抗原与相应免疫应答产物抗体在体内或体外发生特异性结合,引起免疫反应性的能力,是评价食品致敏性的重要指标。Western blotting和间接ELISA用于检测评估不同处理amandin的IgG/IgE结合能力,以兔源anti-amandin antibody为一抗,识别3种amandin溶液的免疫条带变化。如图1-B所示,饱和热空气去皮和热烫去皮未改变amandin免疫条带的分子量。还原条件下,识别出免疫条带分子量为35—41 kDa;非还原条件下识别出分子量为61—63 kDa的免疫条带。但免疫图谱上可以观察到amandin的免疫条带强度发生了改变,因此对Western blotting图谱进行灰度分析。一般来说,相对灰度值越大,表明蛋白质的免疫反应性越强。还原条件下,SHAP的免疫条带灰度值降低了20.68%,BIBW的免疫条带灰度值降低了8.37%;非还原条件下,SHAP的免疫条带灰度值降低了2.75%,BIBW的免疫条带灰度值降低了36.47%,两种去皮方法都在一定程度上降低了amandin的免疫反应性(图1-B)。
Western blotting可以反映致敏条带的分子量信息,但其定量效果具有相对性,因此采用间接ELISA进一步准确测定UA、SHAP和BIBW之间免疫反应性的差异。图1-C显示,SHAP的免疫反应性显著降低了8.41%(<0.05),而BIBW的显著降低13.15%(<0.05),表明饱和热空气去皮和热烫去皮都显著降低了苦杏仁中amandin的免疫反应性,与Western blotting检测结果一致。
2.1.2 不同脱苦方法对amandin免疫反应性的影响 苦杏仁经饱和热空气去皮后分别采用超声快速脱苦和热水脱苦两种方法进行加工,探究两种脱苦方法对苦杏仁中amandin免疫反应性的影响。在还原和非还原条件下,经热水脱苦的苦杏仁中提取的amandin(HWD)和超声快速脱苦的苦杏仁中提取的amandin(UAD)主要特征条带都没有明显变化。非还原条件下,可以明显观察到HWD和UAD在52—66 kDa间的条带都明显增强(图2-A);HWD和UAD在37—52 kDa间的条带明显增强(图2-C)。
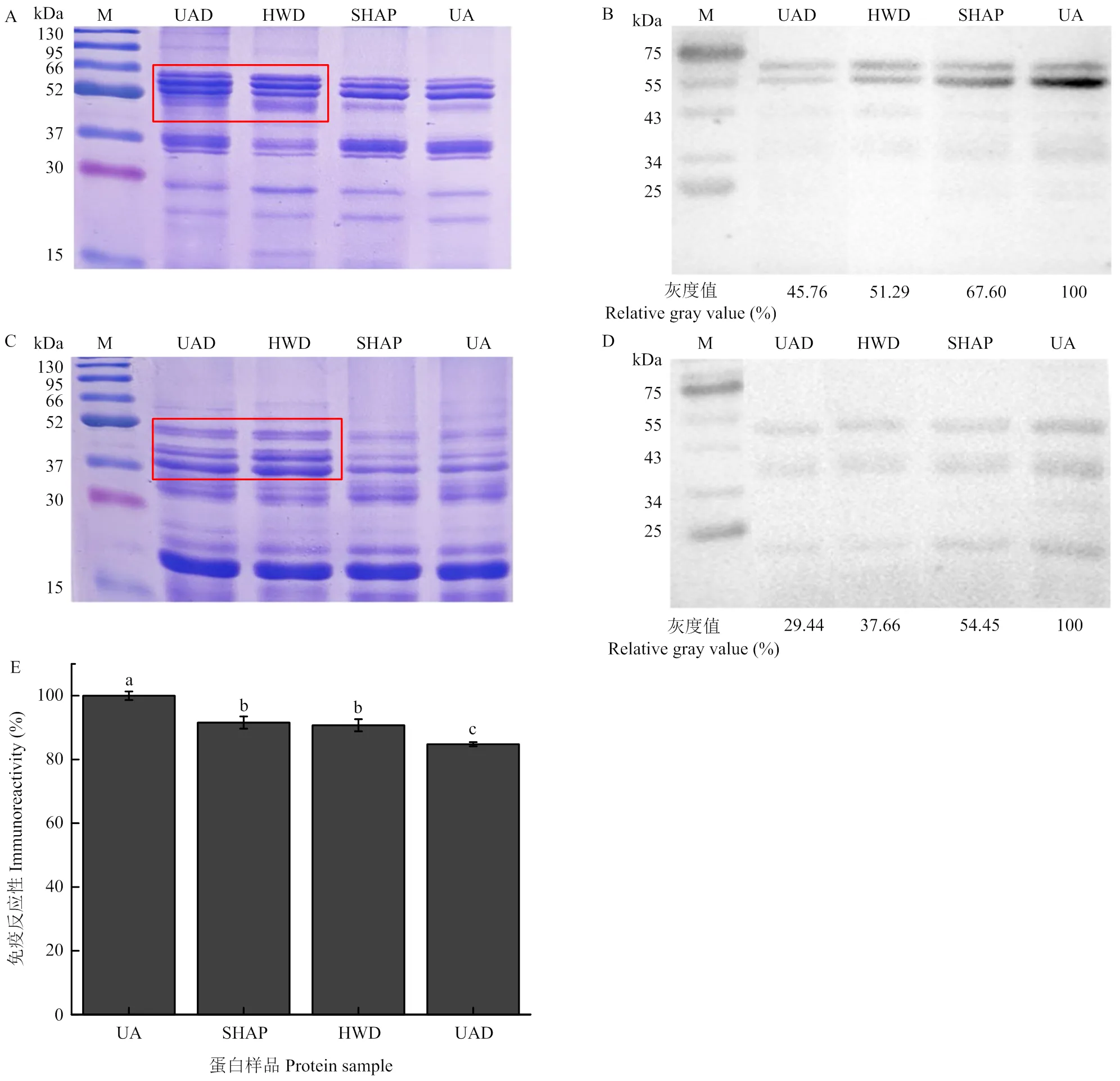
UAD:超声快速脱苦;HWD:热水脱苦。下同
致敏蛋白条带的分子量仍没有明显变化,但在还原和非还原条件下,都可以明显观察从UA到UAD,特异性抗原抗体反应呈现减弱趋势。非还原条件下SHAP的免疫条带灰度降低32.40%,热水脱苦和超声快速脱苦后又分别使amandin的免疫条带灰度降低了16.31%和21.84%(图2-B);SHAP的免疫条带灰度降低了45.55%,HWD和UAD的相对灰度值在SHAP的基础上又分别降低16.79%和25.01%(图2-D)。由此可见,两种脱苦方法都在一定程度上降低了amandin的免疫反应性,且超声快速脱苦的效果更明显。采用间接ELISA测定进一步验证致敏蛋白的免疫反应性变化情况,图2-E显示,SHAP的免疫反应性显著降低了8.41%(<0.05),热水脱苦前后amandin的免疫反应性没有显著变化,而超声快速脱苦使amandin的免疫反应性显著降低6.79%(<0.05),说明间接ELISA测定结果与western blotting试验结果趋势一致,即热水脱苦对amandin的免疫反应性没有显著影响,而超声快速脱苦可以显著降低其免疫反应性。
2.1.3 不同干制方法对amandin蛋白免疫反应性的影响 将经饱和热空气去皮和超声快速脱苦的苦杏仁采用热风干燥和自然干燥两种方法进行加工,探究两种干制方法对苦杏仁中致敏蛋白amandin免疫反应性的影响。还原和非还原条件下,amandin的主要特征条带仍没有改变。还原条件下,热风干燥(HAD)和自然干燥(ND)的蛋白条带无明显差异(图3-A);非还原条件下,ND的低分子量条带消失,与UA的条带组成基本一致(图3-C)。
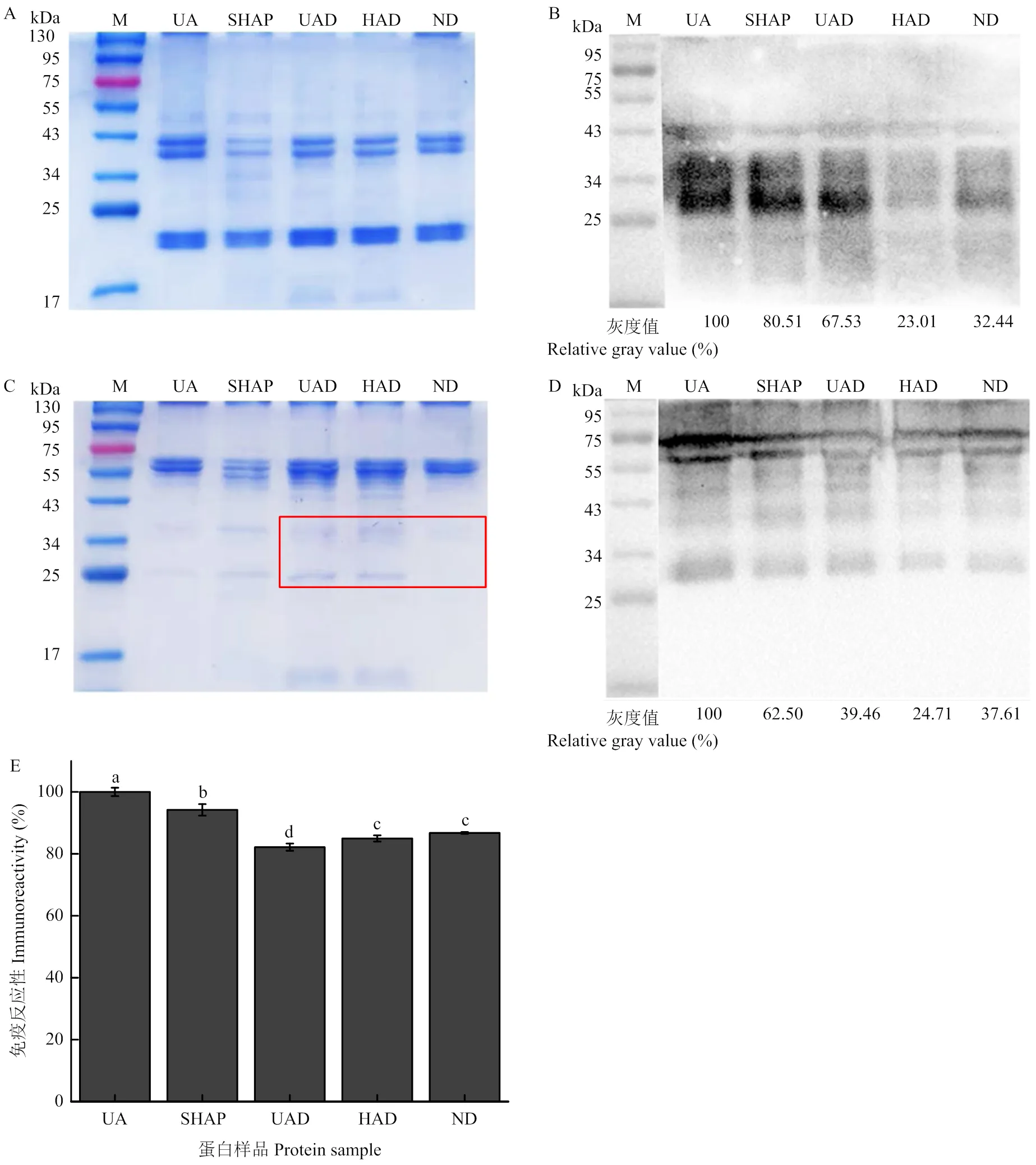
图3 热风干燥(HAD)和自然干燥(ND)后苦杏仁中amandin非还原条件下的SDS-PAGE图谱(A)和Western boltting图谱(B)、还原条件下的SDS-PAGE图谱(C)和Western boltting图谱(D)及ELISA测定结果(E)
Fig. 3 Reduced SDS-PAGE (A) and Western blotting (B), non-reduced SDS-PAGE (C) and Western blotting (D), and ELISA results (E) of amandin in apricot kernels after hot-air drying (HAD) and natural drying (ND)
还原和非还原条件下,去皮、脱苦和干制后苦杏仁中amandin发生特异性抗原抗体反应的条带没有明显改变,但免疫条带强度有明显差异,从左至右总体呈现灰度逐渐降低的趋势。根据灰度分析结果,非还原条件下,饱和热空气去皮后amandin的免疫条带灰度值降低了37.5%,超声脱苦后其免疫条带灰度值又降低了23.04%,经热风干燥和自然干燥后其免疫条带相对灰度值分别又降低14.75%和1.85%;还原条件下,饱和热空气去皮后amandin免疫条带的相对灰度值降低了19.49%,超声快速脱苦后其相对灰度值又降低了12.98%,热风干燥和自然干燥后其相对灰度值又分别降低44.52%、35.09%(图3-B)。间接ELISA测定结果见图3-E,饱和热空气去皮后苦杏仁中的amandin免疫反应性显著降低了5.79%,超声脱苦后又使其显著降低12.04%,自然干燥对其免疫反应性没有显著影响,而热风干燥使其免疫反应性显著上升2.81%(<0.05),但干制后苦杏仁中的amandin的免疫反应性都显著低于未处理苦杏仁中的amandin(<0.05)。Western blotting和间接ELISA测定结果并不完全一致。
2.2 加工对amandin结构的影响
如图4-A所示,去皮和脱苦加工使amandin的圆二色谱负峰减弱,而干制后负峰显著增强,说明加工过程在一定程度上改变了致敏蛋白质结构。由致敏蛋白质的二级结构含量变化发现(图4-B),去皮和脱苦加工对蛋白质中-螺旋结构和-折叠结构的含量没有显著影响,但使-转角含量显著提高,无规则卷曲含量显著降低。饱和热空气去皮和超声快速脱苦后蛋白质的外源荧光强度均显著增强(图4-C)。热风干制使amandin二级结构发生了显著变化,外源荧光强度减弱,表面疏水性显著降低(<0.05),与外源荧光光谱测定结果的趋势一致(图4-D)。Zeta电位测定结果显示,SHAP、UAD和HAD的电位绝对值都显著降低(图4-E)。
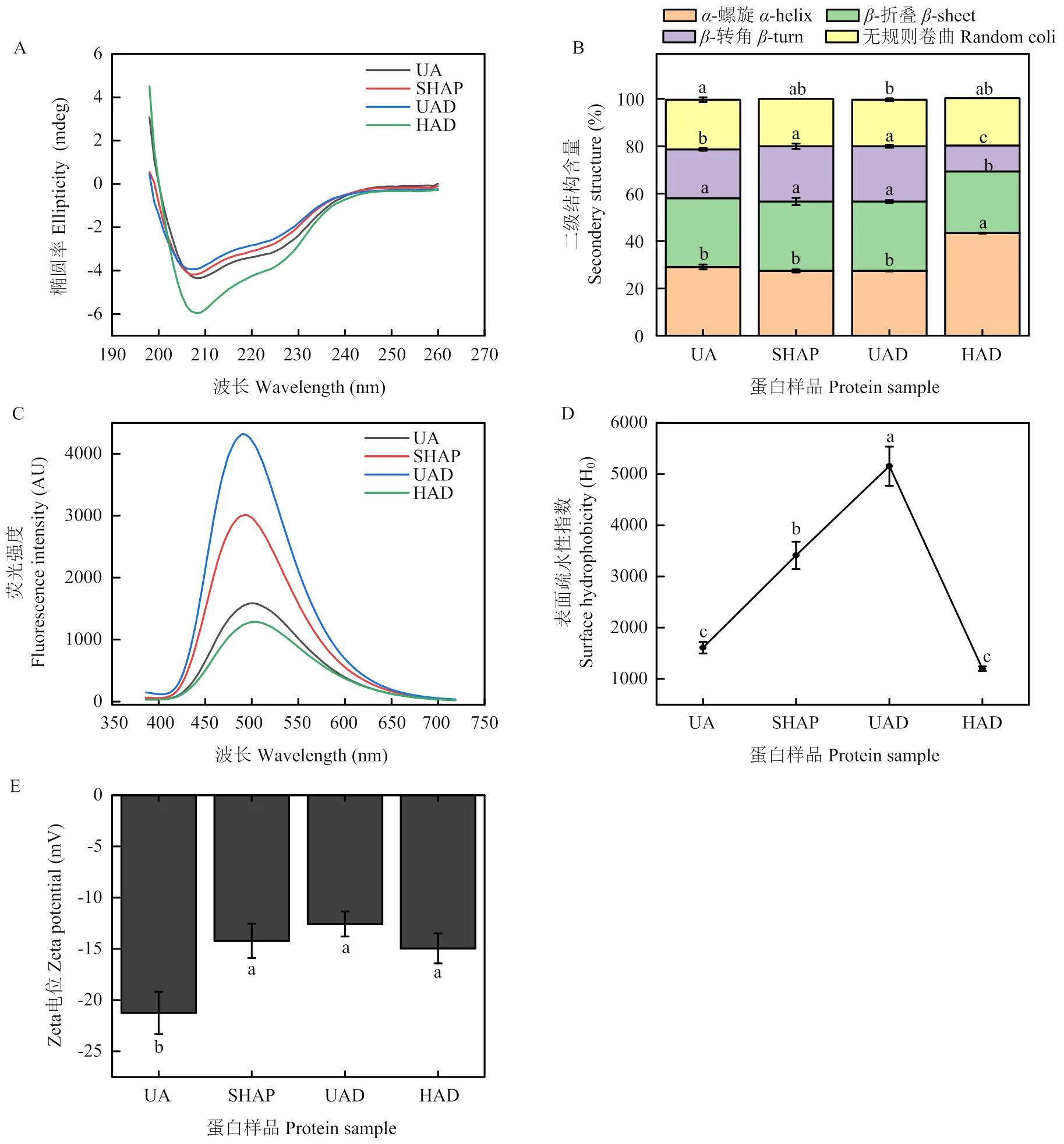
图4 苦杏仁去皮、脱苦、干制加工对amandin圆二色谱(A),二级结构组成(B),外源荧光光谱(C),表面疏水性(D)和Zeta电位(E)的影响
2.3 加工对amandin消化稳定性的影响
胃消化开始时,UA蛋白条带主要分布于25—75 kDa;在胃消化液作用5 min后,25—75 kDa的蛋白条带降解为分子量低于17 kDa的蛋白条带,且随消化作用时间延长,低分子条带逐渐增强;胃消化30 min后,几乎全部降解为低分子量条带。HAD在与胃消化液混合后迅速降解为分子量低于17 kDa的条带,且随肠消化作用时间延长,这些低分子量条带继续降解而逐渐减弱。UA在经胃消化60 min后仍能引起特异性抗原抗体反应,且免疫条带的强度随消化时间的延长逐渐减弱,而HAD的免疫条带仅出现在胃消化过程的0—10 min,且其灰度明显低于UA的免疫条带灰度(图5)。

图5 消化液的SDS-PAGE图谱(A)、未加工苦杏仁中amandin(UA)消化产物的SDS-PAGE图谱(B)及Western blotting图谱(C)、加工后苦杏仁中amandin(HAD)消化产物的SDS-PAGE图谱(D)及Western blotting图谱(E)
3 讨论
3.1 苦杏仁去皮方法的对比分析
去皮是苦杏仁加工过程中的第一道工序,是为了避免在加工过程中苦杏仁种皮对产品色泽和品质产生不良影响。苦杏仁皮占苦杏仁干重的2%—5%[26],富含多酚类化合物、黑色素和苦杏仁苷等功能性成分,还含有大量膳食纤维、半纤维素、木质素等功能性膳食纤维。热烫去皮是现阶段苦杏仁去皮加工的常用方法,其操作简单、成本低,但该方法也存在水资源浪费、能耗大且耗时长等缺点[27]。且在处理过程中,苦杏仁皮中的功能性成分会随去皮水一并作为加工废料被工厂大量排出,去皮水中有机物含量超标,引起资源浪费和环境污染。饱和热空气去皮是一种绿色去皮方法,此方法能耗小、耗时短、排污少,能解决传统去皮方法造成的苦杏仁加工过程中资源浪费和环境污染等问题。
本研究结果显示,amandin的电泳条带出现弥散现象,可能是高温使蛋白质结构部分降解所造成。饱和热空气去皮是利用苦杏仁皮受热胀裂而达到去皮效果,温度相对较低,不易使蛋白质结构发生变化;而热烫去皮温度高达100 ℃,足以使蛋白质发生变性,导致结构改变[14]。去皮加工过程中,amandin存在于苦杏仁内部,受苦杏仁皮和组织的保护,因此凝胶电泳图谱上SHAP和BIBW的主要特征条带没有改变。这与Zhao等[20]的研究结果相似,热加工使虾提取蛋白的高分子量条带消失,降解为低分子量条带。蒸煮过程中,蛋白质易受热变性,导致空间结构改变[28],蛋白高级结构解聚,与致敏性相关的抗原表位被破坏或掩盖,从而影响其IgE结合能力,使致敏蛋白的免疫反应性降低[29]。这与热加工对致敏蛋白免疫反应性影响的相关研究结果基本一致[29-30]。综上,采用饱和热空气去皮和热烫去皮方法对苦杏仁进行加工后,amandin的免疫反应性都显著降低,且热烫去皮处理使其免疫反应性降低更为显著。与热烫去皮相比,饱和热空气去皮减少了苦杏仁苷随脱苦水的流失,且显著影响-葡萄糖苷酶的活性,蛋白质和还原糖的损失均减小[14]。
综合去皮加工成本对苦杏仁品质、苦杏仁致敏性以及环境污染的影响考虑,选择饱和热空气去皮,可以缩短加工时间、降低加工成本,也能显著降低苦杏仁的致敏性。
3.2 苦杏仁脱苦方法的对比分析
苦杏仁在经饱和热空气去皮后,再进行脱苦处理。苦杏仁苷是苦杏仁苦味的主要来源,其本身无毒,但在-葡萄糖苷酶的作用下会分解产生苯甲醛和氢氰酸,氢氰酸为剧毒物质;一次性大量食用未脱苦的苦杏仁会导致严重的中毒症状甚至死亡。因此,苦杏仁的脱苦是开展苦杏仁深加工前的关键工艺技术[17]。热水脱苦是常用的传统脱苦方法,从其操作参数可知,该方法操作简单,但耗时长且需要大量的水、品质损耗大[26],苦杏仁中46种挥发性风味物质在经热水脱苦后仅可检出12种,苦杏仁风味和营养价值极大降低[17]。针对苦杏仁传统脱苦过程中的能源和资源浪费问题,笔者课题组发明了基于超声诱导苦杏仁快速脱苦的方法;该方法大幅缩短了脱苦时间,大量减少了废水的排放和能源资源浪费[16]。由于超声快速脱苦缩短了苦杏仁在水中浸泡的时间,且水浴所需温度更低,可显著减少苦杏仁中可溶性营养成分的流失。
根据SDS-PAGE结果显示,超声处理和长时间的热处理可能使部分蛋白质亚基聚集,形成高分子量蛋白亚基结构。热处理可以使蛋白质分子变性,发生聚集,分子量变大。杨春华等[31]在研究热加工对豆浆中蛋白质的影响时也得到相似结果。而超声空化引起的动力剪切和湍流作用既能使蛋白质原有结构崩解,又能使崩解的基团之间相互作用重组成亚聚集体,从而使蛋白质分子量增大[24]。热水脱苦过程中影响amandin免疫反应性的主要因素是温度,较高的温度可以通过改变蛋白质的构象表位,使其免疫反应性发生改变,而对线性表位的影响不大[32]。但在饱和热空气去皮过程中,部分在高温下易发生改变的蛋白质结构及其组成的构象表位已经被破坏,于是长时间的热水脱苦未能显著改变amandian的免疫反应性。而超声快速脱苦后amandin的免疫反应性显著降低,可能的原因是超声空化效应使蛋白质原有结构崩解,进而形成新的聚集结构[24],致使其抗原表位改变甚至破坏[33],从而导致其免疫反应性降低[34]。马涛等[35]也报道过类似结论,即超声处理改变三文鱼小清蛋白质结构,继而降低其致敏性。还有研究表明,超声处理可以修饰蛋白质结构,从而改变蛋白质的一些特定IgG识别的构象表位,进而影响蛋白质的免疫反应性[36]。去皮苦杏仁经热水脱苦后其中amandin的免疫反应性没有显著变化,而超声快速脱苦使amandin的免疫反应性显著降低。
因此,综合脱苦加工成本以及对苦杏仁品质和免疫反应性的影响考虑,选择超声快速脱苦方法,既可以高效完成脱苦,还能达到降低苦杏仁致敏性的目的。
3.3 苦杏仁干制方法的对比分析
脱苦后苦杏仁要进行干制处理,以延长其保质期和后续产品开发,干制后得到苦杏仁的初级加工产品,即光中杏仁(商品化脱苦杏仁)。
研究结果显示,Western blotting和间接ELISA试验检测干制方法对amandin免疫反应性影响的结果并不完全一致,可能原因是蛋白质的致敏性与其抗原决定簇相关,抗原决定簇又称表位,包括线性表位和构象表位[37]。在进行SDS-PAGE凝胶电泳时,蛋白质经过煮沸处理以及受还原性上样缓冲液的作用发生变性,导致其构象表位破坏,因此Western blotting测定免疫反应性时主要识别的是蛋白质的线性表位和部分构象表位,而ELISA分析时使用的是未变性的致敏蛋白,抗体既能识别其线性表位也能识别其构象表位。因此,Wstern blotting和ELISA测定结果可能呈现差异。Western blotting检测主要是对致敏蛋白条带定性,确定致敏蛋白条带的分子量,只能半定量且灵敏度远低于ELISA。
根据SDS-PAGE、Western-blotting和ELISA结果综合分析,在自然干燥和热风干燥过程中amandin的蛋白质亚基组成没有显著变化。amandin在热风干燥过程中免疫反应性增强可能的原因是:一方面,高温干制过程中蛋白质可能发生热变性,空间结构改变[18],导致线性表位被掩盖而部分构象表位暴露,最终致使免疫反应性增强[38];另一方面,热风干燥过程中致敏蛋白可能与糖类发生美拉德反应,形成糖基化修饰或交联物,从而改变蛋白质结构,影响抗原表位的识别,导致致敏蛋白的免疫反应性发生改变[39]。有研究表明美拉德反应增强了花生致敏蛋白的免疫反应性[40],与热风干制对苦杏仁致敏蛋白免疫反应性的影响结果一致。热风干燥后苦杏仁中amandin的免疫反应性略低于自然干燥的苦杏仁,两种干制方法对amandin免疫反应性的影响没有显著性差异。自然干燥操作简单、成本低,但干制时间长。自然干燥所得产品色泽虽较暗但没有明显褐变,风味物质有散失而对苦杏仁中营养物质也没有显著影响,缺点是干制过程中易受细菌和霉菌污染[41]。热风干燥技术以热空气为介质与食品进行湿热交换,同时由于物料表面水分被汽化,物料表面与内部产生水分浓度差,从而使内部水分向外表面逐渐扩散[42]。该干制技术生产效率高,在农副产品中被广泛运用,但所得产品色泽和营养损失大[18]。
综合以上因素,选择热风干燥方法对苦杏仁进行加工,虽不可避免苦杏仁发生褐变,但生产效率高、成本低,适用于工厂化加工。
3.4 加工对苦杏仁中amandin结构影响的分析
圆二色谱在222 nm和208 nm处出现负峰,表明苦杏仁致敏蛋白中-螺旋结构的存在,在216 nm出现负峰,表明致敏蛋白含有-折叠结构[6]。研究结果显示无规卷曲含量降低,说明加工处理使蛋白质中原有特定无规律肽段构象破坏[43],蛋白质结构相对松散,部分展开。其可能原因是饱和热空气去皮时的热处理使水溶性蛋白分子结构展开,暴露出更多的疏水基团[44],超声快速脱苦时,超声空化作用也会使蛋白质疏水区域展开,导致疏水基团暴露于极性环境中[45]。外源荧光光谱和表面疏水性测定结果也得出一致结论。外源荧光光谱可以反映蛋白质的三级结构变化情况,说明去皮和脱苦加工使amandin表面暴露出更多的疏水基团与ANS结合,在激发光作用下发射荧光[24]。蛋白质表面暴露的疏水基团越多,则表面疏水性越强[46],本研究的表面疏水性测定结果进一步确证了这一结论。热风干制使苦杏仁中水分含量降低的同时可能使蛋白质分子加热变性、巯基氧化、水分子-蛋白质分子间氢键变化,造成了蛋白质原有二级结构和空间构象的破坏。Zeta电位测定结果显示蛋白质分子稳定性降低,蛋白质分子间的静电排斥作用减弱,可能导致蛋白质分子间的聚集状态发生改变[21,47]。
综上,苦杏仁去皮、脱苦和干制加工影响了amandin的二级及三级结构组成,改变了蛋白质分子的聚集状态以及蛋白质分子间的相互作用,进而可能导致构象表位的破坏、掩盖或暴露以及线性表位的掩盖或暴露,最终导致amandin免疫反应性的减弱或增强。
3.5 加工对苦杏仁中amandin消化稳定性影响的分析
amandin在经消化系统进入免疫系统后,与其抗原性相关的蛋白或蛋白片段结构若能仍然保持足够完整则能引起过敏反应[48]。在利用体外静态模拟消化试验评估其消化稳定性时,基于食物在人胃和肠消化系统中滞留的时间分别为1 h和4 h[49],本研究中体外静态模拟胃消化和肠消化的最大取样时间分别设置为60 min和120 min。研究结果显示,HAD比UA更易在胃消化过程中降解。观察肠消化过程的凝胶电泳图谱发现,除消化液本身的蛋白条带外无明显蛋白条带,可能是由于UA和HAD在肠消化液的作用下迅速彻底降解,低分子量的蛋白条带彻底降解为分子量很小的肽段和氨基酸。这与李英英等[50]在研究大豆球蛋白的体外消化稳定性时的报道结果相一致。Western blotting图谱显示在消化液的作用下,与致敏蛋白抗原性相关的蛋白质结构逐渐降解,免疫反应性逐渐减弱;UA的抗原决定簇结构比HAD的更稳定,能耐受更长的消化时间,其潜在致敏性更强,更易在人体内引起过敏反应。经饱和热空气去皮、超声快速脱苦和热风干制后,苦杏仁中amandin的消化稳定性降低,其抗原表位在消化过程中降解速度加快,经胃消化后几乎不能引起免疫反应,苦杏仁的致敏性极大降低。
4 结论
不同加工方法对苦杏仁致敏蛋白amandin的免疫反应性均有一定影响,其中饱和热空气去皮和超声快速脱苦使amandin免疫反应性降低效果最显著。采用饱和热空气去皮、超声快速脱苦和热风干制加工后的苦杏仁致敏性显著降低15.03%。amandin免疫反应性改变是由加工处理导致其蛋白质结构变化造成,其中超声快速脱苦导致的结构变化最明显。此外,加工处理还会导致苦杏仁中amandin消化稳定性的降低,与致敏性相关的抗原结构更易在消化过程中降解,致使苦杏仁潜在致敏性进一步降低。因此,在苦杏仁加工过程中,可以通过优化加工方法来降低苦杏仁的致敏性。
[1] 张金艳, 何萍, 李贻奎. 苦杏仁、桔梗及二者配伍止咳、祛痰作用的研究. 中国实验方剂学杂志, 2010, 16(18): 173-175.
ZHANG J Y, HE P, LI Y K. Experimental study on effect of bitter apricot seed, piatycodon root, and their compatibility for relieving cough and expelling phlegm. Chinese Journal of Experimental Traditional Medical Formulae, 2010, 16(18): 173-175. (in Chinese)
[2] SIDDIQUI S A, ANWAR S, YUNUSA B M, AHMAD NAYIK G, MOUSAVI KHANEGHAH A. The potential of apricot seed and oil as functional food: composition, biological properties, health benefits & safety. Food Bioscience, 2023, 51: 102336.
[3] 张清安, 姚建莉. 苦杏仁资源加工与综合利用研究进展. 中国农业科学, 2019, 52(19): 3430-3447. doi:10.3864/j.issn.0578-1752.2019. 19.013.
Zhang Q A, YAO J L. State-of-the-art on the processing and comprehensive utilization of the apricot kernels. Scientia Agricultura Sinica, 2019, 52(19): 3430-3447. doi: 10.3864/j.issn.0578-1752.2019. 19.013. (in Chinese)
[4] BOCK S A, MUÑOZ-FURLONG A, SAMPSON H A. Fatalities due to anaphylactic reactions to foods. Journal of Allergy and Clinical Immunology, 2001, 107(1): 191-193.
[5] 张洁琼. 杏仁过敏原ELISA方法的建立及加工方式对致敏性的影响[D]. 天津: 天津科技大学, 2013.
ZHANG J Q. Development of enzyme-linked immunoassay and effects of processing for almond allergen, amandin [D]. Tianjin: Tianjin University of Science & Technology, 2013. (in Chinese)
[6] ALBILLOS S M, MENHART N, FU T J. Structural stability of amandin, a major allergen from almond (), and its acidic and basic polypeptides. Journal of Agricultural and Food Chemistry, 2009, 57(11): 4698-4705.
[7] SATHE S K. Solubilization, electrophoretic characterization anddigestibility of almond () proteins. Journal of Food Biochemistry, 1992, 16(4): 249-264.
[8] SATHE S K, TEUBER S S, GRADZIEL T M, ROUX K H. Electrophoretic and immunological analyses of almond (L.) genotypes and hybrids. Journal of Agricultural and Food Chemistry, 2001, 49(4): 2043-2052.
[9] ROUX K H, TEUBER S S, ROBOTHAM J M, SATHE S K. Detection and stability of the major almond allergen in foods. Journal of Agricultural and Food Chemistry, 2001, 49(5): 2131-2136.
[10] WILLISON L N, ZHANG Q, SU M N, TEUBER S S, SATHE S K, ROUX K H. Conformational epitope mapping of Pru du 6, a major allergen from almond nut. Molecular Immunology, 2013, 55(3/4): 253-263.
[11] WILLISON L N, TRIPATHI P, SHARMA G, TEUBER S S, SATHE S K, ROUX K H. Cloning, expression and patient IgE reactivity of recombinant pru du 6, an 11S globulin from almond. International Archives of Allergy and Immunology, 2011, 156(3): 267-281.
[12] VENKATACHALAM M, TEUBER S S, ROUX K H, SATHE S K. Effects of roasting, blanching, autoclaving, and microwave heating on antigenicity of almond (L.) proteins. Journal of Agricultural and Food Chemistry, 2002, 50(12): 3544-3548.
[13] KSHIRSAGAR H H, FAJER P, SHARMA G M, ROUX K H, SATHE S K. Biochemical and spectroscopic characterization of almond and cashew nut seed 11S legumins, amandin and anacardein. Journal of Agricultural and Food Chemistry, 2011, 59(1): 386-393.
[14] 吴东栋. 饱和热空气法去皮工艺优化及其对苦杏仁和皮理化指标的影响[D]. 西安: 陕西师范大学, 2019.
WU D D. Optimization of saturated hot air peeling process and its effect on physical and chemical indexes of apricot and peel[D]. Xi’an: Shaanxi Normal University, 2019. (in Chinese)
[15] 申辉. 苦杏仁去皮过程中品质变化及其原因探究[D]. 西安: 陕西师范大学, 2015.
SHEN H. Quality changes of bitter apricot seed in peeling process and its cause exploration[D]. Xi'an: Shaanxi Normal University, 2015. (in Chinese)
[16] 张宁, 张馨允, 范学辉, 张清安. 苦杏仁超声辅助快速脱苦工艺优化. 食品与机械, 2018, 34(12): 189-194.
ZHANG N, ZHANG X Y, FAN X H, ZHANG Q A. Optimization on fast debitterizing technologies of apricot seed by ultrasound with response surface methodology. Food and Machinery, 2018, 34(12): 189-194. (in Chinese)
[17] 刘辰凤, 潘妍, 贾红亮, 林少华. 苦杏仁脱苦工艺优化及其风味成分的变化. 农业技术与装备, 2022(8): 100-103.
LIU C F, PAN Y, JIA H L, LIN S H. Bitter almond debitterize technology optimization and flavor composition change. Agricultural Technology and Equipment, 2022(8): 100-103. (in Chinese)
[18] 宋云. 苦杏仁脱苦及干制工艺对杏仁品质的影响[D]. 西安: 陕西师范大学, 2016.
SONG Y. Effect of debittering and drying technology of bitter apricot kernels on apricot kernel quality [D]. Xi’an: Shaanxi Normal University, 2016. (in Chinese)
[19] SATHE S K, WOLF W J, ROUX K H, TEUBER S S, VENKATACHALAM M, SZE-TAO K W C. Biochemical characterization of amandin, the major storage protein in almond (L.). Journal of Agricultural and Food Chemistry, 2002, 50(15): 4333-4341.
[20] ZHAO J L, LI Y H, XU L L, JI Y, ZENG J H, TIMIRA V, ZHANG Z Y, CHEN G Z, LIN H, LI Z X. Insight into IgG/IgE binding ability,digestibility and structural changes of shrimp () soluble extracts with thermal processing. Food Chemistry, 2022, 381: 132177.
[21] 朱乾乾. 超高压和酶法处理对苦杏仁蛋白结构和免疫反应性的影响[D]. 无锡: 江南大学, 2020.
ZHU Q Q. Effect of ultra-high pressure and enzymatic treatment on the structure and immunoreactivity of bitter apricot kernel protein [D]. Wuxi: Jiangnan University, 2020. (in Chinese)
[22] YOGESHA M, RAO V G, DEVANGAD P, D'SOUZA J S, CHIDANGIL S. A chemometric study combined with spectroscopy for the quantification of secondary structure of flagellar-associated protein 174 (FAP174). Journal of Chemometrics, 2020, 34(5): 3221.
[23] WU W, WU X J, HUA Y F. Structural modification of soy protein by the lipid peroxidation product acrolein. LWT-Food Science and Technology, 2010, 43(1): 133-140.
[24] CHEN Y X, SHENG L, GOUDA M, MA M H. Impact of ultrasound treatment on the foaming and physicochemical properties of egg white during cold storage. LWT, 2019, 113: 108303.
[25] 胡雪洁. 十七种小麦种质中麸质蛋白的消化稳定性与潜在致敏性[D]. 南昌: 南昌大学, 2021.
HU X J. Digestibility and potential allergenicity of gluten proteins in seventeen wheat varieties [D]. Nanchang: Nanchang University, 2021. (in Chinese)
[26] 范学辉, 张清安, 刘梅, 田呈瑞. 苦杏仁脱苦方法研究进展. 食品工业科技, 2014, 35(7): 396-399.
FAN X H, ZHANG Q A, LIU M, TIAN C R. Progress in detoxification techniques of apricot kernel. Science and Technology of Food Industry, 2014, 35(7): 396-399. (in Chinese)
[27] 吴东栋, 张清安, 范学辉, 史芳芳, 张宁. 苦杏仁皮中生物活性成分的研究进展. 食品与发酵工业, 2019, 45(7): 288-293.
WU D D, ZHANG Q A, FAN X H, SHI F F, ZHANG N. Bioactive components of apricot kernel skin. Food and Fermentation Industries, 2019, 45(7): 288-293. (in Chinese)
[28] RAO H, LI X, XUE W T. Effect of thermal processing and fermentation with Chinese traditional starters on characteristics and allergenicity of wheat matrix. Food Science and Human Wellness, 2023, 12(3): 789-794.
[29] JIMÉNEZ-SAIZ R, BENEDÉ S, MOLINA E, LÓPEZ-EXPÓSITO I. Effect of processing technologies on the allergenicity of food products. Critical Reviews in Food Science and Nutrition, 2015, 55(13): 1902-1917.
[30] 郑礼娜, 林洪, 刘一璇, 李钰金, 李振兴. 不同热加工方式对刀额新对虾过敏原活性的影响. 水产学报, 2011, 35(3): 466-471.
ZHENG L N, LIN H, LIU Y X, LI Y J, LI Z X. Study on effects of different thermal processings on immunocompetence of shrimp () allergen. Journal of Fisheries of China, 2011, 35(3): 466-471. (in Chinese)
[31] 杨春华, 邓涵, 朱杰瑞, 白靖, 杨安树. 热加工对豆浆中蛋白结构及其免疫反应性的影响. 食品科技, 2020, 45(11): 62-67.
YANG C H, DENG H, ZHU J R, BAI J, YANG A S. Effect of thermal processing on the structure and immunoreactivity of soymilk protein. Food Science and Technology, 2020, 45(11): 62-67. (in Chinese)
[32] 成军虎, 马筱冉, 陈璐, 于华宁, 李季林. 热加工与非热加工技术对水产品致敏性的影响研究进展. 现代食品科技, 2022, 38(8): 327-333.
CHENG J H, MA X R, CHEN L, YU H N, LI J L. Research progress on the effects of thermal and non-thermal processing technologies on the allergenicity of aquatic products. Modern Food Science and Technology, 2022, 38(8): 327-333. (in Chinese)
[33] LONG F F, FAN X H, ZHANG Q A. Effects of ultrasound on the immunoreactivity of amandin, an allergen in apricot kernels during debitterizing. Ultrasonics Sonochemistry, 2023, 95: 106410.
[34] 周玥彤. 超声诱导对花生芽中致敏蛋白Ara h 1的影响研究[D]. 沈阳: 沈阳农业大学, 2020.
ZHOU Y T. Research on mechanism of peanut sprout allergic protein Ara h 1 by using ultrasonic treatment [D]. Shenyang: Shenyang Agricultural University, 2020. (in Chinese)
[35] 马涛, 王一侠, 刘艳, 金振涛, 谷瑞增, 鲁军. 超声处理对三文鱼小清蛋白构象及致敏活性的影响. 食品工业, 2017, 38(3): 160-163.
MA T, WANG Y X, LIU Y, JIN Z T, GU R Z, LU J. Effect of ultrasonic treatment on the antigenicity and conformation of salmon parvalbumin. Journal of Food Industry, 2017, 38(3): 160-163. (in Chinese)
[36] TOBAJAS A P, AGULLó-GARCíA A, CUBERO J L, COLáS C, CIVERA A, CONDóN S, SáNCHEZ L, PéREZ M D. Effect of thermal and ultrasound treatments on denaturation and allergenic potential of Pru p 3 protein from peach. European Food Research and Technology, 2022, 249(2): 485-495.
[37] LÓPEZ E, CUADRADO C, BURBANO C, JIMÉNEZ M, RODRÍGUEZ J, CRESPO J F. Effects of autoclaving and high pressure on allergenicity of hazelnut proteins. Journal of Clinical Bioinformatics, 2012, 2(1): 12.
[38] ZHU Y, VANGA S K, WANG J, RAGHAVAN V. Impact of food processing on the structural and allergenic properties of egg white. Trends in Food Science & Technology, 2018, 78: 188-196.
[39] ZHANG Z Y, XIAO H, ZHANG X F, ZHOU P. Conformation, allergenicity and human cell allergy sensitization of tropomyosin from: effects of deglycosylation and Maillard reaction. Food Chemistry, 2019, 276: 520-527.
[40] IQBAL A, ATEEQ N. Effect of processing on the detectability of peanut protein by ELISA. Food Chemistry, 2013, 141(3): 1651-1654.
[41] 彭菊艳, 龚月桦, 王俊儒, 刘燕, 梁宗锁. 不同干燥技术对金银花药用品质的影响. 西北植物学报, 2006, 26(10): 2044-2050.
PENG J Y, GONG Y H, WANG J R, LIU Y, LIANG Z S. Effects of different drying methods on officinal qualities of. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(10): 2044-2050. (in Chinese)
[42] 赵洪雷, 孟德飞, 徐永霞, 王明丽, 郭晓华, 励建荣. 鲐鱼热风干燥动力学及品质变化研究. 包装与食品机械, 2022, 40(6): 8-14.
ZHAO H L, MENG D F, XU Y X, WANG M L, GUO X H, LI J R. Study on hot air drying kinetics and quality changes of scomber japonicus. Packaging and Food Machinery, 2022, 40(6): 8-14. (in Chinese)
[43] 王营娟. 超声对鹰嘴豆分离蛋白理化和功能特性的影响[D]. 郑州: 郑州轻工业大学, 2021.
WANG Y J. Effects of ultrasound on physicochemical and functional properties of chickpea protein [D]. Zhengzhou: Zhengzhou University of Light Industry, 2021. (in Chinese)
[44] 畅柯飞. 热处理对蛋清蛋白聚集行为及界面性质调控作用机制研究[D]. 长春: 吉林大学, 2021.
CHANG K F. Effects of heat treatment on the aggregation behavior and interfacecproperties of egg white protein [D]. Changchun: Jilin University, 2021. (in Chinese)
[45] RESENDIZ-VAZQUEZ J A, ULLOA J A, URÍAS-SILVAS J E, BAUTISTA-ROSALES P U, RAMÍREZ-RAMÍREZ J C, ROSAS- ULLOA P, GONZÁLEZ-TORRES L. Effect of high-intensity ultrasound on the technofunctional properties and structure of jackfruit () seed protein isolate. Ultrasonics Sonochemistry, 2017, 37: 436-444.
[46] CHANDRAPALA J, ZISU B, PALMER M, KENTISH S, ASHOKKUMAR M. Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate. Ultrasonics Sonochemistry, 2011, 18(5): 951-957.
[47] LI D, ZHAO Y, WANG X, TANG H L, WU N, WU F, YU D Y, ELFALLEH W. Effects of (+)-catechin on a rice bran protein oil-in- water emulsion: Droplet size, zeta-potential, emulsifying properties, and rheological behavior. Food Hydrocolloids, 2020, 98: 105306.
[48] 王翠燕, 孙璐, 周催, 孙娜, 王静, 鲁静, 车会莲. BALB/c小鼠动物模型评价食物过敏性的可行性研究. 中国食品学报, 2015, 15(11): 7-15.
WANG C Y, SUN L, ZHOU C, SUN N, WANG J, LU J, CHE H L. Studies on feasibility of the BALB/c mouse model in the evaluation of food allergies. Journal of Chinese Institute of Food Science and Technology, 2015, 15(11): 7-15. (in Chinese)
[49] WEN H W, BOREJSZA-WYSOCKI W, DECORY T, DURST R. Peanut allergy, peanut allergens, and methods for the detection of peanut contamination in food products. Comprehensive Reviews in Food Science and Food Safety, 2007, 6: 47-58.
[50] 李英英, 席俊, 陈慧彬, 尚阿晨, 王一超. 热处理大豆球蛋白的体外消化稳定性. 中国油脂, 2022, 47(10): 18-24.
LI Y Y, XI J, CHEN H B, SHANG A C, WANG Y C.digestion stability of soybean globulin after heating treatment. China Oils and Fats, 2022, 47(10): 18-24. (in Chinese)
Effects of Processing Technology on the Amandin Immunoreactivity and Digestive Stability of Apricot Kernel
LONG FeiFei1, ZHANG QingAn1, ZHANG ZhiHua1, 2
1School of Food Engineering and Nutrition Science, Shaanxi Normal University, Xi'an 710119;2Inner Mongolian GaoYuan Apricot Kernels Juice Co., Ltd, Zhungeer County 017100, Inner Mongolia
【Background】In recent years, allergies have become a global health concern, and the number of allergic individuals continues to rise. Nut is one of the common origins of allergies, and apricot kernels, as a common nut containing the allergenic protein amandin, have become one of the most susceptible nuts to allergies. Therefore, allergy removal of nuts has become a research hotspot. The processing of apricot kernels generally involves procedures, such as peeling, debitterizing and drying, and there are no relevant reports on whether their allergenicity will be affected during these processing. 【Objective】The aim of this study was to explore the impact of processing on the allergenicity with the allergenicity, quality and nutritional characteristics of apricot kernels as the evaluation indicators, and to optimize the processing for reducing the allergenicity of apricot kernels, thus providing the theoretical basis and technical support for the processing of low allergenic nuts products of apricot kernels.【Method】Firstly, the methods of Western blotting and ELISA were used to investigate the effects of different peeling, debitterizing and drying methods on the amandin immunoreactivity in apricot kernels. Then, the circular dichroism spectroscopy, extrinsic fluorescence spectroscopy, surface hydrophobicity and zeta potential measurements were used to study the effects of various processing methods on the structure and surface properties of amandin, and to analyze the mechanism of the immune-reactivity changes of amandin. Finally, the vitro simulation digestion experiments were conducted to investigate the digestive stability of amandin in apricot kernels before and after processing, and Western blotting analysis was conducted on the digestion products to further explore the changes in potential allergenicity of apricot kernels.【Result】In terms of allergenicity, the amandin’s immunoreactivity after being peeled by the saturated hot air and blanched decreased by 8.41% and 13.15%, respectively. After being quickly debitterized by ultrasound, the amandin’s immunoreactivity decreased by 6.79%. Blanching debitterizing had no significant effects on its immunoreactivity. After natural drying and hot air drying, the immune reactivity of the amandin significantly increased by 4.58% and 2.81%, respectively (<0.05). Based on the impact of processing on the quality and nutritional characteristics of apricot kernels, those suitable processing methods to decrease the allergenicity of apricot kernels were optimized like the saturated hot air peeling, ultrasonic rapid debitterizing and hot air drying, and the immune reactivity of apricot kernels decreased by 15.03% under the optimal conditions. In terms of the structure of amandin, the secondary structure composition, tertiary structure, surface hydrophobicity and zeta potential have undergone certain changes during the processing. Among them, the ultrasound rapid debitterizing significantly changed the tertiary structure of amandin and enhanced its surface hydrophobicity (<0.05), resulting in the most significant decrease in its immune reactivity. The digestive stability of the amandin after processing was significantly reduced, and the accelerated degradation rate of structures was related to the specific antigen antibody reactions in allergenic proteins, leading to a further decrease in the potential allergenicity of apricot kernels.【Conclusion】Different processing steps could affect the allergenicity of apricot kernels by changing the structure of amandin, i.e. the reasonable processing methods could be used to reduce the allergenicity of apricot kernels.
apricot kernel; amandin; processing; immunoreactivity; digestive stability

10.3864/j.issn.0578-1752.2023.24.011
2023-05-23;
2023-09-28
陕西省2021年度重点研发计划农业领域一般项目(2021NY-163)、鄂尔多斯市科技局2022年度科技重大专项(2022EEDSKJZDZX022)、西安市科技局科技创新人才服务企业项目(2020KJRC0011)、中央高校基本科研业务费专项资金重点项目(GK202102009)
龙斐斐,E-mail:longfeifei334@163.com。通信作者张清安,Tel:13572932273;E-mail:qinganzhang@snnu.edu.cn
(责任编辑 赵伶俐)
