不同抗旱性春小麦根系生长对干旱胁迫的响应及滴灌复水补偿效应
2023-12-28王荣荣陈天鹏尹豪杰蒋桂英
王荣荣,陈天鹏,尹豪杰,蒋桂英
不同抗旱性春小麦根系生长对干旱胁迫的响应及滴灌复水补偿效应
王荣荣,陈天鹏,尹豪杰,蒋桂英
石河子大学农学院,新疆石河子 832000
【目的】研究不同干旱敏感型春小麦根系生长对阶段干旱胁迫的形态及生理响应差异,阐明新疆滴灌条件下春小麦的抗旱节水生理机制,为新疆麦区进一步节水高产提供科学依据。【方法】2021—2022年采用土柱栽培法,以强抗旱性品种新春6号和弱抗旱性品种新春22号为材料,分蘖和拔节期分别设置轻度(T1和T3,60%—65% FC,FC为田间持水量)、中度(T2和T4,45%—50% FC)干旱胁迫处理后滴灌复水,以常规滴灌为对照(CK,75%—80% FC),研究生育前期干旱胁迫下根系形态特征(根长密度(RLD)、根体积密度(RVD))、抗氧化系统(丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化物酶(POD))、渗透物质(脯氨酸(Pro)、可溶性糖(SS))及根系活力的时空变化特征,分析滴灌春小麦根系生长对干旱-复水的补偿效应。【结果】随干旱胁迫程度增加,根长密度和根体积密度呈先增后降的变化趋势,轻度干旱(T1和T3)条件下,显著增加了20—60 cm土层的根长密度和根体积密度。各土层根系丙二醛含量随着胁迫程度的加剧呈上升趋势,而SOD、POD、脯氨酸及可溶性糖均随干旱程度加剧呈先升后降趋势,并随土层加深逐渐增大。T1处理复水后,根系形态特征、抗氧化酶活性、渗透物质、根系活力均达到最大值,进而提高产量,较其余处理增加2.77%—19.58%。逐步回归分析表明,根体积密度和可溶性糖是决定产量的重要因素,根长密度、SOD和可溶性糖是对新春6号抗旱性影响较为显著的指标,根长密度、丙二醛含量以及POD是对新春22号抗旱性影响较为显著的指标。【结论】春小麦在分蘖和拔节期维持60%—65%田间持水量,滴灌复水后会增加根系在20—60 cm土层的分配比例,提高根系清除活性氧及渗透调节能力,延缓根系衰老,改善根系生理特性,进而提高产量。
春小麦;干旱胁迫;分蘖和拔节期;根系生长;补偿效应
0 引言
【研究意义】因全球气候变化,新疆地区干旱频发,尤其是春夏两季干旱发生频率和危害程度逐渐加强,不利于小麦的幼穗分化和产量形成,成为该地区小麦高产高效的重要限制因素[1]。据统计,小麦生育前、中期干旱发生频率为30%—40%[2],尤其是北疆麦区生育前、中期干旱发生频率高达80%左右[3]。根系在植物-土壤关系中起到了关键的调控作用,干旱发生的时期、程度、时长等与作物根系形态特征和生理特性密切相关,影响根系的生长发育[4-5]。分蘖至拔节期是小麦幼穗分化、根系发育的重要时期,是水分调控的关键时期[6-7]。因此,探明新疆麦区分蘖和拔节期干旱复水后根系适应性及补偿效应变化的潜在机制,挖掘其生理节水潜力,对新疆小麦进一步节水高产具有指导意义。【前人研究进展】根系的形态及结构是作物生长发育程度和适应外部环境潜能的直接表现[8-10]。适度干旱胁迫可通过“补偿效应”维持根系必要的生长。研究发现,干旱条件下作物根系横向生长减弱而纵向生长增强,促进根系向下层土壤生长,抗旱性强的品种根系下扎能力更强,更有利于适应逆境条件[11-12]。根质量密度(RMD)、根长密度(RLD)、根体积密度(RVD)与品种抗旱能力显著相关,且抗旱性强的品种具有较大的根-土交互面及较强的吸收水肥潜能,复水后表现出较高的补偿能力[13-14]。根系抗氧化系统、渗透调节物质是评判其抵抗干旱能力的重要指标[15-17]。轻度干旱下小麦叶片中可溶性糖(SS)含量、超氧化物歧化酶(SOD)以及过氧化物酶(POD)活性迅速升高,复水能缓解前期水分亏缺对产量的影响,产生补偿效应[18]。崔亚坤[19]研究认为小麦生育前期干旱-复水可提高SS含量和抗氧化酶活性,改善根系生理特性,增强根系活力,从而促进干物质积累及提高产量;KANG等[20]分析了两个不同抗旱性苜蓿品种在干旱条件下SOD和POD活性的差异,发现强抗旱性品种根系的抗氧化酶活性较高,复水后具有较强的补偿恢复能力。可见,轻度干旱能提高根系清除活性氧及渗透调节能力,延缓根系衰老,改善根系生理特性,进而提高产量,实现“调水促根”作用。【本研究切入点】滴灌技术提高了根区水分的可控性,但如何利用滴灌技术控制土壤水分的供应,促进作物生育前期根系生长,充分发挥其生理节水潜力提高抗旱性已成为研究的热点问题。前人对干旱条件下春小麦根系的研究仅局限于全生育期干旱处理对其生长的影响,而关于根系生长和产量对单个生育期干旱-复水的响应尚未有深入研究,尤其缺乏干旱区不同土层根系生长及复水后根系产生补偿效应的研究。【拟解决的关键问题】针对新疆特殊的自然生态条件和栽培模式,采用滴灌方式,从干旱-复水作物根系补偿效应着手,选用两种不同抗旱性春小麦品种,采用土柱栽培法,研究生育前期(分蘖和拔节期)不同程度干旱-复水对根系形态特征、抗氧化系统、渗透调节物质及根系活力的影响,明晰不同抗旱性春小麦根系对不同生育时期、不同程度干旱-复水的补偿响应和产量提高的生理机制,以期为干旱区滴灌春小麦高效用水体系的完善提供理论依据。
1 材料与方法
1.1 试验设计
试验于2021和2022年4—7月在石河子大学农学试验站(85°59′ E,44°18′ N)进行,供试土壤类型为灌溉灰漠土,0—60 cm土壤基本性质如表1。春小麦生育期内平均气温为20 ℃,总降水量140 mm,年蒸发量1 000—1 500 mm,小麦生育期间气象指标变化如图1所示。
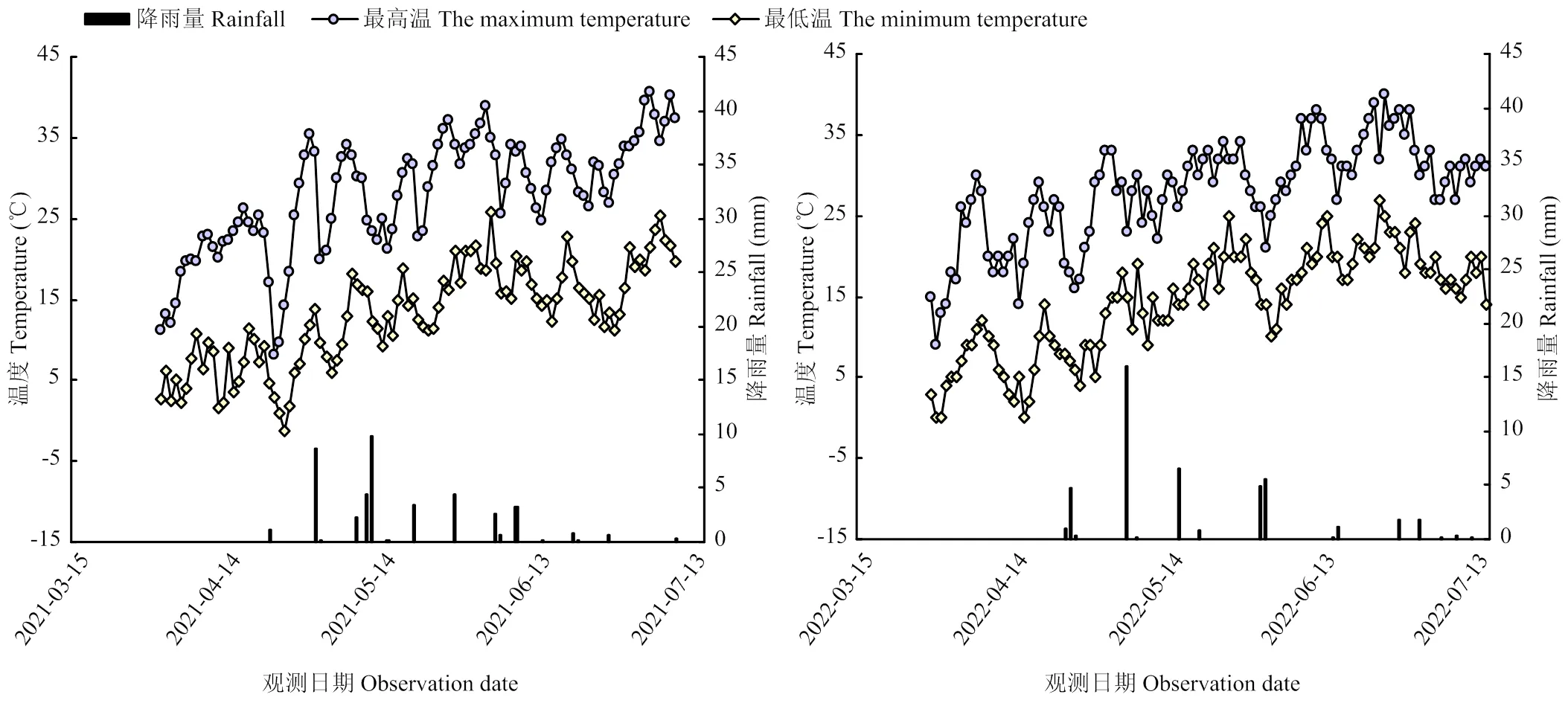
图1 小麦生育期间日平均温度和降雨量

表1 试验地0—60 cm土壤理化性质
采用二因素裂区设计,品种为主区,通过对株高、产量、干旱产量指数及产量-水分高效利用指数等指标进行鉴定,筛选出强抗旱性品种新春6号(株型紧凑,主茎成穗,耐盐碱,抗倒伏,水分不敏感型,丰产性好),弱抗旱性品种新春22号(茎秆较粗,分蘖能力中等,抗倒伏,水分敏感型,稳产性好)[21-23]。干旱处理为副区,设分蘖期正常水分(75%—80% FC,即CK,FC为田间持水量)、轻度亏缺(60%—65% FC,T1)和中度亏缺(45%—50% FC,T2),拔节期正常水分(75%—80% FC,即CK)、轻度亏缺(60%—65% FC,T3)和中度亏缺(45%—50% FC,T4)(表2)。为保证轻度干旱和中度干旱复水时间一致,分蘖期中度较轻度干旱提前10 d进行控水,而拔节期中度干旱较轻度干旱提前6 d进行控水,在达到相应的土壤含水量后,干旱处理时间为7 d,当干旱结束后,加大滴水量至75%—80% FC(称为复水)。

表2 不同生育时期水分处理
FC:田间持水量Field capacity
试验采用土柱栽培,于各小区埋设厚1 cm、直径30 cm、长20 cm的PE管,每3个PE管连成一个整体,总长为60 cm。灌溉方式为滴灌,滴灌带(管径16 mm,滴头间距30 cm,设计流量为2.6 L·h-1)放置在PE管中央。在土柱中装土的过程中,通过向土柱中浇水的方式模拟大田水分分布情况,先将过筛后的干土装入根管口下40—60 cm,多次向PE管中灌水达到田间持水量,再将PE管中0—40 cm装入风干土。在装土的同时,将测定管埋入土柱中,采用电阻式水分张力感应器(Watermark,model 200SS;Irrometer Co.,River-side,USA)测量土壤实时含水量。
播种前将PE管排放于按尺寸挖好的高60 cm的方形土坑中,每个处理播种25管(图2)。PE管下先平铺一层直径0.3—0.8 cm的小石子,并在其上铺100目尼龙网。试验中所用氮肥为尿素(N=46%),磷肥为过磷酸钙(P2O5=12%),N肥基追比为3﹕7,生育期内施P2O5120 kg·hm-2,纯N 255 kg·hm-2,折合每管施纯N 3.4 g、P2O51.6 g,将全部磷肥和基施N肥混入0—40 cm土壤中,追肥分别于分蘖期、拔节期、孕穗-扬花期、灌浆期随水滴施20%、40%、35%、5%。每根管中留苗12株,两年分别于2021年4月3日和2022年4月1日播种,2021年7月7日和2022年7月10日收获,田间管理方式同大田生产。

图2 田间种植示意图
1.2 测定项目与方法
1.2.1 根系形态特征 分别于分蘖期、拔节期、开花期、乳熟期取田间土柱中0—60 cm土层,20 cm为一层。取回的根样清洗后,将其置入根盒,用扫描仪(Epson V500,USA)扫描,扫描后的根系图片用Win-RHIZO(CAN)进行分析,得到小麦根系的根长、根体积,并计算相应密度[24]。
根长密度(RLD)(cm·cm-3)=各土层根长/相应PE管土体积;根体积密度(RVD)(cm3·cm-3)=各土层根体积/相应PE管土体积。
1.2.2 根系生理特征 分别于分蘖期、拔节期、开花期、乳熟期取田间土柱中0—60 cm土层,每间隔20 cm为一层,捡取各层根系洗净后,用冰袋保存迅速带回实验室,立即置于液氮中速冻,-80 ℃冰箱中保存。
抗氧化系统:丙二醛(MDA)含量采用硫代巴比妥酸法[25]测定;超氧化歧化酶(SOD)、过氧化物酶(POD)分别采用氮蓝四唑法[25]、愈创木酚法[25]测定。渗透物质:脯氨酸(Pro)、可溶性糖(SS)分别采用酸性茚三酮比色法[25]、蒽酮比色法[25]测定。根系活力采用氯化三苯基四氮唑(TTC)法[25]测定。
1.2.3 产量 在成熟阶段,每个处理选取3管小麦进行脱粒,自然风干直到谷物含水量约为12.5%,并计算籽粒产量。
1.2.4 补偿指数 补偿指数(C)指各指标在胁迫恢复后与对照相比的恢复程度,可反映小麦根系补偿效应的大小。计算公式:C=(X-X)/X。式中,X为干旱解除后指标实测值;X为对照相应指标实测值。若C为正值则存在补偿现象,若C为负值则说明某项指标在干旱解除后不存在补偿现象[26]。本试验以CK为对照,计算T1、T2、T3以及T4处理各生理指标的补偿指数。
1.3 数据处理
使用Microsoft Excel 2019进行数据处理及图表绘制,利用SPSS 26.0进行统计分析,Duncan及LSD方法进行显著性检验,文中数据均为2021和2022年的平均值±标准误。
2 结果
2.1 干旱胁迫对不同抗旱性春小麦根系形态特征的影响
根系形态特征指标值随生育期推进表现为先增加后降低的趋势(表3)。干旱胁迫对春小麦根系形态影响显著。随干旱胁迫增加,两个春小麦根系0—20 cm土层RLD和RVD在开花期较CK处理平均降低3.20%—20.80%和1.75%—16.92%。
春小麦根系主要集中在0—20 cm土层,但轻度干旱(T1、T3)后根系在深层占比较中度干旱(T2、T4)大,20—60 cm土层RLD和RVD均表现为T1>T3>T2>T4>CK。开花期,RLD和RVD在T1处理下较其余处理分别平均高出5.35%—33.87%、0.26%—17.14%。T1处理下强抗旱性品种新春6号在开花期的RLD和RVD均比弱抗旱性品种新春22号高出14.24%和10.95%。干旱处理、品种互作对RLD影响达极显著水平(<0.01),但对拔节和开花期的RVD影响不显著。结果表明,干旱会使根系表现出“趋水性”,轻度和中度干旱促进根系在20—60 cm土层的生长,并显著提高根系在该土层的分布比例,使根系主要分布区域相对下移,其中T1处理表现最佳。
2.2 干旱胁迫对不同抗旱性春小麦根系抗氧化系统的影响
2.2.1 MDA含量 干旱胁迫显著增加了春小麦根系的MDA含量(图3)。两个品种根系MDA含量在轻度水分胁迫开始显著增加,在中度干旱胁迫时增至最大值,增幅为10.88%—27.83%。复水后,新春6号各处理的根系MDA含量均恢复至CK水平,其中T1处理根系MDA含量最低,各处理较CK处理平均降低6.90%—27.75%,而新春22号仅在T1和T3处理下产生补偿效应,较CK平均减少12.95%和8.49%,中度干旱(T2和T4)则不能恢复到CK。品种间,T1处理下,新春6号开花期根系MDA含量低于新春22号,平均降幅为22.17%。水分处理和品种对根系MDA含量的互作效应达极显著水平(<0.01)。
2.2.2 SOD活性 如表4显示,两个品种根系SOD活性随干旱程度的加剧呈先升后降的趋势。复水后,两个品种根系SOD含量表现存在差异,新春6号表现为T1>T3>T2>T4>CK,各处理均恢复至CK水平,其中T1较CK平均增加7.53%—22.68%,而新春22号变化趋势为T1>T3>CK>T2>T4,T1和T3处理较CK平均增加29.40%和18.81%,T2和T4处理较CK平均降低15.18%和3.52%。从土壤深度来看,随土层加深,SOD活性增加。品种间比较,开花期新春6号根系SOD活性在T1处理下较新春22号平均增加4.36%。水分处理和品种对根系SOD活性的互作效应达到极显著水平(<0.01)。
2.2.3 POD活性 随胁迫程度加剧,根系POD活性呈先升后降的趋势(表5)。适度干旱后复水可提高小麦根系POD活性,T1处理与其余处理差异显著(<0.05),比其余处理平均高出3.01%—23.81%,但两个品种根系中POD活性对干旱复水的响应仍存在差异,其中新春6号根系POD活性在各处理复水后较CK显著增加,而新春22号仅在T1和T3处理较CK平均增加17.83%和5.07%,T2和T3处理较CK平均降低1.89%和8.46%。深层根系POD活性较浅层根系高,40—60 cm根系较0—20 cm根系POD活性平均高出8.35%—29.43%。品种间比较,T1处理下,新春6号根系POD活性在开花期普遍高于新春22号,平均高出12.13%。水分处理和品种互作对分蘖期和拔节期的根系POD活性有显著影响。
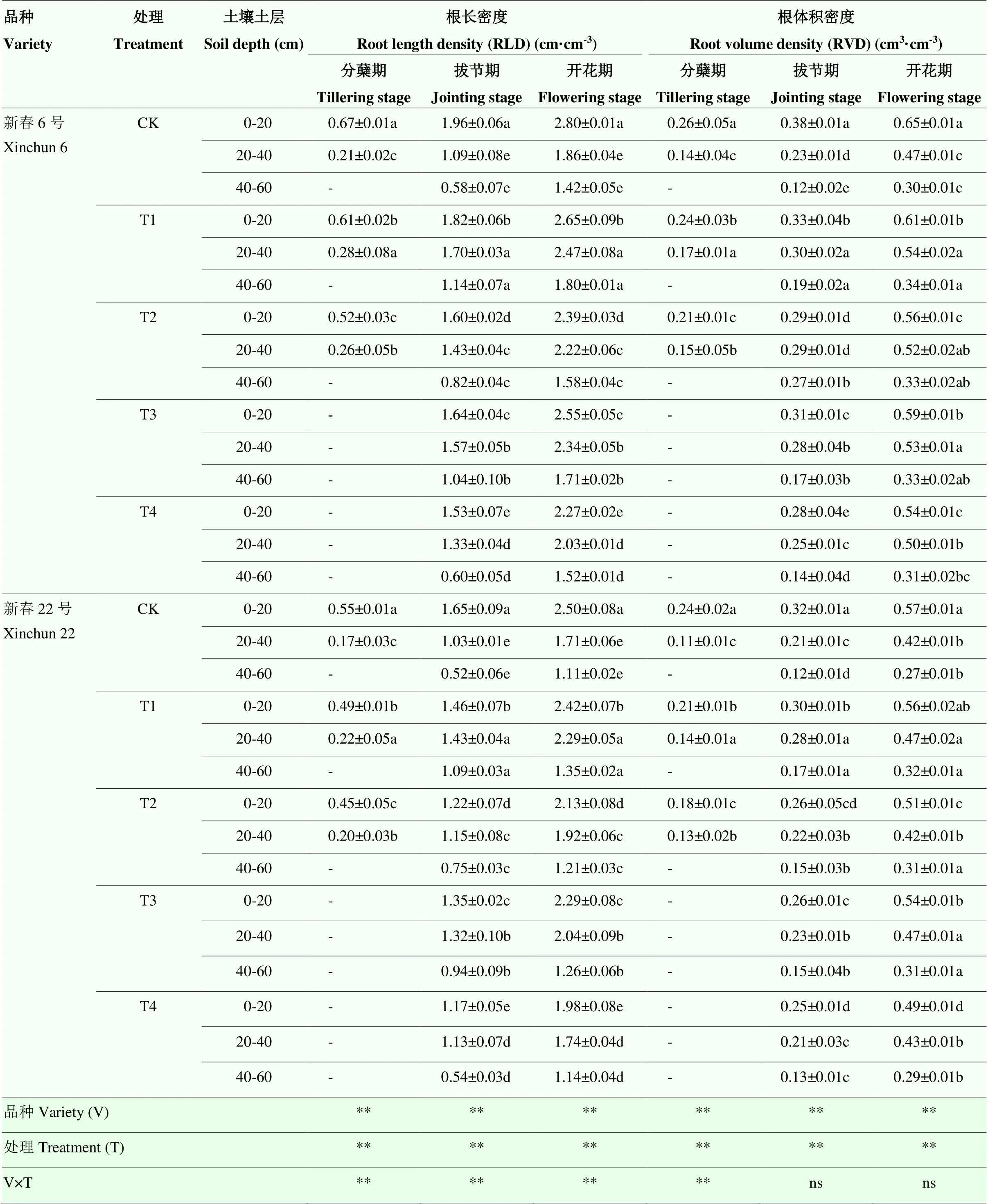
表3 干旱胁迫对不同抗旱性春小麦品种根系形态相关性状的影响
表中数据为2021和2022年的平均值±标准误Data in the table are the mean±SE for 2021 and 2022。-:无此数据No data;数据后不同小写字母表示同一品种在不同干旱胁迫下差异显著(P<0.05)Different lowercase letters after the data indicate significant difference of the same variety in the different drought stress treatments at 0.05 level。*和**分别表示在0.05和0.01水平差异显著,ns表示在0.05水平差异不显著* and ** indicate significant difference at 0.05 and 0.01 levels, respectively, ns indicates no significant difference at 0.05 level。下同The same as below

A:分蘖期tillering stage;B:拔节期jointing stage;C:开花期flowering stage;D:乳熟期milk ripening stage
综上,干旱胁迫促进根系抗氧化酶活性的增加,强抗旱性品种增加幅度高于弱抗旱性品种,且在复水后强抗旱性品种仍能在生育后期维持较高抗氧化酶活性,从而增强根系活性,其中T1处理表现最佳。
2.3 干旱胁迫对不同抗旱性春小麦根系渗透调节物质的影响
2.3.1 Pro含量 随干旱胁迫程度的加剧,两个品种根系Pro含量先增加后降低,与CK差异达显著水平(表6),但不同品种根系对干旱复水的响应不同。新春6号在复水后,不同处理表现为T1>T3>T2>T4>CK,各处理开花期根系Pro含量较CK平均增加8.95%—32.89%;而新春22复水后各处理表现为T1>T3>CK>T2>T4,在T1和T3处理下恢复至CK水平,分别较CK高出25.56%和23.30%,T2和T4处理则显著低于CK(<0.05)。T1处理下,新春6号在开花期根系Pro含量较新春22号平均增加9.68%。水分处理和品种对根系Pro含量的互作效应达极显著水平(<0.01)。
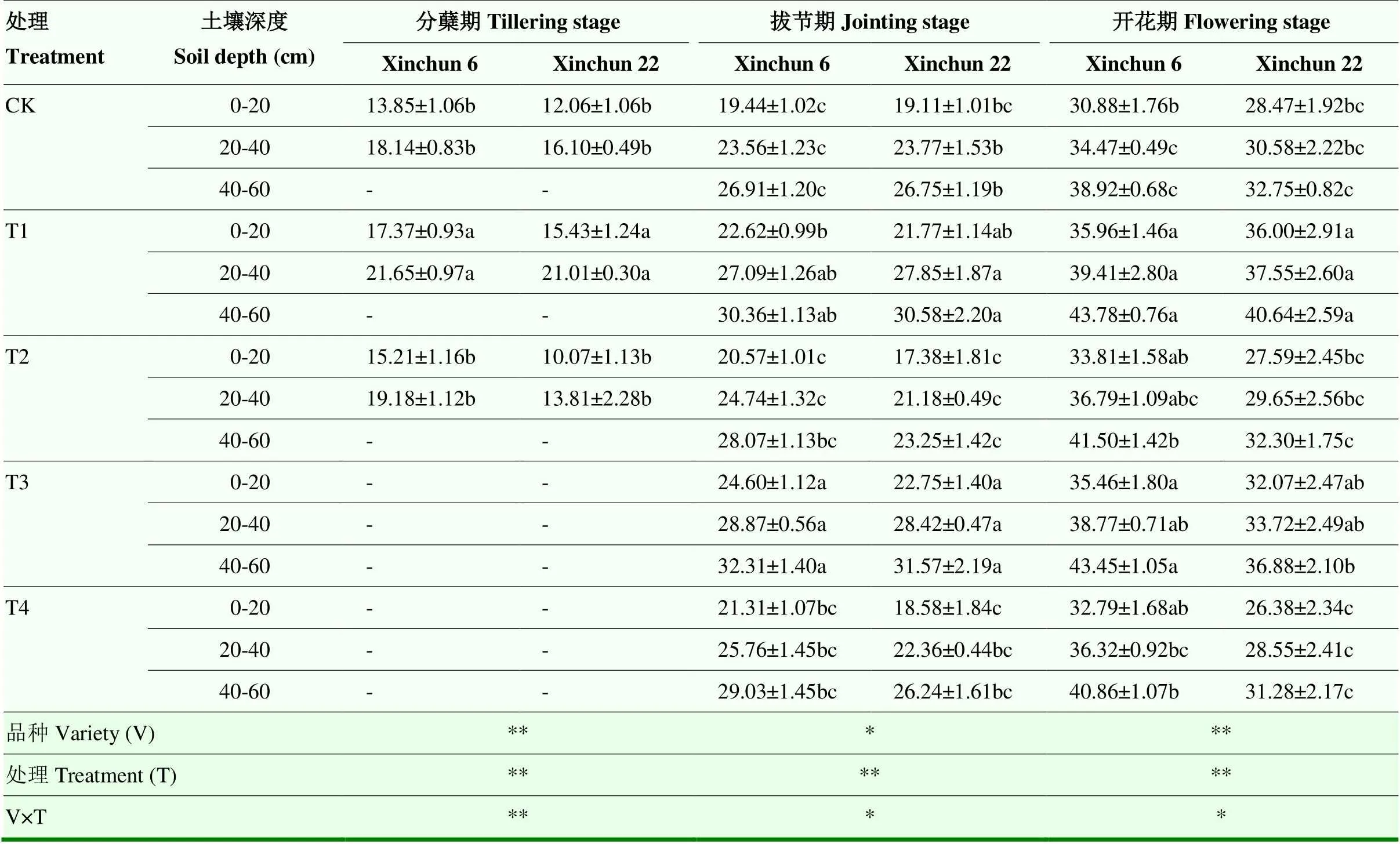
表4 干旱胁迫对不同抗旱性春小麦品种根系超氧化物歧化酶活性的影响

表5 干旱胁迫对不同抗旱性春小麦品种根系过氧化物酶活性的影响
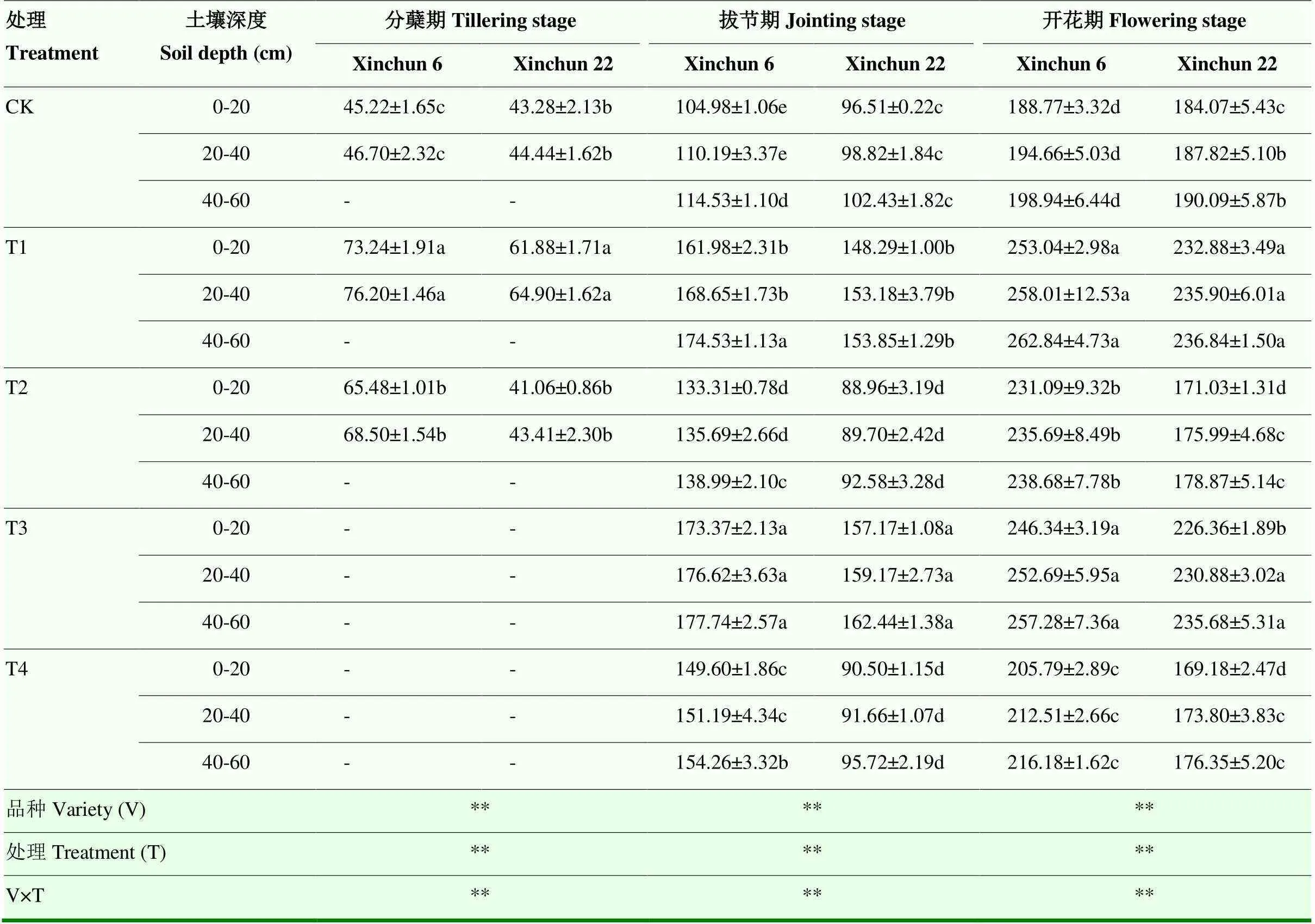
表6 干旱胁迫对不同抗旱性春小麦品种根系脯氨酸含量的影响
2.3.2 SS含量 干旱胁迫对根系SS含量影响显著(表7)。两个品种根系SS含量均随胁迫程度加剧表现为先增后降的趋势,均以T1处理表现最优,与CK差异达显著水平(<0.05)。两个品种根系SS含量对干旱后复水的响应存在差异。在开花期,新春6号各处理复水后较CK显著增加3.79%—30.72%,新春22号仅在T1和T3处理较CK平均增加21.33%和18.99%,而T2和T4处理较CK平均降低7.11%和11.69%。品种间,T1处理下新春6号开花期根系SS含量较新春22号平均增加14.49%。水分处理和品种对根系SS含量的互作效应达极显著水平(<0.01)。可见,干旱胁迫对根系渗透调节物质含量影响显著,轻度干旱能显著增加根系渗透调节物质,生育后期仍能维持较高渗透调节水平应对逆境,其中T1处理表现最佳。
2.4 干旱胁迫对不同抗旱性春小麦根系活力的影响
两个春小麦品种根系活力均随干旱胁迫程度加剧而降低(图4)。新春6号干旱复水后,开花期根系活力较CK平均高出5.17%—15.60%。而新春22号根系活力仅在轻度胁迫(T1、T3)后复水较CK高出5.41%—9.73%,中度胁迫(T2、T4)复水则不能恢复至CK水平,较CK分别降低2.72%、6.61%。从土层深度看,两个品种均表现为随土层加深根系活力增大的变化趋势,干旱处理后0—20 cm土层根系活力降幅较明显,为4.53%—13.03%。品种间,T1处理复水,新春6号根系活力在开花期较新春22号平均高10.67%。品种与水分处理互作对拔节期和乳熟期根系活力的影响达显著水平(<0.05)。可见,水分亏缺降低了春小麦根系活力,而复水能增加强抗旱性品种的根系活力,使生育后期能持续维持较高的根系活力以促进地上部分生长,其中T1处理表现最佳。
2.5 干旱胁迫对不同抗旱性春小麦产量的影响及根系生长与胁迫程度的逐步回归分析
干旱胁迫对产量影响显著(表8)。随干旱程度增加,复水后其产量呈先增加后降低的趋势,两个品种均在T1处理达到最大值。新春6号各处理复水后的产量均高于CK,其中T1处理较CK平均高出2.77%—16.27%,而新春22号仅在T1和T3处理恢复至CK,T2和T4处理低于CK处理,其中T1处理较CK平均高出4.04%—19.58%。新春6号在T1处理下的产量较新春22号高出9.60%,品种与处理互作对产量的影响达极显著水平(<0.01)。

表7 干旱胁迫对不同抗旱性春小麦品种根系可溶性糖含量的影响

表8 干旱胁迫对不同抗旱性春小麦产量的影响
以产量()为因变量,根长密度(1)、根体积密度(2)、根系活力(3)、游离脯氨酸(4)、可溶性糖(5)、丙二醛(6)、超氧化物歧化酶(7)、过氧化物酶(8)为自变量进行逐步回归分析。经过分析得到逐步回归方程:(新春6号)=9.19+0.395+ 0.454+0.212(R=0.881,=62.22**);(新春22号)=10.89+0.635+0.351(R=0.905,=128.95**)。
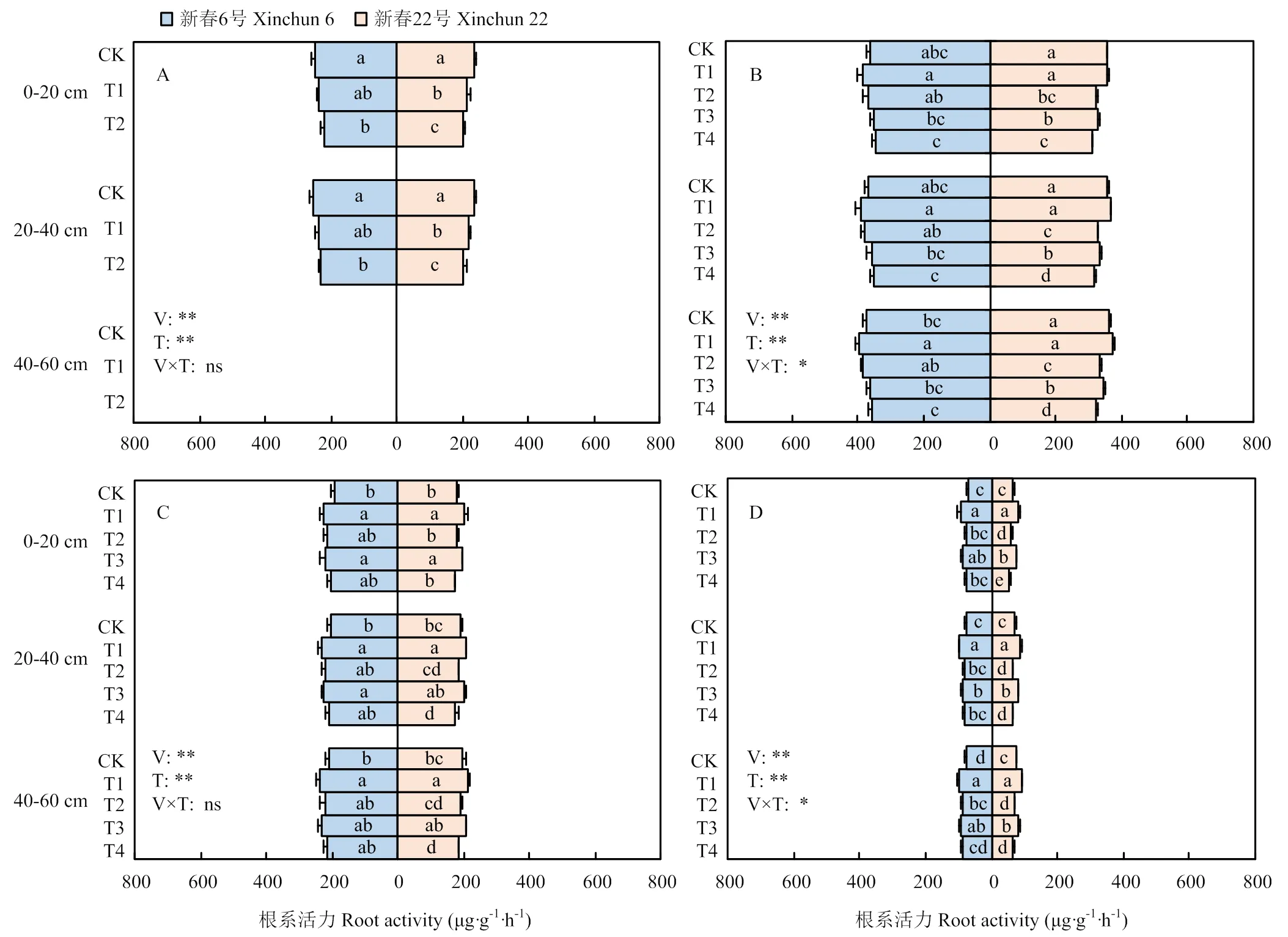
图4 干旱胁迫对不同抗旱性春小麦根系活力的影响
回归分析结果表明,SS、Pro和RLD对新春6号产量影响最大,决定其产量的88.1%,SS和RLD对新春22号产量影响显著,决定其产量的90.5%。
进一步采用逐步回归分析不同胁迫程度下对供试春小麦抗旱性影响较为显著的指标(表9)。轻度胁迫(T1和T3)下,SOD和SS是对新春6号抗旱性影响较显著的指标(2=0.823**),RLD、MDA以及POD是对新春22号抗旱性影响较显著的指标(2= 0.993**);中度干旱(T2和T4)胁迫下,RLD和Pro是对新春6号抗旱性影响较显著的指标(2=0.881**),MDA和RLD是对新春22号抗旱性影响较显著的指标(2=0.866**)。
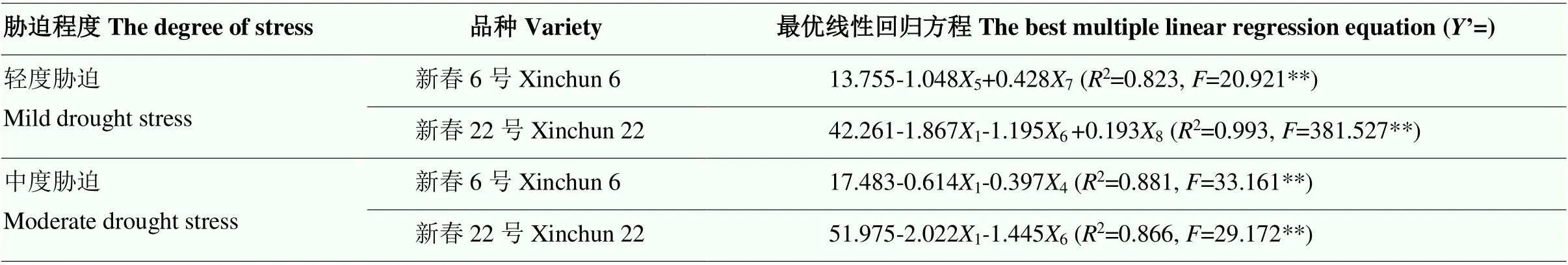
表9 不同抗旱性春小麦根系形态、生理指标与胁迫程度的逐步回归分析
:所测定的不同抗旱性小麦品种根系形态及生理参数The measured root morphological and physiological parameters of different drought-resistant wheat varieties;’:不同胁迫程度different degrees of stress
2.6 干旱胁迫下不同抗旱性春小麦根系生理指标补偿指数的变化
不同程度水分亏缺后复水小麦各生理指标的补偿指数各异(表10)。其中,新春6号根系生理指标在不同水分处理下均产生补偿效应,而新春22号根系各生理指标仅在轻度干旱(T1、T3)处理下产生补偿效应。
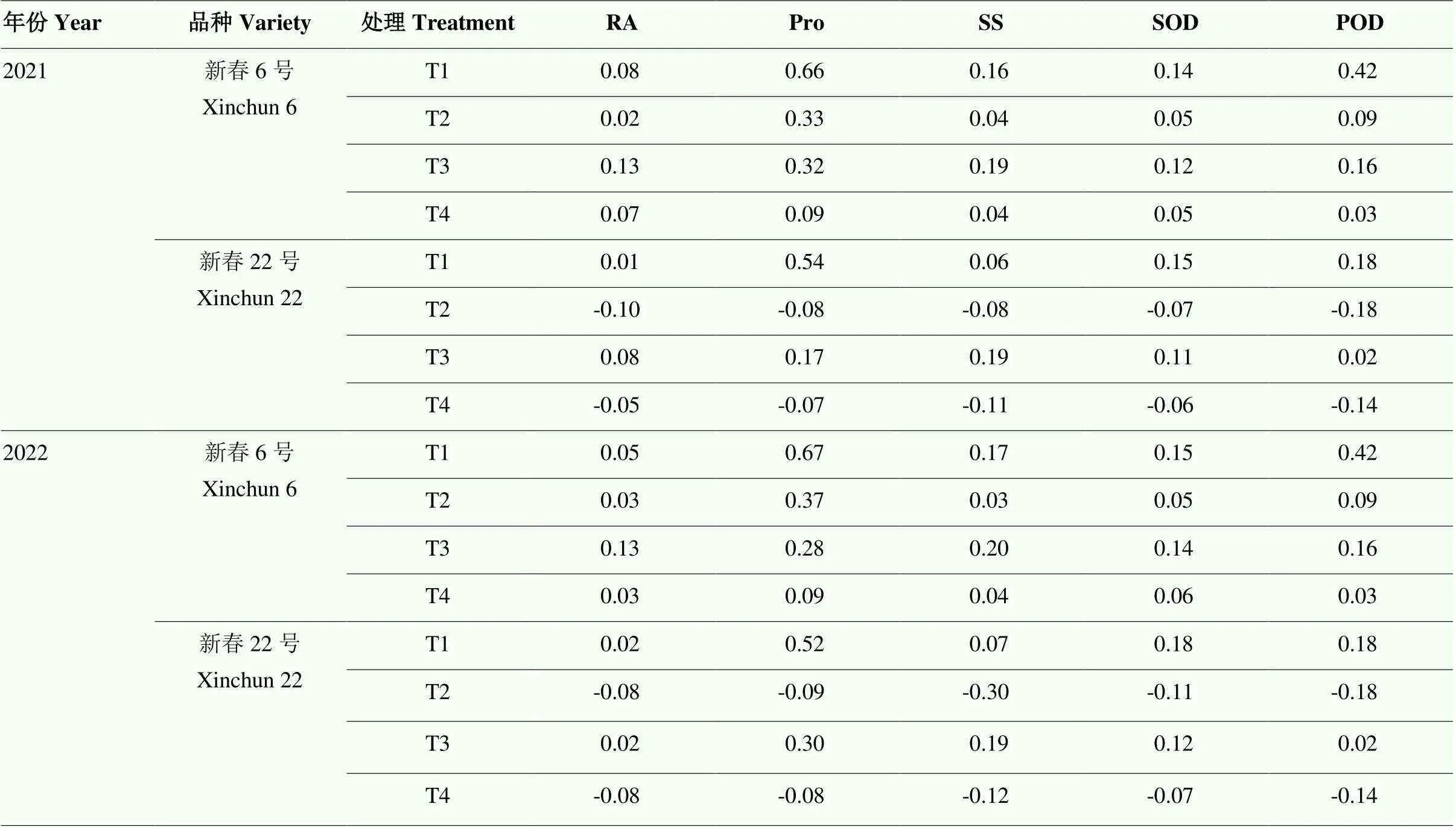
表10 干旱胁迫下不同抗旱性春小麦品种生理指标补偿指数的变化
RA:根系活力root activity;Pro:游离脯氨酸proline;SS:可溶性糖soluble sugar;SOD:超氧化物歧化酶superoxide dismutase;POD:过氧化物酶peroxidase
3 讨论
3.1 干旱胁迫对不同抗旱性春小麦根系形态特征的影响
根系接收到干旱信号后,通过转导信号,调节根系的生理特性,并且通过代谢途径影响同化物在不同器官中的分配比例,最终使根系从形态和分布上来适应胁迫[27-28]。干旱条件下,根系的生长深度、根系分支的形成显著影响到作物对土壤水的吸收及利用,较庞大的根系可使作物大范围吸收土壤水分[29]。本研究表明,干旱胁迫下,两个供试品种的RLD和RVD显著增加,尤其增加了20—60 cm土层深度的根系比例,促进了根系向下延伸,说明增加根部生物量和RLD、RVD是小麦适应干旱胁迫的一种重要的根系生长机制,结果与Gebre[30]、张馨月[31]等的研究一致。Chen等[32]发现,干旱胁迫显著降低了小麦的根系质量和总长度,而强抗旱型品种的根质量和总长度降幅较小。本研究也得出了相似的结论,强抗旱性品种新春6号的RLD和RVD较弱抗旱性品种新春22号平均高出14.24%和10.95%,说明强抗旱性品种适应逆境的能力较强,且干旱胁迫复水后,各时期仍维持较庞大的根系以吸收水分,这可能是其抗旱能力较强的重要原因。因此,本研究中轻度干旱胁迫能促进根系在20—60 cm土层生长,并显著提高根系在该土层的分配比例,有助于植株对水分的吸收,缓解水分亏缺对植株的影响,其中分蘖期轻度干旱(T1)对根系空间生长与分布的促进效应更佳。
3.2 干旱胁迫对不同抗旱性春小麦品种根系生理特性的影响
根系在经历干旱后,会积累大量活性氧(ROS)及MDA,这些物质会严重危害植物细胞和组织,而植物本身具有一套清除ROS和MDA的抗氧化系统来缓解损伤[33-35]。作物在干旱条件下,体内的抗氧化物质以及抗氧化酶活性均会大量增加,并与抗旱能力呈显著正相关[36]。本研究中,轻度干旱(T1和T3)提高了小麦根系中SOD、POD活性;中度胁迫(T2和T4)后又逐渐下降,表明轻度干旱可激活根系的抗氧化保护系统,但中度干旱致使有害物质积累较多,超过抗氧化酶的清除速率,因此出现下降的趋势。这与厉广辉[16]、张海燕[37]等的研究结果基本一致。不同品种对复水响应存在差异,新春6号复水后根系MDA含量下降,抗氧化酶活性高于CK处理,表现出较强的生理补偿,而新春22号根系MDA含量、抗氧化酶活性在中度干旱(T2、T4)后复水未恢复至CK。新春6号根系MDA含量低于新春22号,而抗氧化酶活性高于新春22号,表明新春6号根系在干旱复水后膜系统仍能维持较高保护能力,间接地展现出较优的抗旱性。综上,T1处理复水能使根系维持较强的抗氧化能力,增强根系活力,保证生育中后期干物质向生殖器官转运,从而提高了籽粒产量。
干旱条件下,根系产生大量的SS、Pro等物质来调控自身渗透能力,减少干旱带来的损伤[38]。本研究结果显示,随着干旱程度加剧,SS、Pro含量均呈先增加后降低的趋势,不同指标间增加幅度存在一定差异。但也有研究指出,渗透调节物质的含量随干旱程度加深均不断上升[39],这可能与作物种类、胁迫处理的方法和时间有关。此外,正常水分条件下,新春6号根系的Pro和SS含量均高于新春22号,随干旱程度增加,新春6号根系Pro和SS含量的增加幅度高于新春22号,这说明根系的渗透调节能力因品种不同而异。综上,本研究中TI处理复水能促进根系发育,提高渗透调节能力,促进根系活力的提升,从而提高产量,进一步证明较强的渗透调节能力是抗旱性强品种根系适应干旱胁迫的一种重要生理机制。
3.3 干旱胁迫对不同抗旱性春小麦品种产量的影响及根系的阶段性响应策略
作物具有较大的根系、较高的生理活性有利于保持其对地上部水分和养分的供应,促进地上部干物质积累,有助于提高产量[40]。本研究中轻度干旱处理后,根系在深层分布较多,复水后展现出较强大的抗氧化系统及渗透调节能力,提升根系活力,增强根系对水肥的吸收,从而提高产量,两个品种均在T1处理产量最高,较CK分别增加2.77%—16.27%和4.04%—19.58%。
裴艳武等[41]研究发现,根系生长对干旱胁迫的响应因胁迫程度及时间展现出较为明显的阶段性特征。本研究发现,轻度胁迫下,强抗旱性品种新春6号最先通过增加根系SS含量来适应干旱胁迫,综合补偿效应较高;弱抗旱性品种新春22号根系膜系统的稳定性最先遭到破坏,MDA含量迅速增加。中度胁迫时,新春6号的RLD和Pro含量最先受到影响;而新春22号主要通过改变RLD和MDA来适应干旱。此结果表明,不同抗旱性小麦品种会激活不同的防御机制应对干旱,而这些不同防御机制的启动可能是由于品种本身或响应干旱胁迫的分子生理机制差异所造成。此外,春小麦根系生理特性对不同生育阶段干旱的响应策略也具有差异。分蘖期干旱复水后,根系Pro、SS以及POD等生理指标的补偿指数较高,表现为较优的生理补偿效应;而拔节期干旱复水后,根系Pro含量补偿指数较优。因此,有关不同抗旱性春小麦品种响应阶段干旱胁迫的各生理指标间的相互作用机制及与不同生理特性相关的分子调控机制还需进一步深入研究。
4 结论
分蘖和拔节期轻度干旱(60%—65%田间持水量)可促进春小麦根系生长,增加根系在20—60 cm土层的分配比例,增强根系活性氧清除能力,缓解膜脂过氧化程度,复水后有利于根系产生生长补偿,从而提高根系活力以获得高产。因此,分蘖和拔节期轻度干旱复水可有效延缓根系衰老,是防控春小麦根系早衰、进一步挖掘滴灌节水增产潜力的有效方式。
[1] 丛建鸥, 李宁, 许映军, 顾卫, 乐章燕, 黄树青, 席宾, 雷飏. 干旱胁迫下冬小麦产量结构与生长、生理、光谱指标的关系. 中国生态农业学报, 2010, 18(1): 67-71.
CONG J O, LI N, XU Y J, GU W, LE Z Y, HUANG S Q, XI B, LEI Y. Relationship between indices of growth, physiology and reflectivity and yield of winter wheat under water stress. Chinese Journal of Eco-Agriculture, 2010, 18(1): 67-71. (in Chinese)
[2] 王志强,梁威威,范雯雯, 林同保.不同土壤肥力下冬小麦春季干旱的复水补偿效应.中国农业科学,2011,44(8): 1628-1636. doi: 10.3864/j.issn.0578-1752.2011.08.011.
WANG Z Q, LIANG W W, FAN W W, LIN T B. Studies on compensation effects of rewatering on winter wheat suffering from droughts during spring under different soil fertility conditions. Scientia Agricultura Sinica, 2011, 44(8): 1628-1636. doi: 10.3864/j. issn.0578-1752.2011.08.011. (in Chinese)
[3] 祁嘉郁,巴特尔·巴克.基于水分亏缺指数的北疆春小麦不同生育阶段干旱时空特征.干旱地区农业研究,2021,39(4): 171-178.
QI J Y, BAKE·B T E. Temporal and spatial characteristics of drought in different growth stages of spring wheat in northern Xinjiang based on crop water deficit index. Agricultural Research in the Arid Areas, 2021, 39(4): 171-178. (in Chinese)
[4] Fang Y, Du Y L, Wang J, Wu A J, Qiao S, Xu B C, Zhang S Q, Siddique K H M, Chen Y L. Moderate drought stress affected root growth and grain yield in old, modern and newly released cultivars of winter wheat. Frontiers in Plant Science, 2017, 8: 672.
[5] Xie X B, Quintana M R, Sandhu N, Subedi S R, Zou Y B, Rutkoski J E, Henry A. Establishment method affects rice root plasticity in response to drought and its relationship with grain yield stability. Journal of Experimental Botany, 2021, 72(14): 5208-5220.
[6] PENG C R, XIE J S, QIU C F, QIAN Y F, GUAN X J, PAN X H. Study and application of three high and one ensuring cultivation mode of double cropping rice. Agricultural Science & Technology, 2012, 13(7): 1425-1430.
[7] 李彦彬, 朱亚南, 李道西, 高阳. 阶段干旱及复水对小麦生长发育、光合和产量的影响. 灌溉排水学报, 2018, 37(8): 76-82.
LI Y B, ZHU Y N, LI D X, GAO Y. Effects of alternating drought and watering on growth, photosynthesis and yield of wither wheat. journal of irrigation and drainage, 2018, 37(8): 76-82. (in Chinese)
[8] KHODAEIAMINJAN M, KNOCH D, NDELLA THIAW M R, MARCHETTI C F, KOŘÍNKOVÁ N, TECHER A, NGUYEN T D, CHU J T, BERTHOLOMEY V, DORIDANT I, GANTET P, GRANER A, NEUMANN K, BERGOUGNOUX V. Genome-wide association study in two-row spring barley landraces identifies QTL associated with plantlets root system architecture traits in well- watered and osmotic stress conditions. Frontiers in Plant Science, 2023, 14: 1125672.
[9] Farshad N, Soodabeh J, Mehdi G, ALi E. Studying the physiological and yield responses of sunflower inbred lines to full and limited irrigation. Journal of Integrative Agriculture, 2018, 17(7): 1605-1611.
[10] Alaguero-Cordovilla A, Gran-Gómez F, Tormos- Moltó S, Pérez-Pérez J. Morphological characterization of root system architecture in diverse tomato genotypes during early growth. International Journal of Molecular Sciences, 2018, 19(12): 3888.
[11] 张志勇, 秦步坛, 熊淑萍, 王浩哲, 徐赛俊, 田文仲, 王小纯, 马新明. 小麦开花期灌水对土壤养分及根系分布的影响. 应用生态学报, 2022, 33(12): 3328-3336.
ZHANG Z Y, QIN B T, XIONG S P, WANG H Z, XU S J, TIAN W Z, WANG X C, MA X M. Effects of irrigation at flowering stage on soil nutrient and root distribution in wheat field. Chinese Journal of Applied Ecology, 2022, 33(12): 3328-3336. (in Chinese)
[12] 张翠梅, 师尚礼, 刘珍, 杨帆, 张振科. 干旱胁迫对不同抗旱性苜蓿品种根系形态及解剖结构的影响. 草业学报, 2019, 28(5): 79-89.
ZHANG C M, SHI S L, LIU Z, YANG F, ZHANG Z K. Effects of drought stress on the root morphology and anatomical structure of alfalfa () varieties with differing drought-tolerance. Acta Prataculturae Sinica, 2019, 28(5): 79-89. (in Chinese)
[13] 张翠梅, 师尚礼, 吴芳. 干旱胁迫对不同抗旱性苜蓿品种根系生长及生理特性影响. 中国农业科学, 2018, 51(5): 868-882. doi: 10.3864/j.issn.0578-1752.2018.05.006.
ZHANG C M, SHI S L, WU F. Effects of drought stress on root and physiological responses of different drought-tolerant alfalfa varieties. Scientia Agricultura Sinica, 2018, 51(5): 868-882. doi: 10.3864/j.issn. 0578-1752.2018.05.006. (in Chinese)
[14] 魏清江, 冯芳芳, 马张正, 苏受婷, 宁少君, 辜青青. 干旱复水对柑橘幼苗叶片光合、叶绿素荧光和根系构型的影响. 应用生态学报, 2018, 29(8): 2485-2492.
WEI Q J, FENG F F, MA Z Z, SU S T, NING S J, GU Q Q. Effects of drought and rewatering on leaf photosynthesis, chlorophyll fluorescence, and root architecture of citrus seedlings. Chinese Journal of Applied Ecology, 2018, 29(8): 2485-2492. (in Chinese)
[15] XIE H, BAI G, LU P, LI H, FEI M, XIAO B G, CHEN X J, TONG Z J, WANG Z Y, YANG D H. Exogenous citric acid enhances drought tolerance in tobacco (). Plant Biology, 2022, 24(2): 333-343.
[16] 厉广辉, 万勇善, 刘风珍, 张昆. 不同抗旱性花生品种根系形态及生理特性. 作物学报, 2014, 40(3): 531-541.
LI G H, WAN Y S, LIU F Z, ZHANG K. Morphological and physiological traits of root in different drought resistant peanut cultivars. Acta Agronomica Sinica, 2014, 40(3): 531-541. (in Chinese)
[17] 王笑, 蔡剑, 周琴, 戴廷波, 姜东. 非生物逆境锻炼提高作物耐逆性的生理机制研究进展. 中国农业科学, 2021, 54(11): 2287-2301. doi: 10.3864/j.issn.0578-1752.2021.11.004.
WANG X, CAI J, ZHOU Q, DAI T B, JIANG D. Physiological mechanisms of abiotic stress priming induced the crops stress tolerance: A review. Scientia Agricultura Sinica, 2021, 54(11): 2287-2301. doi: 10.3864/j.issn.0578-1752.2021.11.004. (in Chinese)
[18] MU Q, CAI H J, SUN S K, WEN S S, XU J T, DONG M Q, SADDIQUE Q. The physiological response of winter wheat under short-term drought conditions and the sensitivity of different indices to soil water changes. Agricultural Water Management, 2021, 243: 106475.
[19] 崔亚坤. 分蘖和拔节期土壤干旱对小麦产量形成的影响及其生理机理[D]. 南京: 南京农业大学, 2015.
CUI Y K. Effect of water deficit during tillering and jointing stages on grain yield in winter wheat and its physiological mechanisms[D]. Nanjing: Nanjing Agricultural University, 2015. (in Chinese)
[20] KANG Y, HAN Y, TORRES-JEREZ I, WANG M, TANG Y, MONTEROS M, UDVARDI M. System responses to long-term drought and re-watering of two contrasting alfalfa varieties. The Plant Journal, 2011, 68(5): 871-889.
[21] 徐红军, 于芳祥, 韩新年, 穆培源, 邹波, 王亮. 春小麦新品种新春22号. 中国种业, 2006(9): 53.
XU H J, YU F X, HAN X N, MU P Y, ZOU B, WANG L. A new spring wheat variety Xinchun 22. China seed industry, 2006(9): 53. (in Chinese)
[22] 段理慧. 春小麦新春6号选育报告. 农业工程, 2013, 3(2): 81-82.
DUAN L H. Breeding report of new spring wheat Xinchun 6. Agricultural Engineering, 2013, 3(2): 81-82. (in Chinese)
[23] 李剑峰, 樊哲儒, 张跃强, 王重, 张宏芝, 赵奇, 赵永川. 新疆春小麦品种(系)耐旱性和水敏感性研究. 新疆农业科学, 2016, 53(12): 2232-2241.
LI J F, FAN Z R, ZHANG Y Q, WANG Z, ZHANG H Z, ZHAO Q, ZHAO Y C. Studies on drought tolerance and water sensitivity of spring wheat varieties (lines) in Xinjiang. Xinjiang Agricultural Sciences, 2016, 53(12): 2232-2241. (in Chinese)
[24] 马忠明, 陈娟, 刘婷婷, 吕晓东. 水氮耦合对固定道垄作栽培春小麦根长密度和产量的影响. 作物学报, 2017, 43(11): 1705-1714.
MA Z M, CHEN J, LIU T T, Lü X D. Effects of water and nitrogen coupling on root length density and yield of spring wheat in permanent raised-bed cropping system. Acta Agronomica Sinica, 2017, 43(11): 1705-1714. (in Chinese)
[25] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000.
LI H S. Principles and Techniques of plant physiology and biochemistry experiments. Beijing: Higher Education Press, 2000. (in Chinese)
[26] 王丁, 杨雪, 韩鸿鹏, 张丽琴, 薛建辉. 干旱胁迫及复水对刺槐苗水分运输过程的影响. 南京林业大学学报(自然科学版), 2015, 39(1): 67-72.
Wang D, Yang X, Han H P, ZHANG L Q, XUE J H. The impact of drought and rewatering on water transportation process ofL. seedlings. Journal of Nanjing Forestry University (Natural Sciences Edition), 2015, 39(1): 67-72. (in Chinese)
[27] 丁红, 张智猛, 戴良香, 宋文武, 康涛, 慈敦伟. 不同抗旱性花生品种的根系形态发育及其对干旱胁迫的响应. 生态学报, 2013, 33(17): 5169-5176.
DING H, ZHANG Z M, DAI L X, SONG W W, KANG T, CI D W. Responses of root morphology of peanut varieties differing in drought tolerance to water-deficient stress. Acta Ecologica Sinica, 2013, 33(17): 5169-5176. (in Chinese)
[28] Placido D F, Sandhu J, Sato S J, Nersesian N, Quach T, Clemente T E, Staswick P E, Walia H. The lateral root density gene regulates root growth during water stress in wheat. Plant Biotechnology Journal, 2020, 18(9): 1955-1968.
[29] Wang J T, Du G F, Tian J S, Jiang C D, Zhang Y L, Zhang W F. Mulched drip irrigation increases cotton yield and water use efficiency via improving fine root plasticity. Agricultural Water Management, 2021, 255: 106992.
[30] Gebre M G, EARL H J. Soil water deficit and fertilizer placement effects on root biomass distribution, soil water extraction, water use, yield, and yield components of soybean [(L.) Merr.] grown in 1-m rooting columns. Frontiers in Plant Science, 2021, 12: 581127.
[31] 张馨月, 王寅, 陈健, 陈安吉, 王莉颖, 郭晓颖, 牛雅郦, 张星宇, 陈利东, 高强. 水分和氮素对玉米苗期生长、根系形态及分布的影响. 中国农业科学, 2019, 52(1): 34-44. doi: 10.3864/j.issn.0578-1752. 2019.01.004.
ZHANG X Y, WANG Y, CHEN J, CHEN A J, WANG L Y, GUO X Y, NIU Y L, ZHANG X Y, CHEN L D, GAO Q. Effects of soil water and nitrogen on plant growth, root morphology and spatial distribution of maize at the seedling stage. Scientia Agricultura Sinica, 2019, 52(1): 34-44. doi: 10.3864/j.issn.0578-1752.2019.01.004. (in Chinese)
[32] Chen X, Zhu Y, Ding Y, Pan R, Shen W, Yu X, Xiong F. The relationship between characteristics of root morphology and grain filling in wheat under drought stress. PeerJ, 2021, 9: e12015.
[33] Kou X, Han W, Kang J. Responses of root system architecture to water stress at multiple levels: A meta-analysis of trials under controlled conditions. Frontiers in Plant Science, 2022, 13: 1085409.
[34] Piper F I, Fajardo A. Carbon stress causes earlier budbreak in shade-tolerant species and delays it in shade-intolerant species. American Journal of Botany, 2023, 110(3): 16129.
[35] 孙建, 颜小文, 乐美旺, 饶月亮, 颜廷献, 叶艳英, 周红英. 芝麻不同抗旱基因型对花期干旱胁迫的生理响应机理. 中国农业科学, 2019, 52(7): 1215-1226. doi: 10.3864/j.issn.0578-1752.2019.07.009.
SUN J, YAN X W, LE M W, RAO Y L, YAN T X, YE Y Y, ZHOU H Y. Physiological response mechanism of drought stress in different drought-tolerance genotypes of sesame during flowering period. Scientia Agricultura Sinica, 2019, 52(7): 1215-1226. doi: 10.3864/j. issn.0578-1752.2019.07.009. (in Chinese)
[36] 莫言玲, 郑俊鶱, 杨瑞平, 刘长命, 顾秀荣, 张显, 魏春华. 不同西瓜基因型对干旱胁迫的生理响应及其抗旱性评价. 应用生态学报, 2016, 27(6): 1942-1952.
MO Y L, ZHENG J X, YANG R P, LIU C M, GU X R, ZHANG X, WEI C H. Physiological responses and tolerance to drought stress of different watermelon genotypes. Chinese Journal of Applied Ecology, 2016, 27(6): 1942-1952. (in Chinese)
[37] 张海燕, 解备涛, 汪宝卿, 董顺旭, 段文学, 张立明. 不同时期干旱胁迫对甘薯生长和抗氧化能力的影响. 中国农业科学, 2020, 53(6): 1126-1139. doi: 10.3864/j.issn.0578-1752.2020.06.005.
ZHANG H Y, XIE B T, WANG B Q, DONG S X, DUAN W X, ZHANG L M. Effects of drought treatments at different growth stages on growth and the activity of antioxidant enzymes in sweetpotato. Scientia Agricultura Sinica, 2020, 53(6): 1126-1139. doi: 10.3864/j. issn.0578-1752.2020.06.005. (in Chinese)
[38] Zhou Q, Li Y, Wang X, Yan C, Ma C, Liu J, Dong S. Effects of different drought degrees on physiological characteristics and endogenous hormones of soybean. Plants, 2022, 11(17): 2282.
[39] 张睿, 封晓辉, 吴玉洁, 孙琦, 李静, 李劲松, 刘小京. 长穗偃麦草()幼苗对盐旱胁迫的生理响应. 中国生态农业学报, 2022, 30(11): 1795-1806.
ZHANG R, FENG X H, WU Y J, SUN Q, LI J, LI J S, LIU X J. Interactive effects of drought and salt stresses on the growth and physiological characteristics of. Chinese Journal of Eco-Agriculture, 2022, 30(11): 1795-1806. (in Chinese)
[40] WANG J T, DU G F, TIAN J S, ZHANG Y L, JIANG C D, ZHANG W F. Effect of irrigation methods on root growth, root-shoot ratio and yield components of cotton by regulating the growth redundancy of root and shoot. Agricultural Water Management, 2020, 234: 106120.
[41] 裴艳武, 黄来明, 贾小旭, 邵明安, 张应龙. 干旱胁迫对黄土高原不同质地土壤长柄扁桃和沙柳幼苗生理生态特征的影响. 水土保持学报, 2018, 32(5): 234-239.
PEI Y W, HUANG L M, JIA X X, SHAO M A, ZHANG Y L. Effects of drought stress on the physiological and ecological characteristics ofandseedlings in soils with different texture on the loess plateau. Journal of Soil and Water Conservation, 2018, 32(5): 234-239. (in Chinese)
Response and Drip irrigation Re-watering Compensation Effect of spring wheat roots to drought stress with different drought tolerance varieties
WANG RongRong, CHEN TianPeng, YIN HaoJie, JIANG Guiying
College of Agronomy, Shihezi University, Shihezi 832000, Xinjiang
【Objective】The objective of this study is to investigate the differences in morphological and physiological responses of root growth of drip irrigated spring wheat with different drought sensitivity to stage drought stress, to further elaborate the physiological mechanisms of drought resistance and water conservation in drip irrigated spring wheat in Xinjiang, and to provide a theoretical basis for further water-saving and high-yield in Xinjiang wheat region. 【Method】From 2021-2022, the strong drought resistance variety Xinchun 6 and the weak drought resistance variety Xinchun 22 were used as the test materials by using the soil column cultivation method. Mild (T1 and T3, 60%-65% FC, FC is the fieldcapacity) and moderate (T2 and T4, 45%-50% FC) drought stress treatments were conducted during the tillering and jointing stages, with conventional irrigation as the control (CK, 75%-80% FC), the effects of pre-reproductive drought stress on root morphological characteristics (root length density (RLD), root volume density (RVD)), antioxidant system (malondialdehyde (MDA), superoxide dismutase (SOD), peroxidase (POD)), osmoregulation substance (proline (Pro), soluble sugars (SS)) and spatial and temporal characteristics of root activity were studied. the compensatory effect of drip irrigated spring wheat root growth on drought-rehydration was analyzed.【Result】RLD and RVD showed a trend of increasing and then decreasing with increasing drought stress, and under mild drought (T1 and T3) conditions, RLD and RVD in the 20-60 cm soil layer were significantly increased. The MDA content in the root of each soil layer showed an upward trend with the intensification of stress, while SOD, POD, Pro, and SS all increased first and then decreased with the intensification of drought, and gradually increased with the deepening of the soil layer. After rehydration of T1 treatment, root morphological characteristics, antioxidant enzyme activity, osmotic substances and root activity all reached the maximum value, which in turn increased the yield by 2.77% to 19.58% compared to the rest of the treatments. Stepwise regression analysis showed that RVD and SS were important determinants of yield, RLD, SOD and SS were the most significant indicators of Xinchun 6 drought resistance; RLD, MDA and POD were the most significant indicators of Xinchun 22 drought resistance.【Conclusion】Spring wheat maintains 60%-65% FC during the tillering and jointing stages, after drip irrigation and rehydration, it increases the distribution proportion of roots in the 20-60 cm soil layer, enhances the root system’s ability to remove reactive oxygen species and osmotic adjustment, delays root senescence and improves root physiological characteristics, thus increasing yield.
spring wheat; drought stress; tillering and jointing stages; root growth; compensation effect

10.3864/j.issn.0578-1752.2023.24.003
2023-04-12;
2023-05-21
国家自然科学基金(32060422)、国家级大学生创新创业训练计划(202210759001)、南疆重点产业创新发展支撑计划(2021DB010)
王荣荣,E-mail:1179679457@qq.com。通信作者蒋桂英,E-mail:2448251178@qq.com
(责任编辑 岳梅)
