桑黄酒的研制及其抗肿瘤活性研究
2023-12-27王青春赵立智包海鹰
王青春,韩 晨,赵立智,邹 滨,包海鹰
(1.吉林农业大学菌类中药资源开发与利用重点研究室,长春 130118;2.吉林农业大学食药用菌教育部工程研究中心,长春 130118)
传统中药桑黄,学名粗毛纤孔菌Inonotus hispidus (Bull.) P.Karst.,隶属于担子菌门Basidiomycota、蘑菇纲Agaricomycetes、锈革孔菌目Hymenochaetales,锈革孔菌科Hymenochaetaceae,纤孔菌属Inonotus[1]。据李玉、包海鹰主编的《中国菌物药》[2]记载,桑黄性平,味甘、辛,归肝经和肾经,经考证是我国传统中药桑黄的正源[3]。主要寄生在桑树、水曲柳、椴树、榆树、枣树、苹果树、刺槐杨树和国槐等树种上[4-7]。有关桑黄酒剂方面,在中国古代本草中就有记载。唐代《新修本草》中就有“桑黄,酒煎治乳痈”的记载,说明在唐代用桑黄治疗妇科乳腺疾病时就用其酒剂。宋代《圣惠方》中记载桑黄与木香配伍,服用时热酒调下,治久心病不止。《本草图经》中记载,桑耳切碎,酒煎服,治疗赤白带下。桑黄有黄熟陈白者,又有金色者,皆可用,切碎,酒煎,主带下。明代本草著作《普济方》中记载烘焙炮制的桑黄,服用时热酒下可治疗妇女月水不断等疾病。传统黄酒酿造中,主要以大米、黍米、玉米、小麦为主要原料,用复式发酵法,经蒸煮、加曲、糖化、发酵、压榨、过滤、煎酒、贮存、勾兑而成的酿造酒,属于低度酿造酒[8-9]。风味化合物来源广泛,如原料、发酵过程中的微生物代谢活动、陈酿过程中发生的化学反应等[10],富含功能性低聚糖、γ-氨基丁酸[11-14]等活性物质,具有一定的保健功能,也可作为中药重要辅料和药引使用[15-16]。黄酒是我国特有的酒种,因其酒体柔和,香气宜人,口感醇厚,享有“国酒”的盛誉。
国家癌症中心统计,我国肿瘤登记体系已覆盖5.98 亿人口。根据2020 年报告,我国总体癌症5 年生存率已经从10 年前的30.9%上升到目前的40.5%。目前已有126 种抗肿瘤新药在中国成功上市,广泛惠及中国及全球肿瘤患者。抗肿瘤药物是现代医学亟待解决的问题,在古代文献记载中,桑黄可用于治疗癥瘕积聚等肿瘤类疾病。近年来,经学者深入研究发现桑黄抗肿瘤效果显著,因此本文以传统中药桑黄为主要原料,选用传统黄酒作为酒基,对其抗肿瘤作用进行研究,并探究其作用机制,为桑黄酒的研究开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
桑黄成熟子实体(山东夏津古桑产业研究院,经吉林农业大学包海鹰教授鉴定);黄酒(山东即墨黄酒厂有限公司);苯酚、浓硫酸和香草醛(天津市光复精细化工研究所);水杨酸(天津市华东试剂厂);葡萄糖标准品(上海源叶生物科技有限公司);环磷酰胺(江苏恒瑞医药股份有限公司);IL-6、TNF-α、VEGF 和IFN-γ试剂盒(北京安迪华泰科技有限公司);生理盐水(四川科伦药业股份有限公司);HE 染色剂(上海多烯生物科技有限公司);低熔石蜡、高熔石蜡(上海华永石蜡有限公司);其他试剂均为分析纯。
1.1.2 实验动物与细胞株
体质量为18~20g 的BALB/c 雌性小鼠(北京华阜康生物科技股份有限公司)[许可证号:SCXK(京)2019-0008];小鼠H22 肿瘤细胞株(武汉普诺赛生命科技有限公司)。
1.1.3 仪器与设备
紫外分光光度计(日本岛津有限公司);FA2104-N电子分析天平(上海精其仪器有限公司);ELX800 酶标仪(Bio Tek Instruments,Inc.);转移脱色摇床(海门其林贝尔仪器制造公司,TS-8);电泳仪、凝胶玻璃板、DYCZ-20C 垂直电泳槽和DYCP-40C 转移槽(北京六一仪器厂);PVDF 膜(Millipore,美国);DM3000 倒置显微镜、RM2015 包埋机(德国LEICA 公司);YD-1508R 转轮时切片机、YD-A 生物组织摊片机 (金华市益迪医疗设备有限公司)。
1.2 实验方法
1.2.1 桑黄酒制备工艺
选择无霉变的桑黄成熟子实体,去除杂质,切段保持大小一致,经粉碎过2 号(20 目)筛。多糖和甾醇含量测定法分别为苯酚-硫酸法和香草醛-浓硫酸法。称取3 g 桑黄,用40、50、60、70 和80 倍体积黄酒充分浸提,测定多糖和甾醇含量,确定料液比。浸提第7、14、21、28 和35 d,测定多糖和甾醇含量,确定浸提时间。浸提温度10、18、25、30 和35 ℃,测定多糖和甾醇含量,确定浸提温度。再根据测定桑黄和黄酒的料液比(A)、浸提时间(B)和浸提温度(C)为单因素设计正交试验得出最优制备工艺。
1.2.2 动物分组、造模及给药
参照文献[17-19]的方法建立H22 肝癌小鼠模型。首先复苏H22 肝癌细胞,传5~6 代培养,细胞长满整个培养瓶时,用胰蛋白酶消化贴壁细胞,用生理盐水调节细胞浓度,每只小鼠腹腔注射0.4 mL,制备腹水肝癌模型。8~10d 后,小鼠腹部肿胀,无菌抽取腹水至离心管,同时用生理盐水调节细胞浓度再次腹腔注射,同法传3 代后取腹水瘤细胞,用4%台盼蓝染色细胞计数,用生理盐水把细胞浓度调为每毫升1×106,随后注射腹水瘤细胞0.2mL 接种于50 只小鼠左前肢腋窝,建立H22 肝癌模型。将50 只腹水瘤小鼠随机分为模型组、阳性组和桑黄酒低、中和高剂量组,未接种腹水瘤细胞小鼠作为空白组。模型组小鼠灌胃0.02mL/g 生理盐水,阳性组小鼠腹腔注射0.01mL/g环磷酰胺,桑黄酒浓缩20 倍后,桑黄酒低、中和高剂量组小鼠每日灌胃剂量50、100 和200mg/kg,连续14d。
1.2.3 抑瘤率和脏器指数
连续给药14d 后,小鼠脱颈椎处死,解剖取脾脏、胸腺和肿瘤组织进行称重,并计算抑瘤率和脏器指数。
抑瘤率=(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤重×100%
脏器指数=小鼠脏器质量/小鼠体质量
1.2.4 HE 染色
取各组肿瘤组织与4%甲醛固定24h,按不同体积分数乙醇脱色,浸蜡包埋,切成4μm 薄片,苏木精-伊红染色,封片,选取病理切片并拍照记录。
1.2.5 免疫组化染色
取各组肿瘤组织4%甲醛固定,按不同体积乙醇梯度脱水,浸蜡包埋,切片,按免疫组化试剂盒对Bax、Bcl-2、Caspase-3 和Caspase-9 进行检测,并在400 倍光学显微镜下拍照记录病理状态。
1.2.6 小鼠血清中IL-6、IFN-γ、VEGF 和TNF-α 含量测定
小鼠眼眶取血静置30min 后,20 ℃、3500 r·min-1离心15min,取上清液-20 ℃保存,按照各试剂盒说明书操作步骤检测相关因子表达量。
1.2.7 Western blot 检测肿瘤组织Bax、Bcl-2、Caspase-3、Caspase-8 和Caspase-9 蛋白的表达
取肿瘤组织20~30mg,用PBS 洗涤,每20mg 组织加200~400mL 的细胞裂解液提取肿瘤组织总蛋白,用考马斯亮蓝法测定各肿瘤组织中的蛋白含量浓度,然后进行曝光显影,以显影灰度条表示蛋白表达值,并记录拍照。
1.2.8 统计学分析
实验数据采用SPSS 21.0 统计软件进行分析。按单因素方差分析比较平均值,计算P 值,P<0.05 表明显著差异,P<0.01 具有极显著差异。
2 结果与分析
2.1 桑黄酒料液比的确定
通过含量测定可知,50、60 和70 倍体积的黄酒多糖和甾醇含量较高,故本实验选择50、60 和70 倍体积的黄酒进行后续试验。详见表1。
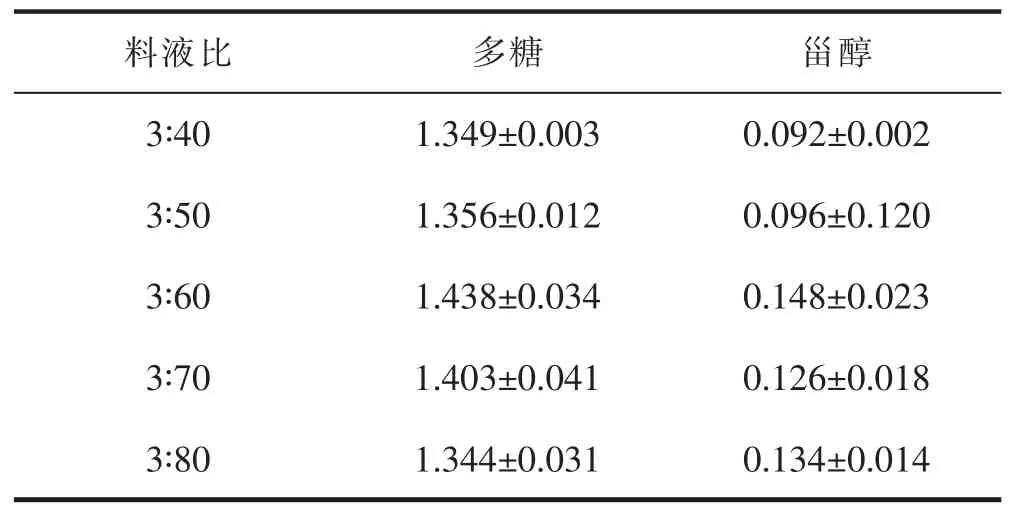
表1 料液比对有效成分含量的影响
2.2 桑黄酒浸提时间的确定
通过含量测定可知,14、21 和28 d 时多糖和甾醇结果较高,故本实验选择14、21 和28 d 进行后续试验。详见表2。
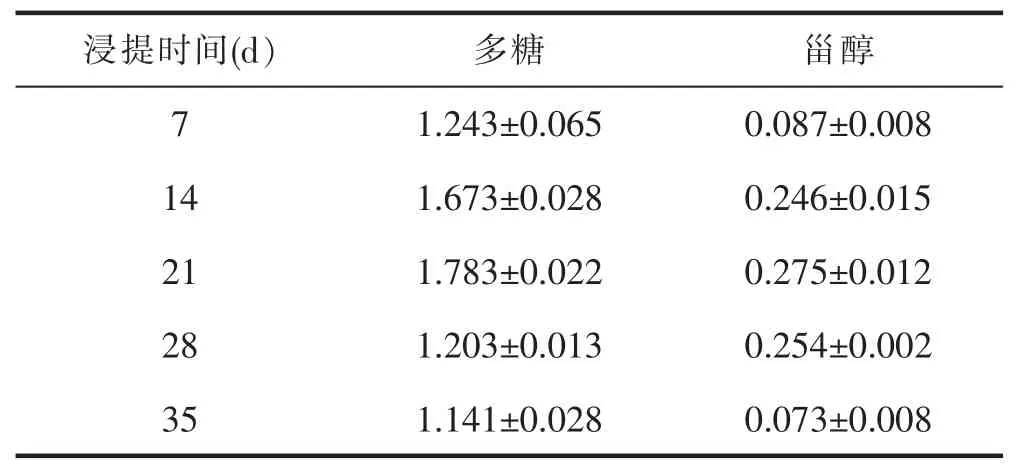
表2 浸提时间对有效成分含量的影响
2.3 桑黄酒浸提温度的确定
通过含量测定可知,18、25、30℃时多糖和甾醇含量结果较好,故本实验选择18、25、30℃进行后续试验。详见表3。

表3 浸提温度对有效成分含量的影响
2.4 桑黄酒制备工艺的确定
单因素试验结果可知,料液比为3∶40、3∶50 和3∶60 倍体积时较好,浸提时间14、21 和28 d 时较好,浸提温度18、25 和30 ℃时较好。取样品9 份,单因素影响结果=多糖含量×50%+甾醇含量×50%进行评分。由表4 可知,影响桑黄酒制备工艺的因素依次为A>B>C,即料液比、浸提时间和浸提温度,最佳条件为A2B2C2,即料液比3∶60,浸提时间21d,浸提温度25℃。
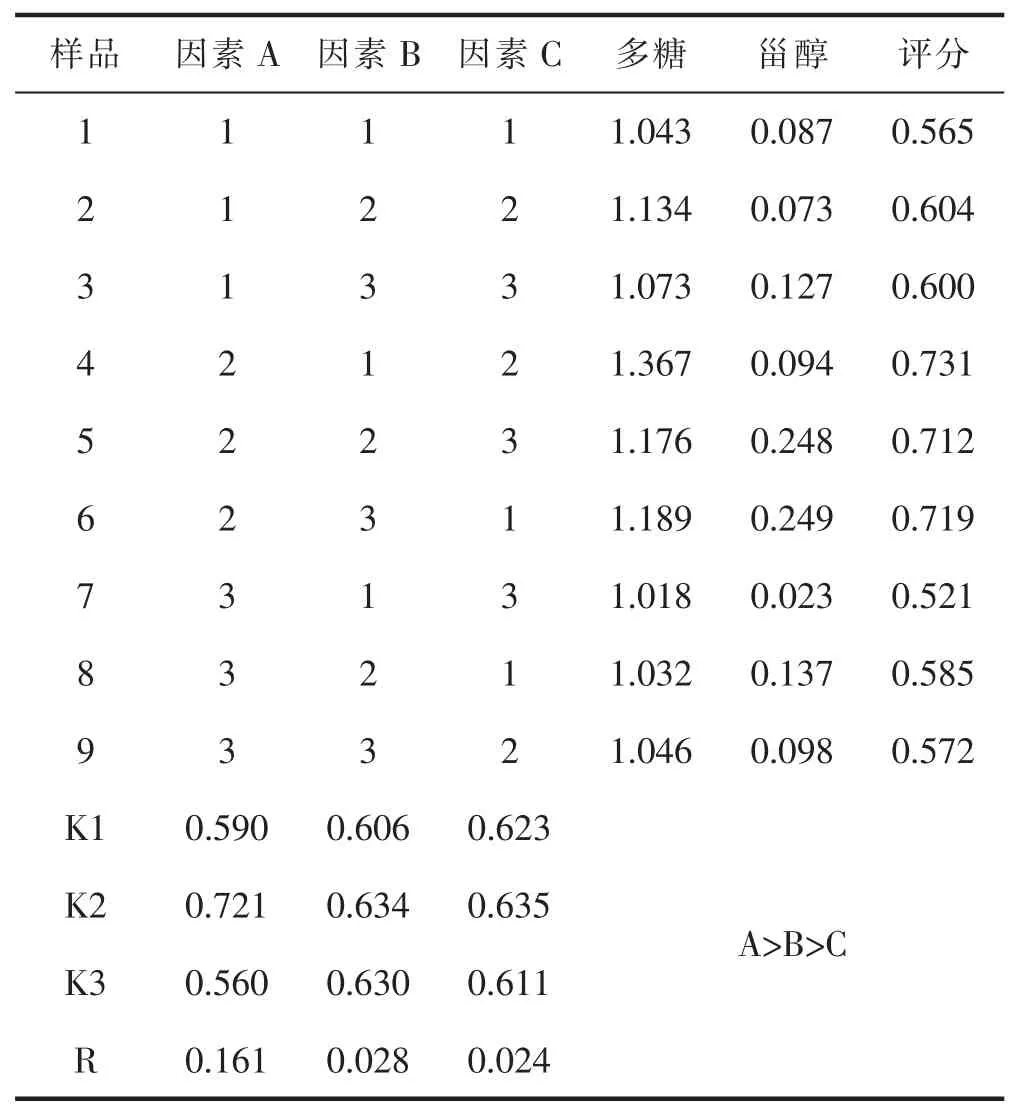
表4 制备工艺正交试验结果
2.5 各组小鼠体质量变化情况
观察肿瘤状态可知模型组肿瘤组织生长迅速,体积大;阳性组肿瘤组织生长缓慢,体积小;桑黄酒各给药组肿瘤组织体积在模型组和阳性组之间。接瘤前,各组小鼠状态无异常。接瘤后,模型组小鼠体质量明显下降,第3d 之后体质量缓慢上升;阳性组小鼠体质量下降一周之后缓慢生长,说明环磷酰胺治疗肿瘤同时有副作用;桑黄酒不同剂量给药组小鼠体质量缓慢增加,如图1 所示。
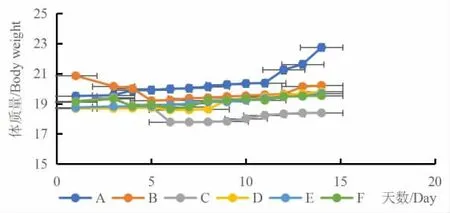
图1 小鼠体质量变化
2.6 抑瘤率和脏器指数
给药前后小鼠体质量变化可知,与模型组相比,阳性组显著降低,其他组无显著差异。与阳性组相比,空白组极显著上升,其他组显著上升。说明给药后缓解了肿瘤小鼠体质量下降,环磷酰胺在治疗肿瘤的同时具有副作用。由瘤重变化可知,与模型组相比,各给药组小鼠瘤重极显著降低,如图2 所示。桑黄酒低、中和高剂量组抑瘤率分别为10.1%、30.9%和38.4%。脾脏指数表明与空白组相比,模型组、阳性组、桑黄酒低、中和高剂量组极显著上升;与模型组相比,空白组和桑黄酒高剂量组极显著下降;与阳性组相比,空白组和桑黄酒高剂量组极显著下降,其他组均有显著性差异。胸腺指数表明,与空白组相比,阳性组极显著下降,模型组、桑黄酒低、中和高剂量组无差异。与模型组相比,阳性组极显著下降;与阳性组相比,空白组、模型组、桑黄酒低、中和高剂量组极显著上升。表明桑黄酒对脾脏和胸腺等免疫脏器具有修复作用,详见表5。
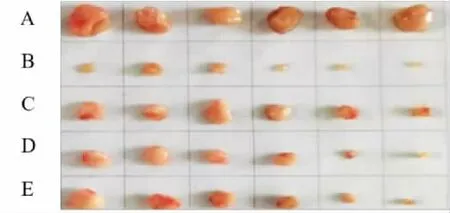
图2 各组小鼠肿瘤图像
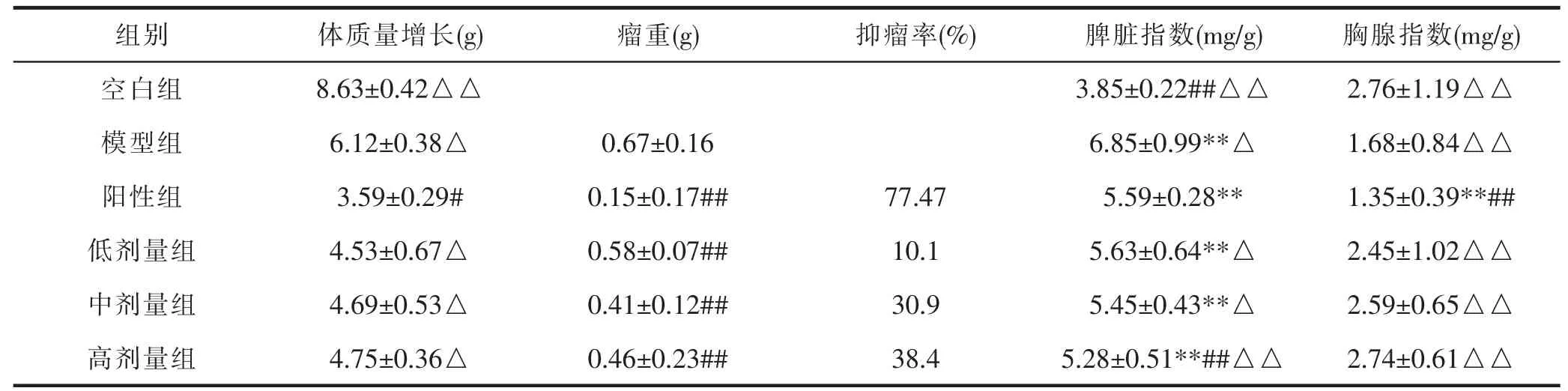
表5 桑黄酒肿瘤抑制率和脏器指数统计表
2.7 肿瘤组织HE 染色结果
HE 染色后在高倍镜(400×)下观察结果可见,模型组肿瘤细胞排列紧密,大小不一,形态正常,极少出现坏死现象。阳性组肿瘤细胞破裂呈不规则变形,排列疏松,多处出现大面积空隙以及凋亡或消融区域。桑黄酒各给药组肿瘤出现不同程度的细胞坏死,消融增多。如图3 所示。
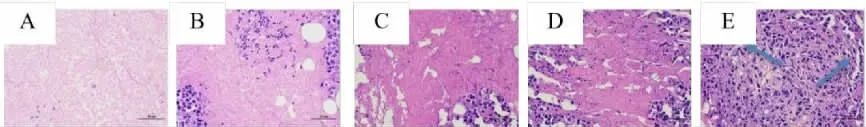
图3 小鼠肿瘤组织HE 染色结果(400×)
2.8 肿瘤组织免疫组化染色结果
采用免疫组化染色对肿瘤组织Bax、Bcl-2、Caspase-3 和Caspase-9 蛋白进行分析。阳性组、桑黄酒低、中和高剂量组显著升高Bax、Caspase-3 和Caspase-9 表达,降低Bcl-2 表达,呈剂量依赖性。表明肿瘤的发生、发展和转归与细胞凋亡有密切联系。如图4 所示。

图4 小鼠肿瘤组织免疫组化染色结果(400×)
2.9 小鼠血清IL-6、IFN-γ、VEGF 和TNF-α 水平的测定
与空白组相比,桑黄酒低、中和高剂量组显著增加IL-6、IFN-γ 和TNF-α 含量,降低VEGF 含量。与模型组相比,桑黄酒中和高剂量组极显著增加IL-6、IFN-γ 和TNF-α 含量,降低VEGF 含量。与阳性组相比,高剂量组显著增加IL-6 含量,极显著增加IFN-γ和TNF-α 含量,降低VEGF 含量,说明桑黄酒的抗肿瘤作用与IL-6、IFN-γ 和TNF-α 上调和免疫调节有关,详见表6。

表6 小鼠血清中各相关因子检测结果
2.10 Western blot 蛋白免疫印迹表达结果
采用Western blot 蛋白免疫印迹对肿瘤组织Bax、Bcl-2、Caspase-3、Caspase-8 和Caspase-9 蛋白进行了分析。与模型组相比,阳性组、桑黄酒低、中和高剂量组极显著升高Bax、Caspase-3、Caspase-8 和Caspase-9 含量,降低Bcl-2 含量,且与剂量成正比。说明桑黄酒促进肿瘤细胞凋亡主要通过线粒体凋亡途径和死亡受体途径。如图5 所示。
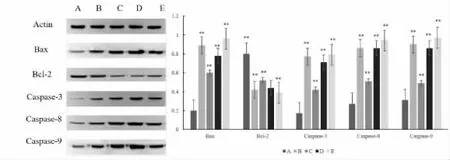
图5 Western blot 蛋白表达结果
3 讨论
桑黄子实体富含多糖类、多酚类、甾体类、萜类、脂肪酸类和氨基酸等多种活性成分,还富含有色素类物质[20-21]。采用非靶向代谢组学,结合多元分析方法对不同发育时期的栽培和野生桑黄进行分析发现,随着子实体发育成熟,1358 种代谢物被注释[7]。依据古代文献记载,桑黄的应用多以“酒煎”“酒热服”为主,且黄酒是自古以来中药药酒的主要酒基和中药炮制的常用辅料。因此,本文利用单因素试验和正交试验得出最优配方为料液比3∶60、浸提时间21d、浸提温度25℃。所得黄酒颜色适中,口感醇美,无异味。采用药效学对其进行了抗肿瘤活性评价。通过建立H22 荷瘤小鼠模型可知,随着桑黄酒剂量增加抑瘤率和胸腺指数逐渐升高,说明桑黄酒可有效保护H22 荷瘤小鼠的免疫脏器。HE 染色发现桑黄酒各给药组肿瘤出现不同程度的细胞坏死,消融增多。
IL-6 是活化的T 细胞和成纤维细胞产生的淋巴因子,能使B 细胞增殖,分泌抗体,是一种用于维持体内平衡的原型细胞因子[22-23]。IFN-γ 由自然杀伤细胞和自然杀伤T 细胞分泌,在固有免疫中发挥作用,并可抑制肿瘤组织中的血管生成,诱导调节性T 细胞凋亡[24-26],能直接抑制肿瘤生长和肿瘤内血管生成并介导肿瘤排斥反应。VEGF 是最关键的肿瘤血管生成刺激因子,可促进血管内皮细胞生长因子,使血管内皮细胞生长,进而诱导肿瘤增殖、浸润及转移[27-28]。TNFα 在超过一定临界值会由抑制肿瘤生长转变为促进增殖肿瘤细胞,是直接杀伤肿瘤细胞因子最强的生物活性因子之一[29-31]。本文结果得知,桑黄酒可增加小鼠血清中IL-6、IFN-γ 和TNF-α 含量,降低VEGF 含量,说明其具有免疫刺激和免疫调控功能,并促进相关因子分泌诱导肿瘤细胞凋亡来达到抗肿瘤目的。
Bax 和Bcl-2 是促进凋亡基因和抑制凋亡基因的Bcl-2 家族重要成员,药物通过体内代谢,经线粒体途径引起Bax 和Bcl-2 的发生,从而激活Caspase-3 和Caspase-9 细胞凋亡,使其细胞核中的DNA 或染色体出现降解或凝聚现象,导致无法复制转录肿瘤细胞,从而抑制肿瘤增殖[32-35]。其次是通过死亡受体途径,使肿瘤坏死因子发挥作用,引起Caspase-8 向线粒体转移,促进线粒体发生级联反应从而抑制肿瘤细胞。免疫组化染色可知,桑黄酒给药组均出现伴有空隙或空泡片状棕黄色坏死区域。Western blot 结果表明,桑黄酒极显著升高Bax、Caspase-3、Caspase-8 和Caspase-9 含量,降低Bcl-2 含量,呈剂量依赖性。机理可能是通过上调Bax,下调Bcl-2,激活Caspase-3、Caspase-8 和Caspase-9 促进凋亡蛋白的表达,从而达到抑制肿瘤细胞增殖的作用。说明桑黄酒促进肿瘤细胞凋亡主要通过线粒体凋亡途径和死亡受体途径而发挥抗肿瘤作用。
综上所述,桑黄酒可通过刺激一些相关因子,多途径引起相关凋亡蛋白的表达,主要是通过线粒体凋亡途径和死亡受体途径来发挥抗肿瘤作用。本文以中医药理论为指导,通过把传统的酒剂与现代药理活性相结合的方法,进行桑黄酒的研制和抗肿瘤活性研究,为进一步开发和发展桑黄产业提供参考依据。
