人参磁石药对不同配比对人参皂苷影响及抗肺炎作用的研究
2023-12-27闫福源刘淑莹
闫福源,刘淑莹,齐 滨
(长春中医药大学·吉林 长春· 130117)
人参为五加科植物人参(Panax ginseng C.A.Meyer)的干燥根及根茎,多于秋采挖后,洗净晒干或烘干[1]。据《神农本草经》记载,属于上药,多服久服不伤人,可延年不老。味甘小寒,主补五脏,安精神,开心益智[2]。其主要活性成分为人参皂苷,具有抗疲劳、抗衰老和提高免疫力等药理作用[3-5]。磁石为氧化物类矿物尖晶石族磁铁矿(Magnetitum),主含四氧化三铁(Fe3O4),采挖后,除去杂石[1],始载于《神农本草经》,为常用矿物中药,其味咸,性寒,归肝、心、肾经[2]。古今用药有生、煅之分,生磁石(原矿物药未经任何特别处理)用以平肝潜阳、镇惊安神力胜,而煅磁石(原矿物药经反复高温煅烧醋淬处理)用以聪耳明目,补肾纳气力强,并易于粉碎和制剂。人参与磁石配伍在《得配本草》中记载,配磁石,治喘咳[6]。配伍后(磁石采用煅磁石),具有补元纳气,固本止喘的功效[7],其中人参的用量为10~15 g,磁石的用量为15~30 g,没有明确配伍比例,并且人参配伍磁石主要活性成分为人参皂苷,因此,有必要鉴定及分析不同配伍比例前后人参皂苷的含量。目前,UPLC-MS 法在分析复杂中药成分的研究中具有独特优势,是揭示中药药效物质基础的有力手段[8-10]。
本研究采用超高效液相色谱-质谱法结合串联质谱碎片离子信息定性、定量分析人参配伍磁石不同配伍比例前后人参中主要人参皂苷成分,并探索二者配伍前后对脂多糖诱导肺炎小鼠的治疗作用。希望从化学成分、药效学两个角度研究人参磁石配伍应用的合理性及科学内涵,为其在临床应用中提供实验理论依据。
1 材料
1.1 仪器与装置
Dionex Ultimate 3000 型超高效液相色谱仪(配有在线真空脱气机、四元泵、自动进样器和柱温箱)、Q-Exactive Orbitrap 质谱仪(配有电喷雾离子源、Xcalibur数据处理系统),美国Thermo 公司;Waters BEH C18色谱柱(100mm×2.1mm×1.7μm);Milli-Q 超纯水系统,美国Millipore 公司;BT25S 型电子天平,赛多利斯科学仪器(北京)有限公司;KDM 型调温电热套,山东鄄城华鲁电热仪器有限公司;高速冷冻离心机(ST-40R 型),赛默飞世尔科技中国有限公司;轮转切片机(RM2245 型)、自动包埋机(EG1150H 型)、烘片机(HI1220 型)、铺片机(HI1210 型),德国莱卡测量系统设备有限公司;三用恒温水浴槽(DK-420S),上海精宏实验设备有限公司;体视显微镜(尼康SMZ25 型),北京瑞科中仪科技有限公司。
1.2 药品与动物
四年生人参,购自吉林通化,经鉴定为五加科植物人参(Panax ginseng C.A.Meyer)的干燥根及根茎;煅磁石购自吉林大药房,安徽亳药千草国药股份有限公 司;Noto-R1、Re、Rg1、Rb1、Rh1、Rg2、Rc、Ro、Rb2、F1、Rd、Rg4、Rh4、20(S)-Rg3、Rg5 人参皂苷对照品,纯度>98%,上海源叶生物科技有限公司;乙腈、甲醇均为色谱纯,美国Fisher 公司;甲酸,色谱纯,上海哈拉丁生化科技有限公司;地塞米松磷酸钠注射液,郑州卓峰制药有限公司;LPS,上海麦克林生化科技有限公司;HE 染色试剂盒,北京索莱宝科技有限公司;IL-1β、IL-6、TNF-α 试剂盒,黄石科研生物科技有限公司;甲醛、二甲苯,北京化工厂。
C57BL/6 小鼠,雄性60 只,体重18~22 g,等级SPF 级,购自辽宁长生生物科技股份有限公司,动物许可证号:SCXK(辽)2020-0001。小鼠自由进食饮水,适应性饲养一周后进行实验。本研究获得长春中医药大学动物伦理委员会的批准。
2 方法
2.1 化学成分分析
2.1.1 色谱条件
流动相A 为0.1%(体积分数)甲酸-水溶液,B 为乙腈。梯度洗脱:0~5 min,25%~30%B;5~8 min,30%~36%B;8~15 min,36%~48%B;15~20 min,48%~70%B;20~25 min,70%~90%B;25~28 min,90%B;28~28.1 min,90%~25%B;28.1~34 min,25%B。流速0.2 mL/min;进样量1 μL;柱温35 ℃。
2.1.2 质谱条件
电喷雾离子源(ESI)采用负离子扫描模式,喷雾电压为-2.5 kV,质量扫描范围m/z 100~1500,鞘气流量40 Arb,辅助气流量12 Arb,扫气流量1 Arb,SLens 射频水平55%,毛细管温度333 ℃。
2.1.3 对照品溶液的制备
精密称取人参皂苷Noto-R1、Re、Rg1、Rb1、Rh1、Rg2、Rc、Ro、Rb2、F1、Rd、Rg4、Rh4、20(S)-Rg3、Rg5 对照品,加入甲醇定容至1mL 容量瓶中,分别配制成对照品母液,对应浓度见表2。各取适量的对照品母液,加入甲醇定容至1mL 容量瓶中,制成混合对照品储备液,冷藏备用。
2.1.4 供试品溶液的制备
取人参、磁石样品,粉碎过筛。圆底烧瓶中加200 mL 蒸馏水,按人参(固定4 g)与磁石不同配比1∶0、2∶1、1∶1、1∶2、1∶3 分别称量,加热回流,磁石先煎20 min,然后共煎30 min,以3000 r/min 离心5 min,取上清液,过0.22 μm 微孔滤膜,备用。
2.1.5 方法学考察
线性关系考察:取适量的混合对照品储备液,用甲醇逐级稀释成浓度梯度的混合对照品溶液,按2.1.3项下条件进行测定,以峰面积(y)为纵坐标、浓度(x)为横坐标,进行线性回归计算,绘制标准曲线。
精密度实验:取2.1.3 项下制备的混合对照品溶液,连续进样6 次,计算各人参皂苷单体峰面积的相对标准偏差(RSD),评价仪器精密度。
重复性实验:取1∶2 比例的人参磁石6 份,按2.1.4项下方法制备供试品溶液,计算各人参皂苷单体峰面积的RSD 值,评价实验方法重复性。
稳定性实验:取2.1.4 项下制备的供试品溶液,分别于0、3、6、12、18、24 h 进样测定,计算各人参皂苷单体峰面积的RSD 值,评价供试品溶液在24 h 内的稳定性。
加样回收率实验:精密称取已知1∶2 比例的人参磁石6 份,精密加入适量的混合对照品储备液,进样测定,计算平均加样回收率和RSD 值。
2.2 体内抗肺炎活性研究
2.2.1 实验药物制备
取人参37.5g,加入500mL 蒸馏水,加热回流30min,以3000r/min 离心5min,取上清液,浓缩定容至250mL;取磁石60g,加入200mL 蒸馏水,加热回流30min,以3000r/min 离心5min,取上清液,浓缩定容至100mL;取磁石75g,加入500mL 蒸馏水,加热回流20min,再加入人参37.5g,加热回流30min,以3000r/min 离心5min,取上清液,浓缩定容至250mL。
2.2.2 动物分组与处理
将60 只小鼠随机分为6 组,分别为正常对照组、LPS 组、阳性药组、人参组、磁石组、人参-磁石组,每组10 只;阳性药组、人参组、磁石组、人参-磁石组分别给予地塞米松2mg/kg、人参提取液0.0125mL/g(相当于人参生药量1.875mg/g)、磁石提取液0.006mL/g(相当于磁石生药量3.75mg/g)、人参磁石混提液0.0125mL/g(相当于人参生药量1.875mg/g、磁石生药量3.75mg/g),连续给药6 天。第7 天,实验组腹腔注射LPS 10mg/kg,正常对照组注射等体积的生理盐水,造模6 h。
2.2.3 样品采集
摘取小鼠眼球,收集全血1~2mL,静置30min 后,于4℃温度3000r/min 离心15min,吸取血清至-80℃保存,取左肺大叶至10%中性甲醛中固定。
2.2.4 小鼠肺组织病理学观察
取固定好的小鼠肺组织,脱水、透明、石蜡包埋,切片厚度为5μm,进行HE 染色,在光镜下观察各组小鼠肺组织的病理学变化。
2.2.5 血清中IL-1β、IL-6、TNF-α 的测定
采用ELISA 法,按试剂盒说明书步骤进行操作,检测小鼠血清中IL-1β、IL-6、TNF-α 的浓度。
3 结果
3.1 化学成分分析
人参皂苷混合标准品及人参配伍磁石不同比例供试品溶液UPLC-MS 负谱总离子流图如图1 所示。利用UPLC-MS 方法结合MS/MS 碎片离子等信息,定性鉴别分析出15 种人参皂苷,详见表1。其中碎片离子采用Costello 规则命名[11]。15 种人参皂苷的线性回归方程测定结果,详见表2。线性相关系数(R2)均在0.9946~0.9999 范围之间,每种人参皂苷分别在其线性范围内的线性关系良好。各人参皂苷的精密度、重复性、稳定性实验以及加样品回收率结果,详见表3。仪器精密度、方法重现性良好,供试品溶液在24 h 内稳定性良好,方法准确、可靠。
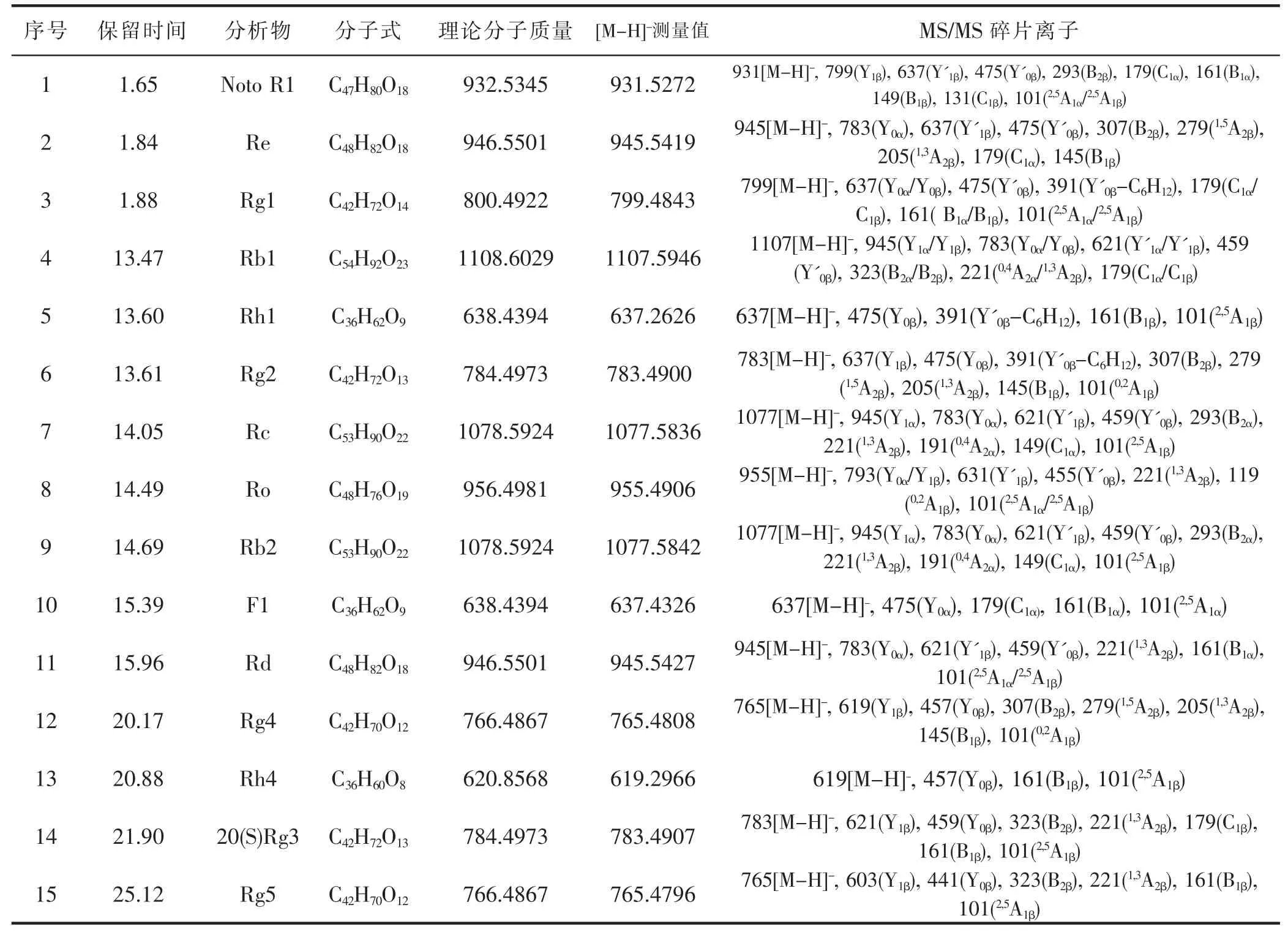
表1 UPLC-MS/MS 法鉴别人参皂苷类成分
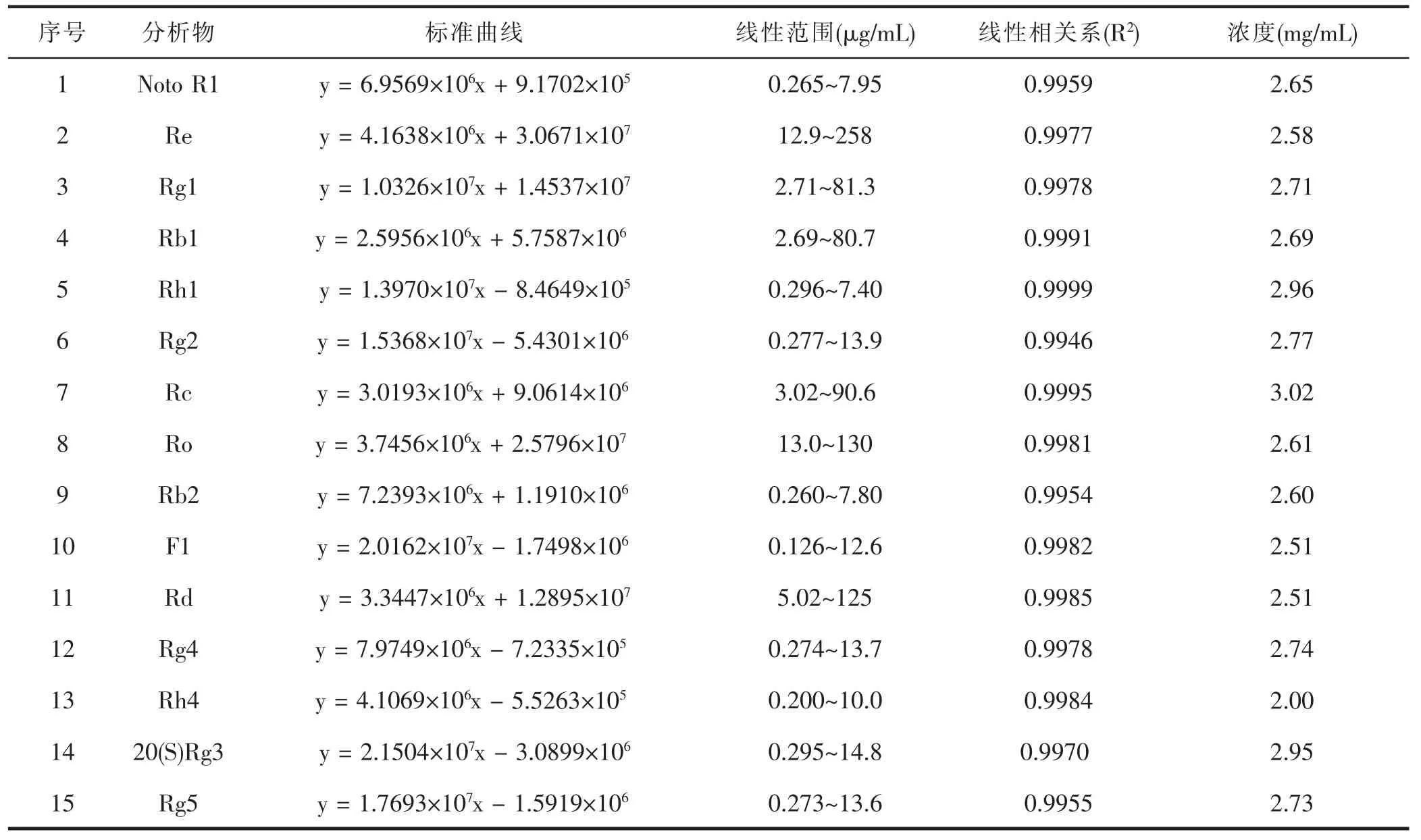
表2 15 种人参皂苷的校准曲线
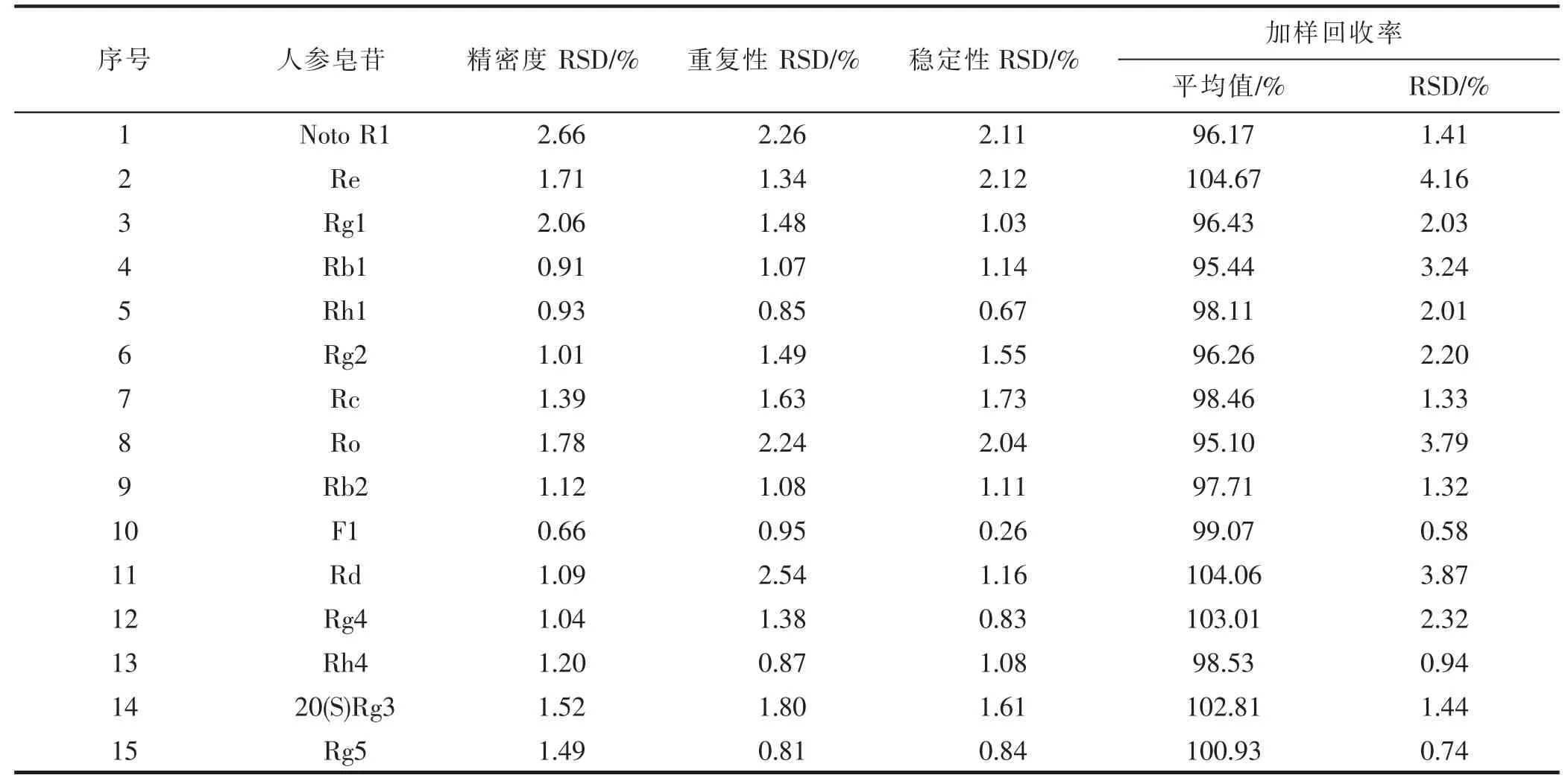
表3 人参皂苷方法学考察
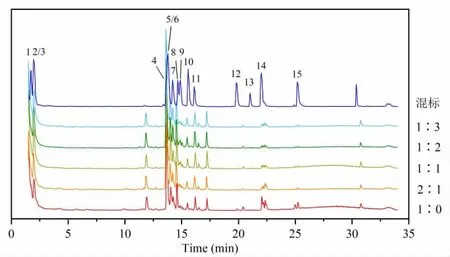
图1 混合标准品及不同比例供试品超高效液相色谱-质谱负谱总离子流图
根据人参皂苷的线性方程计算人参磁石配伍前后人参中15 种主要人参皂苷成分的含量,详见表4。结果分析得知,与人参单煎相比,磁石配伍比例在1∶1时,齐墩果酸型人参皂苷Ro 含量变化最大,增加了10.40%;磁石配伍比例在1∶3 时,三醇型人参皂苷含量变化最大,增加了38.23%;磁石配伍比例在1∶2 时,二醇型人参皂苷及15 种皂苷总和含量变化最大,分别增加了22.03%和18.45%。因此,综合考虑将人参与磁石配伍比例1∶2 作为这个药对的最佳配伍比例,并以此来探究对LPS 诱导肺炎小鼠的治疗作用。
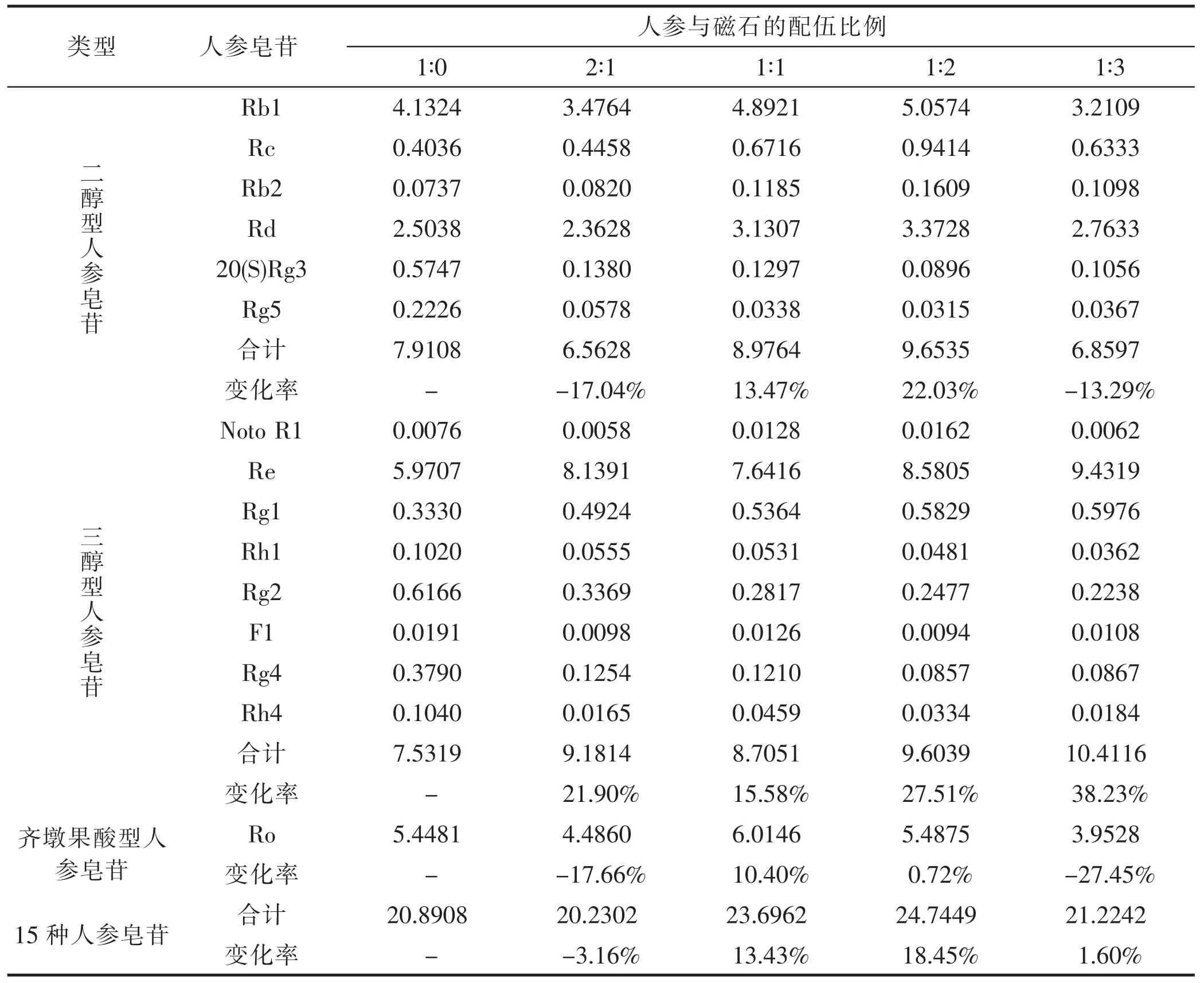
表4 人参皂苷含量测定结果
3.2 体内抗肺炎活性研究
3.2.1 一般情况
正常对照组小鼠表现正常,活泼,反应灵敏;模型组小鼠腹腔注射LPS 后,反应逐渐迟钝,饮食减少,被毛竖起,呼吸加快,全身颤抖,并且肺部有湿罗音。各给药组与LPS 组小鼠相比,状态稍好。
3.2.2 肺组织病理变化
以往的研究表明,肺组织的病理学改变可以反映脂多糖诱导的急性肺损伤情况[12-13]。在本研究中,LPS诱导小鼠6 h 后,各组小鼠肺组织病理切片如图2 所示。由图中可以看出,正常对照组小鼠肺组织结构完整,肺泡壁无异常、无炎症细胞的浸润、肺泡腔无渗出。LPS 组小鼠肺组织出现了明显的病理学损伤,有大量的炎症细胞浸润,肺泡间隔增厚,肺泡腔有渗出。而经过药物干预治疗后,症状明显改善,且人参磁石配伍组效果最佳。
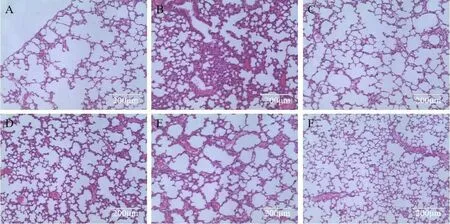
图2 各组小鼠肺组织病理切片染色结果(HE,×20)
3.2.3 给药组对小鼠血清中IL-1β、IL-6、TNF-α 水平的影响
各组小鼠血清中IL-1β、IL-6、TNF-α 的表达量如表5 所示。与正常对照组相比,模型组血清中IL-1β、IL-6、TNF-α 表达水平明显升高(P<0.05),说明造模成功;与模型组相比,阳性药组、人参组、磁石组、人参-磁石组血清中IL-1β、IL-6、TNF-α 表达水平明显降低(P<0.05),且人参-磁石组与阳性药治疗效果最接近,说明人参与磁石配伍可改善小鼠肺部炎症;与人参组、磁石组相比,人参-磁石组血清中IL-1β、IL-6、TNF-α 表达水平明显降低(P<0.05),说明与单味药相比,人参磁石配伍后具有协同作用,药效更佳。
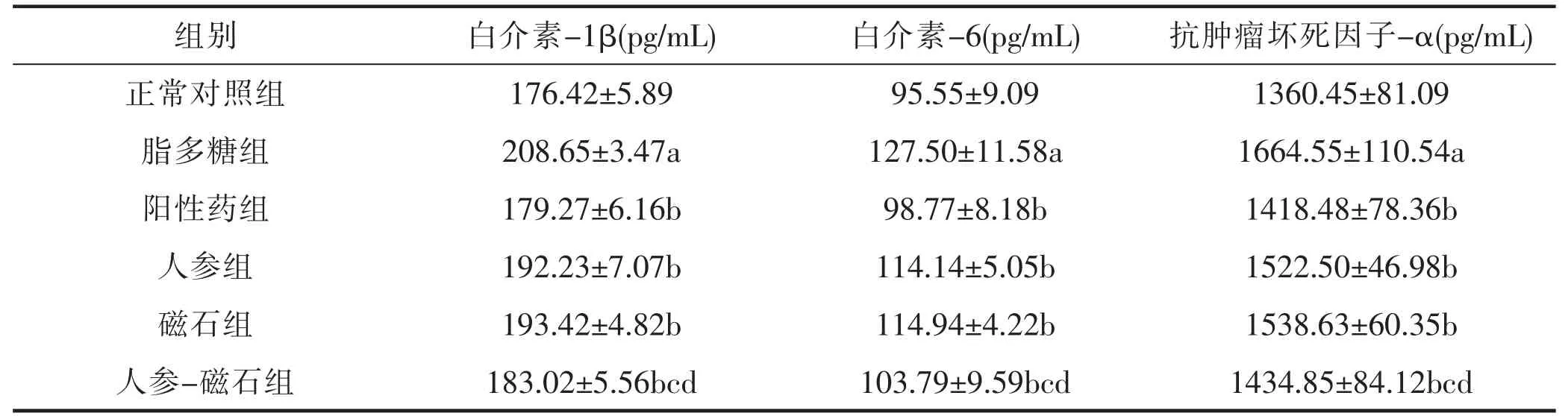
表5 各组小鼠血清中IL-1β、IL-6、TNF-α 水平(x ± s,n=6)
4 讨论
肺炎是指肺部出现炎症,为呼吸系统的多发病、常见病,多发生于年幼及年长者、患有免疫力缺乏症或免疫系统比较差的人[14]。当肺部发生感染或损伤时,会产生复杂的细胞因子网络,IL-1β、IL-6、TNF-α 等促炎因子过度释放,形成炎性细胞爆发,导致内毒素大量进入肺泡,肺泡表面被破坏,病情急剧恶化[15-16],因此及时抑制促炎因子过度表达,在治疗过程中尤为关键。目前在临床上,西医常用抗生素、糖皮质激素及鼻管吸氧等辅助治疗肺炎。然而,长期滥用抗生素产生的病毒抗性使其治疗效果不佳,并导致了抗生素的耐药性发展[17],这使肺炎成为临床治疗中比较棘手的疾病[18]。因此,探索更加安全、有效的防治途径成为临床上亟待解决的问题。中医治疗肺炎建立在辨证论治的基础上,多以清热解毒、开肺化痰、止咳平喘为基本治疗原则[19]。人参配伍磁石,补元纳气,固本止喘。人参甘温,大补元气,为补气第一要药,磁石重坠,擅长潜阳纳气。二药相合,属相使之用,以磁石之重坠入肾,纳人参之补益以固心肾之元气,一补肺肾之气虚,一潜纳肾气,使气得以降而归于丹田,此正“损其肺者益之以气,虚其肾者镇之以重”之谓。
本文对1∶0、2∶1、1∶1、1∶2、1∶3 比例的人参磁石水提液中人参皂苷含量进行测定。结果发现,与人参单煎相比,磁石配伍比例在1∶2 时,二醇型人参皂苷及测定的15 种皂苷总和含量变化最大,分别增加了22.03%和18.45%,此结果与《圣惠》《圣济总录》和《中医临床对药大全》中记载的应用比例范围相符。脂多糖是革兰氏阴性菌细胞壁的主要成分,在机体内可以诱发炎症细胞浸润、炎症因子释放及肺泡上皮细胞死亡,已经被广泛应用诱导肺炎、急性肺损伤等炎症模型[20-21],通过研究人参磁石配伍前后对脂多糖诱导肺炎小鼠模型的抗炎作用发现,人参磁石配伍可显著降低小鼠血清中IL-1β、IL-6、TNF-α 等促炎因子的含量、改善肺组织病理形态,其治疗效果优于单味药组,二者在抗脂多糖诱导的肺炎中具有协同增效作用。
本研究从化学成分含量变化、抗肺炎活性两个角度探究了人参与磁石配伍应用的合理性及科学性,为其临床应用提供了一定实验依据。同时本文对人参、磁石配伍的初步探索,可以为探究二者配伍条件、抗肺炎机制等研究奠定基础,为后续进一步深入研究两者化学成分变化以及代谢组学研究提供理论依据。
