乌司他丁对原发性冲击伤小鼠早期肺损伤治疗作用的研究
2023-12-27胡方超柴家科曲毅睿荀浩怡迟云飞白海良吴育寿苏小薇刘翔宇
胡方超,柴家科,曲毅睿,荀浩怡,刘 甜,迟云飞,白海良,吴育寿,苏小薇,孙 冉,3,刘翔宇
1 解放军总医院研究生院,北京 100853;2 解放军总医院第四医学中心全军烧伤研究所,北京 100048;3 河北北方学院,河北张家口 075132
冲击伤是爆炸物爆炸时以热能、动能、高压冲击波等形式快速释放出的大量能量直接或间接作用于机体引起的损伤[1],严重影响公共安全。阿富汗和伊拉克战争[2]、俄乌战争[3]、曼彻斯特体育馆恐怖袭击[4]、“八二”昆山粉尘爆炸[5]、天津化学品集装箱爆炸[6]中,爆炸冲击不仅造成巨大经济损失,大量冲击伤伤员生命安全更是受到严重威胁。
原发性冲击伤是冲击波直接作用于机体空气-组织交界区域造成的组织损伤[7],肺因肺泡充气的结构特点,是原发性冲击伤主要累及器官之一[8-9],17% ~ 47%死于爆炸的人员有肺原发冲击伤的证据,44%的冲击伤住院患者和71%的危重患者有肺损伤[10]。研究表明,炎症反应可能是原发性冲击伤肺损伤的主要机制,可导致肺功能和组织病理学的变化,并具有时间依赖性[11]。中性粒细胞作为人体免疫的第一道防线,不仅参与多种炎症因子的产生,其释放的中性粒细胞弹性蛋白酶(neutrophil elastase,NE)、基质金属蛋白酶(matrix metalloproteinase,MMP)亦在肺损伤进展中发挥重要作用。本实验在构建中度原发性冲击伤肺损伤小鼠模型的基础上,用乌司他丁进行治疗,通过对比对照组、冲击伤组和乌司他丁组小鼠肺组织病理学、肺组织含水率、血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、NF-κB、CXCL-1、中性粒细胞弹性蛋白酶(neutrophil elastase,NE)、MMP-9含量、NADPH氧化酶(NADPH oxidase,NAO)活性和肺组织NE、MMP-9的表达变化,以及对照组和B组、U组伤后48 h小鼠肺功能,初步探讨乌司他丁是否可以通过抑制中性粒细胞作用,对原发性冲击伤小鼠早期肺损伤起到治疗作用,为临床上原发性冲击伤的救治提供依据。
材料与方法
1 实验动物 清洁级C57BL/6小鼠136只,6 ~8周龄,体质量18 ~ 22 g,由牡丹江医学院提供,于牡丹江医学院科研平台动物实验室恒温条件下适应性饲养1周,实验前禁食12 h,禁水4 h。本研究经解放军总医院第四医学中心实验动物伦理委员会批准(审批号:S201507160113)。
2 主要试剂及仪器 聚黑铝药柱(10 g/次)由中国兵器装备集团有限公司第208所提供;戊巴比妥钠(Sigma,美国);乌司他丁注射液(50 000 U/瓶,广东天普生化医药股份有限公司); Mouse TNF-α、CXCL-1、NF-κB、NE、MMP-9 ELISA试剂盒、NADPH氧化酶(NADPH oxidase,NAO)试剂盒(上海江莱生物科技有限公司);MMP-9抗体(Abcam/ab228402);NE抗体(Affinity/AF0010);辣根过氧化物酶HRP抗体(二抗,Abcam/ab6721);PVDF膜(Millipore,0.22 µm);酶标仪(BioTek-ELx800,美国)、恒温箱(Thermo3111,美国);双垂直电泳槽(CAVOY/ MP-8001)、转移槽(CAVOY/MP-3030);WBP全身体积描记系统(上海塔望智能科技有限公司)等。
3 动物分组及模型建立 根据预实验结果,将136只小鼠按随机数字表法分为对照组(C组,n=16)、冲击伤组(B组,n=60)和乌司他丁组(U组,n=60),实验前禁食12 h,禁水4 h。中度冲击伤小鼠模型的建立参考课题组前期研究[12-13],将B组、U组小鼠(共120只)予0.3%戊巴比妥钠(50 mg/kg)腹腔注射麻醉后,均匀悬吊固定于以爆炸源(聚黑铝药柱,10 g)为中心、直径为50 cm的圆形固定架上,每圈40只,左侧肢体正对爆炸源。根据现场测压结果,3次实验超压为(266 ±9.165) kPa。配制1×104U/mL乌司他丁溶液,U组致伤后立即按照5×104U/kg的剂量腹腔注射配制好的乌司他丁溶液,12 h/次,用药剂量和时机参考课题组前期研究[12,14],并考虑乌司他丁半衰期及不同种属间剂量换算而制定;B组致伤后立即按照5 mL/kg剂量腹腔注射0.9%氯化钠注射液,12 h/次;C组除不致伤外,其余处理均同B组。2 h后各组动物均正常饲养。
4 检测时间点及取材方法 于伤后6 h、24 h、48 h设观察时间点。同一组小鼠均随机两两配对,混合采集血液后离心获取血清;B组、U组伤后6 h、24 h组均采血处死后立即取肺组织行相应处理;C组以及B组、U组伤后48 h组一同处理,随机选取10只小鼠行活体肺功能检测,检测完毕后与其余小鼠一起按上述方法取血和肺组织。
5 左肺组织病理变化 C组以及B组、U组伤后各时间点各选取小鼠4只,眼球取血处死后,两只并血离心取上清,-80℃保存备用。取左肺组织,于4%多聚甲醛溶液中固定,石蜡包埋,连续切片后进行HE染色,光学显微镜下观察,Case-Viewer软件阅片。
6 左肺组织含水量检测 C组以及B组、U组伤后各时间点各选取小鼠6只,眼球取血处死后,两只并血离心取上清,-80℃保存备用。取左肺组织称量湿重后,放置于恒温箱(80℃,72 h)中进行烘烤,称量干重并计算组织含水率。
组织含水率=(湿重-干重)/湿重 × 100%
7 左肺组织NE、MMP-9表达测定 C组以及B组、U组伤后各时间点各选取小鼠4只,眼球取血处死后,两只并血离心取上清,-80℃保存备用。取左肺组织,Western blot法测定左肺组织中NE、MMP-9表达水平。按照试剂盒说明书提取蛋白,依照电泳上样量需要,调整蛋白浓度,100℃煮沸变性10 min;配制12%的分离胶,5%浓缩胶;取35 µg待检测蛋白样品在浓缩胶恒压80 V条件下电泳20 min;在分离胶恒压120 V条件下,电泳至溴酚蓝到凝胶底部;准备PVDF膜和两张厚滤纸,按照滤纸、凝胶、PVDF膜、滤纸的顺序放入海绵垫夹层中,赶尽气泡,300 mA恒流下转膜2 h;转膜后将PVDF膜浸泡于Milk Blocking Buffer中,摇床轻摇封闭1 h,结束后PVDF膜置于杂交袋中;1% BSA/5% milk稀释一抗,加入杂交袋中,封口,4℃孵育过夜,TBST洗膜3次,每次5 min;加入羊抗兔-HRP 二抗(1∶5 000稀释),室温轻摇孵育50 min,TBST洗膜4次,每次5 min;ECL法显色,暗室中曝光、显影并定影,Quantity One v.4.6.2软件读取灰度值。
8 血清TNF-α、NF-κB、CXCL-1、NE、MMP-9含量、NAO活性检测 血清样本需两只小鼠并血获取。小鼠眼球取血、并血后,静置30 min,2 500 r/min离心20 min后取上清,-80℃保存,备后续检测。血清TNF-α、NF-κB、CXCL-1、NE、MMP-9含量采用ELISA检测,方法如下:按照各试剂盒操作说明,将标准品、生物素化抗体、酶结合物及洗涤液进行稀释;在标准品孔、样本孔、空白孔加入相应样品,封板37℃温育1 h;取出酶标板,弃去液体,每孔加入生物素化抗体100 µL,封板37℃温育1 h;弃去液体,吸水纸上拍干,每孔加满洗涤液,静置30 s,甩去洗涤液,吸水纸上拍干,重复3次;每孔加入酶结合物工作液100 µL,封板37℃温育30 min后,上述方法洗板5次;加底物(TMB) 90 µL,封板37℃避光孵育15 min;去除酶标板,每孔加入终止液50 µL,15 min内在450 nm波长处测定各孔的OD值;采用ELISA Calc软件进行数据分析,标准曲线选择四参数Logistic曲线拟合。NAO活性:按照其试剂盒说明书对液体样本直接检测,按照每毫克组织蛋白每分钟在反应体系中使450 nm处吸光值变化0.01为1酶活单位的定义计算酶活性。
9 肺功能检测 C组以及B组、U组伤后48 h,各取小鼠10只,采用无约束全身体积描记系统(whole-body plethysmograph,WBP)对肺功能进行检测,检测完毕后与其余小鼠一同按上述方法取血和肺组织。WBP全身体积描记系统可以通过测量动物呼吸产生的“箱体气流”,对清醒自由活动的小动物进行肺功能及气道反应相关测试。按说明连接系统,待观察小鼠置于体积描记器内,在温度适宜、安静的环境中稳定30 min后开始检测。检测主要指标如下,肺容积指标:潮气量(tidal volume, VT);通气指标:呼吸频率(frequency,F)、每分通气量(minute ventilation volume,MV);气道阻塞指标:呼气中期流速(mid-expiratory flow rate,EF50)、支气管收缩程度指标Penh= PEF/PIF × (Te/Tr-1);传导性指标 :最大呼气流速(peak expiratory flow,PEF) 、最大吸气流速(peak inspiratory flow,PIF)。
10 统计学方法 采用SPSS 23.0软件进行统计学分析,GraphPad9.0进行图形绘制,计量资料符合正态分布以表示,各时间点组间总体比较使用单因素方差分析,组间多重比较使用Bonferroni或LSD校正。P<0.05为差异有统计学意义。
结 果
1 小鼠建模及生存情况 B组及U组造模后2 h内均出现死亡小鼠。B组存活48只,死亡12只;U组存活44只,死亡16只,两组病死率差异无统计学意义(P=0.388)。根据小鼠存活情况,B组伤后各时间点各选取小鼠16只,U组伤后6 h、24 h各选取小鼠14只,伤后48 h选取小鼠16只,C组选取小鼠16只,进行相关指标检测。
2 肺组织病理变化 对照组左肺组织肺泡、支气管等结构清晰,未见明显异常。冲击伤组:伤后6 h,组织肺泡、支气管等结构清晰,血管和肺泡壁可见明显炎症细胞浸润,少量肺泡壁细胞肿胀,组织轻度淤血;伤后24 h,肺组织中较多肺泡壁细胞肿胀、脱落,可见大量炎症细胞浸润,肺泡腔出血严重;伤后48 h,可见大量炎症细胞浸润,大量肺泡壁严重增厚,肺泡腔狭窄,结缔组织增生,组织淤血较多。乌司他丁治疗组:伤后6 h组织肺泡、支气管等结构清晰,血管内可见少量炎症细胞,组织轻度淤血,未见其他明显异常;伤后24 h,组织内可见少量炎症细胞浸润,偶见个别肺泡壁细胞肿胀,组织轻度淤血,未见其他明显异常;伤后48 h,组织肺泡、支气管等结构清晰,组织内可见少量肺泡壁细胞肿胀,肺泡壁轻微增厚,未见明显炎症浸润。见图1。
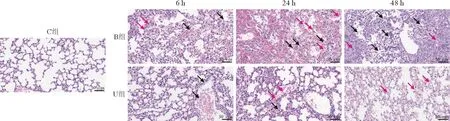
图1 各组小鼠肺组织病理学变化(HE染色,20×)。图中黑色箭头所示为炎症细胞浸润,红色箭头所示为肺泡细胞肿胀、脱落Fig.1 Pathological changes of lung tissues of mice (HE staining, 20×). Black arrows indicate inflammatory cell infiltration; Red arrows indicate swelling and shedding of alveolar cells
3 肺组织含水率 伤后6 h,B组、U组小鼠左肺组织含水量分别为83.28% ± 1.40%和80.81% ±10.86%,差异有统计学意义(P=0.036);B组、U组小鼠左肺组织含水量分别与C组(77.02% ±1.98%)相比,差异均有统计学意义(P<0.01)。伤后24 h,B组、U组小鼠左肺组织含水量分别为85.64% ± 0.87%和82.44% ± 0.94%,差异有统计学意义(P=0.003);B组、U组小鼠左肺组织含水量分别与C组相比,差异均有统计学意义(P<0.01)。伤后48 h,B组、U组小鼠左肺组织含水量分别为82.43% ± 1.59%和79.39% ± 0.73%,差异有统计学意义(P=0.011);B组小鼠左肺组织含水量与C组相比,差异有统计学意义(P<0.01);U组小鼠左肺组织含水量与C组相比,差异无统计学意义(P>0.05)。见图2。
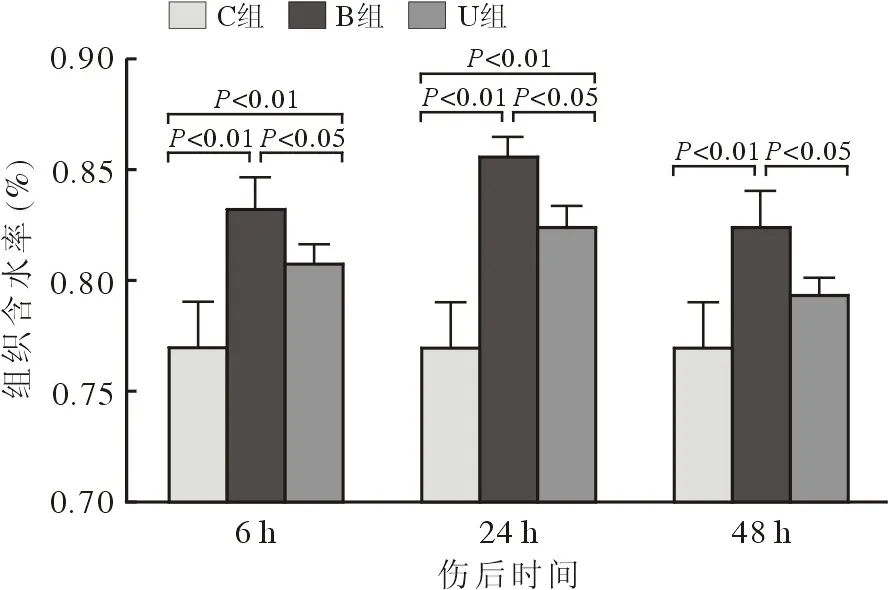
图2 小鼠肺组织含水率比较(n=6)Fig.2 Comparison of lung tissue water content of mice (n=6)
4 肺组织NE、MMP-9表达 B组、U组伤后各时间点左肺组织NE、MMP-9表达均高于C组(0.1833 ± 0.0806、0.0803 ± 0.0255)。U组NE、MMP-9表达均在伤后6 h达到最高(0.3784 ± 0.0771、0.4326 ± 0.1367),24 h、48 h其表达逐渐下降(0.2659 ± 0.0734、0.1941 ± 0.0187;0.2405 ± 0.0755、0.1703 ± 0.0171);B组NE、MMP-9伤后6 h含量分别为(0.4872 ± 0.0494、0.4326 ± 0.1367),伤后24 h其表达降低(0.3204 ± 0.0473、0.3435 ±0.0774),而在48 h,NE、MMP-9表达又出现较大幅度升高(0.6251 ± 0.0453、0.6615 ± 0.1476);B组各时间点左肺组织NE、MMP-9表达亦均高于U组,且在伤后48 h,差异有统计学意义(P=0.034、P=0.033)。见图3。

图3 小鼠肺组织Western blot结果(A)及NE (B)、MMP-9 (C)表达(n=4;aP<0.05,vs C组;bP<0.05,vs B组)Fig.3 Result of Western blot (A) and expression of NE (B), MMP-9(C) in lung tissue of mice (n=4; aP<0.05, vs group C;bP<0.05, vs group B)
5 血清TNF-α、NF-κB、CXCL-1、NE、MMP-9含量、NAO活性变化 伤后各时间点,B组、U组血清TNF-α、NF-κB、CXCL-1、NE、MMP-9含量、NAO活性均高于C组,差异均有统计学意义。B组伤后各时间点各指标均较U组显著升高,其中两组伤后6 h、24 h、48 h的TNF-α、NF-κB、CXCL-1含量差异均有统计学意义(P<0.01)。NE含量伤后6 h两组差异无统计学意义,伤后24 h、48 h,B组显著升高,两组差异有统计学意义(P<0.01)。MMP-9含量,伤后6 h两组差异无意义;伤后24 h,两组MMP-9含量均有降低,且U组显著下降,两组差异有统计学意义(P<0.01);伤后48 h,两组MMP-9含量均升高,其中B组显著升高,两组差异有统计学意义(P<0.01)。两组NAO活性伤后6 h、24 h差异无统计学意义,伤后48 h B组NAO活性继续升高,而U组活性较24 h下降,两组差异有统计学意义(P<0.01)。见图4。

图4 小鼠血清TNF-α (A)、NF-κB (B)、CXCL-1 (C)、NE (D)、MMP-9 (E)含量、NAO (F)活性变化(U组伤后6 h、24 h,n=7;余n=8)Fig.4 Comparison of sera TNF-α (A), NF-κB (B), CXCL-1 (C), NE (D), MMP-9 (E) contents and NAO (F) activity of mice (Group U: 6 h, 24 h,n=7; Other groups: n=8)
6 肺功能结果 与C组比较,伤后48 h B组小鼠肺功能显著下降,主要表现为容量指标VT降低,通气指标F增加、MV降低,传导指标PIF、PEF降低,以及气道阻塞指标EF50和反应气道狭窄的Penh升高,各指标差异均有统计学意义(P<0.01)。与B组比较,U组肺功能有所改善,其中VT、PIF升高,F、EF50、Penh降低,差异有统计学意义(P<0.01)。见表1。

表1 伤后48 h各组小鼠肺功能指标对比(n=10)Tab. 1 Comparison of lung function indexes of mice in each group at 48 h after injury (n=10)
讨 论
原发性冲击伤是爆炸引起的超压通过产生剥脱效应、内爆效应和惯性,集中作用于机体,特别是空气-组织交界区域,所直接造成的组织损伤,肺因肺泡内充满单层上皮细胞和丰富的血管结构,存在大量的空气及组织交界区域,是主要受累器官[7,15-16]。肺原发性冲击伤通常不会在体表产生明显的创面,其早期体征不明显,但症状严重,具有“外轻内重,发展迅速”的特点,如果治疗不及时,可发展为急性呼吸窘迫综合征[17],导致高达46% ~ 57%的病死率[18]。
乌司他丁是从人新鲜尿液里提取的一种酸性糖蛋白,含两个活性区域,具有广谱抗炎作用[19-20],可减少不良刺激所引起的炎症因子产生和氧自由基释放[21-22],减轻各种炎症介质对主要脏器功能的损害和液体渗出[23-24],改善凝血功能[12,14],并能有效抑制急慢性肺损伤[25-27]。
本实验测量比较了对照组、冲击伤组和乌司他丁组小鼠肺组织病理、肺组织含水率以及伤后48 h肺功能的改变,结果显示,冲击伤组伤后6 h即可见到较明显中性粒细胞浸润,24 h、48 h有大量炎症细胞浸润,肺泡壁严重增厚,肺泡腔狭窄,结缔组织增生,组织淤血较多;而乌司他丁组各时间点炎症细胞浸润显著减少,肺泡肿胀及淤血程度较冲击伤组显著减轻。伤后6 h、24 h、48 h乌司他丁组肺组织含水率均低于冲击伤组,差异有统计学意义。伤后48 h乌司他丁组肺功能较冲击伤组有所改善,其中VT、PIF升高,F、EF50、Penh降低。以上结果表明,乌司他丁可以有效抑制原发性冲击伤小鼠肺组织的炎症细胞浸润,防止肺泡结构破坏,减轻肺出血和肺水肿,增加呼吸容量,缓解气道狭窄,改善呼吸功能,证明了乌司他丁对冲击伤小鼠早期原发性肺损伤具有一定的治疗作用。
TNF-α是体内重要的炎症因子,在炎症反应启动和发展过程中起到重要作用。肺组织破坏导致TNF-α过量释放,不仅破坏血管内皮紧密连接[28],引起血管通透性增加,促进中性粒细胞渗出并在肺内聚集[11,29],还可以通过激活IκB通路使NF-κB活化[29],进而诱导IL-8等多种细胞因子的生成,参与炎症反应[30-31],而IL-8可引起中性粒细胞趋化和活化,促进溶酶体和氧自由基的释放,加重炎症反应和组织破坏[32-33]。本实验结果提示,乌司他丁干预使得冲击伤小鼠血清TNF-α、NF-κB、CXCL-1(小鼠体内IL-8功能同源物)含量显著降低,证明了乌司他丁可以抑制炎症因子产生,减少血液中炎症介质水平,保护肺组织紧密连接,减少炎症细胞浸润,减轻肺水肿和氧化损伤,发挥对原发性冲击伤小鼠肺组织的保护作用。
中性粒细胞可导致原发性冲击伤肺损伤加重[34-35]。冲击波在肺部产生压力差,导致肺泡微血管破裂,引起肺出血,进而激活肺泡巨噬细胞向肺内迁移并释中性粒细胞相关趋化因子,趋化中性粒细胞向肺组织内聚集。中性粒细胞通过产生氧自由基和脱颗粒释放NE、MMP-9等蛋白水解酶,加重肺组织破坏[35-36]。中性粒细胞受刺激后会激活其NAO,导致大量超氧化物的生成[37],因此NAO活性可用作反应体内ROS生成的指标;NE可降解细胞外基质中几乎所有蛋白,破坏紧密的细胞间连接,增强血管通透性,并能减弱巨噬细胞对中性粒细胞的吞噬作用[38-39]。MMP-9是多形核中性粒细胞迁移和肺泡毛细血管渗漏的必需条件[35],其可降解包括Ⅳ型胶原、纤维连接蛋白和明胶在内的基底膜成分,并刺激肺成纤维细胞、肺泡Ⅱ型上皮细胞和血管内皮细胞等释放出更多的MMP,导致中性粒细胞进一步聚集,放大对肺组织的损伤[40]。本实验中,冲击伤组、乌司他丁组伤后各时间点NAO活性均较对照组显著升高,但在伤后48 h,乌司他丁组的NAO活性较冲击伤组显著下降,提示乌司他丁可能通过抑制NAO活性减少ROS生成,进而减轻氧化应激损伤;而血清NE、MMP-9含量和肺组织NE、MMP-9表达水平检测结果表明,正常小鼠血清和肺组织中仅有少量NE、MMP-9,B组血清NE、MMP-9含量和肺组织中NE、MMP-9表达水平显著升高,乌司他丁组血清NE、MMP-9含量和肺组织中NE、MMP-9表达水平较冲击伤组显著降低,证明乌司他丁可以有效抑制NE、MMP-9的产生,减少细胞外基质的破坏,保护肺组织紧密连接,减少中性粒细胞浸润和炎症因子产生,进而防止肺组织的进行性破坏。
本实验主要存在一些不足:(1)没有进行血药浓度监测和药物不同剂量之间的疗效对比,不能确定最佳用药剂量;(2)本实验仅针对中度原发性冲击伤肺损伤进行研究,但爆炸冲击往往造成更严重的损伤类型,如重度冲击伤、烧冲复合伤等,其病理生理改变更加复杂,器官障碍发生早、并发症多、病死率高,乌司他丁能否通过抑制中性粒细胞作用改善该类严重、复杂损伤的多器官功能,提高生存率,是下一步研究的重点;(3)需进一步的机制研究对实验结论进行更加充分的说明。
综上所述,本实验结果表明早期应用乌司他丁可以抑制原发性冲击伤肺损伤小鼠体内细胞因子产生、中性粒细胞聚集、氧自由基和多种中性粒细胞来源丝氨酸蛋白酶产生,有效抑制了过度炎症反应,防止肺组织进行性损伤,最终表现为肺组织病理学的好转和肺功能改善,证明了乌司他丁对原发性冲击伤小鼠早期肺损伤具有治疗作用,为临床上原发性冲击伤的救治提供依据。
作者贡献胡方超:实验设计与实施,数据整理与分析,文章撰写;柴家科:资金获取,实验指导,文章审读与修订;曲毅睿、荀浩怡:共同参与实验实施;刘甜、迟云飞:实验设计,文章审读与修订;白海良、吴育寿、苏小薇、孙冉、刘翔宇:场地布置,器材准备,辅助实施。
利益冲突所有作者声明无利益冲突。
数据共享声明本论文相关数据可依据合理理由从作者处获取,Email:hfcyuan@163.com。
