炎症微环境下过表达Wnt5a对人牙周膜干细胞增殖和成骨分化的影响
2023-12-27杨燕美
张 璇,王 辰,杨 琳,段 霏,杨燕美,顾 斌
1 解放军总医院第一医学中心口腔科,北京 100853;2 解放军总医院研究生院,北京 100853;3 军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850
牙周炎是一种复杂的慢性炎症性疾病,主要表现为局部过度免疫反应和牙周支持组织的渐进性破坏,可能诱发心脑血管等多系统疾病,成为危害人类口腔乃至全身健康的一大疾患[1-2]。现有牙周炎治疗手段大多致力于清除致病菌和控制炎症状态,未能从根本上恢复牙周组织结构。近年来,干细胞相关组织工程技术已取得一定突破,从人牙周组织中分离发现的人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)成为最适宜牙周再生的候选种子细胞[3-4]。hPDLSCs是具有多向分化及自我更新能力的成体干细胞,具有低免疫原性及特异性,在牙周组织的维护、重建、再生和固定中发挥了重要作用[5-7]。大量研究证实,慢性牙周炎时局部炎症微环境抑制了hPDLSCs的再生修复能力,明确炎症微环境下hPDLSCs的增殖和成骨分化机制对牙周组织再生治疗至关重要[8-10]。
Wnt 通路是炎症微环境下影响干细胞骨向分化的重要调节途径,包括由 β-catenin 介导的经典信号通路、非经典的 Wnt/Ca2+信号通路和 Wnt/PCP 信号通路[11]。Wnt5a是一种分泌型Wnt 配体,既能作用于经典Wnt/β-catenin通路[12],又能通过非经典Wnt/Ca2+通路发挥作用[13]。越来越多的研究证明,在干细胞成骨分化过程中,Wnt5a发挥着潜在的双重作用,并与细胞生长环境息息相关[14-15]。但关于Wnt5a对牙周膜干细胞成骨分化的影响仍待探究,Wnt5a对不同细胞成骨分化的影响可能与其局部微环境的状态有关。本研究通过慢病毒转染技术过表达hPDLSCs中的Wnt5a,进一步探究Wnt5a对炎症微环境下hPDLSCs增殖及成骨分化的调控作用,为基于干细胞技术的牙周炎治疗提供新的方法和理论依据。
材料与方法
1 实验材料 慢病毒扩增载体 (Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin,吉凯基因,中国);α-MEM培养基、胎牛血清、PBS缓冲液、0.25%胰蛋白酶-EDTA (Gibco,美国);青链霉素(Hyclone,美国);Ⅰ型胶原酶(Sigma,美国);CCK-8试剂盒(Dojindo,日本);OriCell人相关干细胞成骨诱导分化试剂盒、人相关干细胞成脂诱导分化试剂盒(赛业生物,中国);RNA提取试剂盒(天根生化,中国);逆转录试剂盒(TaKaRa Bio,日本);引物(生工生物工程,中国);苯甲基磺酰氟PMSF、蛋白酶抑制剂、磷酸酶抑制剂(Selleck,美国);RIPA裂解液、碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒(碧云天,中国);Wnt5a、RUNX2、COL-1、GAPDH单克隆抗体(1∶1000,Cell Signaling Technology,美国);山羊抗兔(1∶5000,Abcam,英国);PVDF转印膜(Millipore,美国);BCA蛋白定量试剂盒、ECL显影液、CO2恒温孵箱(Thermo,美国)。
2 样本收集 实验所用离体牙均取自解放军总医院第一医学中心口腔颌面外科门诊,来源于8例(男性4例,女性4例) 18 ~ 25岁因正畸或阻生需要拔除无龋前磨牙及第三磨牙的患者。纳入标准:牙周组织健康、无牙体疾病,无系统性疾病、血常规正常、无吸烟史、半年内无特殊服药史。本实验经解放军总医院医学伦理委员会批准(批准号:S2022-688-01),所有受试者均签署知情同意书。
3 hPDLSCs分离培养 拔牙前对患者进行口腔洁治,拔牙时碘伏消毒,牙齿拔除后立即放入含双抗的α-MEM 培养基中,在超净工作台中使用大量 PBS 缓冲液自根尖向冠方反复冲洗离体牙表面,刮取根中1/3牙周膜,移入含有Ⅰ型胶原酶的EP 管中并剪碎,在37℃ 恒温孵箱消化45 min,期间每隔 15 min 震荡一下。加入等量完全培养基(含 10% FBS、100 U/mL青霉素/链霉素的α-MEM培养基)终止消化,800 r/min离心5 min,留沉淀,重悬后置于培养皿(6 cm),于37℃、5% CO2的恒温箱培养7 ~ 10 d,观察到细胞从组织块边缘爬出。细胞生长融合约80%时加胰蛋白酶(0.25%)-EDTA消化,为第1代hPDLSCs。通过有限稀释法克隆培养,培养至3 ~ 5代以进行后续检测。
4 慢病毒转染 将hPDLSCs接种于 6 孔培养板中,调整细胞密度为5 × 104/mL。镜下观察细胞伸展汇合至60% ~ 70%时,分别加入阴性对照病毒和Wnt5a过表达慢病毒感染细胞(MOI=10)。在37℃恒温孵箱中静置12 ~ 16 h后观察,更换为完全培养基。培养48 h后,通过荧光显微镜观察细胞状态。使用3 µg/mL工作浓度的嘌呤霉素(Puromycin)筛选48 h,扩增传代后使用实时定量PCR、Western blot法验证Wnt5a过表达效率,用于后续实验。
5 构建炎症微环境及细胞分组 将PDLSCs按照不同处理方法进行分组。(1)正常组:未经任何处理的 hPDLSCs;(2)炎症组:用含10 ng/mL肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)培养基处理24 h的hPDLSCs;(3)阴性对照组:转染阴性对照病毒的hPDLSCs; (4)过表达组:转染过表达Wnt5a慢病毒的hPDLSCs;(5)TNF-α + 阴性对照组:用含10 ng/mL TNF-α的培养基处理24 h的阴性对照组hPDLSCs;(6)TNF-α + 过表达组:转染过表达Wnt5a慢病毒并用含有10 ng/mL TNF-α的培养基处理的hPDLSCs。
6 CCK-8 法检测细胞生长曲线 在 96 孔板中加入100 µL/孔的细胞悬液(2 × 103/孔,n=6),培养24 h (37℃,5% CO2)使其贴壁,每隔2 d换液。在特定时间点(1 d、3 d、5 d、7 d)加CCK-8溶液(10 µL),继续孵育2 h后检测吸光度(450 nm),绘制生长曲线。
7 成骨诱导及茜素红S (alizarin red S,ARS)染色实验 将不同处理后的hPDLSCs制成细胞悬液接种于6孔板(5 × 104/mL),使用α-MEM培养基(含10%胎牛血清)培养。待细胞生长融合达到60% ~70%时换为成骨诱导分化培养基培养2周,每隔3 d换液1次。待细胞聚集,出现钙结节时,弃去诱导液,PBS冲洗3次,每次5 min。4%多聚甲醛固定30 min,加ARS染液。PBS冲洗3次,镜下观察并拍照。
8 ALP染色 对不同处理后的hPDLSCs 成骨诱导 7 d,去除孔板内的培养基。使用4% 多聚甲醛室温固定,PBS 洗3 次,每次 5 min。加ALP染液,室温避光孵育 30 min。弃去染液,蒸馏水清洗3 次,终止显色。
9 实时定量 PCR检测炎症因子、成骨基因和Wnt5a的mRNA表达 提取待检测细胞的总RNA,利用反转录试剂盒将其逆转录为cDNA,以 cDNA 为模板使用实时荧光定量 PCR仪进行扩增。每组样品设置3个复孔,数值均以内参基因GAPDH进行标准化,采用 2-△△Ct相对定量法检测炎性细胞因子(IL-1β、IL-6、TNF-α)、成骨关键基因(RUNX2、COL-1、ALP)和Wnt5a的mRNA表达,引物序列见表1。

表1 实时定量PCR 引物Tab. 1 Primers of RT-qPCR
10 Western blot检测RUNX2、COL-1和Wnt5a的蛋白表达 采用细胞裂解液试剂盒分别提取细胞总蛋白,BCA 蛋白定量试剂盒检测蛋白浓度,按照各组浓度定量至相同蛋白水平。采用10%的分离胶、电泳液和电转液,蛋白上样后以80 V电压电泳30 min。待样品进入分离胶,改为120 V电泳60 min。使用电转槽250 mA电转90 min,将蛋白移至PVDF膜上,将膜放入含5% BSA的封闭液内,在摇床上室温封闭1 h。TBST摇床洗涤3次,5 min/次。加入一抗4℃孵育过夜。TBST洗去一抗后,按照一抗的种属选择相应浓度的兔源二抗室温孵育1 h。通过ECL显色试剂盒显色,蛋白凝胶成像系统曝光成像,Image J软件进行灰度值分析。
11 统计学分析 本研究所有实验结果均重复3次,实验数据采用GraphPad Prism 9.0进行统计学分析,通过Shapiro-Wilk进行正态性检验,数据以表示,两组比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
结 果
1 牙周膜干细胞形态学观察 酶消化法分离原代hPDLSCs,体外培养7 d后可见组织块边缘有贴壁细胞长出,见图1A。10 d可见细胞数量增加,待汇合度达80%时开始传代,传代后细胞生长加速明显,第1代细胞为纺锤状和长条状,似成纤维细胞,并呈漩涡状聚集生长,见图1B。
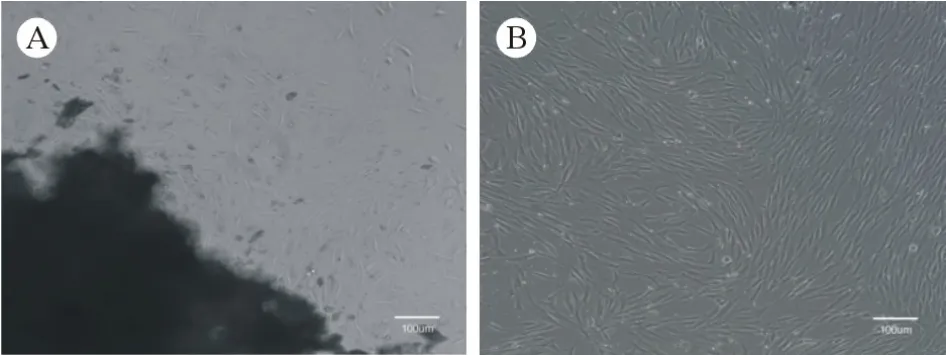
图1 光镜下观察hPDLSCs形态 (100×)A:原代细胞培养7 d;B:P1 代细胞Fig.1 Observation of hPDLSCs under light microscope (100×)A: Primary cells were cultured for 7 d ; B: Cells of the first passage
2 炎症微环境下 hPDLSCs 中炎症因子和成骨相关基因的变化 成骨诱导 7 d 后,使用 10 ng/mL TNF-α刺激 hPDLSCs 24 h,通过 RT-qPCR 检测炎症因子IL-1β、IL-6和 TNF-α 的转录水平。如图2所示,炎症组IL-1β (t=33.19,P<0.01)、IL-6(t=10.09,P<0.01)和 TNF-α (t=9.157,P<0.01)的mRNA表达水平均升高,表明已成功构建体外炎症微环境。RT-qPCR 结果显示炎症组成骨相关基因 RUNX2 (t=3.248,P=0.031)、ALP (t=8,P<0.01)和COL-1 (t=4.187,P=0.014)的表达均降低,而Wnt5a (t=5.861,P<0.01)的水平升高,见图3。上述结果证明TNF-α构建的炎症微环境破坏了hPDLSCs的成骨分化潜力并上调了Wnt5a。
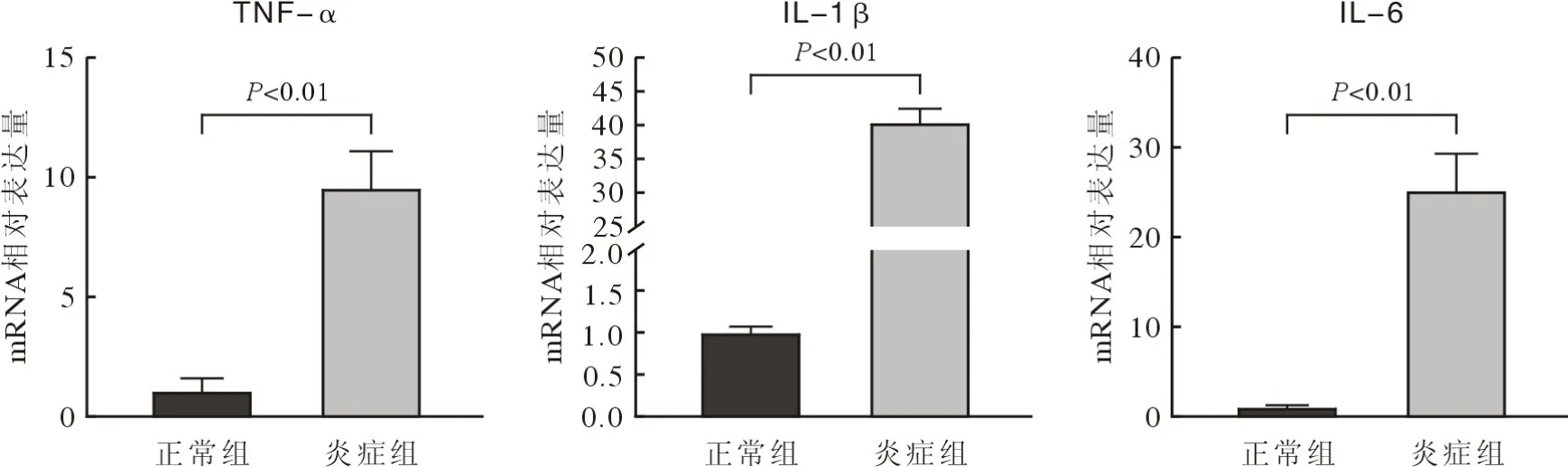
图2 实时定量PCR检测炎性因子mRNA相对表达量Fig.2 Relative mRNA expression level of inflammatory factors were detected by real-time quantitative PCR

图3 实时定量PCR检测正常及炎症微环境下成骨相关基因和Wnt5a的mRNA表达量Fig.3 Relative mRNA expression level of osteogenic-related genes and Wnt5a were detected by real-time quantitative PCR
3 慢病毒转染获得过表达Wnt5a的hPDLSCs过表达Wnt5a慢病毒载体构建如图4所示。感染细胞48 h 后通过倒置荧光显微镜观察可见阴性对照组、过表达组的hPDLSCs 均显示 GFP 绿色荧光(图5),表明慢病毒已成功转染进细胞内。通过Western blot 及 RT-qPCR 检测发现,与阴性对照组相比,过表达组Wnt5a 的mRNA表达量上升了13.57倍(t=97.45,P<0.01),蛋白水平的表达约上升了17倍(t=145.5,P<0.01),见图6。
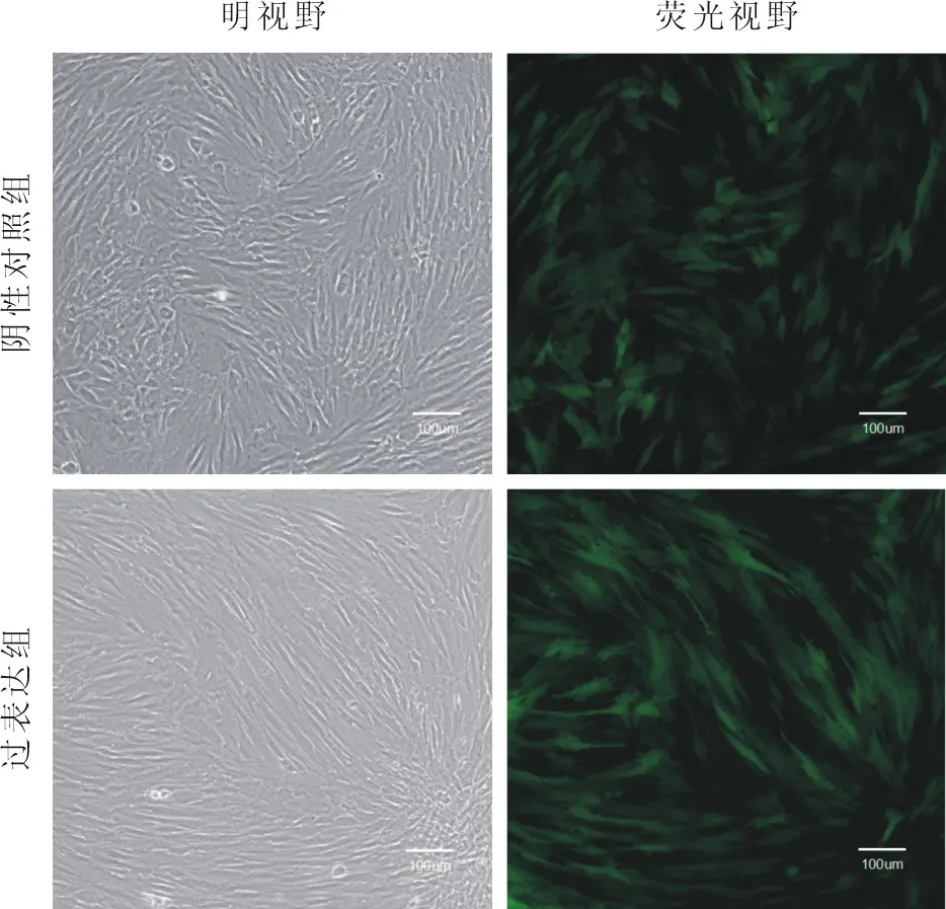
图5 慢病毒感染人牙周膜干细胞 48 h 后荧光显微镜图 (100×)Fig.5 Fluorescence microscopic observation of hPDLSCs after transfection for 48 hours (100×)
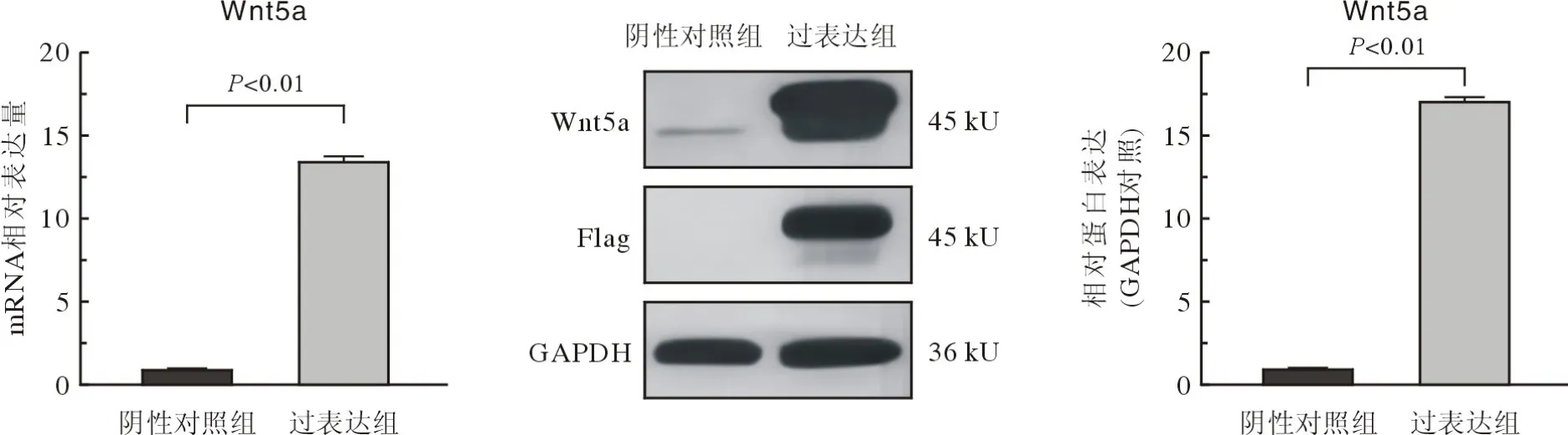
图6 转染Wnt5a过表达载体后hPDLSCs中Wnt5a mRNA和蛋白表达增加Fig.6 Wnt5a mRNA and protein expressions in hPDLSCs were significantly increased after transfection with Wnt5a overexpression vector,GAPDH served as an internal control
4 过表达Wnt5a对 hPDLSCs 增殖活力的影响CCK-8法检测发现,在培养的前3 d内各组细胞生长曲线基本重合,5 d时细胞活力开始出现差异,7 d时可见炎症组hPDLSCs增殖能力显著高于对照组,提示炎症微环境促进了hPDLSCs的增殖。过表达Wnt5a组在正常条件下细胞活力显著增强(t=8.003,P<0.01),而在炎症条件下其增殖能力显著下降(t=11.89,P<0.01),见图7。
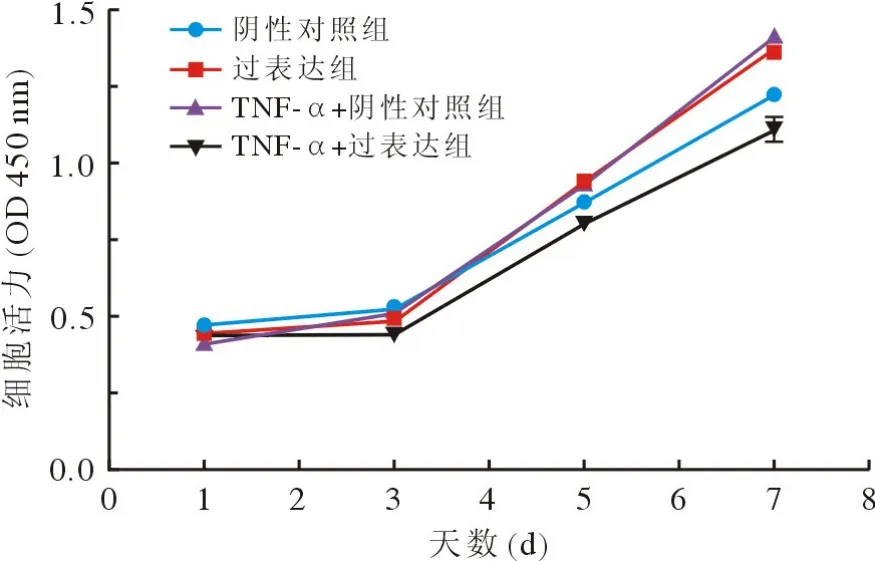
图7 CCK-8 法检测不同处理组 hPDLSCs增殖Fig.7 CCK-8 assay detected the growth of hPDLSCs in different groups
5 正常环境及炎症微环境下过表达Wnt5a对hPDLSCs成骨分化的影响 ALP 染色结果显示,正常培养条件下Wnt5a过表达组的ALP 着色深度较阴性对照组浅,但在TNF-α刺激的炎症微环境下,Wnt5a过表达组的ALP染色深于阴性对照组,见图8。成骨诱导 21 d 后行ARS 染色,结果显示正常培养条件下与阴性对照组相比,Wnt5a过表达组ARS 染色更深,钙盐结节形成量也更多。炎症组Wnt5a过表达后,其着色深度及钙结节的形成量均高于对照组,提示过表达Wnt5a对hPDLSCs成骨分化的抑制作用在炎症微环境下被逆转,见图9。这也与RT-qPCR 和Western blot结果一致。成骨诱导培养 7 d 时,与对照组相比,正常培养条件下的Wnt5a过表达组COL-1、RUNX2的mRNA (t=7.165,P<0.01;t=16.54,P<0.01)和蛋白(t=36.48,P<0.01;t=81.91,P<0.01)表达水平显著降低;而炎症微环境下过表达Wnt5a组与对照组相比,其COL-1和RUNX2的mRNA (t=3.627,P=0.022;t=4.032,P=0.016)及蛋白 (t=57.27,P<0.01;t=27.23,P<0.01)表达水平显著升高,见图10、图11,证明炎症微环境下过表达Wnt5a对hPDLSCs成骨分化有促进作用。
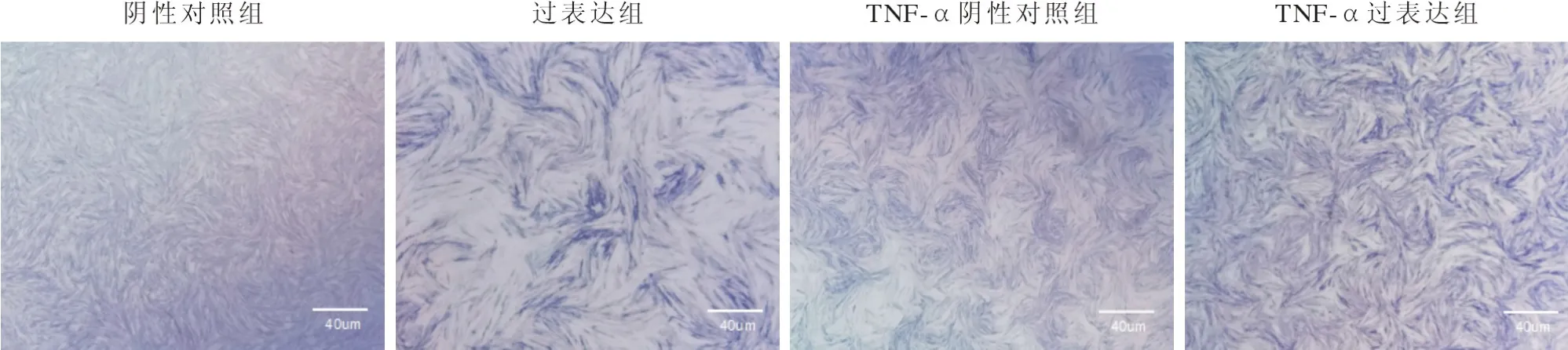
图8 成骨诱导第7天ALP染色结果(40×)Fig.8 ALP staining results on 7 d of osteogenesis induction (40×)

图9 成骨诱导第21天茜素红染色结果(100×)Fig.9 ARS staining results on 21 d of osteogenesis induction (100×)
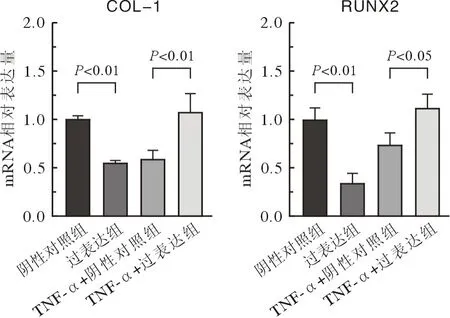
图10 实时定量PCR检测成骨相关基因的mRNA表达水平Fig.10 mRNA expression levels of osteogenic genes were detected by RT- qPCR

图11 Western blot检测COL-1和RUNX2蛋白表达(定量数据表示所分析蛋白质的水平)Fig.11 The protein expressions of COL-1 and RUNX2 were detected by Western blot after 7 d of osteogenic induction (quantitative data represents the levels of analyzed proteins)
讨 论
牙周炎是一种以局部免疫反应为主的炎症性疾病,是我国成年人牙齿丧失的主要原因之一[16]。随着牙周再生工程的飞速发展,hPDLSCs在牙周组织再生修复中的价值受到了越来越多的关注。近年来研究显示,慢性牙周炎时大量促炎介质释放,在对抗病原微生物的同时也诱导了牙周结构分解和代谢损伤,牙周炎患者局部特殊的炎症微环境不利于牙周硬组织的修复[17-18]。因此,研究炎症细胞因子在hPDLSCs骨形成和组织再生过程中的作用对于慢性牙周炎的治疗具有重要意义。
Wnt5a是非经典Wnt/Ca2+信号通路的分泌型配体,参与了干细胞生长发育和炎症相关疾病发生发展的全过程[19]。在炎症发生的早期阶段,Wnt5a/Fzd7复合物通过Ca2+诱导IL-10的分泌,阻断TLR-2/NF-κB信号通路,以减轻炎症反应[20]。随着炎症反应的发展,对抗微生物可使Wnt5a的表达上调和释放增加,释放出的Wnt5a又可以触发促炎信号级联并进一步增加炎性因子的分泌[21]。这些结果提示Wnt5a可能是潜在的炎症因子,具有促炎和免疫的双重作用。TNF-α是一系列抗炎过程中的上游因子,参与炎症发生发展全过程[22]。TNF-α的作用是剂量依赖性的,浓度为10 ng/mL时成骨抑制尤其显著,且刺激炎症因子分泌量最高,可诱导干细胞产生明显的炎症反应[23-24]。同时,TNF-α浓度为10 ng/mL时,对细胞的增殖促进作用最为显著[25],此时细胞数量多且活性高。因此,本实验选择10 ng/mL TNF-α诱导炎症微环境,结果证明炎症微环境下hPDLSCs成骨分化能力受损,主要表现为TNF-α刺激后hPDLSCs中成骨关键基因RUNX2、ALP、OCN的mRNA表达水平降低,而炎性因子IL-6、IL-1β、TNF-α表达水平显著升高,同时Wnt5a表达上调。这提示Wnt5a可能是PDLSCs在炎症微环境下成骨分化能力减弱的分子机制。
RUNX2、COL-1和ALP在早期成骨过程中发挥着重要作用,是反映成骨分化的经典指标。RUNX2可直接调控成骨过程,通过调节细胞周期,加速成骨细胞分化和软骨细胞成熟[26]。COL-1作为骨基质中含量最为丰富的部分,是组成骨骼和大多数结缔组织的主要蛋白[27]。已有研究将带有Wnt5a质粒的COL-1支架用于原位软骨组织工程,Wnt5a质粒可通过刺激聚集蛋白、Ⅱ型胶原蛋白和SOX9基因的表达,抑制软骨肥大,促进软骨修复。ALP表达于骨骼发育的初期,其表达水平与成骨细胞成熟程度呈正相关[28]。有研究发现高浓度的Wnt5a (100 ng/mL)显著抑制ALP活性、矿化结节形成和成骨相关基因的表达,提示Wnt5a可能是干细胞骨形成的负调节因子[29]。然而,牙周炎状态下的骨再生与正常骨形成存在一定差异,局部炎症环境对hPDLSCs功能产生影响。因此,深入探究hPDLSCs在炎症微环境中的骨向分化潜力,促进牙周组织再生,是干细胞治疗能否成功的关键。
本实验利用慢病毒在hPDLSCs中转染重组Wnt5a,成骨诱导培养7 d时实时定量PCR及Western blot 检测成骨关键基因的表达、ALP染色评估细胞体外矿化能力,成骨诱导21 d时ARS染色评估钙结节形成能力,证明正常培养条件下过表达Wnt5a抑制hPDLSCs中RUNX2、COL-1及ALP的表达,Wnt5a参与了早期矿化过程。相反,在炎症微环境下过表达Wnt5a后,hPDLSCs中RUNX2、COL-1的mRNA和蛋白表达水平以及钙化结节形成量增加,表明Wnt5a在炎症微环境下促进hPDLSCs成骨分化,过表达Wnt5a后hPDLSCs的成骨分化能力增强。此外,本实验还研究了过表达Wnt5a在炎症微环境下对hPDLSCs增殖能力的影响。CCK-8检测发现前3 d细胞生长曲线基本重合,从4 d开始各实验组增殖能力出现显著差异。与对照组相比,炎症刺激下hPDLSCs的增殖能力增强,这与既往研究结果一致[23]。过表达Wnt5a在正常环境下促进hPDLSCs增殖,炎症环境下其增殖活力却显著下降,这意味着炎症微环境下hPDLSCs再生能力可能随着Wnt5a的增加而减弱。
综上所述,本研究证明了炎症微环境会损伤hPDLSCs的成骨分化潜力并上调Wnt5a;正常培养条件过表达Wnt5a后,hPDLSCs增殖能力增强、骨向分化能力减弱,说明Wnt5a作为负调节因子介导了人牙周膜干细胞的成骨分化过程。但在TNF-α刺激的炎症微环境下,Wnt5a对hPDLSCs成骨的抑制作用被逆转。目前对于炎症微环境下hPDLSCs再生机制的研究还很少,但许多研究已经提示Wnt5a可能作为治疗炎症相关骨性疾病的潜在靶点,未来还需要进一步探索其下游信号分子的潜在机制,并为基于干细胞治疗的牙周再生提供新思路。
致谢我们要感谢实验室主任段小涛、王勃研究员对实验资源的提供和出色的技术支持。感谢军事科学院军事医学研究院提供的显微镜和图像分析服务。
作者贡献张璇:总体构思,数据管理,规范分析,资金获取,调查研究,方法设计,有效验证,可视化处理,撰写初稿,审读和修订;王辰:数据管理, 资金获取,调查研究;杨琳:调查研究,资金获取,有效验证;段霏:调查研究,数据管理,项目管理;顾斌:总体构思,资金获取,项目管理,资源提供,监督指导,审读和修订;杨燕美:总体构思,项目管理,资金获取,方法设计,监督指导,审读和修订。
利益冲突所有作者声明无利益冲突。
数据共享声明支持本研究结果的数据可根据合理要求从第一作者和通信作者处获得。
