肠炎宁颗粒联合蒙脱石散治疗小儿轮状病毒性肠炎的临床研究
2023-12-27吴小红颜海峰古裕鸟
吴小红,颜海峰,古裕鸟
海南医学院第二附属医院 儿科二区,海南 海口 570311
小儿轮状病毒性肠炎是小儿腹泻的常见病因,由轮状病毒感染引起,2010—2014 年我国多地区门诊患者中,轮状病毒阳性检出率平均为12.9%[1]。小儿轮状病毒性肠炎可通过粪、口传播,潜伏期为2~4 d,病程一般为2 周左右,多发于秋冬季,临床多表现为急性腹泻、腹痛、发热、呕吐等,严重者可伴脱水、酸中毒等,甚至危及生命[2]。我国当前感染轮状病毒肠炎的婴幼儿基数大,且囿于规范、有效的治疗方案的缺失,严重威胁婴幼儿的健康成长[3]。因此,积极探索小儿轮状病毒性肠炎规范、有效防治措施是儿科临床亟待解决的关键问题。
研究证实,轮状病毒破坏肠道屏障,导致肠道菌群紊乱,激发炎症反应,促进小儿轮状病毒性肠炎进展[4]。肠炎宁颗粒是治疗小儿轮状病毒性肠炎的常用中成药,可减少大肠杆菌、金黄色葡萄球菌等有害菌数量,对于肠道菌群失调疾病,特别是小儿轮状病毒性肠炎具有显著的疗效[5]。蒙脱石散直接作用于肠道黏膜,有效抑制病毒、炎症等致病因子[6]。本研究针对在海南医学院第二附属医院收治的130 例小儿轮状病毒性肠炎患儿,观察肠炎宁颗粒与蒙脱石散联合使用对小儿轮状病毒性肠炎炎症因子、肠道菌群的影响,为探讨该方案干预肠道菌群、抑制微炎症、延缓小儿轮状病毒性肠炎进展提供依据。
1 资料与方法
1.1 一般临床资料
选取2020 年3 月—2021 年7 月在海南医学院第二附属医院收治的130 例小儿轮状病毒性肠炎患儿。其中男77 例,女53 例;年龄6 个月~4 岁,平均(2.52±0.23)岁;病程1~4 d,平均(1.76±0.25)d。本研究通过海南医学院第二附属医院伦理委员会审查(审批号HNYXY2020002)。
诊断标准:西医符合《诸福棠实用儿科学》中关于小儿轮状病毒性肠炎的诊断标准[7],发病急,粪检轮状病毒阳性;泄泻,大便次数≥4 次/d;粪便稀色淡,呈蛋花样或水样便;可同时伴有发热、呕吐等。中医符合《中医病证诊断疗效标准》中湿热型泄泻[8],大便溏薄,轻重相间,夹有未消化物,面黄,舌质黄,苔腻,脉弱,神倦纳差。
入选标准:(1)患儿近1 个月内未接受与研究相关的药物治疗;(2)患儿符合诊断标准;(3)患儿年龄在研究范围内;(4)患儿监护人已签订知情同意书,并自愿参与本研究。
排除标准:(1)合并其他消化系统疾病者;(2)伴重度脱水、电解质紊乱者;(3)近期服用抗病毒药物治疗的患儿;(4)存在其他肠炎病病症患儿;(5)对本研究相关药物过敏。
剔除、脱落标准:(1)治疗过程中出现严重不良反应的患儿;(2)患儿及其监护人未遵行规定方案治疗或自行退出者;(3)治疗过程中出现危急重症患儿。
1.2 药物
肠炎宁颗粒治疗购自江西康恩贝天施康药业有限公司,规格10 g/袋,产品批号17 030201;蒙脱石散购自博福–益普生(天津)制药有限公司,规格3 g/袋,产品批号220901、210603。
1.3 分组和治疗方法
采用随机数字表法将所有患儿随机分为对照组和治疗组,每组各65 例。对照组包括男40 例,女25 例,年龄范围7 个月~4 岁,平均(2.48±0.35)岁,病程持续时间1~3 d,平均(2.17±0.36)d。治疗组包括男37 例,女28 例,年龄范围6 个月~4 岁,平均(2.55±0.32)岁;病程持续时间为1~4 d,平均(2.15±0.32)d。两组患儿的一般资料对比无统计学意义,具有可比性。
两组患儿均给予相同的常规对症治疗,包括退热、抗病毒、止吐以及维持水、电解质、酸碱平衡。对照组口服蒙脱石散,6 个月以下患儿每次1/3 袋,1~2 岁患儿每次2/3 袋,3 岁以上患儿每次1 袋,3 次/d。治疗组在对照组基础上口服肠炎宁颗粒,6个月以下患儿每次1/3 袋,1~2 岁患儿每次2/3 袋,3 岁以上患儿每次1 袋,3 次/d。两组患儿治疗时间均为5 d。
1.4 临床疗效判定标准[9]
治愈:经过5 d 的治疗,患儿的排便频率和性状恢复正常,其他症状完全消失;有效:经过5 d 的治疗,患儿的排便频率和性状明显减少,其他症状显著改善;无效:经过5 d 的治疗,患儿的临床症状未表现出改善迹象。
总有效率=(治愈例数+有效例数)/总例数
1.5 观察指标
1.5.1 主要症状改善时间 对比两组患儿治疗过程中的退热时间、止泻时间、止吐时间
1.5.2 中医症候评分 参考中医证候评分标准进行分值统计[8-9]。观察记录两组患儿治疗前后的大便清稀、低热、呕吐、食欲不振、腹胀、口渴评分情况,0 分为无症状,2 分为轻度症状,4 分为中度症状,6 分为重度症状;次症每项各3 分,“无”记为0 分,“轻度”记为1 分,“中度”记为2 分,“重度”记为3 分。中医症候评分的分值越高则表示临床症状越严重。
1.5.3 血清炎症因子 采集所有患儿治疗前后空腹静脉血3 mL,3 000 r/min 离心10 min,分离血清,使用日立H7600 全自动生化分析仪,按照双抗体夹心酶联免疫吸附试验法检测血清白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、C 反应蛋白(CRP)水平,所使用的试剂盒均购自上海生工生物技术公司。
1.5.4 肠道菌群 将1 g 粪便放入无菌采集管中,加入5 mL 粪便稀释液,振荡混合后稀释至8~10倍,接种于SS 琼脂培养基中,37 ℃下使用GENbox厌氧培养系统培养36~48 h。通过菌落数=(菌落数/涂布量)×稀释倍数×稀释液体积/质量计算每克样本内的菌落数,结果以lg CFU/g 表示
1.6 不良反应监测
观察并记录两组患儿在观察期间发生的不良反应情况,包括便秘、恶心、皮疹、腹胀腹痛、头痛等不良反应。
1.7 统计学分析
2 结果
2.1 两组临床疗效比较
治疗后,治疗组患儿总有效率显著高于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组临床疗效的比较Table 1 Comparison on clinical efficacies between two groups
2.2 两组主要症状改善时间比较
治疗后,治疗组患儿的退热时间、止泻时间、止吐时间明显短于对照组(P<0.05),见表2。
表2 两组主要症状消失时间比较()Table 2 Comparison on disappearance times of major symptoms between two groups ()

表2 两组主要症状消失时间比较()Table 2 Comparison on disappearance times of major symptoms between two groups ()
与对照组相比:*P<0.05*P<0.05 vs control group
2.3 两组中医症候评分比较
治疗后,两组大便清稀、低热、呕吐、食欲不振、腹胀、口渴评分较治疗前下降明显(P<0.05),且治疗组中医症候评分降低更显著(P<0.05),见表3。
表3 两组中医症候评分比较(,n=65)Table 3 Comparison on symptom score of traditional Chinese medicine between two groups (,n=65)

表3 两组中医症候评分比较(,n=65)Table 3 Comparison on symptom score of traditional Chinese medicine between two groups (,n=65)
与同组治疗前相比:*P<0.05;与对照组治疗后相比:▲P<0.05*P<0.05 vs same group before treatment;▲P<0.05 vs control group after treatment
2.4 两组血清炎症因子比较
治疗后,两组血清CRP、IL-6、TNF-α 水平均显著降低(P<0.05),治疗组血清炎症因子水平较对照组更低(P<0.05)。见表4。
表4 两组血清CRP、IL-6、TNF-α 水平比较()Table 4 Comparison on serum levels of CRP,IL-6,and TNF-α between two groups ()
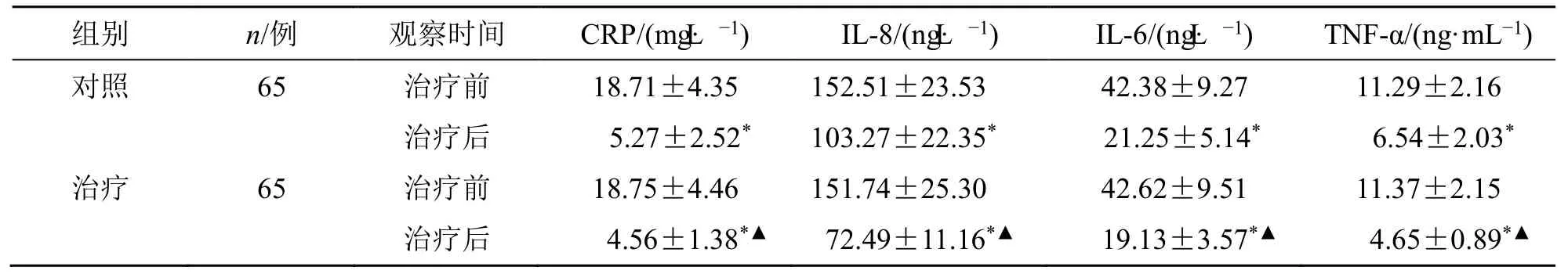
表4 两组血清CRP、IL-6、TNF-α 水平比较()Table 4 Comparison on serum levels of CRP,IL-6,and TNF-α between two groups ()
与同组治疗前相比:*P<0.05;与对照组治疗后相比:▲P<0.05*P<0.05 vs same group before treatment;▲P<0.05 vs control group after treatment
2.5 两组肠道菌群比较
经治疗,两组双歧杆菌、嗜酸乳杆菌较治疗前显著增加,大肠杆菌均显著下降(P<0.05),治疗组双歧杆菌、嗜酸乳杆菌较对照组更高,大肠杆菌较对照组更低(P<0.05),见表5。
表5 两组肠道菌群比较()Table 5 Comparison on intestinal microbiota between two groups ()

表5 两组肠道菌群比较()Table 5 Comparison on intestinal microbiota between two groups ()
与同组治疗前相比:*P<0.05;与对照组治疗后相比:▲P<0.05*P<0.05 vs same group before treatment;▲P<0.05 vs control group after treatment
2.6 两组不良反应的比较
对照组便秘3 例、恶心2 例;治疗组便秘2 例、恶心1 例、皮疹1 例。两组患儿不良反应发生率分别为7.69%、6.15%,无明显差异。
3 讨论
依据其临床特征,小儿轮状病毒性肠炎属于中医学“腹泻”范畴。小儿脏腑发育未全,脾胃虚弱,健运失调,遇湿邪困阻,发为腹泻,脾胃不足为本,湿邪为标[10]。肠炎宁颗粒组方为金毛耳草、地锦草、枫树叶、樟树根、香薷等,全方具有清热祛湿、解毒行气的功效,具有提高免疫、抑菌、抗病毒作用,同时还能改善肠道屏障功能作用[11]。蒙脱石散属于硅酸盐,具有吸附作用,缩短泄泻时间,防止泄泻的水分流失、内环境紊乱,同时可增强肠道黏膜功能,抑制病菌繁殖,改善肠道菌群结构,是治疗小儿轮状病毒性肠炎的常用药物[12-13]。
肠炎宁颗粒联合双歧杆菌乳杆菌三联活菌可改善患儿腹泻的临床症状,调节肠道微生态,从而有效治疗腹泻[14]。小儿轮状病毒性肠炎可上调TLR4水平,促进炎性因子IL-6、TNF-α 大量释放,而肠炎宁颗粒可抑制TLR4/MyD88/NF-κB 信号通路,从而抑制炎症和轮状病毒[4]。本研究结果显示,治疗组退热时间、止泻时间、止吐时间均短于对照组,中医症候大便清稀、低热、呕吐、食欲不振、腹胀、口渴评分低于对照组,总有效率高于对照组(P<0.05),提示肠炎宁颗粒联合蒙脱石散具有改善小儿轮状病毒性肠炎临床症状和中医症候、提高临床疗效的作用。
轮状病毒侵袭肠道黏膜,致大量单核细胞浸润,产生促炎因子TNF-α,从而进一步损伤机体[15]。IL-6 是多效性细胞因子,与肠道炎症密切相关[16]。IL-6 与TNF-α 共同作用,增加血管通透性,破坏肠黏膜,促进炎症反应,是小儿轮状病毒性肠炎重要的发病机制[17]。研究表明,CRP 在轮状病毒感染后上升,是预测疾病进展的关键指标之一[18]。IL-8 可诱导淋巴细胞浸润小肠上皮细胞,引发小肠上皮细胞坏死、脱落和吸收表面积减小,同时增加肠腔内的渗透压,从而影响水分吸收,最终导致稀水样便的发生[19]。临床研究证实,蒙脱石散可辅助治疗放射性肠炎,减轻黏膜损伤,改善炎症反应[20]。本研究显示,治疗后,治疗组血清炎症因子IL-6、TNF-α、CRP 水平显著低于对照组,提示肠炎宁颗粒联合蒙脱石散可有效抑制小儿轮状病毒性肠炎患儿炎症。
研究表明,轮转病毒感染肠道会损伤肠道黏膜,通透性增加,导致菌群失调,因此及时恢复肠道微生态平衡是治疗小儿轮状病毒性肠炎的关键[21]。吲哚-3-乳酸是由双歧杆菌产生的一种代谢物,可以通过抑制核因子-κB 信号通路来降低肠道上皮细胞的炎症反应[22]。嗜酸乳杆菌作为肠道益生菌可通过调节炎症信号通路有效发挥抑炎作用[23]。大肠杆菌属于条件致病菌,在肠道感染中,其数量的稳定对于制约肠稳态平衡有重要作用[24]。本研究结果显示,治疗后两组肠道菌群均有改善,治疗组患儿双歧杆菌、嗜酸乳杆菌、大肠杆菌恢复优于对照组,提示肠炎宁颗粒联合蒙脱石散可有效调节小儿轮状病毒性肠炎患儿肠道菌群。
综述所述,肠炎宁颗粒联合蒙脱石散可有效治疗小儿轮状病毒性肠炎,改善临床症状和中医症候,其作用机制可能与调节肠道菌群、抑制炎症等有关。
利益冲突所有作者均声明不存在利益冲突
