广西北部湾来源植物内生真菌及其次级代谢产物的细胞毒活性研究
2023-12-26王玉妃余慧琳王诗怡孔凡栋周丽曼王聪
王玉妃?余慧琳?王诗怡?孔凡栋?周丽曼?王聪

摘要:目的 從北部湾红树林区采集的植物样品中分离真菌,并从中发现具有活性的次级代谢产物。方法 采用10倍稀释法通过3种培养基分离北部湾红树林岸边植物中的真菌,发酵后进行化学成分分析,筛选优先研究菌株,并采用现代色谱分离技术对优选菌株次级代谢产物进行分离纯化,通过波谱方法和文献数据对比解析鉴定化合物结构,采用CCK-8法进行化合物细胞毒活性检测。结果 从北部湾红树林区来源的4个植物样品中共分离得到94株真菌,筛选出3株优选菌株,从中分离的3个主产物,分别鉴定为phomoxanthone A(1)、isomeleagrin(2)和(-)-(6S, 1'S)-pestalotin(3)。细胞毒活性测试表明,化合物1和2具有多种细胞毒活性。结论 首次发现isomeleagrin对5637人膀胱癌细胞、DU145人前列腺癌细胞、A673人横纹肌肉瘤细胞具有一定的细胞毒活性,红树林区来源真菌具有产生细胞毒活性化合物的潜力。
关键词:广西北部湾;真菌;次生代谢产物;细胞毒活性
中图分类号:R978.1 文献标志码:A
Endophytic fungi and their secondary metabolites from plants in Guangxi Beibu Gulf study on cytotoxic activity
Wang Yufei, Yu Huilin, Wang Shiyi, Kong Fandong, Zhou Liman, and Wang Cong
(Key Laboratory of Chemistry and Engineering of Forest Products, State Ethnic Affairs Commission, Guangxi Key Laboratory of Chemistry and Engineering of Forest Products, Guangxi Collaborative Innovation Center for Chemistry and Engineering of Forest Products, Key Laboratory of Universities In Guangxi for Excavation and Development of Ancient Ethnomedicinal Recipes,
Guangxi Minzu University, Nanning 530006)
Abstract Objective Fungi were isolated from plant samples collected from the mangrove area of Beibu Gulf to find active secondary metabolites. Methods Fungi were isolated from mangrove riparian plants in Beibu Gulf by 10-fold dilution method using three media. After fermentation, the chemical composition analysis was carried out to screen the priority research strains. The secondary metabolites of the preferred strains were isolated and purified by modern chromatographic separation technology. The structures of the compounds were identified by spectral methods and literature data. The cytotoxic activity of the compounds was detected by CCK-8 method. Results A total of 94 strains of fungi were isolated from four plant samples from the mangrove area of Beibu Gulf, and three preferred strains were screened. Three main products were isolated and identified as phomoxanthone A(1), isomeleagrin(2) and (-)-(6S, 1'S)-pestalotin(3). Cytotoxic activity tests showed that compounds 1 and 2 had a variety of cytotoxic activities. Conclusion It was found for the first time that isomeleagrin had certain cytotoxic activity against 5637 human bladder cancer cells, DU145 human prostate cancer cells and A673 human rhabdomyosarcoma cells. Mangrove-derived fungi have the potential to produce cytotoxic active compounds.
Key words Beibu Gulf of Guangxi; Fungi; Secondary metabolites; Cytotoxic activity
红树林是一种由海洋向陆地过渡的特殊生境,包括红树植物及其生态下所有生物群落[1],具有盐渍化、沼泽化、厌氧、高温、强紫外辐射、有机质含量高的特点[2]。其极端的生态环境刺激相关微生物激活沉默基因,激发生物合成潜力,进而产生具有显著生物活性和新颖结构的代谢物,包括肽类、萜类、酯类、酚类、聚酮类、多糖类等,它们具有抗癌、抗菌、抗炎、抗感染、抗病毒等特性[3-4]。近年来,红树林真菌在生物活性分子研究中的应用日益广泛[5],被认为是寻找药物先导化合物的重要资源库,是具有潜力的生物多样性热点研究领域[6]。
广西北部湾地处热带和亚热带区域,拥有多个海草床生长区和国内最大红树林区[7-8],具有丰富的微生物类群和进行药物研发的独特资源优势。自2002—2022年,已发现87种新化合物和50种已知活性化合物,其中不乏结构新颖和活性显著的化合物,近年来已成为微生物资源与化学研究的热点区域之一[9-10]。
本研究采用10倍稀释法从广西北部湾钦州红树林区采集的4种植物样品水龙、黄婵、丁香蓼和莲子草中进行真菌分离,共获得94株真菌,使用2种培养基对获得的菌株进行发酵并对其次级代谢产物进行研究,结合HPLC化学筛选,确定了3株优先研究菌株,分离鉴定了其主要次级代谢产物分别为phomoxanthone A(1)、isomeleagrin(2)、(-)-(6S,1'S)-pestalotin(3)。用CCK-8法对3个化合物分别进行细胞毒活性检测,结果表明化合物1和2都具有多种细胞毒活性,其中首次发现化合物2对5637人膀胱癌细胞的增殖抑制活性较强,对A673、L-02、DU145细胞具有一定的细胞毒活性。
1 材料与方法
1.1 材料
1.1.1 样品来源
水龙(Ludwigia adscendens (L.) Hara)、黄婵(Allamanda schottii Pohl)、丁香蓼(Ludwigia prostrata Roxb.)、莲子草(Alternanthera Sessilis (Linn.) DC.)共4个植物样品均采自广西北部湾钦州。水龙(21°54'2'',108°36'45'')、黄婵(21°54'8'',108°36'22'')、丁香蓼(21°53'56'',108°36'51'')、莲子草(21°54'5'',108°36'50'')。
1.1.2 分离培养基(添加氯霉素为5 mg/100 mL)
PDA培养基(g/100 mL):葡萄糖2.0,马铃薯20.0,琼脂2.0,海水素3.3。
真菌2号培养基(g/100 mL):味精1.0,磷酸二氢钾0.05,海水素3.3,酵母膏0.3,琼脂2.0,麦芽糖2.0,葡萄糖1.0,甘露醇2.0。
孟加拉红培养基(g/100 mL):孟加拉红3.6,琼脂2.0,海水素3.3,pH 7.0。
1.1.3 发酵培养基
真菌2号培养基(g/100 mL):味精1.0,磷酸二氢钾0.05,海水素3.3,酵母膏0.3,琼脂2.0,麦芽糖2.0,葡萄糖1.0,甘露醇2.0。
大米培养基:大米80 g,海水120 mL。
1.1.4 试剂和仪器
Brucker AVANCE 400 MHz核磁共振波谱仪(美国Brucker公司);HCB-1300V洁净工作台 (青岛海尔特种电器有限公司);AL104分析天平(瑞士梅特勒公司);硅胶板(青岛海洋化工厂);YXQ-LS-75SII高压灭菌锅(上海博迅医疗生物仪器股份有限公司);CR-080R春霖超声波清洗机(深圳市春霖清洗设备有限公司);半制备C18柱(Nacalai tesque公司);Varian 330检测器(Varian公司);LRH-500A生化培养箱(广东泰宏君科学仪器股份有限公司);MAGNA-1R550傅里叶变换红外光谱(Thermo公司);SCI-VS混匀仪(美国塞洛捷克);MCO-18AC二氧化碳细胞培养箱(PHCbi公司);NIB-100显微镜(宁波永新光学股份有限公司);MS105DU十万分之一天平(Mettler Toledo公司);WZZ-2S/2SS自动旋光仪(上海申光仪器仪表有限公司);SHIMADZU SCL-10A HPLC(日本岛津公司);200~300目正相硅胶(青岛海洋化工集团公司)。
1.2 样品预处理与菌株分离
植物样品的预处理:将植物样品用无菌海水冲洗干净,用吸水纸吸干表面水分,用75%酒精进行表面消毒,无菌海水冲洗4~5次后取其根、茎、叶、花各部位的一小部分加入适量无菌海水进行研磨,用无菌枪头吸取10 mL于离心管作为母液。取1 mL母液加9 mL无菌海水混合即得10倍稀释液。
采用稀释涂布法分离纯化样品真菌,分别取1 mL母液或稀释液,均匀地涂布在3种分离培养基平板(PDA培养基、真菌2号培养基,孟加拉红培养基),每个稀释度涂布两个平板,放入28 ℃恒温培养箱培养。挑取培养基中出现的单菌落进行纯化,若发现不纯应挑取此菌落做进一步划线分离,重复以上操作直至获得纯菌株。将分离纯化得到的单菌落进行保藏(斜面保藏:菌株接入斜面培养基,置于4 ℃冰箱;甘油管保藏:菌株接入含20%甘油的液体培养基,每个菌株保存4管,冻存管标注菌种保藏号及保藏日期,于-20 ℃冰箱保藏)。
1.3 菌株的筛选
1.3.1 菌株发酵
菌株采用两种培养基(真菌2号培养基、大米培养基)进行静置发酵,发酵周期为27 d。
1.3.2 菌株鉴定
植物来源的真菌MDCW-567、MDCW-415、MDCW-441的菌株鑒定包括基因组DNA提取、扩增、纯化、测序等工作由上海生工生物工程股份有限公司完成,利用NCBI数据库对比真菌的ITS序列,并采用软件MEGA(Version 7.0)完成菌株系统进化树的绘制[11]。
1.3.3 浸膏提取
发酵液用两倍体积的乙酸乙酯反复萃取3次,浓缩乙酸乙酯萃取液即得粗浸膏。
1.3.4 细胞增殖抑制活性
使用CCK-8法检测抗肿瘤活性,其原理是CCK-8试剂含2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐(WST–8),其在电子载体1-甲氧基-5-甲基吩嗪硫酸二甲酯(1-Methoxy PMS)作用下被细胞线粒体中的脱氢酶还原成高水溶性黄色甲臜产物(formazan),甲臜产物数目与活细胞数目成正比。细胞增殖越多越快则颜色越深;化合物的细胞毒性越大,则颜色越浅。
CCK-8法抗肿瘤活性测试:采用10%胎牛血清培养液将细胞配成单个细胞悬液,96孔板每孔板接种100 μL 5×104/mL细胞,在5% CO2、37 ℃的条件下预培养24 h。用DMSO溶解样品,基础培养基(DMEM高糖培养液、RPMI1640培养液)稀释样品后,吸出孔内旧培养基,每孔添加100 μL用新鲜培养基配制样品溶液(终浓度20 μmol/L)进行初筛,每个样品设定1个浓度和3个复孔,放置在培养箱中培养48 h。实验分为空白组(blank)、对照组(control)和药物组(drug)。吸出旧培养基,每孔直接加入稀释十倍的100 μL CCK-8溶液,在37 ℃、5% CO2继续培养1~4 h(避光操作,实时观察)。酶标仪检测450 nm下吸光度作为原始数据结果。将Excel软件用于原始数据的标准化处理,初筛通过每孔A值计算细胞增殖抑制率作为初筛结果,公式=(AControl-ADrug)/(AControl-ABlank)×100%,统计抑制率。IC50通过GraphPad Prism 8(版本8.0.2,GraphPad Software Inc)计算,实验结果以±s为单位。阳性对照样品中:盐酸阿霉素doxorubicin(Dox)。
2 结果与分析
2.1 菌株的分离
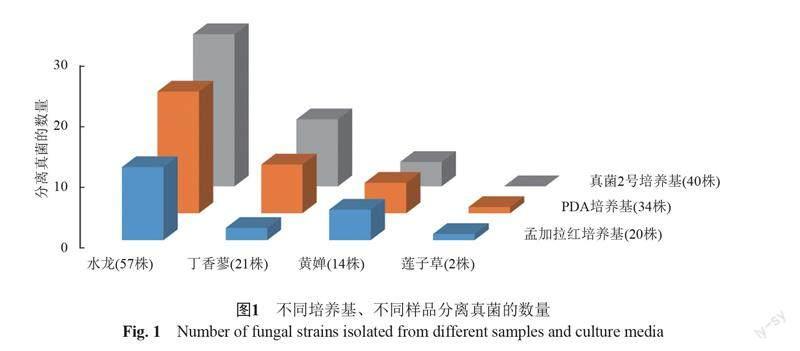
采用10倍稀释法从水龙、黄婵、丁香蓼、莲子草等4种植物样品中分离获得94株真菌(图1)。
水龙(57株):MDCW-333~MDCW-338,MDCW-340~MDCW-341,MDCW-343~MDCW-350,MDCW-352~MDCW-353,MDCW-355,MDCW-359,MDCW-362~MDCW-363,MDCW-366,MDCW-369,MDCW-381,MDCW-383,MDCW-385,MDCW-387,MDCW-391~MDCW-416,MDCW-419,MDCW-422~MDCW-424。
黄婵(14株):MDCW-339,MDCW-364,MDCW-365,MDCW-372,MDCW-373,MDCW-382,MDCW-386,MDCW-389,MDCW-390,MDCW-407,MDCW-417,MDCW-418,MDCW-420,MDCW-421。
丁香蓼(21株):MDCW-342,MDCW-351,MDCW-354,MDCW-356,MDCW-357,MDCW-358,MDCW-360,MDCW-361,MDCW-367,MDCW-368,MDCW-370,MDCW-371,MDCW-374,MDCW-375,MDCW-376,MDCW-377,MDCW-378,MDCW-379,MDCW-380,MDCW-384,MDCW-388。
莲子草(2株):MDCW-441,MDCW-567。
2.2 菌株鉴定
2.2.1 菌株MDCW-567
菌株MDCW-567的ITS序列的PCR擴增序列的长度为512 bp,与NCBI数据库中的高粱附球菌(Epicoccum sorghinum)菌株在系统发育树上处于同一分支。故将菌株MDCW-567(GenBank号 OQ 627405)初步鉴定为高粱附球菌菌株(图2)。对其形态特征作进一步观察,结果符合高粱附球菌菌株形态特征。故初步鉴定菌株MDCW-567为高粱附球菌菌株,并命名为Epicoccum sorghinum MDCW-567。
2.2.2 菌株MDCW-415
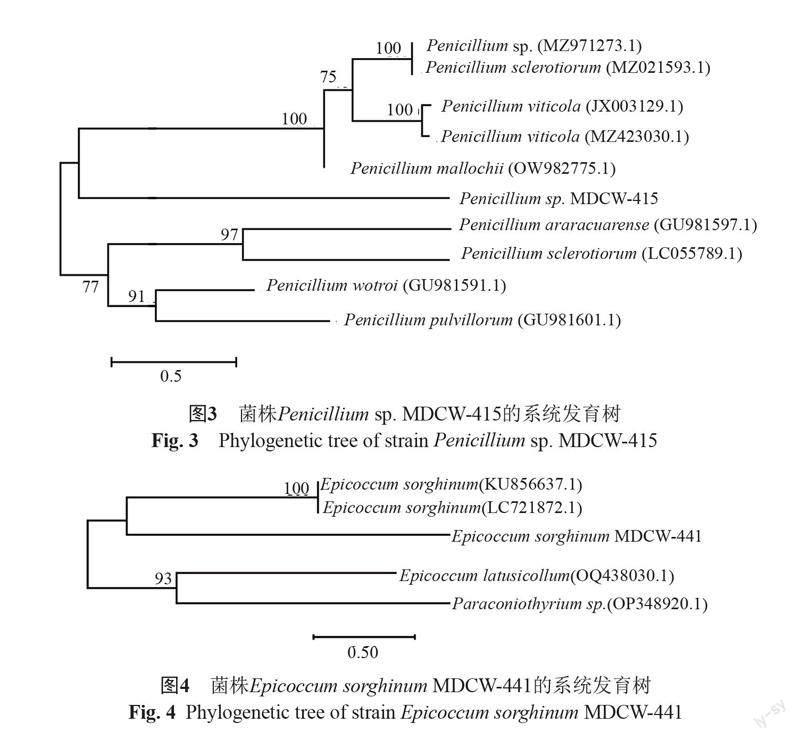
菌株MDCW-415的ITS序列的PCR扩增序列的长度为549 bp,与NCBI数据库中的青霉属(Penicillium sp.)菌株在系统发育树上处于同一分支。故将菌株MDCW-415(GenBank号 OQ 629792)初步鉴定为青霉属菌株(图3)。对其形态特征作进一步观察,结果符合青霉属形态特征。故初步鉴定菌株MDCW-415为青霉菌,并命名为Penicillium sp. MDCW-415。
2.2.3 菌株MDCW-441
菌株MDCW-441的ITS序列的PCR扩增序列的长度为512 bp,与NCBI数据库中的高粱附球菌菌株在系统发育树上处于同一分支。故将菌株MDCW-441(GenBank号OQ 641371)初步鉴定为高粱附球菌菌株(图4)。对其形态特征作进一步观察,结果符合高粱附球菌菌株形态特征。故初步鉴定菌株 MDCW-441为高粱附球菌菌株,并命名为Epicoccum sorghinum MDCW-441。
2.3 化合物的分离与鉴定
对Epicoccum sorghinum MDCW-567(莲子草;孟加拉红培养基;10倍稀释菌液即样品研磨液通过10倍稀释后得到的菌液)大米培养基中的单一次级代谢产物进行分离,通过凝胶柱色谱以二氯甲烷:甲醇=1:1洗脱,TLC检测合并,通过HPLC半制备(C18半制备柱,乙腈:酸水=40:60,流量4 mL/min)纯化,得到化合物1(8 mg,tR=9.2 min),通过MS和NMR鉴定该化合物为phomoxanthone A(图5)。对Penicillium sp. MDCW-415(水龙;PDA培养基;母液即样品研磨液)真菌2号培养基中的单一次级代谢产物进行分离,通过凝胶柱色谱以二氯甲烷:甲醇=1:1洗脱,TLC检测合并,通过HPLC半制备(C18半制备柱,甲醇:水=55:45,流量4 mL/min)纯化得到化合物2
(8.2 mg,tR=7.0 min),通过MS和NMR鉴定该化合物为isomeleagrin。对Epicoccum sorghinum MDCW-441(莲子草;PDA培养基;10倍稀释菌液即样品研磨液通过10倍稀释后得到的菌液)大米培养基中的单一次级代谢产物进行分离,通过凝胶柱色谱以二氯甲烷:甲醇=1:1洗脱,TLC检测合并,通过HPLC半制备(C18半制备柱,甲醇:水=55:45,流量4 mL/min)纯化得到化合物3(12.7 mg,tR=8.8 min),通过MS和NMR鉴定该化合物为(-)-(6S, 1'S)-pestalotin。
化合物1:黄色粉末;ESI-MS m/z 773.2 [M+Na]+,分子式C38H38O16,[α]25D=+69.0 (c=0.60,CH2Cl2)。1H NMR(CDCl3,400 MHz)δ:14.09(1H,s,8-OH),11.51(1H,s,1-OH),7.38(1H,d,J=8.8 Hz,H-3),6.56(1H,d,J=8.8 Hz,H-2),5.40(1H,s,H-5),4.28(1H,d,J=12.8 Hz,H-12),4.17(1H,d,J=12.8 Hz,H-12),2.44(2H,m,H-7),2.34(1H,m,H-6),2.31(2H,m,H-7),2.06(3H,s,5-OC(O)CH3),1.88(3H,s,12-OC(O)CH3),1.00(3H,d,J=5.9 Hz,H-11);13C NMR(CDCl3,100 MHz)δ: 187.9(s,C-9),177.8(s,C-8),170.2(s,12-OC(O)CH3),169.7(s,5-OC(O)CH3),161.7(s,C-1),154.0(s,C-4a),141.3(d,C-3),115.5(s,C-4),109.6(d,C-2),106.4(s,C-9a),100.3(s,C-8a),80.5(s,C-10a),70.5(d,C-5),64.7(t,C-12),33.4(t,C-7),27.7(d,C-6),20.8(q,5-OC(O)CH3),20.6(q,12-OC(O)CH3),17.6(q, C-11)。以上数据与文献报道一致[12],故鉴定化合物1为phomoxanthone A。
化合物2:黄色粉末;ESI-MS m/z 434.2 [M+H]+,分子式C23H23N5O4,[α]25D=-45.0 (c=0.50,MeOH)。1H NMR(CD3OD,400 MHz)δ: 8.81(1H,s,H-18),8.25(1H,s,H-15),7.90(1H,s,H-20),7.63(1H,d,J=7.8 Hz,H-4),7.30(1H,t,J=7.7 Hz,H-6),7.10(1H,t,J=7.7 Hz,H-5),7.03(1H,d,J=7.8 Hz,H-7),6.06(1H,br s,H-22),5.49(1H,s,H-8),3.75(3H,s,1-OCH3),1.31(3H,s,H-24),1.29(3H,s,H-25);13C NMR(CD3OD,100 MHz) δ: 166.5(s,C-13),161.1(s,C-10),147.9(s,C-7a),144.2(s,C-9),143.6(d,C-22),135.2(d,C-18),131.0(s,C-12),129.7(s,C-16),129.5(d,C-6),127.0(s,C-3a),126.0(d, C-4),124.8(d,C-5),122.1(d,C-20),113.8(t,C-23),113.0(d,C-7),111.7(d,C-8),104.2(d,C-15),103.3(s,C-2),65.7(q,1-OCH3),54.3(s,C-3),43.5(s,C-21),23.8(q,C-24),23.8(q,C-25)。以上數据与文献报道一致[13],故鉴定化合物2为isomeleagrin。
化合物3:白色固体;ESI-MS m/z 237.1 [M+Na]+,分子式C11H18O4,[α]25D=-32.6 (c=0.10,MeOH)。1H NMR(CD3OD,400 MHz)δ: 5.17(1H,d,J=1.7 Hz,H-3),4.36(1H,dt,J=12.9 Hz,3.6 Hz,H-6),3.80(3H,s,4-OCH3),3.60(1H,m,H-1'),2.84(1H,ddd,J=17.2 Hz,12.9,1.7 Hz,Ha-5),2.30(1H,dd,J=17.2 Hz,3.8 Hz,Hb-5),1.62(2H,m,H-2'),1.38(2H,m,H-3'),1.29(2H,m,H-4'),0.94(3H,t,J=7.1 Hz,H-5');13C NMR(CD3OD,100 MHz)δ: 176.5(s,C-4),170.3(s,C-2),90.1(d,C-3),80.2(d,C-6),72.6(d,C-1'),57.0(q,4-OCH3),33.3(t,C-2'),30.2(t,C-5),29.1(t,C-3'),23.7(t,C-4'),14.4(q,C-5')。以上数据与文献报道一致[14],故鉴定化合物3为(-)-(6S, 1'S)-pestalotin。
2.4 化合物的细胞增殖抑制活性
对化合物1~3进行细胞增殖抑制活性测试,检测化合物对人胃癌细胞MKN-45在内的17种肿瘤细胞与人慢性髓原白血病细胞K-562、人正常肝细胞L-02、人胚肾细胞293-T的影响。对初筛显示出细胞增殖抑制活性的化合物1和化合物2进一步实验,IC50结果见表2,盐酸阿霉素为阳性对照。结果显示,化合物1对于MKN-45、HCT 116、5637、L-02细胞的增殖抑制活性较强,IC50值分别为2.2、3.5、5.0和2.5 μmol/L。化合物2对于5637细胞的增殖抑制活性较强,IC50值为5.0 μmol/L,对A673、L-02、DU145细胞的增殖抑制活性次之,IC50值分别为17.0、17.0和19.7 μmol/L。化合物3对所测的20种细胞没有表现出细胞增殖抑制活性。
3 讨论
真菌被认为是天然活性产物的重要来源,部分植物内生真菌已进化出生产与宿主植物具有同等或类似生物活性物质的能力[15]。北部湾位于热带和亚热带交界处,是中国生物多样性最高的海域之一,从古到今有多种海洋植物药用经验[16],是药物研发的资源宝库。
本研究通过10倍稀释法从来源于广西北部湾红树林区的4种植物水龙、黄婵、丁香蓼、莲子草中分离获得了94株真菌,采用10倍稀释法分别获得了适应高浓度和低浓度菌液的种类丰富的真菌[17],其中母液分离真菌数量多于10倍稀释液。本研究从94株植物内生真菌中筛选了3株含有单一次级代谢产物的菌株,分别是分离自莲子草的Epicoccum sorghinum MDCW-567、Epicoccum sorghinum MDCW-441和分离自水龙的Penicillium sp. MDCW-415。经过分离纯化与结构鉴定从Epicoccum sorghinum MDCW-567获得化合物1为phomoxanthone A,从Penicillium sp.MDCW-415获得化合物2为isomeleagrin,从Epicoccum sorghinum MDCW-441获得化合物3为(-)-(6S, 1'S)-pestalotin。化合物1和2对5637、L-02细胞系表现出细胞毒性,此外化合物1还对MKN-45、HCT116细胞系表现出细胞毒性,化合物2还對DU145、A673细胞系表现出细胞毒性,化合物3对所测20株细胞系均未表现出细胞毒性。
拟茎点霉酮A(phomoxanthone A)可视为邻位二取代的联芳基衍生物,曾从印尼红树植物Rhizhopora mucronata的内生真菌Phomopsis sp. IM 41-1中分离鉴定[18],研究表明它对菌核菌、贵腐霉菌、金黄色葡萄球菌均有不同程度抗菌活性。还有研究表明其对于抗稻瘟病菌、人口腔表皮样癌细胞(KB cells)、人淋巴细胞瘤细胞(BC-1 cells)、非洲绿猴肾细胞(Vero cells)有活性[19]。本研究进一步证明了该化合物对另外四种细胞系(5637、L-02、HCT 116、MKN-45)有较强的细胞毒活性。
Isomeleagrin于2022年被首次从广西有毒药用植物娃儿藤的内生青霉Penicillium commune Charles Thom(Trichocomaceae)中分离出[13]。Meleagrin是一种具有复杂结构的异戊烯化吲哚生物碱[20],通常有防污、抗癌、抗虫、抗菌等活性[21-22]。Melegrin通过异构化作用形成Isomelegrin,其选择性抑制HGC 27细胞的增殖,IC50值为2.01 μmol/L[13]。本研究首次发现Isomeleagrin对于5637细胞系具有较强的细胞毒活性,对于L-02、DU145和A673具有一定的细胞毒活性。
(-)-(6S, 1'S)-pestalotin是一种吡喃酮衍生物,大多来源于内生真菌拟盘多毛孢属真菌中[23],以往研究发现(-)-(6S, 1'S)-pestalotin可以作为植物生长调节剂,没有抗氧化、抗真菌、免疫抑制活性[24]。本文进一步测试其对20株细胞系的抑制活性,发现此化合物对其增殖均无影响。
目前对于广西北部湾来源的红树林区植物内生真菌次级代谢产物活性研究相对较少,以前的研究多数停留在菌株分离、筛选和鉴定上,对菌株次级代谢产物的研究尚不深入[25]。本文从采集自北部湾的四株植物中分离真菌并对其次级代谢产物的细胞毒活性进行研究,发现phomoxanthone A对5637、L-02、HCT 116和MKN-45细胞有较强的细胞毒活性。同时,本文首次发现isomeleagrin对于5637人膀胱癌细胞有较强的细胞毒活性,丰富了吲哚生物碱类物质作为抗癌活性成分的研究。天然产物是新药设计与研发的重要源泉,通过挖掘特色天然新资源为创新药物的研究提供有价值的先导化合物,对于促进新药创制研发有重大意义[26]。
参 考 文 献
何子邦, 李顺莲, 吴友浪, 等. 广西沿海红树林土壤放线菌多样性、新颖性及抗菌活性研究[J]. 中国抗生素杂志, 2022, 47(5): 463-473.
Elena A, Georgios D, Peter P. Lead compounds from mangrove-associated microorganisms[J]. Mar Drugs, 2018, 16(9): 319.
Zhu Y H, Jiang X B, Hu B, et al. Advances in the study of the structures and bioactivities of metabolites isolated from mangrove-derived fungi in the South China Sea[J]. Mar Drugs, 2013, 11(10): 3601-3616.
Hong K, Gao A H, Xie Q Y, et al. Actinomycetes for marine drug discovery isolated from mangrove soils and plants in China[J]. Mar Drugs, 2009, 7: 24-44.
Sunil K D, Manish K G, Ved P M, et al. Mangrove-associated fungi: A novel source of potential anticancer compounds[J]. J Fungi, 2018, 4(3): 101.
Cai R L, Jiang H M, Mo Y L. Ophiobolin-type sesterterpenoids from the mangrove endophytic fungus Aspergillus sp. ZJ-68[J]. J Nat Prod, 2019, 82(8): 2268-2278.
Wu J, Xiao Q, Xu J, et al. Natural products from true mangrove flora: source, chemistry and bioactivities[J]. Nat Prod Rep, 2008, 25(5): 955-981.
Li M Y, Xiao Q, Pan J Y, et al. Natural products from semi-mangrove flora: source, chemistry and bioactities[J]. Nat Prod Res, 2009, 26(2): 281-298.
王聪, 苏艳, 高谕康, 等. 广西北部湾来源抗菌活性真菌菌株的分离筛选及活性产物鉴定[J]. 国际药学研究杂志, 2019, 46(04): 270-276.
张艳婷, 彭帅, 黄炳耀, 等. 1株珊瑚共附生真菌Talaromyces verruculosus GXIMD 02504的次级代谢产物及抑菌活性研究[J]. 中国抗生素杂志, 2022, 47(10): 1045-1050.
王聪, 王玉妃, 孙建, 等. 海洋曲霉Aspergillus ruber TX-M4-1的次级代谢产物研究[J]. 中草药, 2022, 53(18): 5600-5606.
Isaka M, Jaturapat A, Rukseree K, et al. Phomoxanthones A and B, novel xanthone dimers from the endophytic fungus Phomopsis species[J]. J Nat Prod, 2001, 64(8): 1015-1018.
Cao H Y, Zhao J Y, Yi C, et al. Undescribed meleagrin alkaloids from the endophytic fungus Penicillium commune[J]. Phytochem Lett, 2022, 204: 113441.
Nalin R G R, Savitri K N, Jayasinghe L, et al. Secondary metabolites produced by an endophytic fungus Pestalotiopsis microspora[J]. Natur Prod & Bioprosp, 2019, 9(6): 411-417.
Zhang Y, Mu J, Feng Y, et al. Broad-spectrum antimicrobial epiphytic and endophytic fungi from marine organisms: isolation, bioassay and taxonomy[J]. Mar Drugs, 2009, 7(2): 97-112.
高程海, 夏家朗, 梁考云, 等. 北部灣海洋植物及其共附生微生物次级代谢产物研究进展[J]. 广西植物, 2022, 42(8): 1259-1272.
王聪, 杜为胜, 杨朝龙, 等. 涠洲岛火山口真菌的分离及次级代谢产物鉴定[J]. 菌物学报, 2023, 42(2): 553-561.
Yoshihito S, Takehiro S, Fumiaki S, et al. Isolation of a Phomoxanthone A derivative, a new metabolite of tetrahydroxanthone, from a Phomopsis sp. Isolated from the mangrove, Rhizhopora mucronata[J]. Nat Prod Commun, 2013, 8(12): 1735-1737.
Els?sser B, Krohn K, Fl?rke U, et al. X‐ray structure determination, absolute configuration and biological activity of phomoxanthone A[J]. Eur J Org Chem, 2005, 0(21): 4563-4570.
He F, Han Z, Peng J, et al. Antifouling indole alkaloids from two marine derived fungi[J]. Nat Prod Commun, 2013, 8(3): 329-332.
Tibrewal N, Tang Y. Biocatalysts for natural product biosynthesis[J]. Annu Rev Chem Biomol, 2014, 5: 347-366.
Vala A K. Marine-derived fungi: Potential candidates for anticancer compounds[M]. Marine Niche: Applications in pharmaceutical sciences, 2020: 145-158.
Nalin R G R, Savitri K N, Jayasinghe L, et al. Secondary metabolites produced by an endophytic fungus Pestalotiopsis microspora[J]. J Nat Prod, 2019, 9(6): 411-417.
Zhang W F, Ma J K, Zhang X X, et al. Immunosuppressive polyketides from the mangrove endophytic fungus Pestalotiopsis sp. HHL-14[J]. Chem Nat Compd, 2021, 57(6): 1130-1133.
张艳, 蓝桃菊, 廖仕同, 等. 广西北部湾红树植物内生真菌多样性[J]. 微生物学通报, 2017, 44(4): 783-794.
陈士林, 孙奕, 万会花, 等. 中药与天然药物2015~2020年研究亮点评述[J]. 药学学报, 2020, 55(12): 2751-2776.
收稿日期:2023-03-22
基金项目:广西自然科学基金(No. 2021GXNSFBA075036,No. 2021GXNSFBA220040);广西民族大学相思湖青年创新团队项目(No. 2021RSCXSHQN01);广西民族大学引进人才科研启动项目(No. 2020KJQD09);广西高等学校千名中青年骨干教师培育计划;广西硕士研究生创新项目(No. YCSW2023255)
作者简介:王玉妃,女,生于1999年,在读硕士研究生,研究方向为海洋药物化学。E-mail: Wyf19991126@126.com
*通信作者,E-mail: wangcong123206@163.com
