紫甘薯响应盐胁迫的转录组分析及调控网络发掘
2023-12-26鞠好庆范维娟李茹月陈路路陆新露马秋香
鞠好庆, 范维娟, 孙 哲, 乔 宇, 李茹月, 陈路路, 陆新露, 张 鹏, 马秋香*
(1.中国科学院分子植物科学卓越创新中心 植物分子遗传国家重点实验室,上海 200032; 2.上海辰山植物园 上海市资源植物功能基因组学重点实验室,上海 201602; 3.泰安市农业科学院,山东 泰安 271000)
甘薯储藏根富含淀粉,茎叶可食用,是全球重要的粮食、蔬菜、饲料和工业原料作物,兼具保健作用和药用价值,综合利用价值非常高.甘薯具有产量高、稳产性好、耐逆境能力强等诸多优点,可在多种生态环境下种植[1-2].根据联合国粮农组织(FAO)近10年的统计,我国是全球甘薯种植面积和产量最大的国家,年产量逾5 000万t.土壤盐渍化和次生盐渍化导致可耕地面积大幅度减少,阻碍了农作物的生长,降低了作物的产量,严重制约着农业的可持续发展,已成为制约世界灌溉农业可持续发展和影响生态环境的重要因素.盐碱地在我国分布广泛,全国约有1亿hm2盐碱地,其面积超过我国陆地总面积的10%[3],并有加剧的倾向,严重影响了国家的粮食安全.甘薯根系发达,茎蔓匍匐生长并且再生不定根的能力很强,有很强的抗贫瘠和抗风性能力,可在含盐量0.5%的盐渍荒地上栽植[4-5].因此,研究甘薯耐盐相关的代谢途径,了解它响应盐胁迫的分子机制,对于增加土地的利用率和筛选抗盐甘薯品种具有重要意义.
甘薯为同源异源六倍体(2n=6x=90),基因组高度杂合[6].早期国内外关于甘薯耐盐性相关的研究主要集中在品种筛选[4-5]和生理指标鉴定方面[7].甘薯基因组测序的完成促进了耐盐相关功能基因的挖掘和鉴定[6],结合高通量转录组分析,为挖掘和鉴定植物的优异功能基因奠定了基础[8].对盐胁迫和对照条件下的甘薯二倍体盐生野生近缘种、紫甘薯进行转录组分析,挖掘到大量盐胁迫响应相关的功能基因[9-10].分析假厚藤与厚藤甘薯耐盐近缘种的转录组发现,MAPK信号通路相关基因和WRKY、ERF(ethylene responsive factor)转录因子与耐盐性正相关[11-12].盐胁迫的榕薯转录组分析表明,淀粉和蔗糖代谢通路、Ca2+通路中的基因受到明显诱导表达,并且NAM-ATAF1/2-CUC2、ERF等基因表达差异明显[13].这些转录组分析为开展甘薯耐盐胁迫研究奠定了基础.
紫甘薯富含花青素和多酚类物质,是目前重要的功能性食品[14-15].为了进一步提高紫甘薯的应用范围,本研究对日本紫甘薯品种‘Ayamurasaki’进行盐胁迫处理,对不同时间点样品的表型和生理指标进行分析测定,并进行转录组分析,获得差异表达基因和代谢通路,分析差异表达的转录因子并构建共表达网络,研究结果可为分析紫甘薯的耐盐胁迫响应及分子调控机制等提供依据.
1 材料与方法
1.1 材料
供试材料为日本紫甘薯品种‘Ayamurasaki’(绫紫),离体试管苗由中国科学院分子植物科学卓越创新中心薯类生物技术研究组保存.
1.2 方法
1.2.1 盐胁迫处理选取长势一致,生长2个月的甘薯盆栽苗,利用200 mmol·L-1NaCl溶液浇灌处理,分别在0、1、6、24 h收获根系,用于相关生理生化指标的测定和高通量转录组分析,每组样品3个生物学重复.
1.2.2 总RNA提取、cDNA文库构建、高通量测序总RNA提取、cDNA文库构建及高通量测序委托华大基因完成.对获得的原始序列去接头和低质量序列,组装获得转录本信息,与参考基因组(http://public-genomes-ngs.molgen.mpg.de/index.html?org=Ipomoea+batatas&db=ipoBat3&hgsid=4735)比对,对获得的转录本进行注释.
1.2.3 差异表达基因筛选与GO(gene ontology)功能和KEGG路径(kyoto encyclopedia of genes and genomes pathway)显著性富集分析利用DESeq软件,以差异倍数|log2Fc|>1(Fc为Fold Change)和错误发现率(false discovery rate,FDR)<0.001为标准,进行差异表达基因的筛选.将筛选到的差异表达基因进行GO功能注释和KEGG路径分析.采用TBtools软件[16]绘制差异表达基因的表达热图,构建转录因子调控网络.
1.2.4 甘薯生理生化指标测定过氧化氢(H2O2)含量测定:取1 g叶片加入10 mL体积分数为0.1%预冷的TCA溶液,冰浴研磨,匀浆液12 000g离心15 min.取1 mL上清,添加1 mL 100 mmol·L-1磷酸盐缓冲液(PBS)(pH为7.0),2 mL KI(1 mol·L-1),摇匀,静置10 min,于390 nm波长处测定OD值(紫外分光光度计).根据标准曲线求得H2O2含量.
采用氮兰四唑NBT光化还原法[17]测定叶片超氧化物歧化酶(superoxide dismutase,SOD)的活性.
以3%磺基水杨酸提取叶片的游离脯氨酸(proline,Pro),采用茚三酮法[18]测定其含量.
脂质过氧化的程度以丙二醛(malondialdehyde,MDA)的含量表示,按照文献[19]的方法测定其含量.
2 结果与分析
2.1 盐胁迫下甘薯生理生化指标的测定
盐胁迫可使甘薯的生理生化指标,如H2O2、SOD、Pro、MDA等发生一系列的变化.200 mmol·L-1NaCl盐胁迫处理后发现,随着处理时间的延长,紫甘薯根中H2O2的含量持续升高(图1a);而SOD的活性则先上升后下降,在6 h到达最高值(图1b);Pro含量先降后升,在6 h降到最低,24 h已显著高于对照(图1c);MDA的含量则逐渐升高(图1d);各个指标在不同处理时间与对照相比,差异均显著(处理1 h的Pro含量除外).结果表明,随着盐胁迫处理时间的增加,甘薯根部细胞膜受损程度逐渐加剧,体内发生一系列的胁迫响应.
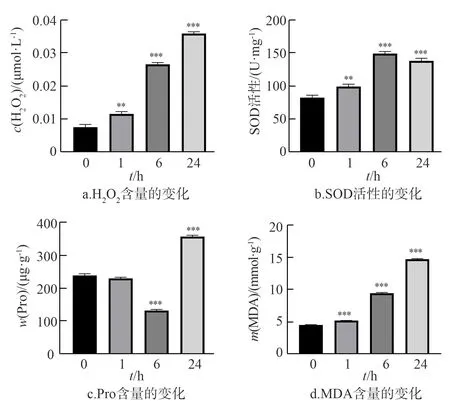
图中数据为3次重复的平均值±标准差,显著性差异采用t检验,**,***分别为差异显著(P<0.01)和极显著(P<0.001).
2.2 差异表达基因的筛选
利用DESeq软件对差异表达的基因进行筛选,共获得3 202个差异表达基因,其中877个基因上调,2 325个基因下调.与对照组0 h相比,处理6 h后,基因表达响应最为显著,297个基因特异性上调,2 079个基因下调;处理24 h后,差异表达基因最少,共计239个;42个基因在3个时间点均呈下调表达趋势,具体见图2.
2.3 差异表达基因的KEGG 路径富集分析
为进一步研究差异表达基因是否参与特定的代谢通路,对其进行KEGG路径富集分析.结果表明,差异表达基因共涉及117条通路.与0 h相比,盐胁迫处理1 h涉及106条通路,6 h涉及114条通路,24 h涉及64条通路.取各个处理组富集程度最显著的10条通路绘制柱状图(图3).当Q<0.05时(Q值是以FDR校正的P值),盐胁迫1 h时有7条显著表达的代谢途径,主要是代谢(ko01100)、苯丙烷生物合成(ko00940)、植物昼夜节律(ko04712)、光合作用(ko00195)等途径,分别属于新陈代谢与生物体系统2大类;盐胁迫6 h有9条显著表达的代谢途径,主要是次级代谢物生物合成(ko01110)、代谢(ko01100)、脂肪酸代谢(ko00071)与丙酸代谢(ko00640)等途径,全部属于新陈代谢大类;盐胁迫24 h有14条显著表达的代谢途径,主要是次级代谢物生物合成(ko01110)、苯丙烷生物合成(ko00940)、类黄酮生物合成(ko00941)与代谢(ko01100)等途径,也全部属于新陈代谢大类.

Fig.2 Comparison analysis of differentially expressed genes (DEGs) at different time points after NaCl treatment

纵轴,富集的通路;横轴,柱越高代表此通路受盐胁迫影响越大(下同).
2.4 差异表达基因的GO分析
对差异表达基因进行GO富集分析发现,相对于0 h,盐胁迫1 h的处理组有184个差异表达基因参与了9个GO功能分类项,其中10个差异表达基因参与“生物学过程”中的1个分类项,123个差异表达基因参与“分子功能”中的3个分类项,65个差异表达基因参与“细胞组分”中的5个分类项;盐胁迫6 h的处理组有672个差异表达基因参与了28个GO功能分类项,其中125个差异表达基因参与“生物学过程”中的14个分类项,266个差异表达基因参与“分子功能”中的7个分类项,490个差异表达基因参与“细胞组分”中的7个分类项;盐胁迫24 h的处理组有125个差异表达基因参与了18个GO功能分类项,其中50个差异表达基因参与“生物学过程”中的4个分类项,103个差异表达基因参与“分子功能”中的11个分类项,23个差异表达基因参与“细胞组分”中的3个分类项(图4).
由图4知,在“生物学过程”中,“响应胁迫”这一类别受影响极为明显,此外天冬氨酸家族氨基酸代谢过程也受到明显影响,可能与逆境下储存氮元素有关.在“分子功能”中,金属离子结合等功能受胁迫影响较大,可能与盐胁迫下,紫甘薯促进阳离子吸收,降低水势、减少水分析出有关.在“细胞组分”中,微体等膜系统受胁迫影响较大,暗示膜系统在高渗条件下被破坏.

纵轴,富集的GO条目.
2.5 参与“响应胁迫”的差异表达基因趋势分析
植物在逆境胁迫时会产生胁迫响应,GO富集分析表明,24 h盐胁迫的样本中生物学过程“响应胁迫”这一类显著富集,根据log2Fc对不同种类的基因进行热图绘制(图5).对差异表达的基因分析发现,活性氧(ROS)清除的相关基因、蛋白合成与降解的相关基因、水分胁迫蛋白的相关基因、离子平衡与转运蛋白的相关基因及信号转导与调控的相关基因均受到显著诱导表达(图5).ROS清除的相关基因均表现出上调趋势,其中铁超氧化物歧化酶(FeSOD)和多酚氧化酶(PPO)基因受诱导最为显著(图5a).P4H10(prolyl 4-hydroxylase 10)为胶原蛋白合成中的一种关键酶,参与蛋白质合成与降解,其基因显著上调表达.表达泛素化相关蛋白的E2泛素结合酶(ubiquitin-conjugating enzyme,UBC)和E3泛素连接酶(ubiquitin-protein ligase,UBPL)的基因也受到明显诱导(图5b).参与水分运输的水通道蛋白,如质膜内在蛋白基因(plasmamembraneintrinsicprotein1-4,PIP1-4)、液泡膜内在蛋白基因(tonoplastintrinsicproteins1-4,TIP1-4)和小分子碱性膜内在蛋白基因(smallandbasicintrinsicproteins2-1,SIP2-1)等也明显受到诱导上调表达(图5c).参与离子平衡与转运的蛋白LAZ1(lazarus 1)是1个具有DUF300保守结构域的跨膜蛋白[20],在盐胁迫下基因显著上调表达(图5d).表明在盐胁迫条件下,紫甘薯的细胞内发生了一系列的响应,以适应盐胁迫造成的伤害.
在参与盐胁迫响应的信号转导与调控的相关基因中(图5e),可以看到有6类共18种转录因子出现明显的差异表达,包括5个ERF、3个MYB(my elob lastosis)、4个WRKY、2个NAC、3个bZIP(basic-leucine zipper)、1个ARF(auxin response factor)类转录因子.其中ERF家族以上调为主,MYB家族以下调为主.并且发现,激酶PEPKR2(phosphoenolpyruvate carboxylase-related kinase 2)、MEKK1(MAPK/ERK kinase kinase 1)等表达的基因也显著上调表达,暗示着它们极有可能正向调控紫甘薯的耐盐性.

所有基因使用log2Fc值进行比较,并聚类.图5 参与“响应胁迫”的差异基因表达分析
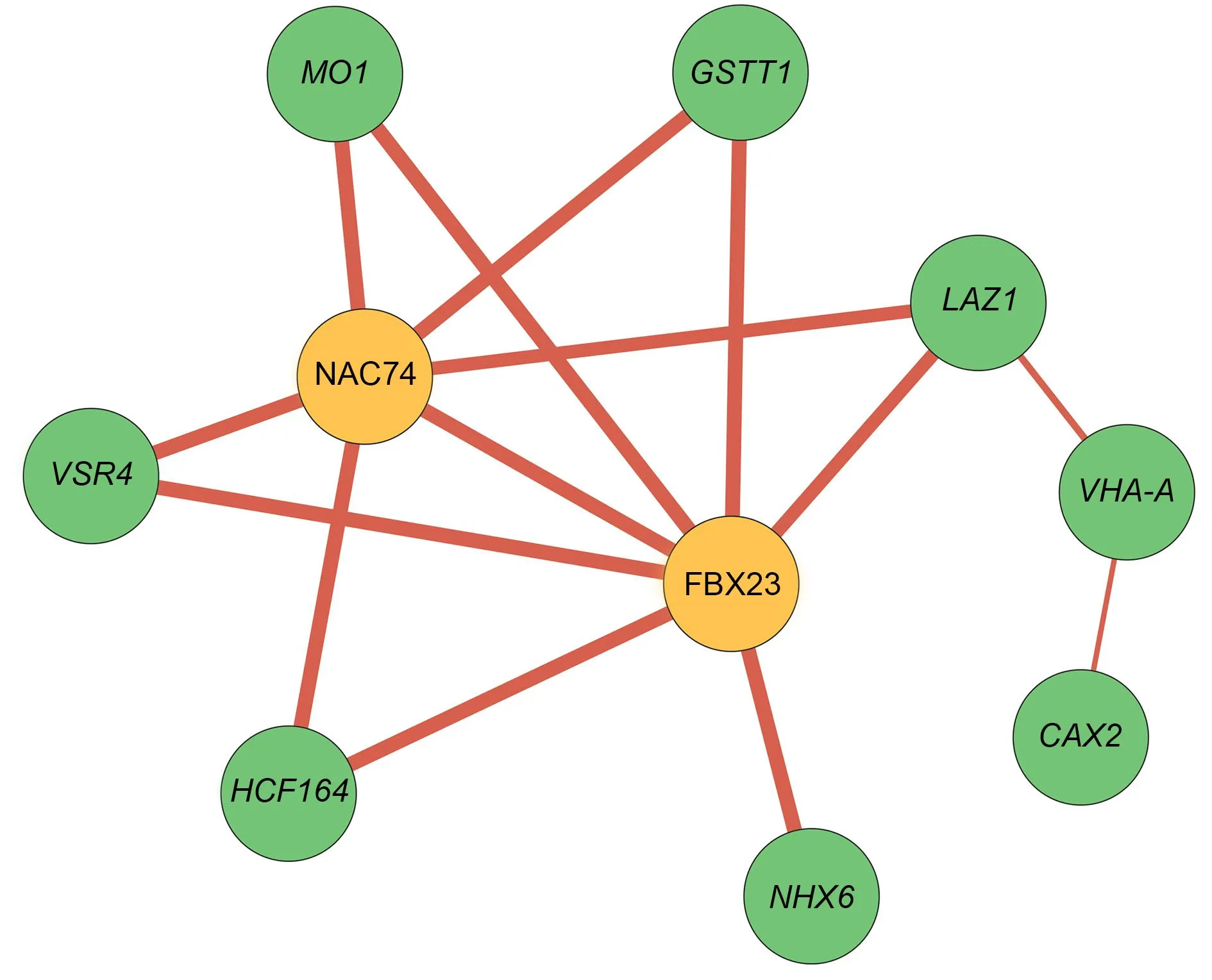
橙色表示参与信号与调控的核心调控因子,绿色表示具体行使功能的基因;红色线条表示正相关,线条的宽度与相关性绝对值成正比.皮尔逊积矩相关系数(r)阈值为|r|>0.98.图6 胁迫响应基因共表达网络Fig.6 Gene co-expression network of DEGs involved in "response to stress"
对这些显著表达的差异基因进行基因共表达网络分析,获得一个双核心网络(图6).网络中的基因受盐胁迫均上调表达.其中NAC家族的NAC74与F-box家族的FBX23位于核心位置,在响应盐胁迫过程中,可能通过调控单加氧酶MO1(monooxygenase 1)、谷胱甘肽巯基转移酶GSTT1(glutathione S-transferase T1)、液泡分选受体VSR4(vacuolar sorting receptor 4)、跨膜蛋白家族LAZ1与硫氧还蛋白超家族HCF164(high chlorophyll fluorescence 164)发挥作用.Na+/H+逆向转运蛋白NHX6(Na+/H+exchanger 6)仅受FBX23的调控,而LAZ1通过与液泡膜ATP合酶组分VHA-A(V-type proton ATPase catalytic subunit A)、阳离子交换蛋白CAX2(cation exchanger 2)相互作用响应盐胁迫.此网络为进一步分析甘薯根中盐胁迫响应调控机制提供了思路.
3 讨论
植物耐盐性是一个复杂性状,涉及多种细胞代谢活动,受多个基因的调控,其中消除毒害和维持离子平衡在植物的耐盐调控中具有重要作用.此外,环境和土壤因素强烈影响盐胁迫相关基因的表达[21].本研究对紫甘薯进行NaCl处理,通过高通量测序检测基因的差异表达,并对关键生物学过程及代谢途径进行富集分析,建立胁迫响应基因共表达网络.此研究为紫甘薯的耐盐调控机理及抗逆遗传改良提供了参考.
盐胁迫处理会导致大量ROS的产生,植物则通过ROS的清除应对这种非生物胁迫.ROS,如H2O2等具有双重作用,在低浓度时,可以作为重要的信号分子,通过诱导细胞内一系列保护和防御基因来保护植物;但它过量积累时,会引起细胞结构和功能的破坏[22-23].盐处理后,紫甘薯根系中H2O2明显积累(图1a),暗示盐胁迫引发氧化胁迫.超氧化物歧化酶活性逐渐增强(图1b),暗示ROS清除酶在保护细胞免受盐损伤方面起重要作用.转录组数据也表明,甘薯根部ROS清除相关的基因明显受到诱导上调表达(图5a),如过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、超氧化物歧化酶(ZnSOD和FeSOD)和多酚氧化酶,它们都具有较强的清除氧自由基等毒素的能力,保护细胞不受损伤.其中后两者的表达最为显著,推测它们在紫甘薯抗盐胁迫的响应中发挥更为重要的作用.GO富集分析也表明,与抗氧化相关的通路明显富集(图4),其中在“分子功能”显著表达的21条类别中有8类与氧化还原或抗氧化相关.这也与文献[24-25]的结果一致,如:拟南芥受盐胁迫也会导致ROS相关基因转录本增加[24];胡杨受盐胁迫会导致抗氧化酶被激活,NADPH氧化酶(reduced nicotinamide adenine dinucleotide phosphate oxidase)被抑制,以减少ROS[25].另外,Fan等[26]对碱胁迫的棉花进行转录组分析发现,次级代谢途径中有关ROS清除的基因明显高表达,以消除ROS来提升棉花的耐碱性;Dalal等[27]对盐胁迫下小麦基因亚型Raj3765进行转录组分析发现,它通过上调抗氧化防御基因,如谷胱甘肽过氧化物酶基因(glutathioneperoxidase7,GPX7)、APX3等,显著提升耐盐性,促进根系生长.
高盐和干旱胁迫对植物造成的一个主要伤害是引起渗透胁迫.水通道蛋白(Aquaporin,PIP或TIP)在细胞水分转运中起重要作用,植物的质膜和液泡膜上都有水通道蛋白.盐胁迫下,紫甘薯根部有多个水通道蛋白受到显著诱导,包括PIP1-4、PIP2-3、TIP3、TIP1-4、SIP2-1等,表明水孔蛋白可能通过调控根部水分的运输响应盐胁迫(图5c).将苹果中的MdPIP1;2基因转入拟南芥后发现,盐胁迫下MDA及钠离子积累较少,转基因拟南芥表现出较强的耐盐性[28].在干旱或盐分条件下,参与细胞渗透保护的胁迫响应基因在ZmPIP1;1过表达植物中上调表达,过表达植株的抗旱性和耐盐性增强[29].而在拟南芥中过表达大豆GsTIP2;1基因则会抑制拟南芥对盐和脱水胁迫的耐受性[30].这些研究证实了水通道蛋白在盐胁迫响应中发挥不同的作用[28-30].
植物对逆境胁迫的适应性反应之一是维持正常的蛋白质合成与降解.水稻中过表达OseIF-1(eukaryotictranslationinitiationfactor1)可调节离子积累和细胞内氧化还原状态,从而提升转基因植株的耐盐性[31].泛素和泛素结合蛋白在逆境条件下通过蛋白酶的作用来降解受损伤的蛋白质,增强植物对盐胁迫的抵抗能力[32-33].具有泛素受体和转运蛋白功能的OsDSK2a(dominantsuppressorofKAR2)在盐胁迫下表达受抑制,其通过影响GA(gibberellic acid)代谢抑制植物生长[34].盐胁迫处理紫甘薯后,翻译起始因子eIF5A2、延伸因子LOS1(low expression of osmotically 1)、泛素相关蛋白酶E1泛素激活酶(ubiquitin-activating enzyme,UBA1)、胶原蛋白合成关键酶P4H10等相关基因受诱导显著上调表达(图5b).推测甘薯可能通过增加蛋白质的合成能力和迅速降解受损和变性的蛋白来达到抗盐的目的.
盐胁迫使植物质膜受到破坏,大量的Na+涌入细胞,也破坏了植物体内原有的电势平衡.植物获得耐盐性的一个很重要的策略就是在胁迫条件下重建离子平衡.各种离子运输蛋白是重建离子平衡的决定因素.植物质膜H+-ATPase、液泡膜H+-ATPase、P-type ATPase和H+-PPase均具有维持细胞质内pH值稳定、为细胞吸收和转运营养物质及离子提供质子驱动力的生理功能,Na+的外排和区隔化也都依赖跨膜电化学势梯度提供能量.本研究中的转录组结果表明,盐胁迫条件下,参与离子平衡与转运的基因NHX6和跨膜蛋白基因LAZ1表达显著上调,而高亲合性K+转运蛋白基因(high-affinityK+transporter,HKT6)表达明显下调(图5d).Fan等[35]研究发现,甘薯中共表达拟南芥来源的Na+/H+逆向转运蛋白基因NHX1可以显著提升甘薯的抗盐胁迫能力及产量,这与本研究结果一致.在棉花植株中,沉默GhNHX3D的表达可增加叶片、茎和根中Na+的水平,降低根系中K+的含量,提高盐的敏感性[36].Oh等[37]对正常和盐处理的冰花表皮盐泡细胞进行转录组分析,发现高亲合性K+转运蛋白HKT1和同源KT1表达的基因在盐胁迫过程中受诱导下调表达.一般而言,HKT蛋白会将植物体内木质部汁液的Na+外排,以降低盐胁迫对植物的伤害;然而,大麦HvHKT1;5干扰株系比野生型耐盐性提升,Na+从根部运输减少,K+/Na+浓度更大[38].玉米中的ZmLAZ1-4作为锌转运蛋白调节锌的稳态[39],这也暗示IbLAZ1极有可能参与某种金属离子的转运,从而促进甘薯对于盐胁迫的抵抗.
植物中的多种转录因子在抗盐胁迫等各种生理活动中具有重要的作用.bZIP蛋白不仅参与种子贮藏基因的表达、光形态的发生以及器官建成的控制,而且还参与植物对脱落酸(ABA)、逆境胁迫、光和发育中各种信号的反应.在胁迫条件下,bZIP转录因子可以与ABA诱导基因启动子区域的ABRE(ABA-responsive element)结合来调节下游靶基因的表达[40].在小麦中,TabZIP15可能与烯醇化酶TaENO-b(Triticumaestivumenolase-like b)进行互作,参与糖酵解和糖异生途径的调节,从而提高小麦的盐胁迫耐受性[41].本文转录组分析结果表明,bZIP1、bZIP4和bZIP1-2等多个bZIP蛋白基因受诱导表达(图5e),表明bZIP蛋白在紫甘薯的盐胁迫响应中起重要作用.锌指蛋白不仅对植物的发育起重要调节作用[42],而且对植物抵抗逆境胁迫起关键作用.研究发现,盐胁迫下拟南芥、水稻及棉花中的锌指蛋白基因表达量增加[43-44].WRKY是一类含有锌指结构的转录因子,大量研究集中于WRKY在病菌侵染时的功能分析[45],也有研究发现,WRKY家族能对生物和非生物胁迫产生应答,在干旱和盐胁迫反应中起作用[46].番茄SlWRKY8可能通过诱导DREB2A(dehydration-responsiveelementbinding)和AREB(ABAresponsiveelementbindingprotein)等基因的表达,提升植株的耐盐性.盐胁迫下水稻基因OsWRKY54在根中快速高表达,其缺失导致地上部Na+积累量增加,水稻植株对盐胁迫的敏感性增强[47].在甘薯盐胁迫的样本库里(图5e),WRKY的表达发生了显著变化,暗示着WRKY在甘薯盐胁迫响应过程中起作用.MYB类转录因子是一类非常重要的转录因子,大量存在于植物中,是植物转录因子中最大的家族之一,它们通过参与多种基因的转录调节,在植物的生长发育、生物和非生物胁迫反应等过程中发挥着重要的作用[48-49].苦荞麦(Fagopyrumtataricum(L.) Gaertn.)的基因FtMYB22通过ABA依赖途径抑制多种生理生化反应,减弱植物耐盐与耐干旱能力[50].本研究显示盐胁迫下,紫甘薯根部的MYB类转录因子下调表达,推测其可能在甘薯胁迫响应中起负调控作用.
拟南芥中F-box蛋白家族EST1(Enhancedsalttolerance1)基因突变后显示出耐盐表型,与野生型相比,NaCl处理后Na+含量显著降低,Na+/H+逆向转运蛋白活性更高[51].在拟南芥中过表达甘薯的NAC3基因,可通过ABA途径与泛素化来增强植株的耐盐性[52].转录因子共表达网络表明,NAC家族的NAC74与F-box家族的FBX23位于核心位置(图6),推测它们通过调控参与氧化还原的基因GSTT1和参与离子平衡与转运的基因VHA-A、LAZ1等,从而正向调控紫甘薯的耐盐性.
4 结语
本文对紫甘薯进行盐胁迫处理,分析其生理指标的变化,通过高通量测序鉴定差异表达基因,分析了KEGG路径与GO富集通路,并对“响应胁迫”中的差异表达基因进行深度挖掘,鉴定在盐胁迫过程中显著表达的基因并构建网络,为进一步探究紫甘薯耐盐分子机制和挖掘耐盐关键基因提供了理论依据.
感谢上海辰山植物园杨俊博士在原始数据分析过程中给予的大力帮助.
