柠檬酸-壳聚糖还原体系制备抗氧化纳米铜
2023-12-26张彦霏章伟伟林秀仪徐江涛胡传双
张彦霏 章伟伟 林秀仪 徐江涛 胡传双
(华南农业大学材料与能源学院,广东 广州 510642)
随着电子信息技术的飞速发展,电磁辐射防护逐渐受到世界各国的广泛关注。电磁辐射不仅干扰电子设备的正常使用,而且危及通信设施的信息安全[1]。有研究表明[2-4],长期处于一定强度的电磁辐射下,人体细胞会被杀死,进而影响免疫系统,身体健康受到极大伤害,会造成记忆力减退、高血压、视力减退、婴儿畸形流产、癌症等危害。木质材料具有易加工、可循环使用、可生物降解等特点[5-7],可将木质原料作为基体,采用不同的加工方式使其与不同的导电单元复合制备木质电磁屏蔽材料,并通过吸收、反射和折射电磁波达到电磁屏蔽的效果[8]。李坚[9]课题组在桦木单板表面进行化学镀,得到镍合金电磁屏蔽材料。Shi等[10]对桦木胶合板进行电镀处理,得到具有良好导电率和电磁屏蔽性能的木基涂层材料,屏蔽性能可达60 dB。Xi等[11]以天然木材为基材,脱脂后再高温碳化,制得高性能的多孔生物质热解碳(PBPC)材料,其具有规则有序的多孔结构,最大反射损耗(RL)可达-68.3 dB。Wei等[12]通过在木材表面喷涂碳化钛多层纳米片(MXene)超薄片制备MXene涂层木材,制得的复合材料具有较高的电导率,在8.2~12.4 GHz下可获得31.1 dB的电磁干扰屏蔽性能。
金属系导电涂料是一种功能性涂料,一般采用纳米金属作为导电颗粒,喷涂或刷涂后即可形成导电涂层,从而具备屏蔽电磁波干扰的功能[13]。与纳米银相比,纳米铜的导电性与之相近,但成本低,不足之处在于纳米铜颗粒的活性高,极易发生氧化生成氧化铜,导致电阻率上升[14]。甚至有研究表明,未经抗氧化处理的纳米铜分散液在空气中静置8 h后就会被氧化为铜离子态[15]。为提高纳米铜的抗氧化性,保证其良好的导电性能,一般会在纳米铜颗粒表面包覆其他金属或有机物。相比于包覆金属法,有机物包覆纳米铜的成本低、操作简单,更易推广和应用[16-17]。Sarwar等[18]以柠檬酸对纳米铜颗粒进行表面改性,使用海藻酸钠进行辅助,可以赋予铜优异的抗氧化性。方亚超等[19]采用苯并三氮唑的复配剂改性微米级树枝状超细铜粉,结果表明,当热处理低于200 ℃时改性纳米铜未被氧化,保持了其较低的电阻率。张小敏等[20]以苯并三氮唑/柠檬酸复配改性纳米铜粉,使其具有较好的抗氧化性能,用于导体浆料时适应性较好。
当前有机物包覆纳米铜方案一般先制备出纳米铜颗粒,然后再进行表面改性以获得较好的抗氧化性。分步操作增加了工序,且纳米铜颗粒在分离提纯过程存在氧化的风险。本研究选用柠檬酸溶解壳聚糖作为铜离子的还原体系,通过液相还原法一步制备抗氧化纳米铜颗粒,即制备和抗氧化处理同步进行。柠檬酸和壳聚糖不仅可以与铜离子形成稳定的络合物,有助于在还原过程中生成小尺寸的纳米铜颗粒,而且还能附着在产物纳米铜上,提高纳米铜的抗氧化性。除此之外,该方法所制备的纳米铜颗粒在多次水洗之后仍可保持较好的抗氧化性能。此外,柠檬酸的加入也有利于缩短反应时间,从而提高反应效率,并且柠檬酸还能和木材中部分羟基发生酯化反应生成交联网络[21],有利于后续与木基材料复合。
1 材料与方法
1.1 试验材料
1.2 试验设备
表1 试验设备信息Tab.1 Test equipment information
1.3 制备方法
配置一定浓度柠檬酸溶液100 mL,边搅拌边加入3 g壳聚糖粉末,在60 ℃下搅拌30 min,使其完全溶解。待溶液透明,向其中逐滴缓慢滴加10 wt%的硫酸铜4 g,升温至80 ℃搅拌30 min,此时溶液为蓝绿色。再向溶液中逐滴滴加15 wt%的次亚磷酸钠至所需浓度,继续搅拌反应,并在不同反应时间取少量液体用于测试。反应结束后取出,使用相应浓度的柠檬酸溶液稀释后,离心分离得到纳米铜(CuNPs),并用去离子水洗涤4次以上,样品气干12 h后保存备用。
1.4 表征方法
1.4.1 紫外/可见光谱法
使用紫外可见分光光度计,在反应不同时间取样进行测试,测试过程保持相同的溶液稀释倍数,选择仪器波长范围为190~1 000 nm,以监测合成过程中不同铜种类的演化及其相应的氧化态。
1.4.2 粒径及电位分析
使用激光粒度分析仪,按照操作步骤,在去离子水分散体系中,确保PDI(聚合物分散性指数)小于1 的情况下,表征铜颗粒的粒径分布以及Zeta电位数值,循环3次取平均值。
1.4.3 热稳定性分析
使用X射线粉末衍射,选择扫描范围为20°~80°,速度为10°/min,检测改性前后晶体的特征峰值,从而判断是否氧化;使用同步热重分析仪,在空气条件下,以10 ℃/min的速度加热至600 ℃,评估纳米铜在表面改性前后的热稳定性能。
1.4.4 纳米铜结构、形貌分析
(3)利用MnO2和浓盐酸混合加热制Cl2的离子方程式为遇水剧烈反应,液面上产生的白雾是盐酸小液滴,并有刺激性气味的SO2气体产生,反应的化学方程式为。
利用场发射扫描电子显微镜(FE-SEM)及能谱分析(EDS),能谱关注Cu、C、N、O元素,研究纳米铜的化学结构、尺寸和形貌。
1.4.5 表面形貌及保护层分析
利用场发射高分辨扫描/透射电子显微镜(HRS/TEM)及能谱EDX线元素分析(EDX)以及电子衍射(SAED),高分辨使用默认倍数,能谱使用线扫,关注Cu、C、N、O元素,研究样品表面是否被包裹以及被包裹的物质成分所含元素;利用X射线光电子能谱仪(XPS),研究所制备纳米铜颗粒表面形貌及保护层的结构成分。
2 结果与分析
壳聚糖与酸溶液中的H+反应生成具有氨基官能团的质子化壳聚糖,将这些官能团引入壳聚糖主链中,可以提高其在水中的溶解度。同时,由于柠檬酸的弱酸性,可帮助溶解壳聚糖。研究表明,壳聚糖溶液浓度越大,对铜离子的络合作用增强[22],有助于获得小粒径的纳米铜颗粒。然而,过高的壳聚糖浓度会导致体系黏度过大,不利于分散、反应及后续分离等操作。因此,本研究仅探讨还原剂次亚磷酸钠用量、柠檬酸浓度对制备的纳米铜形态以及热稳定性的影响。
2.1 次亚磷酸钠用量对纳米铜的影响
次亚磷酸钠还原硫酸铜制备纳米铜的反应式如(1)所示,还原剂用量直接影响纳米铜的制备。试验中硫酸铜浓度为0.25 wt%,壳聚糖浓度为3 wt%,柠檬酸浓度梯度为5 wt%,调节次亚磷酸钠浓度梯度分别为0.3 wt%、0.6 wt%、0.9 wt%、1.2 wt%。于反应中不同时间取样,用紫外/可见光谱法分析表征纳米铜的生成情况,纳米铜颗粒在大约580 nm的表面等离子体共振条件下出现特征峰[23]。
如图1所示,随着反应时间的增加,溶液的颜色从浅绿色逐步变为砖红色。在0.3 wt%浓度时,溶液为红棕色。随着次亚磷酸钠浓度从0.6 wt%提高到1.2 wt%,反应得到的铜纳米颗粒从深红色转变为浅红色。紫外光谱在580 nm处出现了一个峰值,证实了铜纳米颗粒的存在[23]。研究表明,使用水溶性氨基粘土基质悬浮液合成的铜纳米颗粒为红色[24]。峰值的强度随着次亚磷酸钠的浓度增大而增大,表明生成的铜纳米颗粒粒径更小。由图1可见,当次亚磷酸钠浓度大于0.6 wt%时,反应时间为0.5 h和1 h时,无论次亚磷酸钠的浓度是否增加,特征峰峰值均略有下降,但特征峰位置不受影响。而在次亚磷酸钠的浓度为0.3 wt%,反应时间为1 h时,特征峰急速下降,几近消失,表明纳米铜发生了氧化现象。

图1 不同次亚磷酸钠浓度条件下合成纳米铜的UV/vis吸收光谱Fig.1 UV/vis absorption spectra of copper nanoparticles synthesized at different concentrations of sodium hypophosphite
Zeta电势是决定纳米颗粒悬浮液稳定性的关键参数。不同次磷酸钠浓度制得的产物Zeta电位和粒径如图2所示。对于物理稳定的纳米颗粒悬浮液,仅通过静电斥力稳定,至少需要±30.0 mV的Zeta电位[25]。由图2a可以看出,不同浓度还原剂合成的铜悬浮液,铜纳米颗粒具有正的表面电荷,Zeta电位值随亚磷酸钠溶液浓度的上升呈上升趋势,从0.3 wt%时的+26.9 mV增加到1.2 wt%时的+39.4 mV,表明该体系足以维持稳定纳米铜的胶体分散。由图2b可知,当次磷酸钠浓度大于0.6 wt%时,随着次磷酸钠浓度的增加,纳米铜的水合直径快速下降,从微米级变为纳米级。当次亚磷酸钠浓度为1.2 wt%时,纳米铜的水合直径最小,约为669 nm。当次亚磷酸钠浓度为0.3 wt%时,其纳米铜的粒径与1.2 wt%浓度时的相当。由图1及电位分析可知,这可能源于铜的团聚或部分氧化,进而导致在溶液中不稳定,发生部分沉淀,测得的粒径偏小。因此,过量的还原剂对于提供还原环境,并保证纳米铜的分散十分重要。后续试验采用浓度为1.2 wt%的次亚磷酸钠制备纳米铜。
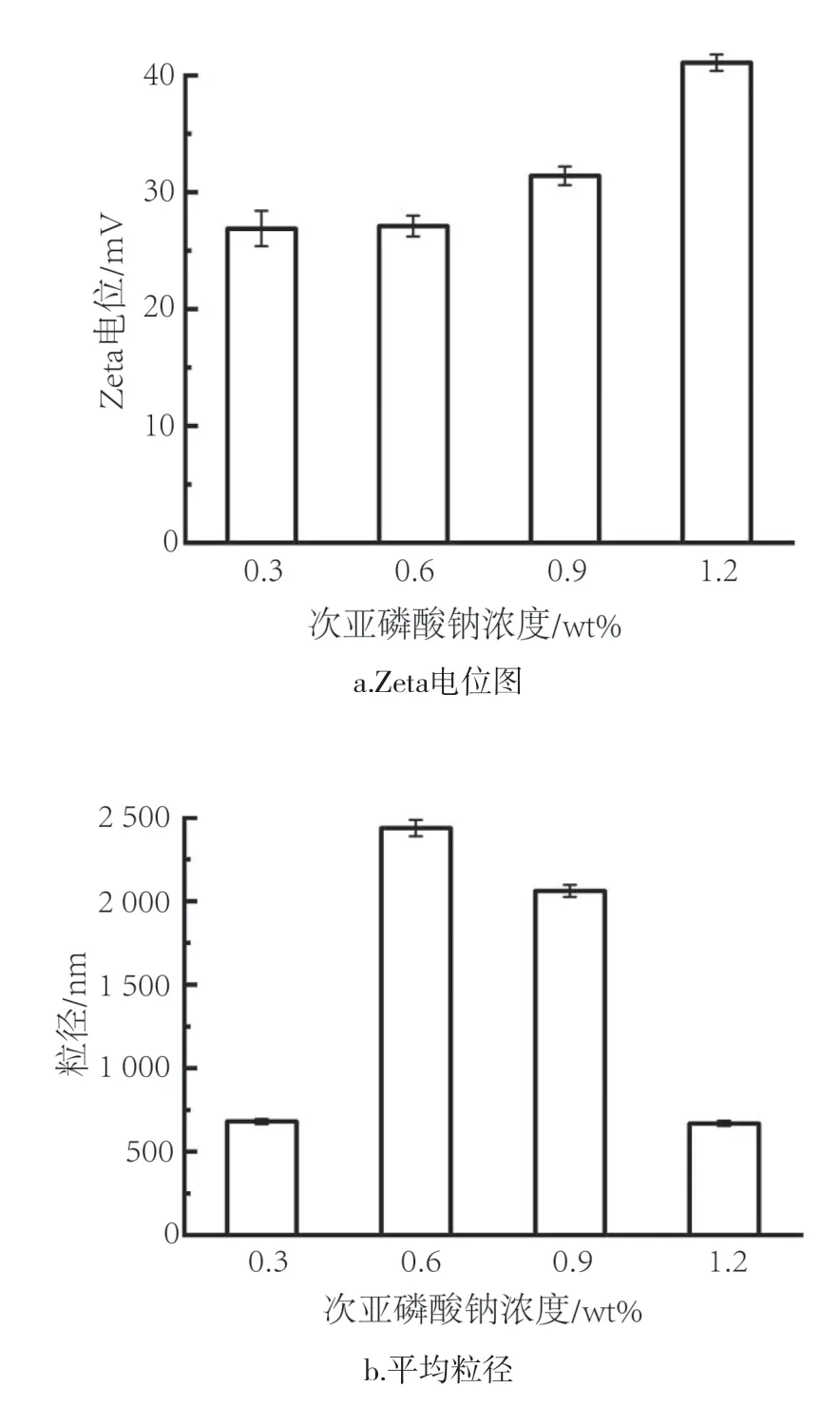
图2 不同次亚磷酸钠条件下合成的铜的Zeta电位与平均粒径Fig.2 Zeta potential and average particle seize of copper synthesized under different conditions of sodium hypophosphate
2.2 柠檬酸浓度对纳米铜结构及热稳定性的影响
不同柠檬酸浓度所制备的纳米铜的UV-Vis如图3所示。图3a以乙酸溶解壳聚糖作为对比,从图中可以看出,未加柠檬酸时,直到3 h处才出现纳米铜的特征吸收峰,而且随着反应时间的增加,溶液的颜色从浅蓝逐步变为灰褐色。这主要是因为纳米铜部分氧化生成黑色的氧化铜,此时纳米铜的特征峰也有所减弱。对比可知,柠檬酸-壳聚糖体系提高了铜的还原速度,5 min左右在580 nm处就出现铜的吸收峰,表明该体系可以大幅加速纳米铜的生成。随反应时间的增加,铜的特征吸收峰增强,在1 h时达到最高点。这是因为随着柠檬酸浓度的增大,反应速度加快,纳米铜的特征吸收峰也愈发明显。
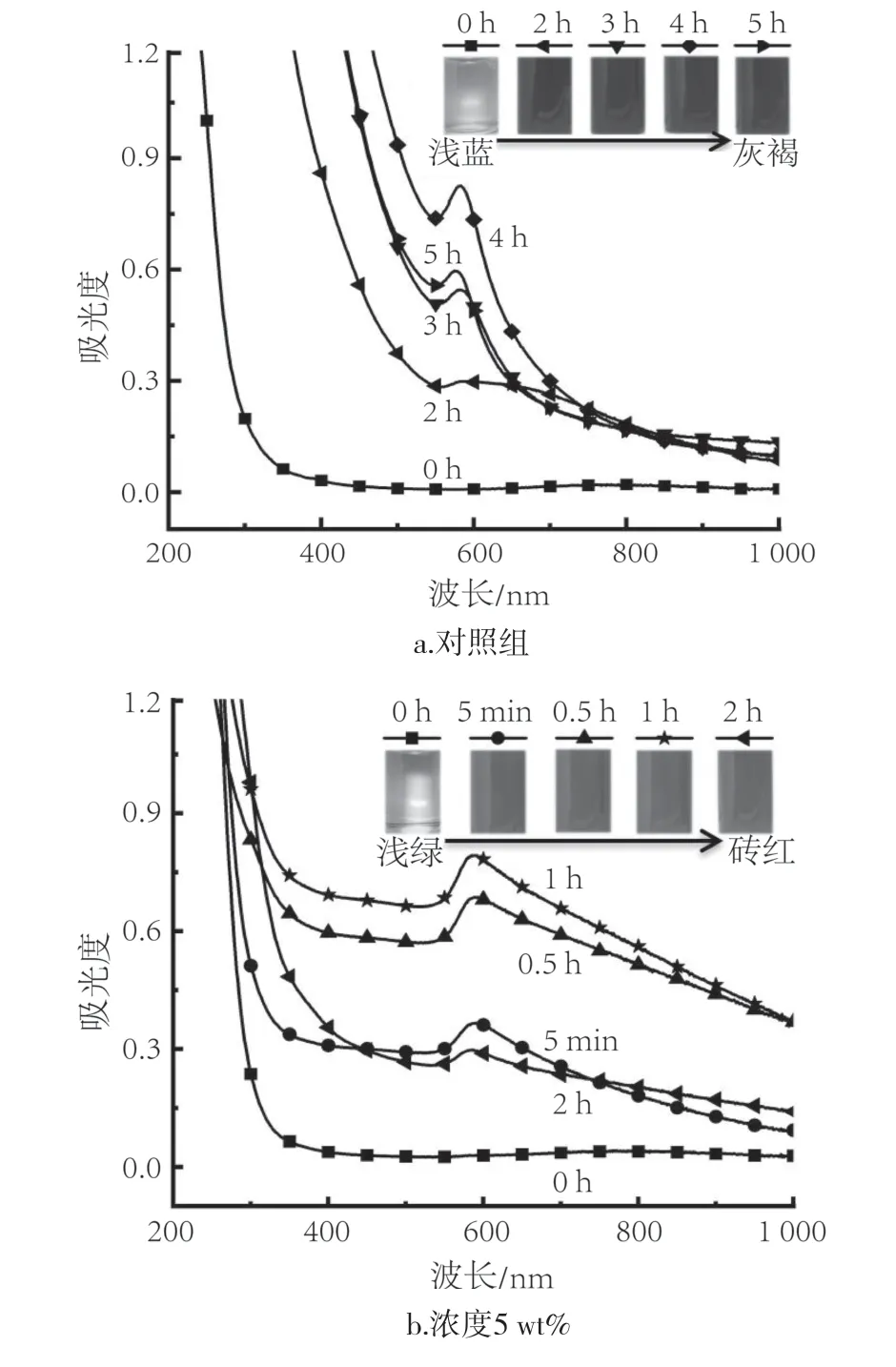
图3 不同柠檬酸浓度下纳米铜的UV/Vis吸收光谱Fig.3 UV/Vis absorption spectra of copper nanoparticles at different citric acid concentrations
不同柠檬酸浓度所制备产物的Zeta电位和粒径如图4所示。从图4a中可以看出,随着柠檬酸的加入,体系的Zeta电位均在40.0 mV左右,表明柠檬酸的加入已经足够稳定,对于纳米铜在溶液中的稳定分散影响不大。由图4b可知,反应时间0.5 h时的纳米铜粒径均大于1 h的,且纳米铜的水合直径随着柠檬酸浓度的增加而减小。当柠檬酸浓度达20 wt%时,纳米铜的水合直径最小,约为527 nm。
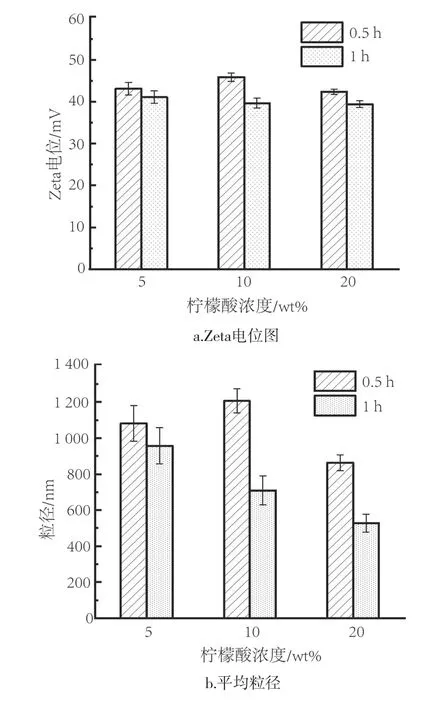
图4 不同柠檬酸浓度条件下不同时间合成的铜的Zeta电位与平均粒径Fig.4 Zeta potential and average particle seize of copper synthesized at different time under different citric acid concentrations
2.3 纳米铜产物结构及热稳定性分析
使用最优条件制备产物的SEM、平均粒径分布和SEM-EDS如图5所示。铜粉的SEM图显示,纳米铜为不规则颗粒状,分布均匀,粒径约为162 nm。SEM-EDS(图5c)表明,纳米铜颗粒的组成非常均匀,且其表面有一定含量的碳和氧元素,表明纳米铜颗粒表面可能附着了少量的柠檬酸或壳聚糖。
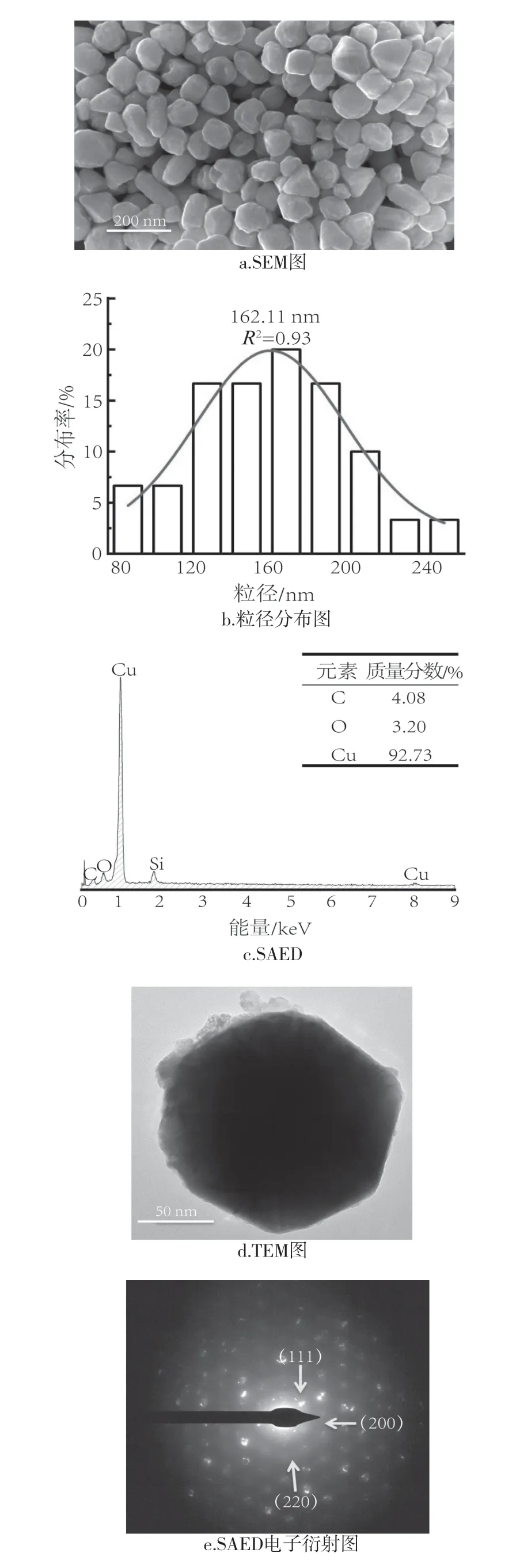

图5 最优条件下合成的铜及水洗后的纳米铜各项性能Fig.5 Properties of copper synthesized under optimal conditions and corresponding to individual copper nanoparticle of nano-copper after washing and drying
为验证这一点,本研究使用场发射透射电子显微镜研究了纳米铜颗粒的表面根形貌及结构成分,如图5d所示。从图中可以看出,所制备的纳米铜颗粒表面被一层物质(浅灰色外壳)吸附。图5f为单个粒子的线元素分布图,可见纳米铜颗粒中心的Cu信号最强,颗粒边缘的Cu信号减弱,而C、O、N信号不变,这可能是由于纳米铜颗粒表面均匀包裹着一层柠檬酸-壳聚糖混合物。非晶态、单一和多结构材料通常分别由连续的同心、斑点和连续的环状图案表示。从图5e中可以看到,合成的纳米铜颗粒具有多晶性,由(111)、(200)和(220)晶面组成[26]。
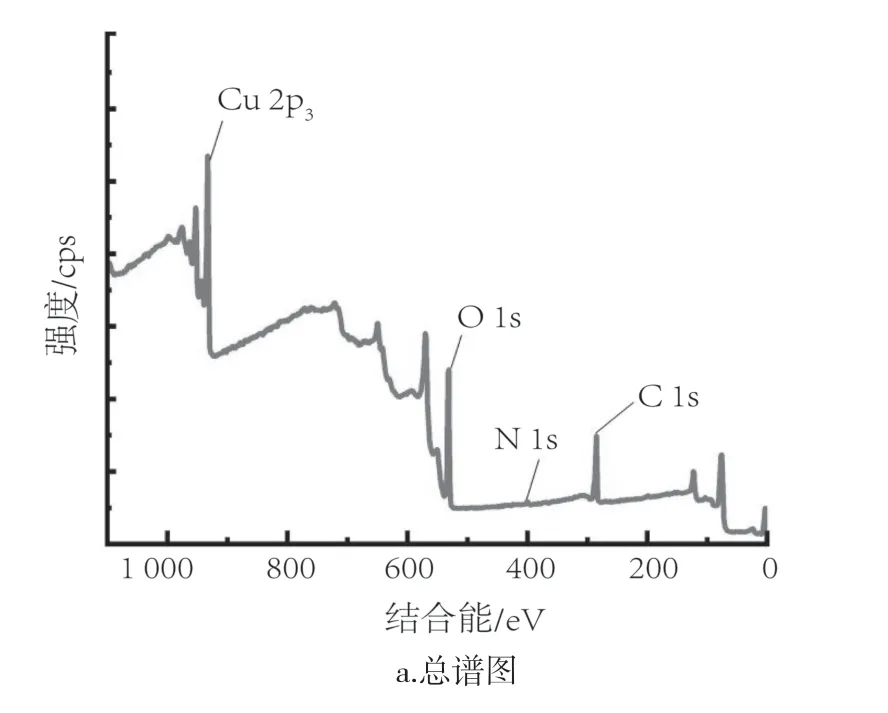
使用X射线光电子能谱(XPS)对纳米铜颗粒的表面组成进行分析,如图6所示。由图可知,纳米铜颗粒包含Cu、C、N、O等元素,其中N元素结合能峰的出现证实了壳聚糖的存在,其光发射峰贡献为398.4 eV(C—N/CO—N)[27]。Cu 2p谱图在结合能为932.6 eV(Cu 2p3/2)和952.2 eV(Cu 2p1/2)处显示两个峰,这是典型的金属铜峰[28]。C 1s谱可以拟合为结合能的不同贡献之和,分别为285.0 eV(C—C/C—OR)、286.4 eV(C—NH2/C—OH)和288.9 eV(COOR/C=O)。由于COO—是柠檬酸所特有的,这证明了柠檬酸的存在[29]。另一个发射峰402.2 eV可归因于氨基官能团。O 1s谱可以拟合为532.6 eV(C=O/COOR/C—OH)和533.3 eV(COO—)结合能的不同贡献之和,COO—基团的存在,验证了柠檬酸的存在。综上,XPS结果表明,柠檬酸-壳聚糖在铜颗粒表面具有很强的化学吸附作用。同时,柠檬酸与壳聚糖的混合物具有耐水性及塑性强等特点[30-33],可以更好地附着在纳米铜颗粒表面。因此,可以有效防止纳米铜颗粒的氧化,从而使得在柠檬酸-壳聚糖体系下制备的纳米铜具有良好的抗氧化性能。
在优化条件下制备的纳米铜的XRD和TG-DTG如图所示。由图7a可见,纳米铜衍射图谱中出现了与典型的纯铜面心立方(fcc)晶体结构的晶面衍射峰相对应的峰位,其衍射角2θ值分别为43.4°(111),50.3°(200)和74.1°(220),与铜的标准卡片(JCPDS04-0836)一致,峰型窄且尖锐[34]。空气中保存30 d的纳米铜以及经过160 ℃热处理2 h的纳米铜均未出现氧化铜或氧化亚铜的出峰。纳米铜颗粒在空气中极易发生氧化,Sarwar等[35-36]将制备的纳米铜用柠檬酸处理,仍会出现轻微的氧化峰。本研究中的纳米铜表面覆盖了柠檬酸-壳聚糖的混合物保护层,表现出优异的抗氧化性。样品在多次水洗后,经160 ℃热处理前后,在衍射角2θ为43.4°,50.3°和74.1°处可见明显的铜特征峰,未见氧化铜或氧化亚铜特征峰。因此,制备的样品具有良好的抗氧化性及耐水洗性。这可能与柠檬酸-壳聚糖混合物在纳米颗粒表面构建的覆盖层有关,同时还具有抗氧化的效果。从TGA曲线(图7b)可以看出,当温度达到200 ℃时,纳米铜的TGA曲线一直保持平直状态,质量变化较小;而在250 ℃时,增重率为0.5%,表明纳米铜发生了部分氧化。可见,在柠檬酸-壳聚糖体系下制备的纳米铜具有良好的抗氧化性能。

图7 最优条件下合成的铜的XRD和TG-DTG曲线Fig.7 XRD and TG-DTG curves of copper synthesized under optimal conditions
3 结论
本研究选用柠檬酸溶解壳聚糖作为铜离子的还原体系,以五水硫酸铜为铜源,次亚磷酸钠为还原剂,成功制备出粒径小且稳定均一、抗氧化性能优异的纳米铜颗粒,主要得出以下结论:
1)壳聚糖和柠檬酸对铜离子的络合作用在反应过程中可以更好地分散纳米铜,在次亚磷酸钠浓度为1.2 wt%、柠檬酸浓度为20 wt%条件下合成的纳米铜为不规则颗粒状,粒径在162 nm左右。
2)壳聚糖和柠檬酸附着在纳米铜颗粒表面可形成抗氧化保护层,从而提高纳米铜颗粒的抗氧化性,室温下在空气中放置30 d后、水洗或低于160 ℃环境中均未出现氧化现象。
