褐飞虱RNAi显微注射中麻醉方法的比较
2023-12-25张朋稳段至柔刘常权彭英传张万娜肖海军
张朋稳,段至柔,刘常权,彭英传,张万娜,肖海军,张 晶*
(1.江西农业大学农学院昆虫研究所,南昌 330045;2.北京林业大学草业与草原学院,北京 100083)
褐飞虱Nilaparvatalugens(Stål) 属于半翅目飞虱科(Hemiptera: Delphacidae),是我国乃至亚洲许多国家水稻上的首要害虫,极具破坏性[1]。RNA 干扰(RNA interference,RNAi)技术是由双链RNA(dsRNA)介导的,由特定酶参与的特异性基因沉默,在转录后水平上阻断基因的表达[2]。RNAi 作为一种简便、高效的基因干扰技术,除了可以作为昆虫基因功能研究的重要技术手段外,也是极具潜力可应用于害虫防治的技术[3]。目前已有多种dsRNA 传递方法被应用于昆虫的RNAi 研究中,如显微注射、转基因植物、喂食法和浸泡法等[4]。显微注射dsRNA 是一种非常有效且能够准确评估靶基因功能的研究方法,已被广泛应用于果蝇、蝗虫、褐飞虱、粉虱等多种昆虫的基因功能研究[5-8]。
在显微注射试验中,由于褐飞虱等昆虫个体较小、活力强,通常需要在实施显微注射前先进行适当麻醉,以便于显微注射操作。同时也有利于减少显微注射对试验对象的损伤,待昆虫复苏并进一步做生物表型测定研究。适当麻醉的要求,一方面需要确保足够的麻醉时间和合适的苏醒时间,另一方面要尽可能降低麻醉过程对试验昆虫苏醒后活力的负面影响。因此,探究适宜RNAi 显微注射试验的麻醉方法和条件,对于提升RNAi 显微注射试验的效率、可操作性,以及降低显微注射后靶标试验昆虫表型测定误差具有重要实践价值。
有关果蝇麻醉方法的研究比较多,在实验室中常用来麻醉果蝇的麻醉剂有:二氧化碳、短时低温冷冻、乙醚、乙酸乙酯、三乙胺(TEA)等[9-14]。有研究表明,二氧化碳麻醉会降低黑腹果蝇Drosophilamelanogaster的寿命、繁殖力、交配成功率,并增加德国小蠊Blattellagermanica的发育时间,损伤其运动和取食行为[15-19]。高浓度二氧化碳气体会干扰触发中枢神经系统功能的信号,低浓度时会刺激觅食行为[12,20]。在低温(非致命)下,昆虫会失去运动能力,称为冷昏迷[21]。昆虫冷昏迷的机制可能与昆虫体内维持电位的钠钾泵活性依赖于温度有关[22]。低温麻醉的效果,取决于收集或饲养昆虫的环境以及昆虫对冷应激的反应,并且低温可能显著改变试验昆虫的某些生理和行为[13,23,24]。乙醚和三乙胺均是果蝇的有效麻醉剂,但由于它们有较强的挥发性,易对人体致害,因此试验操作明显受到限制[16,25,26]。
目前RNAi 显微注射试验中麻醉稻飞虱的方法主要有二氧化碳和冰上麻醉[27,28]。高浓度二氧化碳必须在压力条件下储存,对设备和操作都有严格要求,需要考虑安全和成本问题[22,25]。因此,探究一种简便、安全、稳定的褐飞虱麻醉方法对开展RNAi 研究有重要意义。我们分别比较了不同比例的乙醚与乙酸乙酯混合液、冰上麻醉对褐飞虱的麻醉效应,评估了麻醉时间,苏醒时间以及不同麻醉方法在显微注射试验中对褐飞虱存活率的影响,以探明适宜RNAi 显微注射试验中麻醉褐飞虱的方法。
1 材料与方法
1.1 供试昆虫与寄主植物
从江西农业大学科技园试验稻田采集褐飞虱,在感性水稻品种台中本地1 号(Taichung Native 1,TN1,IRRI Acc.No.00105)上长期饲养。饲养温室的条件为光周期16L∶8D,温度(26±0.5)℃,湿度70%~80%。
本试验供褐飞虱取食的水稻品种为日本晴(Nipponbare,IRGC Acc.No.136196),2021 年5 至10 月种植于江西农业大学科技园试验稻田。冬季将水稻材料转移至温室中培养,培养条件:光周期14L∶10D,温度为(28±2)℃,湿度70%~80%。
1.2 液体麻醉
试验设置5 种液体麻醉处理,分别是乙醚(T1)、乙醚∶乙酸乙酯(3∶1)(T2)、乙醚∶乙酸乙酯(2∶1)(T3)、乙醚∶乙酸乙酯(1∶1)(T4)和乙醚∶乙酸乙酯(1∶2)(T5)。从培养箱中取出饲养的褐飞虱,置于实验台室温下静置适应20 min。选用指形玻璃试管(直径=3 cm,高=15 cm),在距离试管底1 cm处作上标记,作为小麻醉室(直径=3 cm,高=1 cm)。随机吸取10 头活力好、龄期一致的褐飞虱,轻轻转入试管底部。用移液枪吸取不同剂量的液体麻醉剂,注入棉塞的中央,然后迅速将棉塞推移至试管底部标记1 cm 位置,使棉塞下端的弧线最低点与离瓶底1 cm 的横线相交,并开始以秒表计时,室温下麻醉。待供试全部褐飞虱麻醉后(以褐飞虱失去攀附试管壁、亦不能爬行跳跃等活动能力为准),记录时长为麻醉时间[29]。同时,拔掉棉塞停止麻醉,立即将褐飞虱转入塑料培养皿(直径=9 cm,高=1.5 cm)中,观察褐飞虱苏醒情况,记录第1 头褐飞虱和全部供试褐飞虱苏醒所需时间(以褐飞虱能够爬动离开晕倒位置为苏醒标准)[13,30](图1)。本试验设置五种液体麻醉剂组合,每种麻醉剂组合设置3 种不同剂量,每组试验至少重复3 次。

图1 液体麻醉处理褐飞虱流程示意图Fig.1 Schematic diagram of liquid anesthesia treatment of brown planthopper
1.3 低温麻醉
试验设置3 种低温麻醉处理,分别是冰浴低温20 min(T6)、40 min(T7)和60 min(T8)。将麻醉管(10 mL 带盖离心管)埋入冰中预冷。随机吸取10 头活力好的龄期一致的褐飞虱,轻轻吹入离心管底部,继续将离心管埋入冰中,保持低温麻醉不同时间(20,40,60 min)。然后将褐飞虱转入室温塑料培养皿(直径=9 cm,高=1.5 cm)中,观测褐飞虱苏醒活动,记录第1 头及所有供试褐飞虱苏醒所需时间(以褐飞虱能够爬动离开晕倒位置为苏醒标准)[14,31,32]。本试验设置3 组冰上麻醉时间,每组试验至少重复3 次。
1.4 体外合成dsRNA
以测序正确GFP-Pearly101载体质粒为模板,利用在线网站Primer-BLAST设计GFP基因特异性dsRNA合成引物,正向和反向引物 5′端分别加上 T7 启动子序列EGFP-414-T7-F/R(EGFP-414-T7-F:TAATACGA CTCACTATAGGGAAGTTCAGCGTGTCCGG;EGFP-414-T7-R:TAATACGACTCACTATAGGGCACCTT GATGCCGTTCTTC),PCR 扩增片段经凝胶回收试剂盒(Vazyme,DC301-01)纯化后,连入PEASY-T3载体(TRAN,CT301)。按照上述方法转化大肠杆菌Trans1-T1(TRAN,CD501)中,通过菌落PCR 检测和测序,以序列正确的重组载体质粒为模板,继续以含T7 启动子序列基因引物EGFP-414-T7-F/R 扩增,凝胶回收试剂盒(Vazyme,DC301-01)纯化后得到dsRNA 合成的模板(浓度不低于200 ng/μL)。使用T7 RiboMAX™ Express RNAi System 试剂盒(promega,P1700),按照操作说明书合成并纯化dsRNA 至5000 ng/μL,然后以每管10 μL 分装,-80 ℃保存备用。
1.5 显微注射dsRNA 与存活率测定
选取褐飞虱3 龄若虫,每10 头作为一组处理,以200 μL 乙醚(T1)、乙醚∶乙酸乙酯(3∶1)(T2)、乙醚∶乙酸乙酯(2∶1)(T3)、乙醚∶乙酸乙酯(1∶1)(T4)和乙醚∶乙酸乙酯(1∶2)(T5)、冰上20 min(T6)、冰上40 min(T7)分别麻醉褐飞虱若虫。将不同处理麻醉后的褐飞虱转移至1.5%的琼脂固体平板上,在褐飞虱腹面的前中胸之间进行GFP-dsRNA 显微注射,以未麻醉未注射褐飞虱若虫为对照(CK)。显微注射后的褐飞虱转移至含有湿润滤纸和水稻嫩茎的培养皿中复苏0.5 h,将苏醒的褐飞虱转移至五叶期日本晴水稻上取食。从显微注射GFP-dsRNA 当天起,连续8 天观察记录每组处理稻苗上存活的褐飞虱数。处理后每组测定15 头褐飞虱存活率,每个处理至少设置3 个重复。
1.6 数据统计与分析
本研究中数据分析使用的软件是IBM SPSS Statistics 23 版本,采用单因素方差分析(One-way ANOVA)比较两组之间的差异,采用Tukey HSD 方法进行多重比较。
2 结果与分析
2.1 不同麻醉剂组合处理对褐飞虱成虫麻醉效应比较
试验结果表明,使用乙醚(T1)、乙醚∶乙酸乙酯(3∶1)(T2)、乙醚∶乙酸乙酯(2∶1)(T3)、乙醚∶乙酸乙酯(1∶1)(T4)和乙醚∶乙酸乙酯(1∶2)(T5)这五种液体麻醉剂麻醉褐飞虱成虫,每组均表现出随着麻醉剂量(100、300、400 μL)增加,平均麻醉时间显著缩短(F=65.30,df=2,P<0.01),第1 头褐飞虱苏醒时间和全部个体苏醒时间相应增加(F=1.066,df=2,P=0.352;F=1.224,df=2,P=0.303)(表1)。同时我们还发现,与其他麻醉组相比,当使用乙醚∶乙酸乙酯(1∶2)麻醉方式麻醉时,褐飞虱成虫的平均麻醉时间、平均第1 头苏醒时间和全部个体苏醒时间均显著增加(F=5.796,df=1,P<0.05;F=459.21,df=1,P<0.01;F=256.58,df=1,P<0.01),说明使用乙醚∶乙酸乙酯(1∶2)处理麻醉褐飞虱成虫,所需的苏醒恢复时间显著增加。
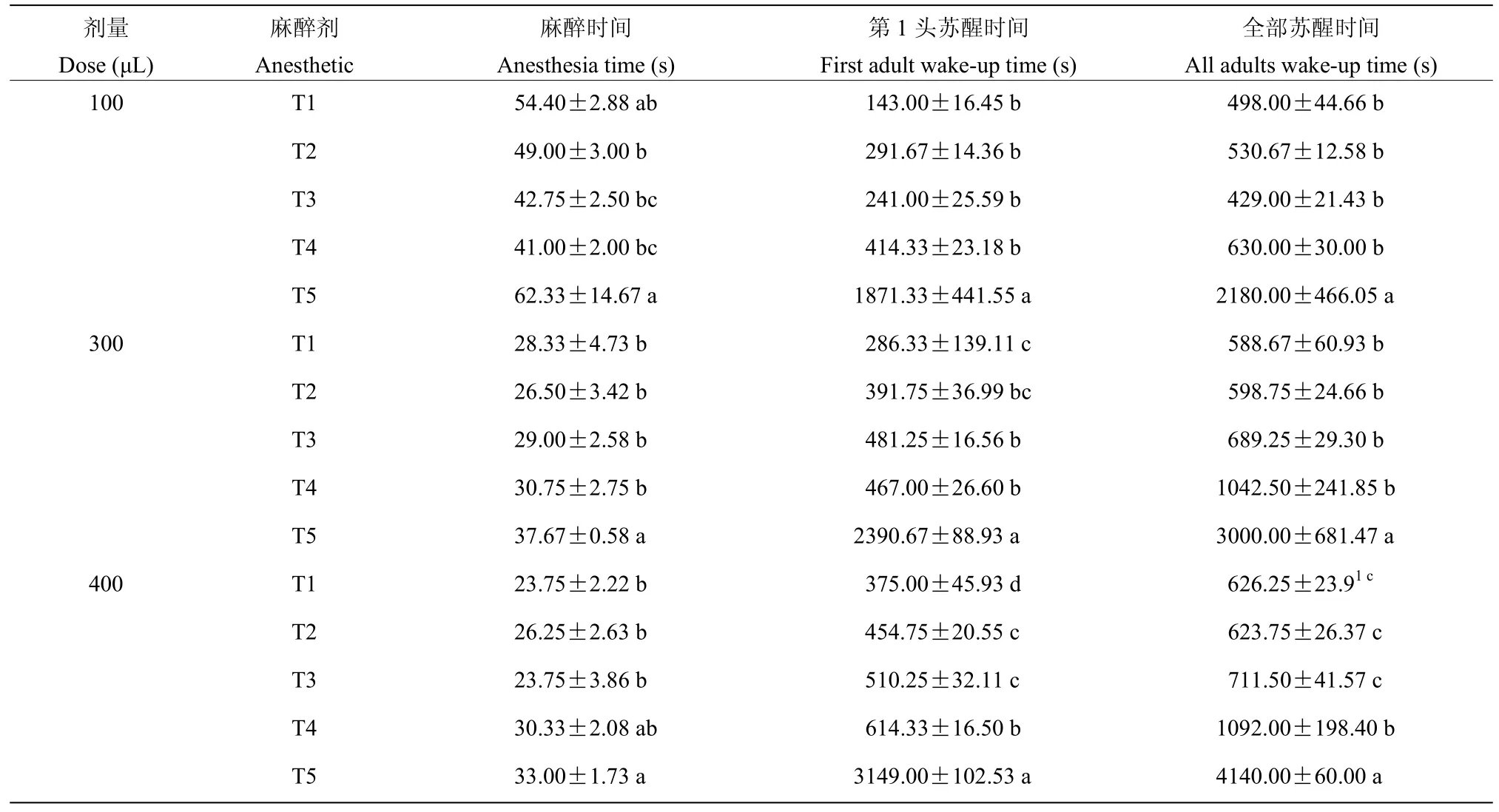
表1 不同麻醉剂处理对褐飞虱成虫的影响Table 1 Effects of different anesthetic treatments on the adults of brown planthopper
2.2 不同麻醉剂组合处理对褐飞虱若虫麻醉效应比较
分别选用100、200 和300 μL 剂量的乙醚(T1)、乙醚∶乙酸乙酯(3∶1)(T2)、乙醚∶乙酸乙酯(2∶1)(T3)、乙醚∶乙酸乙酯(1∶1)(T4)和乙醚∶乙酸乙酯(1∶2)(T5)五种麻醉剂处理褐飞虱若虫。结果表明,随着麻醉剂量的增加,平均第一头若虫苏醒时间和全部若虫苏醒时间均显著增加(表2)(F=8.45,df=2,P<0.01;F=3.83,df=2,P<0.01)(表2)。相比于其他麻醉处理组,当使用300 μL 剂量的乙醚∶乙酸乙酯(1∶2)麻醉剂处理褐飞虱若虫时,其第一头苏醒时间和全部褐飞虱若虫苏醒时间均显著增加(F=41.874,df=4,P<0.01;F=32.867,df=4,P<0.01)。
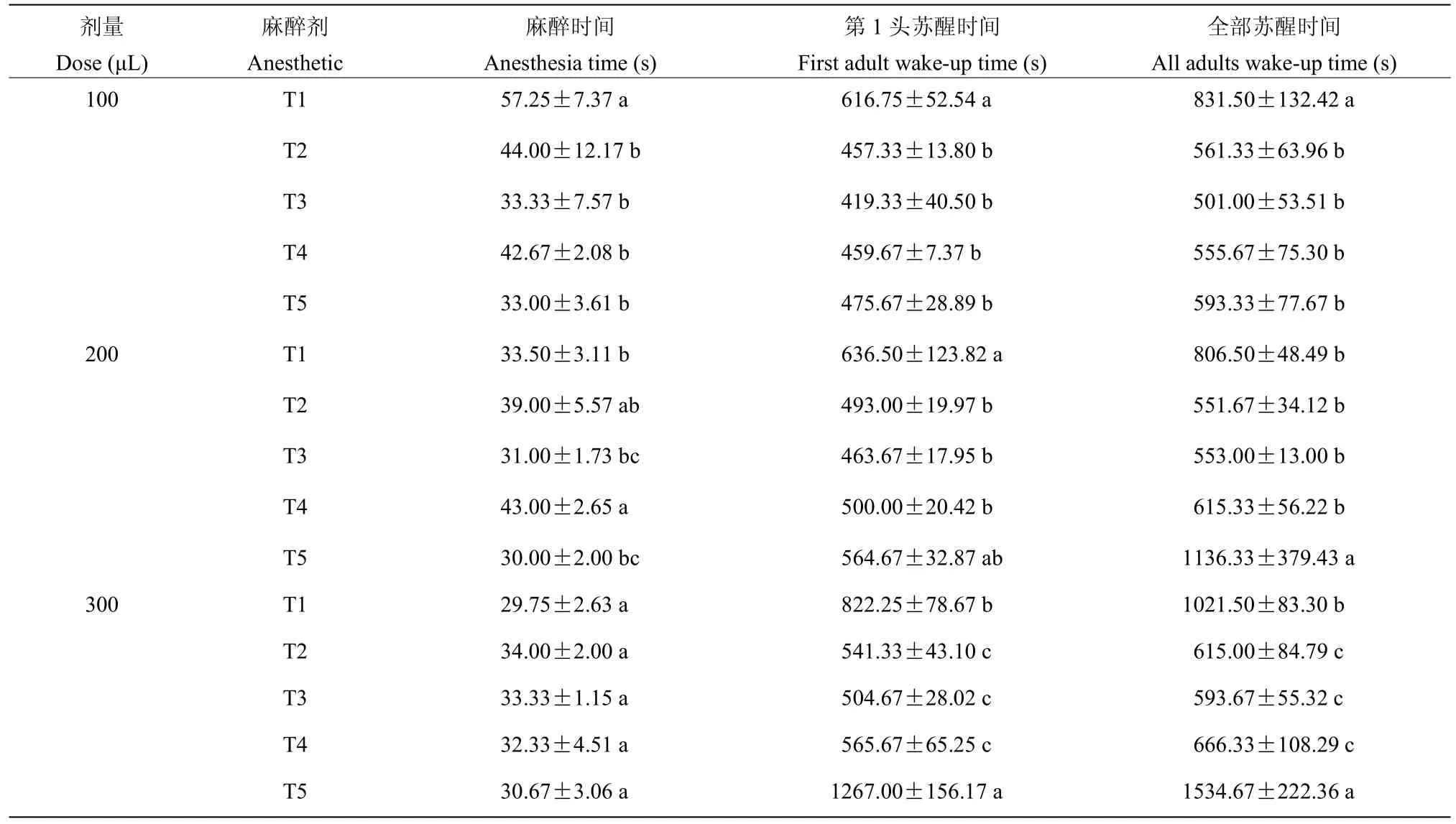
表2 不同麻醉方法对褐飞虱若虫的影响Table 2 Effects of different anesthetic treatments on the nymphs of brown planthopper
2.3 低温麻醉对褐飞虱的麻醉效应
试验选择不同低温处理时间梯度(20、40、60 min)的冰浴处理分别对褐飞虱成虫和若虫进行低温麻醉。结果表明,随着在冰上麻醉时间的增加,褐飞虱成虫、若虫的平均第一头苏醒时间和全部个体苏醒时间均显著延长。当冰浴低温麻醉时间增加至40 min 时,褐飞虱若虫第一头苏醒时间显著增加;当冰浴低温麻醉时间增加至60 min 时,褐飞虱成虫平均第一头苏醒时间才有显著增加(图2A)。无论成虫或若虫,冰浴低温麻醉时间增加至40 min 时,褐飞虱平均全部个体苏醒时间均显著性增加(图2B)。在相同处理下,褐飞虱若虫的苏醒时间显著比成虫延长,表明褐飞虱若虫对低温麻醉的敏感性更强。
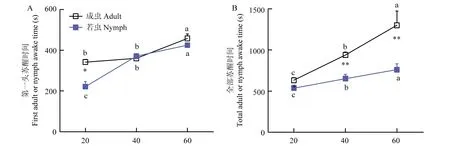
图2 不同低温麻醉处理对褐飞虱成虫和若虫苏醒时间的影响Fig.2 Effects of different low temperature anesthesia treatments on the recovery time of adults and nymphs of brown planthoppers
2.4 不同麻醉处理方法对显微注射后褐飞虱存活率的影响
为了测试褐飞虱不同麻醉处理后进行显微注射dsRNA 操作,并观测表型,基于上述不同麻醉处理方法对褐飞虱若虫麻醉效应比较的结果,在显微注射时选择200 μL 剂量麻醉剂组合和20 min、40 min 低温处理的褐飞虱若虫,以未处理褐飞虱为对照,观测了不同麻醉处理方法对显微注射后褐飞虱存活率的影响。结果表明,与对照(CK)相比,所有注射组褐飞虱若虫的存活率均有所降低,表明显微注射对褐飞虱可造成一定的负面影响,冰浴低温麻醉40 min 处理(T7)显著降低褐飞虱若虫的存活率。不同麻醉处理方法和处理后天数对褐飞虱的存活率有显著差异(Ptime*treatment<0.001)。其中,乙醚∶乙酸乙酯(1∶2)(T5)麻醉处理褐飞虱存活率与对照组(CK)最接近。各处理影响程度从小到大依次为乙醚∶乙酸乙酯(1∶2)(T5),乙醚∶乙酸乙酯(1∶1)(T4),乙醚(T1),乙醚∶乙酸乙酯(2∶1)(T3),乙醚∶乙酸乙酯(3∶1)(T2),冰上20 min (T6),冰上40 min(T7)(图3)。因此,醚酯混合物可作为RNAi 显微注射前麻醉褐飞虱的有效麻醉处理方法,推荐使用乙醚∶乙酸乙酯(1∶2)麻醉剂处理,对显微注射后褐飞虱的存活影响较小。

图3 不同麻醉处理方法对显微注射后褐飞虱存活率的比较Fig.3 Comparison of the survival rate of brown planthopper after microinjection by different anesthesia treatments
3 讨论
显微注射技术已被广泛应用于对褐飞虱的基因功能研究中[33]。在显微注射中,若褐飞虱麻醉时间过短,褐飞虱仍保留对注射刺激的应激能力,导致注射的dsRNA 无法完全进入虫体,影响基因的干扰效果;若麻醉时间过长,对虫体可能存在过麻醉伤害,不利于试验的准确性和稳定性。因此,建立一种安全、成本适宜且易于操作的可应用于显微注射褐飞虱的麻醉方法具有重要意义。
乙醚和乙酸乙酯是在果蝇和其他昆虫中应用较多的液体麻醉剂,麻醉时所需的装置简单,操作简便[11,29,34-36]。在本研究中探讨了乙醚和乙酸乙酯混合液以及冰上麻醉是否可以有效麻醉褐飞虱以及比较不同麻醉方法在显微注射试验中对褐飞虱存活率的影响。本研究在预试验中用纯乙酸乙酯麻醉褐飞虱成虫和若虫,均发现大部分褐飞虱长时间(2 h 以上)都没有醒来,说明纯乙酸乙酯并不适合用于显微注射试验中固定褐飞虱的麻醉剂,可能因为纯乙酸乙酯作为昆虫的窒息剂能对褐飞虱产生低毒性[37]。在应用乙醚∶乙酸乙酯(1∶3)比例处理麻醉褐飞虱的预试验中,也发现褐飞虱在麻醉后1 h 仍有90%以上个体无法正常苏醒。然而,通过比较不同配比的乙醚和乙酸乙酯混合液体麻醉剂,发现无论是乙醚,还是乙醚∶乙酸乙酯(3∶1)、乙醚∶乙酸乙酯(2∶1)、乙醚∶乙酸乙酯(1∶1)、乙醚∶乙酸乙酯(1∶2)都可以有效麻醉褐飞虱,表明一定浓度范围内的乙酸乙酯,可对褐飞虱起麻醉作用。麻醉剂中乙酸乙酯的浓度越高,褐飞虱成虫和若虫的苏醒时间均相应增加,表明乙酸乙酯起麻醉效应的时间比乙醚长,这与在果蝇中的麻醉效应相似[13]。同时发现与成虫麻醉结果相比,褐飞虱若虫对含较高浓度乙醚的麻醉剂更为敏感;褐飞虱若虫对含较高浓度乙酸乙酯的麻醉剂的敏感性不如成虫,体现在相同剂量的同一种麻醉剂下,成虫和若虫的苏醒时间差异,表明不同发育阶段的褐飞虱对同一种麻醉剂也会产生不同影响,这可能与不同麻醉剂的作用机制有关。使用不同方法麻醉固定褐飞虱若虫,进一步比较显微注射后褐飞虱的存活率差异,发现不同麻醉方法对褐飞虱若虫存活率的负面影响程度从小到大依次为乙醚∶乙酸乙酯(1∶2),乙醚∶乙酸乙酯(1∶1),乙醚,乙醚∶乙酸乙酯(2∶1),乙醚∶乙酸乙酯(3∶1),冰上20 min,冰上40 min,表明醚酯混合物可作为麻醉褐飞虱的有效麻醉剂,且使用乙醚∶乙酸乙酯(1∶2)麻醉剂对显微注射后褐飞虱的存活影响较小,原因可能是乙醚更容易挥发,乙酸乙酯的挥发性和刺激性更小且麻醉效应时间长[36]。另外,本研究发现冰上麻醉褐飞虱,方法简便,但比较耗费时间,在相同低温麻醉处理下,褐飞虱若虫的全部苏醒时间明显要比成虫的时间长,表明褐飞虱若虫对低温麻醉的敏感性更强。无论冰上麻醉20、40、60 min 均不造成褐飞虱死亡,然而当冰上麻醉时间为40 min 时,显微注射褐飞虱若虫复苏后死亡率较高,在预试验中冰上麻醉60 min 处理后显微注射褐飞虱,发现约90%若虫长时间(4 h)仍没有复苏,说明低温麻醉40、60 min 均不适合用于显微注射试验中麻醉褐飞虱,可能因为褐飞虱在长时间持续低温引起的应激状态下,进一步显微注射产生的伤害应激影响了褐飞虱的某些生理过程。
总之,本研究的试验结果表明乙醚和乙酸乙酯混合液可作为有效麻醉褐飞虱的麻醉剂,且使用乙醚∶乙酸乙酯(1∶2)麻醉剂对显微注射后褐飞虱的存活影响较小。乙醚和乙酸乙酯混合液麻醉所需装置简单,操作简便且安全性和稳定性较好,可为在实验室中褐飞虱麻醉方法的选择提供参考。然而乙醚和乙酸乙酯混合液对褐飞虱的生理和行为的具体影响,乙醚和乙酸乙酯混合液与二氧化碳的麻醉效应比较,以及乙醚和乙酸乙酯混合液与二氧化碳麻醉对显微注射后褐飞虱存活率的影响比较还需进一步深入研究。
