两种金小蜂类icarapin蛋白潜在致敏性的初步评价
2023-12-25曹昀珅叶恭银
曹昀珅,杨 义,方 琦,汪 芳,叶恭银
(浙江大学昆虫科学研究所/水稻生物育种全国重点实验室/农业部作物病虫害分子生物学重点实验室,杭州 310058)
寄生蜂是膜翅目寄生性昆虫,其物种丰富,寄主广泛[1],被广泛用于农业和卫生害虫控制,在生物防治领域作用显著[2,3]。寄生蜂在害虫生防应用中还具有安全性高的特点,几乎不会攻击寄主外的生物,更不蛰刺人畜,是重要的害虫天敌资源[2,4]。目前寄生蜂的应用以活体田间释放为主,但其高效大面积应用仍受到工厂化繁育及田间释放的规模限制[5]。寄生蜂毒液和唾液中蛋白种类丰富,可以作为天然的新型杀虫蛋白资源库[5-7]。已有成功案例表明利用基因工程技术可将毒液基因资源用于提高植物抗虫性或改良虫生真菌的杀虫效果[8,9],这为寄生蜂的应用提供了新的思路。
目前,有关寄生蜂的生理生化研究多集中于其寄生因子以及杀虫肽类[5]。随着测序技术的不断发展,越来越多的寄生蜂毒液或唾液蛋白组分被解析,其中存在有过敏原同源基因,如透明质酸酶、allergen 3、allergen 5、icarapin 等[10-12],具有潜在的应用风险。
Icarapin 是一类重要的致敏蛋白,最早于西方蜜蜂Apismellifera的毒液中分离得到[13]。与蜂毒过敏患者的血清杂交试验结果表明该蛋白有人畜致敏活性[14],症状表现为恶心、呕吐、哮喘、水肿等,严重时甚至会引发休克反应[15]。本实验室前期从蝶蛹金小蜂Pteromaluspuparum和丽蝇蛹集金小蜂Nasonia vitripennis唾液腺转录组及基因组中鉴定到icarapin 的同源基因[16,17],但其是否具有致敏性仍有待评估。蝶蛹金小蜂是蔬菜害虫菜粉蝶Pierisrapae、果树害虫柑橘凤蝶Papilioxuthus、玉带凤蝶P.xuthus等鳞翅目蝶类的蛹期优势寄生蜂[16];丽蝇蛹集金小蜂是多种卫生害虫的天敌,是重要的卫生害虫天敌资源[17];两种寄生蜂具有良好的应用潜力。为此,本研究在克隆、表达与纯化获得两种金小蜂类icarapin 蛋白的基础上,利用小鼠致敏模型对其进行了致敏性的初步评价,为有关寄生蜂毒液或唾液源杀虫活性蛋白的安全评价提供了参考。
1 材料与方法
1.1 供试昆虫
试验所用的蝶蛹金小蜂和丽蝇蛹集金小蜂均为野外采集后在室内经多代驯化后的实验室种群。2 种蜂的寄主分别是菜粉蝶蛹和家蝇Muscadomestica蛹。室内饲养的条件如下:温度(25±1)℃,光周期10L∶14D,相对湿度70%。羽化后的成蜂以无菌水配制的10%蜂蜜水饲喂,以延长寿命。2 种蜂及其寄主的饲养方法与张倩倩[18]和钱岑等[19]报道一致。
1.2 菌种与表达载体
DH5α和BL21(DE3)感受态细胞购自全式金生物科技有限公司。pET-28a(+)质粒购自宝日医生物技术有限公司。
1.3 试剂
TRizol 试剂购自宝日医生物技术有限公司。反转录试剂盒TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix 购自全式金生物技术有限公司。DNA 凝胶回收试剂盒购自北京擎科生物科技有限公司。ClonExpress® II One Step Cloning Kit 购自诺唯赞生物科技有限公司。特异性引物由尚亚生物技术有限公司合成。BugBuster® Master Mix 裂解液和cOmplete™ His-Tag 纯化树脂购自Merck 医药生物科技公司。Tris-MOPS-SDS Running Buffer Powder、SurePAGETM预制胶购自南京金斯瑞生物科技有限公司。IPTG、NaH2PO4、NaCl 和咪唑购自上海生工生物工程技术服务有限公司。小鼠的6×His-Tag 抗体和HRP 标记的山羊抗小鼠IgG 抗体购自南京金斯瑞生物科技有限公司。西方蜜蜂icarapin 蛋白准备以及小鼠的致敏注射和取血由杭州华安生物技术有限公司进行。小鼠组胺酶联免疫分析试剂盒以及小鼠IgE 酶联免疫分析试剂盒购自酶免实业有限公司。
1.4 全虫总RNA 的提取和反转录
分别取蝶蛹金小蜂和丽蝇蛹集金小蜂寄生后第5 d 的幼虫6 头,使用PBS 缓冲液清洗后,加入钢珠和TRizol 试剂后,以25 Hz 的频率匀浆破碎2.5 min。按照TRizol 试剂使用说明书上的操作提取两种金小蜂的全虫总RNA,以此为模板,反转录获得蝶蛹金小蜂和丽蝇蛹集金小蜂的cDNA。
1.5 编码基因的克隆和表达载体的构建
选择pET-28a(+)质粒为表达载体,采用限制性内切酶XhoⅠ和EcoRⅠ进行双酶切。按照表1 的序列合成两组特异性引物,以蝶蛹金小蜂和丽蝇蛹集金小蜂的cDNA 为模板进行PCR 扩增目的片段。反应条件为:95 ℃变性10 s,55 ℃退火5 s,72 ℃延伸5 s,共40 个循环。采用DNA 凝胶回收试剂盒纯化回收PCR 扩增得到的目的片段和酶切后的线性化载体,并分别将蝶蛹金小蜂和丽蝇蛹集金小蜂的片段和载体相互连接,构建得到重组载体pET-28a(+)-icarapin-Pp 和pET-28a(+)-icarapin-Nv。然后将重组载体转入DH5α感受态细胞,以卡那霉素浓度50 μg/mL 的LB 培养基筛选,挑选阳性克隆菌落进行PCR 鉴定和测序。

表1 本试验所用引物序列Table 1 Primer sequences in this study
1.6 序列分析及系统发育树构建
蛋白的分子量、等电点和亲水系数等特征由Expasy-ProtParam 在线预测得到,信号肽由signal P 5.0 在线预测。使用NCBI 的在线Blastp 将2 种金小蜂的类icarapin 蛋白与NR 库进行比对,挑选具有较高相似性的同源序列使用Clustal W 进行多序列比对,采用MEGA 5 进行系统发育树的构建。
1.7 qRT-PCR
分别取2 种寄生蜂不同发育阶段及幼虫组织进行qRT-PCR 分析,以探究类icarapin 蛋白编码基因在2种金小蜂中的表达模式。取样时期与组织分别为:初孵幼虫(寄生结束后第2 d)、老熟幼虫(寄生结束后第5 d)、白蛹、白眼黄蛹、红眼黄蛹、黑蛹、初羽化成虫、幼虫唾液腺和幼虫残体(去除唾液腺),每个时期取4 个生物学重复。相对表达量用2-ΔΔCt法计算,并进行归一化处理。以金小蜂科内高度保守的18S 作为内参,引物序列见表1。反应条件如下:95 ℃预热3 min;95 ℃复性10 s 以及60 ℃退火30 s,后两步重复40 个循环;PCR 结束后进行熔解曲线分析引物效果。
1.8 重组类icarapin 蛋白的诱导表达
选取插入片段序列正确的质粒,将其转化到BL21(DE3)化学感受态细胞中,以卡那霉素浓度50 μg/mL的LB 固体培养基筛选。取阳性菌落接种于含卡那霉素的LB 液体培养基中,以37 ℃、200 r/min 培养过夜。次日按过夜菌液∶LB 液体培养基=1∶100 比例稀释,以37 ℃、200 r/min 摇菌至对数生长阶段(菌液OD600在0.6~0.8)。向菌液中加入终浓度1 mmol/L 的IPTG(同时取少量菌液作为对照组,不进行IPTG诱导),在16 ℃的摇床中120 r/min 诱导过夜。摇菌完毕的菌液,以4 ℃、12000 r/min 离心收集菌体沉淀。用BugBuster® Master Mix 裂解液重悬浮沉淀,菌液体积为所用裂解液体积的40 倍。以4 ℃、14000 r/min条件离心取上清液,通过SDS-PAGE 电泳和Western blot 检测鉴定蝶蛹金小蜂和丽蝇蛹集金小蜂类icarapin蛋白的表达情况。
1.9 重组类icarapin 蛋白的纯化
重组蛋白的纯化根据Ni-NTA Reagent Kit 进行(Merck 医药生物科技公司),具体步骤如下:(1)将裂解后的上清液加入经结合缓冲液充分润洗的His-Tag 纯化树脂;(2)4 ℃的摇床上慢速轻柔混匀,结合过夜;(3)用漂洗缓冲液洗净杂蛋白;(4)加入洗脱缓冲液收集目标蛋白,并通过SDS-PAGE 电泳鉴定蛋白纯度。
1.10 小鼠致敏模型的建立
取24 只6 周大的BALB/c 小鼠,体重在18~22 g 范围内,随机分成4 组,每组雌鼠和雄鼠各3 只,计6 只。阴性对照组注射PBS 缓冲液,阳性对照组注射明确有致敏性的西方蜜蜂icarapin 蛋白[14]。其余两组为试验组,分别注射蝶蛹金小蜂和丽蝇蛹集金小蜂的类icarapin 蛋白。在试验的第0 d、第7 d 和第14 d对各组小鼠分别进行注射处理,其中阳性组和试验组每次每只小鼠皮下注射含有0.04 mg/mL 的icarapin 蛋白或类icarapin 蛋白的PBS 溶液0.25 mL,阴性对照注射仅0.25 mL PBS 溶液。试验第21 d 时,对各组小鼠分别静脉取血,供后续试验。
1.11 类icarapin 蛋白致敏性评价
在哺乳动物中,血液中免疫球蛋白E(IgE)以及组胺(Histamin)的增加是接触或摄入致敏原后的重要生理特征。本试验以末次注射一周后小鼠血清中总IgE 以及组胺浓度的差异为考察致敏能力强弱的生理指标。分别采用酶免实业有限公司的小鼠组氨酶联免疫分析试剂盒以及小鼠IgE 酶联免疫分析试剂盒进行测定,具体操作参照试剂盒使用说明。
2 结果与分析
2.1 克隆及序列分析
分别使用2 种金小蜂类icarapin 蛋白编码基因的引物对其进行PCR 扩增,经测序后得到2 种金小蜂类icarapin 蛋白编码基因的序列信息(图1),与基因组中的序列一致[18,19]。蝶蛹金小蜂和丽蝇蛹集金小蜂类icarapin 蛋白编码基因开放阅读框分别为645 bp 和714 bp,预测相对分子质量分别为24.94 kDa 和24.90 kDa,等电点分别为4.09 和4.11,平均亲水系数分别为-0.607 和-0.602。信号肽预测表明丽蝇蛹集金小蜂的类icarapin 蛋白具有信号肽,而蝶蛹金小蜂的类icarapin 不具有信号肽。
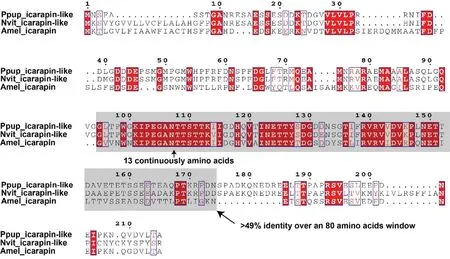
图1 两种金小蜂类icarapin 蛋白与西方蜜蜂icarapin 的序列比对Fig.1 Sequence alignment of icarapin-like proteins in two pteromalid wasps and icarapin in Western honey bee
根据FAO/WHO 的致敏性预测标准[20],潜在蛋白符合:(1)在80 个氨基酸窗口与已知过敏原的序列相似性高于35%;(2)连续6 个以上的氨基酸与已知致敏原一致,则可能具有潜在的致敏性。为了预测两种金小蜂类icarapin 蛋白的潜在致敏性,对其与已知过敏原西方蜜蜂icarapin 蛋白进行了序列比对。结果表明,蝶蛹金小蜂与丽蝇蛹集金小蜂的类icarapin 蛋白与西方蜜蜂icarapin 蛋白的相似性分别为41%和33%,在80 个氨基酸窗口内分别具有53%和49%的序列相似性,且均具有13 个连续一致的氨基酸残基(图1),表明2 种金小蜂类icarapin 蛋白具有潜在的致敏性。
使用NCBI 中在线搜索了2 种金小蜂类icarapin 蛋白的同源序列,使用Clustal W 进行多序列比对后使用MEGA 5.0 软件构建了系统发育树。结果表明,4 种金小蜂的类icarapin 蛋白聚为一支,与榕小蜂Ceratosolensolmsi和短管赤眼蜂Trichogrammapretiosum的类icarapin 较为相似(图2)。
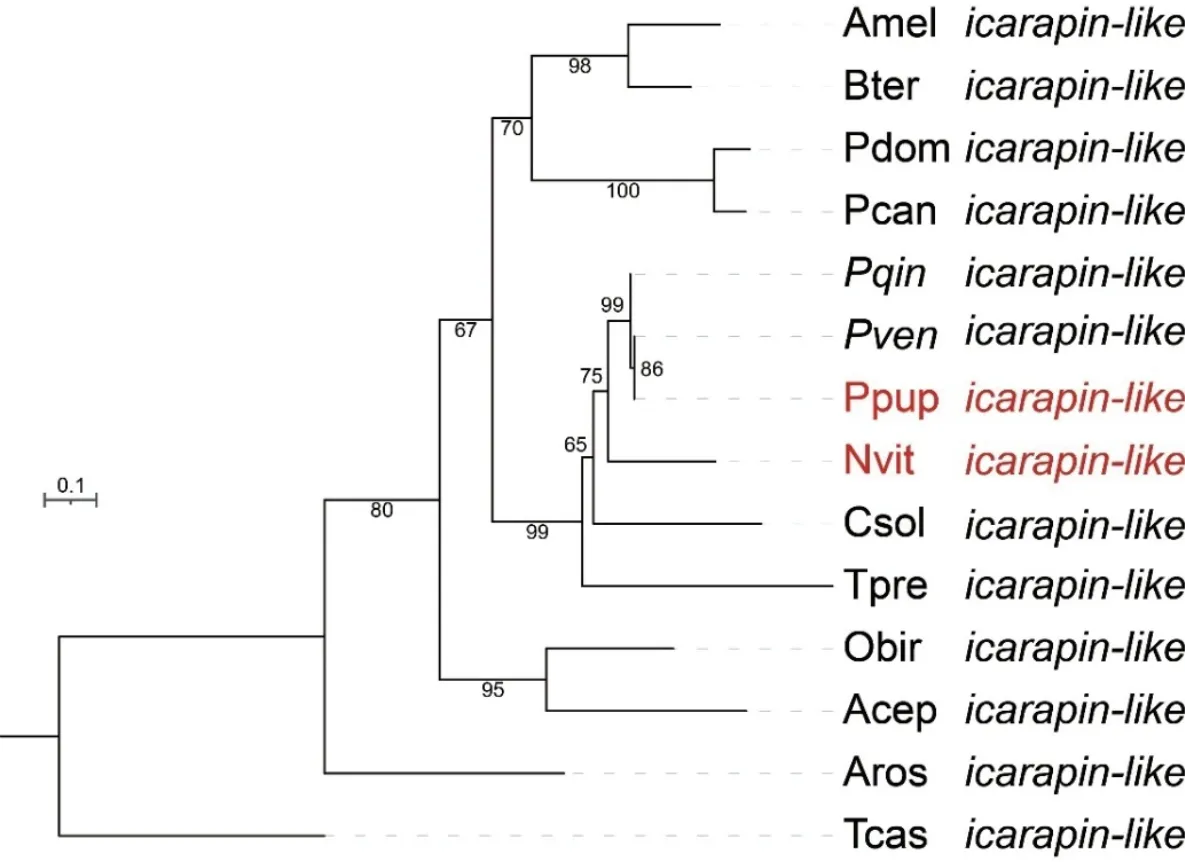
图2 代表性昆虫类icarapin 蛋白的系统发育分析Fig.2 Phylogenetic analyses of the icarapin-like protein coding genes in representative insects
2.2 类icarapin 蛋白编码基因表达模式
使用qRT-PCR 的方法分析了2 种金小蜂类icarapin 基因的表达模式。结果表明,类icarapin 基因在2种金小蜂雌、雄虫的各个发育阶段均有表达。在蝶蛹金小蜂的白蛹及成虫期具有最高的表达量,而在丽蝇蛹集金小蜂的黄蛹期表达量最高(图3)。类icarapin 蛋白编码基因在2 种金小蜂幼虫唾液腺和残体中均有一定表达(图4)。
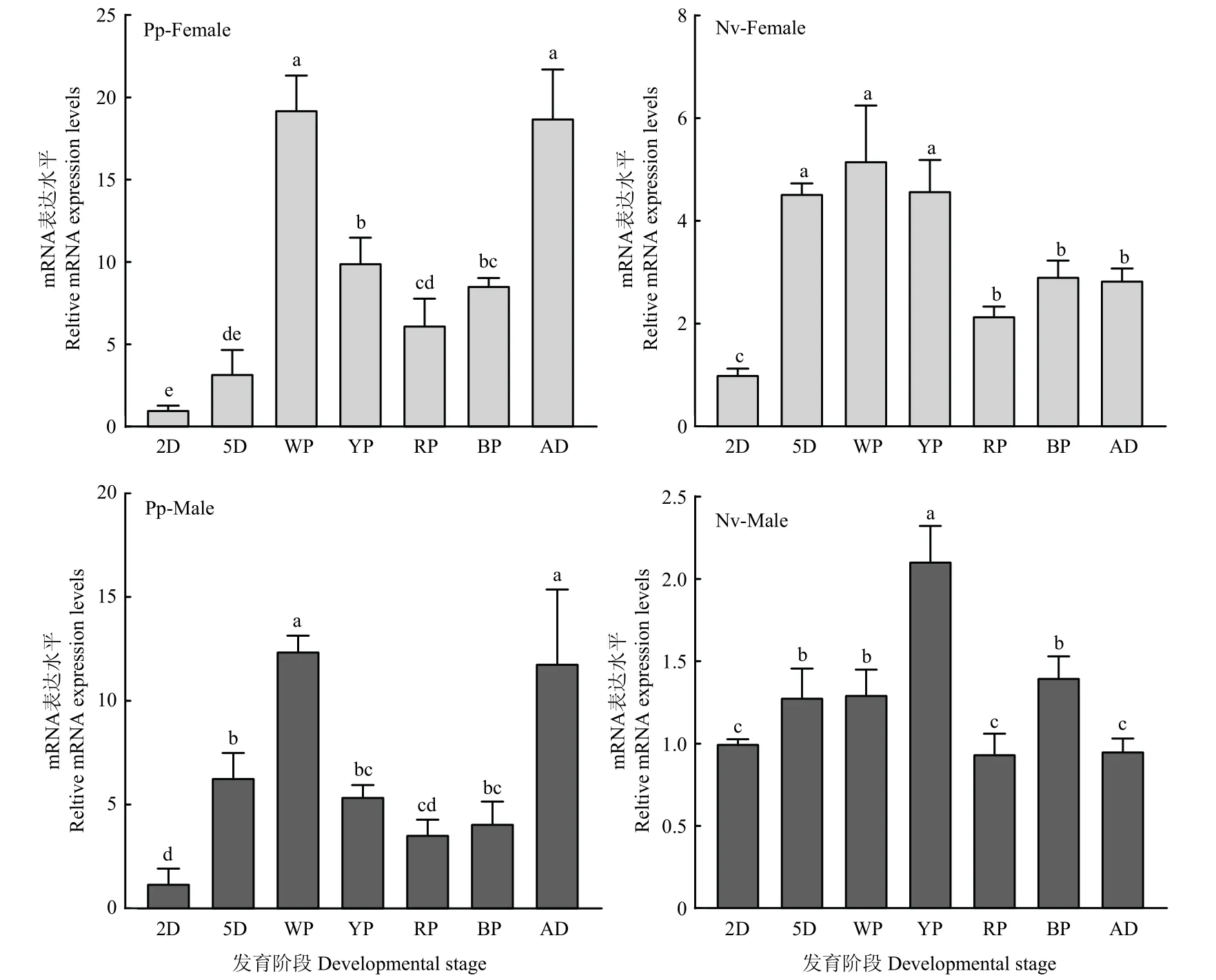
图3 类icarapin 蛋白编码基因在两种金小蜂不同发育时期的表达情况Fig.3 The expression profiles of icarapin-like protein coding genes in different development stages of the two pteromalid wasps

图4 类icarapin 蛋白编码基因在两种金小蜂唾液腺和残体中的表达情况Fig.4 The expression profiles of icarapin-like protein coding genes in saliary glands and carcass of larva of the two pteromalid wasps
2.3 重组类icarapin 蛋白的表达和纯化
使用pET-28a(+)大肠杆菌表达系统对蝶蛹金小蜂和丽蝇蛹集金小蜂的类icarapin 蛋白进行原核表达,成功构建两种金小蜂的类icarapin 蛋白质编码基因的表达载体后,以未诱导的pET-28a(+)-icarapin-Pp 和pET-28a(+)-icarapin-Nv 为阴性对照,SDS-PAGE 和Western blot 结果表明,在大肠杆菌BL21(DE3)裂解后的上清具有大小约为30 kDa 的条带(图5),符合两种金小蜂的类icarapin 蛋白的理论大小。将诱导表达后的菌体裂解,取上清液与His-Tag 纯化树脂结合,成功获得了蝶蛹金小蜂和丽蝇蛹集金小蜂较高纯度的重组类icarapin 蛋白(图5)。
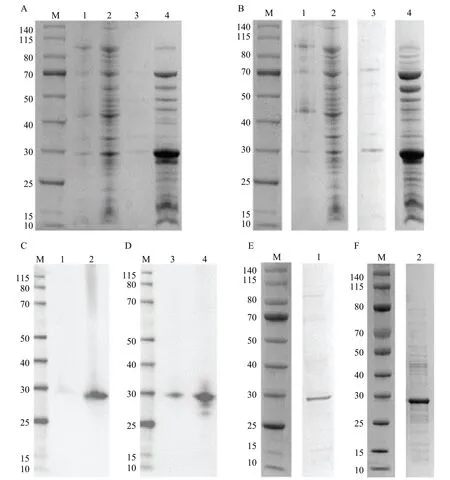
图5 两种金小蜂icarapin 蛋白的表达与纯化Fig.5 SDS-PAGE result of expressed and purified recombinant icarapin proteins of two pteromalid wasps
2.4 重组类icarapin 蛋白的潜在致敏性评价
采用小鼠致敏模型对2 种金小蜂类icarapin 蛋白的潜在致敏性进行了评价,结果如图6 所示。阴性对照组、阳性对照组、蝶蛹金小蜂类icarapin 蛋白组和丽蝇蛹集金小蜂类icarapin 蛋白组的小鼠血中总IgE平均浓度分别为206.2(±17.59)ng/mL、252.7(±19.19)ng/mL、345.8(±28.23)ng/mL、306.9(±21.57)ng/mL;组胺平均浓度分别为18.64(±1.98)ng/mL、22.74(±2.53)ng/mL、27.42(±3.87)ng/mL、24.96(±1.53)ng/mL。注射了蝶蛹金小蜂和丽蝇蛹集金小蜂类icarapin 蛋白的2 个试验组以及阳性对照组小鼠血清中总IgE 含量以及组胺浓度均高于阴性对照组(IgE:PAmelvsPBS=1.39e-3,PPpvsPBS=1.22e-06,PNvvsPBS=4.73e-06;组氨:PAmelvsPBS=0.01,PPpvsPBS=5.81e-4,PNvvsPBS=1.05e-4;图6),表明2 种寄生蜂的类icarapin 蛋白具有潜在的致敏性。

图6 小鼠血清中组胺和总IgE 浓度Fig.6 Concentrations of histamine and total IgE in BALB/c mice serum
3 讨论
寄生蜂活性物质作为备受重视的杀虫蛋白候选资源库,其杀虫基因转入昆虫病原物或作物中,可能会对哺乳动物有一定的影响[2,21]。同时昆虫含有丰富的蛋白质,具有较高的营养价值,近几十年来国内外对昆虫作为食物或饲料的应用价值进行了大量的基础研究[22,23]。因此有必要对这些基因的表达产物进行应用风险评估。
Icarapin 是西方蜜蜂中一种常见的过敏原,保守存在于多种昆虫中[24-26]。本研究在2 种重要的金小蜂中克隆得到了icarapin 的同源基因。发育动态的结果显示,该蛋白的编码基因在2 种金小蜂的整个发育历期中均有表达,即无论哪一时期皆有与类icarapin 蛋白接触的可能性。根据FAO/WHO 的致敏性预测标准,预测2 种金小蜂中类icarapin 蛋白均具有潜在的致敏性,需进一步评价。
BALB/c 小鼠模型是鉴定候选蛋白潜在致敏性的有效模型,已有多种致敏原的BALB/c 小鼠模型报道[28],动物血清中IgE 和组胺水平是评价致敏反应的重要指标[29]。本研究通过pET-28a(+)体系成功对2 种金小蜂的类icarapin 蛋白进行表达。在此基础上建立了小鼠致敏模型,以血清组胺和IgE 浓度为测定指标,与西方蜜蜂icarapin 蛋白相比,初步明确了2 种金小蜂的icarapin 蛋白均具有潜在的致敏风险。但该蛋白真正的生理功能尚未知,是否能够有效作用于靶标害虫仍需进一步探究。
Rauber 等[29]利用40 例icarapin 阳性的蜂毒过敏病人血清与icarapin 中15-mer 的多肽进行特异性IgE的检测并鉴定到一个主要的IgE 表位(Api m 10160-174;氨基酸序列:ADSDVTTLPTLIGKN)。但是,西方蜜蜂icarapin 的该区域与2 种寄生蜂并不保守,相似性仅为13%。就2 种金小蜂与西方蜜蜂icarapin 连续一致的13 个氨基酸区域组成的多肽,Rauber 等[29]在西方蜜蜂的研究中表明该肽与蜜蜂毒液过敏病人血清的IgE 反应并不高。可见,2 种寄生蜂icarapin 蛋白可能具有新的IgE 表位,且对人致敏的风险不大。但是,本研究仅是基于小鼠模型的评价,这2 种蛋白对人是否具有真正的致敏性仍需要进一步确认。即在利用基于小鼠模型进一步测定其特异性IgE 浓度和基于RBL-2H3 细胞系进行致敏性评价的基础上,尚需要开展基于蜂毒过敏病人血清对其交叉致敏性的测定。此外,考虑到寄生蜂在自然界不会主动蛰刺人畜,直接接触人的风险较低,应用寄生蜂活体在自然界控制害虫的致敏风险应该相对较低。但未来在具体应用到寄生蜂毒液、唾液等杀虫活性蛋白时,在应用前建议需要对其致敏风险进行系统评价。
