一株球孢白僵菌的分离鉴定及其对茶丽纹象甲幼虫的室内致病力测定
2023-12-25付楠霞罗宗秀李兆群修春丽陈宗懋蔡晓明
付楠霞,罗宗秀,李兆群,边 磊,修春丽,陈宗懋,蔡晓明
(中国农业科学院茶叶研究所,杭州 310008)
茶丽纹象甲MyllocerinusaurolineatusVoss 属鞘翅目Coleptera 象甲科Curculionidae,是我国茶园重要的食叶害虫。该虫主要以成虫嚼食茶枝嫩叶使形成不规则弧形缺刻,造成茶叶减产降质,严重时仅留叶脉[1]。茶丽纹象甲成虫为害时期集中,防治难度大,且其为害时期与我国乌龙茶区的春茶和绿茶区的夏茶采摘季重叠,因此给我国茶产业造成了巨大的经济损失[2]。目前生产上,喷施化学农药是防治茶丽纹象甲的主要手段。但长期使用化学农药防治不仅会造成我国茶叶及茶制品的农药残留问题,还易误杀茶园的非靶标有益生物,引发茶园生物多样性下降、生态环境失衡等负面问题,不利于茶产业的健康可持续发展[3-6]。因此,亟需研发对该虫绿色无公害的防控措施。
球孢白僵菌Beauveriabassiana(Bals.)Vuill 是世界上目前研究和应用最多的虫生真菌之一,由于其在自然界分布广泛,寄主范围广且对人、畜、作物、害虫天敌及自然环境相对安全,球孢白僵菌已成为多种农林害虫种群控制及生物防治的重要生防资源[7,8]。据Inglis[9]和李亦菲等[10]报道,球孢白僵菌能以15 个目149 科中的750 多种昆虫为寄主。目前,美国、欧洲、日本及印度等许多国家用球孢白僵菌生防产品防治农林害虫及重要检疫性害虫,并取得显著成果[11,12]。我国对球孢白僵菌的研究始于20 世纪50 年代,据周哲宇等[13]报道,目前为止,我国已登记注册了20 余种白僵菌产品,主要用于防治亚洲玉米螟Ostrinia furnacalisGuenée、马尾松毛虫DendrolimuspunctatusWalker、松褐天牛MonochamusalternatusHope、光肩星天牛AnoplophoraglabripennisMotschulsky、东亚飞蝗LocustamigratoriamanilensisMeyen、稻纵卷叶螟CnaphalocrocismedinalisGuenée、美国白蛾HyphantriacuneaDrury、斜纹夜蛾SpodopteralituraFabricius 及地下害虫日本弧丽金龟PopilliajaponicaNewman 等多种农林害虫。其中,用球孢白僵菌防治亚洲玉米螟和马尾松毛虫的案例最为成功,用于防治二者的应用面积曾达上百万公顷,堪称世界之最[14-17]。
虽然球孢白僵菌已经成为多种农林害虫生物防治手段的重要组成部分,但利用生防真菌防治茶丽纹象甲的研究报道相对较少,特别是缺乏对幼虫毒力高的菌株资源。如王定峰等[18,19]分别从广东英德茶园和12株原寄主为鞘翅目昆虫的白僵菌中筛选出对茶丽纹象甲成虫具有高毒力的菌株Bb1-1 和Bbr1552,但二者均以成虫为试验对象,对幼虫的致病效率如何尚不明确。此外,茶丽纹象甲成虫取食量大且为害期集中,利用球孢白僵菌防治成虫时常存在成虫感病致死前已对茶园造成严重为害的弊端。笔者近两年研究发现,茶丽纹象甲以幼虫在茶园土壤中越冬,每年四月中下旬会集中迁移到1~5 cm 土壤表层化蛹羽化。若在此时期对幼虫进行集中防治,则可在源头上避免茶丽纹象甲成虫的为害。因此,迫切需要筛选出适用于防治茶丽纹象甲老熟幼虫的生防菌株。本研究报道了从自然罹病的茶丽纹象甲幼虫分离得到的1 株球孢白僵菌,并研究了其对茶丽纹象甲老熟幼虫的室内毒力,旨在为茶丽纹象甲的生物防治提供新的杀虫微生物资源。
1 材料与方法
1.1 材料
供试甲虫:自然罹病的茶丽纹象甲幼虫僵虫于2021 年4 月12 日采自浙江省绍兴市柯桥区平水镇平阳村有机茶园(东经120.61122°北纬29.84760°),致病力测定所需老熟幼虫于2022―2023 年3―4 月采集于同一茶园。
培养基:含0.1 g/L 氯霉素的马铃薯葡萄糖(potato dextrose agar,PDA)培养基(马铃薯300.0 g/L,葡萄糖20.0 g/L,琼脂15.0 g/L,氯霉素0.1 g/L)购自广东环凯微生物科技有限公司。
试剂:真菌基因组DNA 抽提试剂盒Ezup Column Fungi Genomic DNA Purification Kit 购自生工生物工程(上海)股份有限公司;EZ-10 Spin Column DNA Gel Extraction Kit、2×Taq Master Mix 购自南京诺维赞生物科技有限公司;pEASY Blunt Zero Cloning Kit 购自北京全式金生物技术股份有限公司;普通琼脂糖凝胶DNA 回收试剂盒购自天根生化科技(北京)有限公司。
1.2 供试菌株的分离纯化
将自然罹病的茶丽纹象甲僵虫在超净台中用75%酒精表面消毒5 min,之后用无菌水反复清洗3 次以去除所粘连的土块,然后用高温灭菌的剪刀将僵虫剪碎成小块。随后每3 个尸块一组,呈等边三角形状接种到含0.1 g/L 氯霉素的马铃薯葡萄糖PDA 培养基上。置于27 ℃培养箱中培养7 d 后,用接种环挑取边缘菌丝于PDA 培养基上划线纯化;待长出菌落后挑取不同形态、颜色、大小的菌落用平板划线法转接到新的PDA 培养基上。重复上述操作直至得到纯菌落,于4 ℃冰箱保存备用。
1.3 致病菌株的分类鉴定
1.3.1 形态学鉴定 在超净工作台中,用无菌接种环通过划线法,将分离纯化后的菌株接种到灭菌的含有0.1 g/L 氯霉素的PDA 培养基上。然后沿接种划线部位分别斜插入2~3 片无菌盖玻片,并将PDA 培养基平板置于27 ℃的培养箱中培养。分别在接菌后第5~10 d 取出长有菌丝的盖玻片,采用光学显微镜(基恩士,VHX-7000),观察菌株菌丝、产孢结构和分生孢子形态的显微结构。
用上述PDA 培养基平板制备浓度为20~30 个孢子/mL 的孢子悬浮液,无菌条件下,用移液枪吸取500 μL接种到含0.1 g/L 氯霉素的PDA 培养基中,用灭菌玻璃棒轻轻涂布,使其均匀分布培养基表面,封口膜封边。然后于27 ℃培养箱中培养并在培养后第9 d 拍照记录菌落正反面形态和颜色。根据菌株形态学特征,参考蒲蛰龙和李增智[20]的方法初步鉴定虫生真菌的分类地位。
1.3.2 分子生物学鉴定 将分离的致病菌株接种在含0.1 g/L 氯霉素的PDA 培养基上培养5 d 后,刮下孢子和菌丝,利用真菌基因组DNA 抽提试剂盒提取基因组DNA。参照 Chaithra 和Castrillo 等[21,22]的方法,PCR 扩增该菌株的ITS 和B locus 基因间隔区序列。其中,ITS 序列的扩增引物为真菌核糖体rDNA 区通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′),B locus基因间隔区序列的扩增引物为B5.1F(5′-CGACCCGGCCAACTACTTTGA-3′)/B3.1R(5′-GTCTTCCAGTA CCACTACGCC-3′)。PCR 反应体系:2×Taq Master Mix 25 µL、基因组DNA 模板30~60 ng、10 µmol/L上下游引物各1µL,ddH2O 补足至50 µL。ITS 序列的PCR 反应程序:95 ℃预变性3 min;95 ℃预变性15 s,51 ℃退火15 s,72 ℃延伸40 s,共30 个循环;72 ℃延伸5 min。B locus 基因间隔区序列的PCR反应程序:95 ℃预变性3 min;95 ℃预变性30 s,55 ℃退火30 s,72 ℃延伸1 min 30 s,共30 个循环;72 ℃延伸5 min。ITS PCR 产物经1%琼脂糖凝胶电泳检测,用普通PCR 产物回收试剂盒(天根)回收纯化目的片段,并送至浙江尚亚生物技术有限公司测序。B locus 基因间隔区序列PCR 产物则连接到pEASY®-Blunt Zero 载体上,挑选阳性克隆后测序。在NCBI 对测序所得基因片段进行Blast 同源性分析,并下载近缘物种的ITS 和B locus 基因间隔区序列。用MEGA 5.0 软件的ClustalW 将分离所得菌株的ITS和B locus 基因间隔区序列与近缘物种序列进行多序列比对,然后用邻近法(Neigbor-joining method)构建分子系统进化树并对其进行检验,Bootstrap 值为1000。
1.4 孢子悬浮液配制
取培养13 d 的菌株在超净工作台内加入含0.5‰ 吐温-80 的蒸馏水(即2000 倍吐温-80 稀释液)刮除菌落,洗出平皿内的孢子,转移到灭菌的三角瓶中,使用磁力搅拌器中速搅拌 20 min,使其均匀分散,配制成母液。然后采用10 倍稀释法稀释母液,并在显微镜下用血球计数板计数,每个浓度孢子悬浮液重复计数3 次。将孢子悬浮液浓度分别稀释至1×108个孢子/mL、1×107个孢子/mL、1×106个孢子/mL 和1×105个孢子/mL,备用。
1.5 对茶丽纹象甲幼虫致病力测定
挑选虫态一致健康的茶丽纹象甲老熟幼虫为试验试虫,参考陈春艳等[23]和段玉林等[24]的试验方案,分别运用浸虫法和拌土法两种方式接种球孢白僵菌悬浮液。浸虫法的具体操作:将茶丽纹象甲幼虫置于2 mL浓度为1.0×105个孢子/mL~1.0×108个孢子/mL 的球孢白僵菌Maure 1.1 孢子悬浮液中,浸渍20 s,然后转移至含有20 g 土壤(RH 22%)的小培养杯中(高和宽:4 cm×4.5 cm)。拌土法则将拌有2 mL 浓度为1.0×105个孢子/mL~1.0×108个孢子/mL 的球孢白僵菌Maure 1.1 孢子悬浮液的20 g 土壤(RH 22%)转移到小培养杯中,然后将健康的茶丽纹象甲老熟幼虫转移到该培养杯(高和宽:4 cm×4.5 cm)中。
每个浓度梯度3 次重复,每个重复10 头试虫,浸虫法和拌土法的对照组均采用0.5‰吐温-80 的无菌水溶液处理。所有的试虫均置于22 ℃、光周期16L∶8D、湿度为70%的培养箱中培养。每2 d 喷施无菌水以保持土壤的湿度,处理后第3 d 开始,每天观测1 次,记录试虫的死亡数。死虫保湿培养观察菌丝生长情况(虫尸上长出肉眼可见的菌丝),并拍照记录染病僵虫的虫态。
1.6 数据统计及分析
根据统计的试虫死亡数,用Excel 计算出各处理的死亡率和校正死亡率。死亡率=(处理总数-存活数)/处理总数×100%;累计校正死亡率=(处理组累计死亡率-对照组累计死亡率)/(1-对照组累计死亡率)×100%;利用Graphpad Prism 5.0 软件绘制球孢白僵菌致病力曲线。以孢子悬浮液浓度(孢子/mL)的对数值和死亡率的机率值,计算Probit 毒力回归方程及致死中浓度LC50。根据各浓度下侵染天数和累计死亡率的机率值,计算Probit 回归方程和致死中时间LT50。
2 结果与分析
2.1 致病菌株的分类鉴定
2.1.1 形态学鉴定 从茶丽纹象甲幼虫僵尸中分离、纯化得到一株致病菌株,在PDA 培养基上该菌株菌落呈圆扁平状,正面为乳白色,背面淡黄色,菌落初期表面绒毛状,边缘有放射性毛状菌丝,接种后第9 d菌落直径达23 mm,表面长出粉状颗粒感孢子,菌落呈棉絮状(图1a,b)。光学显微镜镜检发现:菌丝无色细长,表面光滑,粗约为1.4~3.3 μm(图1c),分生孢子梗着生于营养菌丝上,产孢细胞基部呈近球形或瓶状(图1d, e),分生孢子球形或近球形、透明、光滑,平均大小约为2.0~3.0 μm(图1e, f)。结合致病菌株的菌丝、孢子及菌落形态特征,初步认定该致病菌为白僵菌,菌株编号为Maure 1.1。

图1 菌株Maure 1.1 的形态特征Fig.1 Morphology characteristics of strain Maure 1.1
2.1.2 分子生物学鉴定 PCR 分别扩增菌株Maure 1.1 的ITS 和B locus 基因间隔区序列片段,琼脂糖凝胶电泳显示,ITS 的PCR 产物在略大于500 bp 获得一条特异性条带,而B locus 基因间隔区的PCR 产物的分子量在略大于1500 bp 处(图2)。测序结果显示,ITS 和B locus 基因间隔区序列片段PCR 产物大小分别为533 bp 和1582 bp。将ITS 序列在NCBI 中以rRNA/ITS 数据库中来源于真菌和参照材料的ITS 序列为比对对象进行Blast,比对分析结果发现菌株Maure 1.1 与球孢白僵菌B.bassianaARSEF 1564 的ITS 序列相似度高达97.83%。运用邻接法构建该菌株的ITS 序列系统进化树(图3),结果表明该菌株与球孢白僵菌B.bassianaARSEF 1564 以98%的置信度聚于同一分支,这表明Maure 1.1 与球孢白僵菌的同源性最高,亲源关系最为接近。B locus 基因间隔区序列在NCBI 中以标准核酸数据库进行比对结果表明,菌株Maure 1.1与球孢白僵菌B.bassiana菌株RCEF2614 的B locus 基因间隔区的相似度高达100%。运用邻接法构建该菌株的B locus 基因间隔区序列系统进化树(图4),结果表明该菌株与球孢白僵菌B.bassianastrain RCEF2614 以100%的置信度聚于同一分支,这表明Maure 1.1 与该菌株的同源性最高,亲源关系最为接近。结合形态学鉴定结果,将菌株Maure 1.1 鉴定为球孢白僵菌B.bassiana。

图2 菌株Maure 1.1 ITS(A)和B locus(B)基因间隔区序列PCR 扩增产物Fig.2 ITS (A) and B locus intergenic region genomic sequence (B) PCR products amplified from the isolate Maure 1.1

图3 基于ITS 序列运用邻近法构建的菌株Maure 1.1 及其近源菌株的系统进化树Fig.3 Phylogenetic tree of the isolate Maure 1.1 and the other close related strains constructed with neighbor-joining method based on the ITS sequence
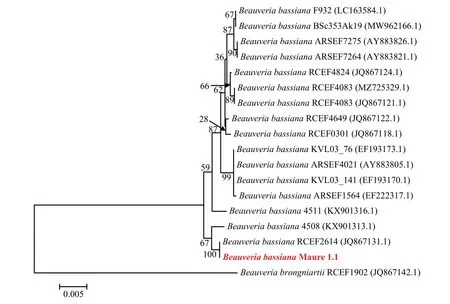
图4 基于B locus 基因间隔区序列运用邻近法构建的菌株Maure 1.1 及其近源菌株的系统进化树Fig.4 Phylogenetic tree of the isolate Maure 1.1 and the other close related strains constructed with Neighbor-joining method based on the B locus intergenic region genomic sequence
2.2 致病菌株Maure 1.1 对茶丽纹象甲幼虫的毒力测定
2.2.1 茶丽纹象甲幼虫染病状态 对照组的茶丽纹象甲老熟幼虫虫体乳白色,体表干净且遍布纤毛,在土壤中活跃蠕动。球孢白僵菌孢子液处理组的茶丽纹象甲老熟幼虫,虽然在感染初期,其取食行为、虫体外部形态与健康幼虫无差别,在接种4~6 d 后,部分幼虫活动性明显降低,幼虫虫体开始僵硬化。在侵染6~9 d 后,被感染死亡的茶丽纹象甲老熟幼虫大量死亡,呈僵虫状,体表沾满泥土,并遍布白色菌丝。对感染死亡僵虫虫体上的菌株再进行分离纯化和形态及分子鉴定,发现再分离菌株的形态特征、ITS 和B locus基因间隔区序列均与供试菌株一致,确定致病菌株为球孢白僵菌菌株Maure 1.1。这些结果表明,本试验分离所得的球孢白僵菌菌株Maure 1.1 可成功侵染茶丽纹象甲老熟幼虫。
2.2.2 不同处理方式下球孢白僵菌对茶丽纹象甲幼虫累计校正死亡率 在22 ℃的培养条件下,不同处理方式和不同孢子浓度下,球孢白僵菌Maure 1.1 对茶丽纹象甲老熟幼虫的致死率变化如图5 所示。由图5A可知,在浸虫法处理条件下,接种不同孢子浓度的茶丽纹象甲幼虫处理后的3~11 d 内,其死亡率均随时间的延长而增加。在处理第11 d 后,茶丽纹象甲幼虫的累计校正死亡率达到最大。其中,在孢子浓度为1.0×105个孢子/mL~1.0×108个孢子/mL 时,茶丽纹象甲幼虫的死亡率分别达到60%、66.67%、70%和76.67%。由此可见,在该处理方式下,茶丽纹象甲幼虫死亡率随着接种孢子浓度的增加而增大。由图5B可知,拌土法处理条件下,不同浓度的白僵菌Maure 1.1 孢子液对茶丽纹象甲的累计校正死亡率也随接种时间的延长而增加,均在处理第11 d 时死亡率达到最大。其中在孢子浓度为1.0×107个孢子/mL 和1.0×108个孢子/mL 时,茶丽纹象甲幼虫的死亡率分别达到70.00%和73.33%;在孢子浓度为1.0×106个/mL 和1.0×105个/mL 时,茶丽纹象甲幼虫的死亡率均为63.33%。综上,在茶丽纹象甲幼虫集中化蛹和羽化的土壤温度条件下,无论是通过浸虫法还是拌土法施用球孢白僵菌Maure 1.1,均可对茶丽纹象甲幼虫表现出较好的致死率。

图5 不同处理方式下不同浓度球孢白僵菌孢子溶液对茶丽纹象甲幼虫的累计校正死亡率Fig.5 The cumulative adjusted mortality of tea weevil M.aurolineatus larve treated with B.bassiana spores of different concentrations under different inoculation methods
2.3 致病菌株Maure 1.1 对茶丽纹象甲幼虫的剂量效应(LC50)和时间效应(LT50)
致病球孢白僵菌分离株Maure 1.1 对茶丽纹象甲幼虫的Probit 回归方程和对应的LC50如表1 所示。在接种后第8~11 d,随着接种后时间的延长,LC50呈现递减模式。其中在接种后第8 d,浸虫法和拌土法的LC50分别为3.82×108和9.89×107个孢子/mL;在接种后第11 d,浸虫法和拌土法的LC50分别为2.00×103和1.11×103个孢子/mL。在所有测试中,拌土法所需的LC50均稍小于浸虫法的LC50值,表明通过拌土法施用致病球孢白僵菌分离株Maure 1.1 对茶丽纹象甲幼虫有较强的毒力效应。

表1 球孢白僵菌菌株Maure 1.1 对茶丽纹象甲老熟幼虫的Probit 回归方程和LC50Table 1 The Probit regression equations and LC50 values of mature M.aurolineatus larvae infected with the isolated B.bassiana Maure 1.1 strain
随着接种浓度的增加,菌株Maure 1.1 对茶丽纹象甲老熟幼虫的LT50逐步递减。当接种的孢子浓度为1×108个/mL 时,菌株Maure 1.1 对茶丽纹象甲老熟幼虫的LT50最小,其中浸虫法和拌土法两种处理方式的LT50分别为7.87 d 和7.60 d。当接种的孢子浓度为1×105个/mL 时,菌株Maure 1.1 对茶丽纹象甲老熟幼虫的LT50最大,其中浸虫法和拌土法两种处理方式的LT50分别为10.06 d 和9.12 d。在相同的接种浓度下,浸虫法所对应的LT50值均稍高于拌土法(表2)。
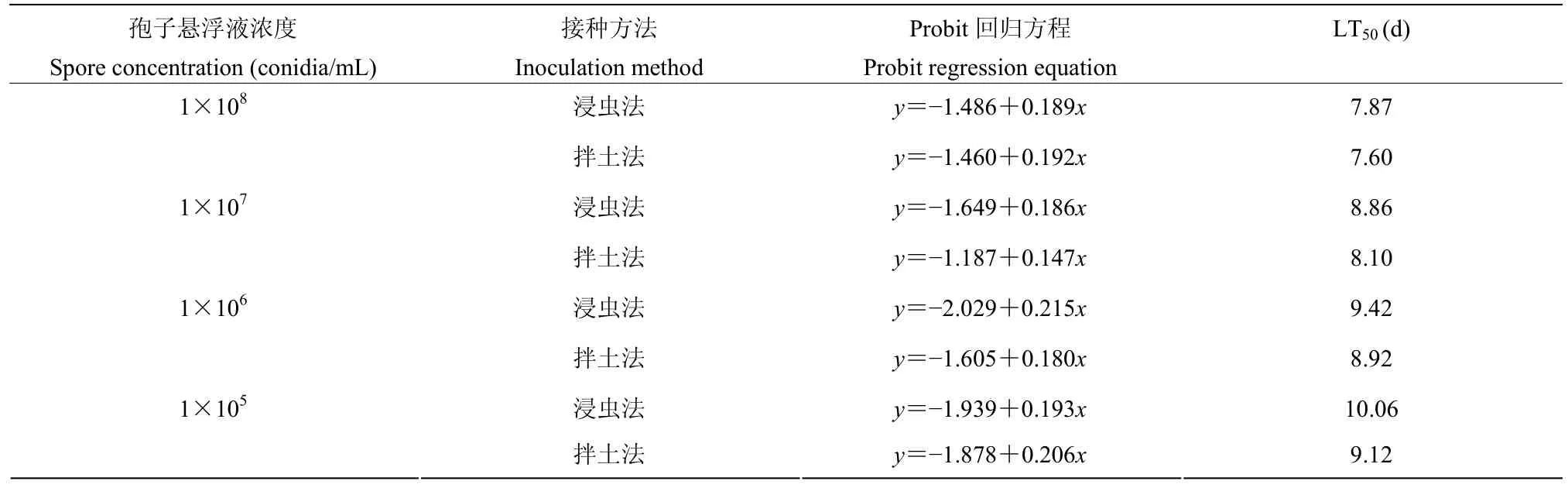
表2 球孢白僵菌菌株Maure 1.1 对茶丽纹象甲老熟幼虫的Probit 回归方程和LT50Table 2 The Probit regression equations and LT50 values of mature M.aurolineatus larvae infected with the isolated B.bassiana Maure 1.1 strain
3 讨论
昆虫病原真菌是一种重要的农林害虫生防资源,具有对人畜和生态环境绿色安全的特点。为开发出可防治茶丽纹象甲的生防菌株,本研究从田间自然罹病致死的茶丽纹象甲幼虫僵虫虫体上分离了一株虫生真菌菌株,形态学特征和分子系统进化关系分析结果表明该菌株为球孢白僵菌,命名为Maure 1.1。室内毒力测定显示,在茶丽纹象甲幼虫化蛹羽化温度条件下,处理11 d 后,不同浓度下的Maure 1.1 孢子悬浮液对老熟幼虫的致病力均可达到50%以上,表明该菌株具有进一步研究的价值,可作为防治茶丽纹象甲幼虫的候选菌株,丰富了茶丽纹象甲生防微生物资源。
茶丽纹象甲以成虫嚼食叶片为害茶树,目前化学防治是其主要防治手段。与成虫不同,茶丽纹象甲的幼虫和蛹均生活在土壤中,且无成虫的坚硬鞘翅保护,更易受到致病菌株的侵染,以幼虫和蛹为防治对象可为防治茶丽纹象甲提供一种新思路。笔者近两年对茶棚地面下70 cm×35 cm 区域内1~10 cm 深度土壤茶丽纹象甲幼虫的分布调查数据显示,四月中下旬,当表层土壤温度达到20 ℃左右时,约有75.8%的幼虫已迁移到1~5 cm 的土壤层,并在此土壤层化蛹羽化(未发表数据)。若能抓住该时期利用昆虫病原真菌对其进行集中防治,则可在源头上避免茶丽纹象甲成虫的危害。本研究利用茶丽纹象甲化蛹羽化出土前在土壤中向上迁移的特性,测定了浸虫法和拌土法两种处理方式下Maure 1.1 对茶丽纹象甲老熟幼虫的致病力。在所有测试中,相同试验条件下,拌土法的LC50和LT50均稍小于浸虫法对应的数值,推测茶丽纹象甲在土壤中迁移的过程中增加了与Maure 1.1 孢子的接触机率,因而更易感病。本试验中致病力测定的培养温度和土壤湿度条件均基于此时期田间的测报数据而设置,试验结果表明在此土壤温湿度条件下,运用Maure 1.1 菌株防治茶丽纹象甲幼虫是可行的,为该菌株的实际田间应用提供了重要的理论依据。
笔者调查发现4 月底茶园1~5 cm 的土壤层中常有茶丽纹象甲幼虫、蛹和初羽化成虫共存的现象,这表明,茶丽纹象甲幼虫在田间的实际化蛹时间虽然相对集中,但并不完全一致。本研究虽明确了Maure 1.1菌株对茶丽纹象甲老熟幼虫的致病力,但其对蛹和初羽化茶丽纹象甲成虫的毒力效应如何也需进一步研究。此外,孢子的成功萌发是昆虫病原真菌发挥致病效力的关键环节,在实际田间应用过程中常受到环境温度、湿度和紫外线强度等多个环境因子的影响[25-29]。Mann 和Davis[30]的研究表明,球孢白僵菌孢子的萌发和生长受温度影响较大,其最适的致病温度为23~25 ℃。葛银银等[25]研究发现,增加环境相对湿度可显著提升球孢白僵菌的田间防治效率。本报道只测定了单一温湿度条件下(22 ℃,20%~24%),球孢白僵菌Maure 1.1 对老熟幼虫的室内毒力效应,其在茶园复杂环境条件下的实际防治效果尚不明确。王成树等[31]的研究证明球孢白僵菌种群中约有20%的野生菌株以异核体的形式存在,约35%的异核体球孢白僵菌在继代培养中会发生性状分离,进而导致致病力的快速退化或变异。本研究所鉴定的野生菌株球孢白僵菌Maure 1.1 是否以异核体存在,其在继代培养中是否会发生性状分离有待进一步明确。因此,为了将分离所得的Maure 1.1 菌株制成微生物杀虫剂,并在自然环境条件下大规模防治茶丽纹象甲,后续我们还需探究Maure 1.1 菌株对蛹和初孵成虫的毒力大小、田间防治效果及其继代培养等一系列问题。
