亚热带森林根系和菌根真菌调控凋落叶分解和主场效应
2023-12-25王振宇万晓华黄志群
王振宇,万晓华,*,黄志群
1 福建师范大学地理科学学院, 福州 350007
2 湿润亚热带生态-地理过程教育部重点实验室, 福州 350007
凋落物分解是森林中一个基本的生态过程,不仅调控植被的生长,也深刻影响着全球陆地的净初级生产力[1—2]。“主场效应”(HFA),即凋落物在原生生境内的分解速度更快,被证明是小尺度范围内调控凋落物分解的一个关键因素[3—4]。由于凋落物在分解的过程中产生大量的养分以及凋落物下层适宜的温度和水分条件,大量根系向凋落物层生长成为热带和亚热带森林的普遍现象[5—7]。以往关于凋落物分解的研究往往集中在气候条件[8—9]、环境因子[10]和凋落物质量[11]等对凋落物分解的影响,而关于根系和菌根真菌如何调控凋落物层分解以及主场效应的研究还比较缺乏。
越来越多的证据表明,根系及其相关的菌根真菌可能是调控凋落物分解以及HFA效应的重要生物因子[12—13]。比如,在温带森林中,丛枝菌根(AM)树种加强了其生境内凋落叶的分解,而外生菌根(ECM)树木森林则抑制了AM树种凋落叶的分解[14];又如在北方森林中,从96%的AM树种组成的森林到100%的ECM树种组成的菌根梯度,无论不同菌根树种的占比如何,根系及其菌根真菌的存在都显著提高了凋落物的分解速率[13]。HFA效应的发生主要是由于不同生境的分解者以不同的功能方式降解特定凋落物类型[3]。此外,根系分泌物在不同植被之间化学性质差异较大[15],而不同的菌根类型也会以特定的机制调节微生物群落[13,16—17]。这些因子导致同一生境内植物根系和分解者之间逐渐形成了特殊而又稳定联系[12,18—19]。因此,预测根系和菌根的存在可能会对HFA效应产生正反馈[12]。
森林中,约43%植物净初级生产力被分配到地下[20],根系为共生菌根真菌和其他异养微生物提供光合产物,刺激酶的合成,加强有机质的分解[21]。菌根真菌和腐生真菌是森林中控制绝大多数凋落物分解的两个关键类群[22]。腐生真菌通过分泌一系列胞外酶来促进低质量凋落物的分解[16,23]。但在菌根真菌中,AM真菌没有已知的腐生能力,但它们可以通过刺激其他异养微生物(尤其是腐生真菌)的活性来促进凋落物的分解[24—26]。而ECM真菌,一方面本身可以通过产生胞外酶来加速分解[27—28]。另一方面,由于对限制性养分的竞争,ECM真菌也可能通过抑制腐生真菌的繁殖从而减缓凋落物的分解速率[17,29—30],即“Gadgil效应”[31]。比如最近的一项研究表明,由于AM树种周围的土壤腐生真菌丰度较高,使得AM树种的凋落物比ECM树种具有更快的分解速率[16]。因此预计,不同菌根类型对腐生真菌的丰度的影响可能会调控凋落物的分解速率和HFA效应。
本研究在福建三明亚热带地区以两种不同菌根类型的阔叶树种为研究对象,设置凋落物互换和去除根系两种处理,探究不同菌根类型的根系长入凋落物层如何影响凋落叶的分解以及HFA效应。为深入理解不同菌根类型对养分循环过程的影响及其机制提供科学依据。假设:1)楠木人工林中,根系在凋落物层生长会加快凋落物分解,而格氏栲人工林中,根系在凋落物层生长会减缓或对分解没有影响。这个假设基于“Gadgil”效应,即AM菌根通过根系分泌物刺激腐生真菌的生长和酶的合成从而促进凋落物的分解,而ECM根系与腐生真菌存在拮抗作用。2)由于不同的根系分泌物和菌根类型会以独特方式调节土壤微生物群落,在原生生境植物根系和土壤微生物之间形成稳定和特殊的联系,因此,根系的存在会加强两种林分的HFA效应。
1 材料与方法
1.1 样地设置
研究地位于福建三明森林生态系统国家野外科学观测研究站(26°19′N, 117°36′E)。该地区属于亚热带季风气候,年均温和年均降水量分别为19.1℃和1656 mm。地势以低山丘陵为主,土壤主要为花岗岩发育的酸性红壤。2017年8月,选取54年的楠木(Phoebezhennan,AM 树种)和56年的格氏栲(Castanopsiskawadamii,ECM树种)纯林为研究对象,两个林分前茬均为格氏栲天然林。楠木林的平均树密度、平均树高和平均胸径分别为1076株/hm2、15.9 m和15.4 cm,格氏栲林为1010株/hm2、19.8 m和27.4 cm。两个林分凋落叶初始化学性质见表1。
1.2 实验设计
2017年6—8月,在楠木和格氏栲林中分别设置3个20 m×20 m的大样方,每个样方间隔50 m。每个样方内,用5个凋落物框(1 m × 1 m)收集新鲜且未被破坏的凋落叶,在室温下(25 ℃)风干15 d。采用网袋法(大小为20 cm × 25 cm,网眼大小为1.5 mm的尼龙网袋)进行分解实验,每个网袋两侧设置12个大小为0.25 cm2的小孔,便于土壤生物的进出[32]。随后每个网袋中放入15 g风干凋落叶。每个大样方内设置2个2 m × 2 m 的小样方,一个为有根处理:去除地表凋落物后将网袋直接铺于地表,细根可以自由的长入网袋;另一个为无根处理:在凋落物网袋下铺设1 μm × 1 μm孔径大小的尼龙网,以隔离细根和共生菌根。以往的研究表明,1 μm孔径可以通过养分,水分以及某些细菌,但可以阻挡72%的菌丝生长[33—34]。每个小样方都被平均分成两部分,分别放置15个楠木和15个格氏栲凋落物网袋,并用塑料绳固定。网袋布设完成后,于第30、90、180、360、540 d和720 d进行6次取样,并保存于4℃小型冰箱。在360 d时,取样后网袋中一部分样品放入冰盒中,立即送往实验室提取DNA。本次实验总计取样360袋。
1.3 测定项目与方法
将每次收集的网袋带回实验室后,残余的凋落物在65℃下烘干至恒重。碳氮含量用元素分析仪测定(Elemental EL MAX CNS analyser)。用连续流动分析仪测定(Skalar San++,荷兰)总磷含量。用酸解法测定木质素含量[35]。凋落叶酶活性测定参照Saiya-Cork的方法[36],用微孔板酶检测技术测定。本研究测定与碳(包括纤维素水解酶;β-葡萄糖苷酶;多酚氧化酶;过氧化物酶)、氮(乙酰氨基葡萄糖苷酶)、磷(酸性磷酸酶)获取有关的6种酶活性。为了对比不同处理之间酶活性的差异,将原始单位(μmol g-1h-1)转化为以天为单位(mol/g),得到凋落叶整个分解过程中累积的碳、氮、磷降解酶活性[37],分别用EC、EN、EP表示。
用内转录间隔区(ITS)测序的方法鉴定微生物的群落组成。DNA的提取采用ZR Microbe DNA MiniPrep kit试剂盒(Zymo 公司,美国)。反应体系和扩增条件的设置、后续OTU数据的处理参照Fang等[16]的方法。丛枝菌根真菌、外生菌根真菌和腐生真菌的鉴定依据Tedersoo等[38]提供的方法。将操作性分类单元(OTU)表归一化到最小测序深度,使用丛枝菌根真菌、外生菌根真菌和腐生真菌的OTUs条数作为相对丰度的度量。
1.4 统计分析
凋落物分解速率的变化采用Olson经典指数模型拟合,式中,k为分解系数,k值越大,分解越快。Mo为初始干重,Mt为凋落叶在t时刻的干重[39]。
通过下式计算两种凋落物的平均HFA效应:
Mean HFA=(khome-kguest)/kguest× 100
式中,khome和kguest分别是凋落叶在原始生境和其他生境中的分解系数。方差分析(ANOVA)用来检测凋落物类型、生境、根系处理及其相互作用对凋落物分解率、酶活性和腐生真菌丰度的影响。线性回归用于确定初始凋落叶质量和不同酶活性与分解速率的关系。冗余分析(RDA)确定初始的凋落叶质量和腐生真菌丰度与碳氮磷降解酶活性的关系,基于置换检验获得因子显著性(VIF<1.2)。Shapiro-Wilk′s检验和 Leven′s检验分别用于正态性和方差齐性检验。所有分析在R 4.0.0中进行。
2 结果与分析
2.1 根系对凋落物分解率和HFA效应的影响
在原生生境中,楠木(AM树种)和格氏栲(ECM树种)的凋落叶分解速率没有显著差异 (图1)。楠木根系的存在显著增加了原生生境凋落叶的分解速率 (图1)。然而对于格氏栲凋落叶来说,根系存在显著增加了其在客场的分解速率(图1)。相反,无论有根无根,楠木凋落物在主场和客场的分解速率均无显著差异(图1)。此外,有根和无根情况下,楠木凋落物的平均HFA值分别为-4.4%和7.7%,且无显著差异 (图1);而格氏栲凋落叶分别为-31.2%和6.2%,具有显著差异 (图1)。

图1 根系处理和生境对楠木和格氏栲凋落叶分解速率 (k) 以及平均主场效应(HFA)的影响
2.2 植物根系对碳氮磷水解酶活性的影响
在原生生境,格氏栲(ECM树种)根系的去除显著增加了格氏栲凋落叶的碳氮降解酶的活性(图2),但降低了磷降解酶的活性(图2)。此外,在楠木(AM树种)人工林中,根系存在也显著增加了格氏栲凋落叶磷降解酶活性(图2)。线性回归表明,磷降解酶活性对分解速率有正的效应(图3,校准R2= 18%;P= 0.021),而碳氮降解酶活性对分解速率无显著影响。
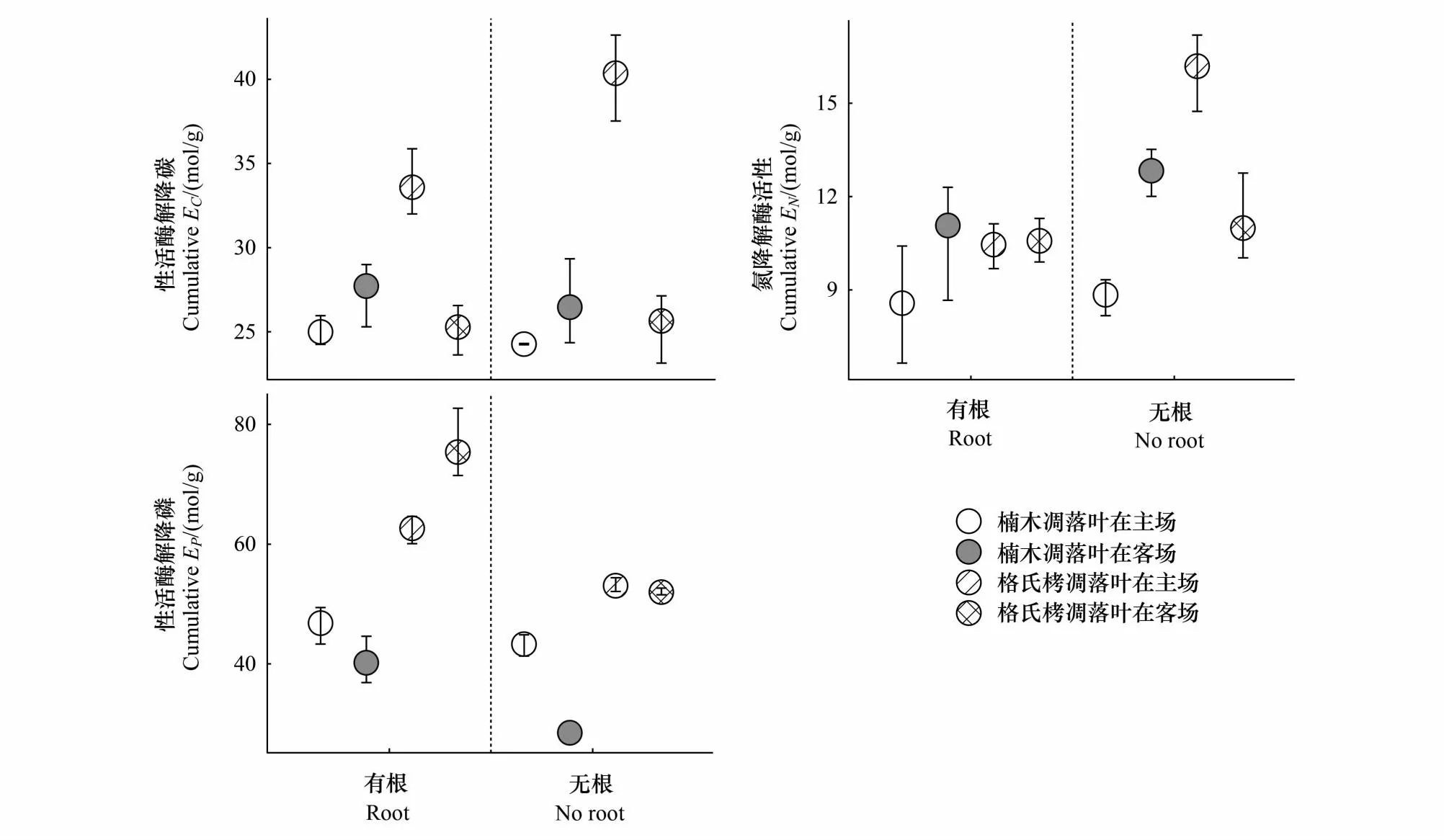
图2 根系处理和生境对楠木和格氏栲凋落叶碳氮磷降解酶活性的影响

图3 磷降解酶活性和凋落叶分解率的关系以及根系处理和生境对楠木和格氏栲凋落叶腐生真菌丰度的影响
2.3 植物根系对真菌群落组成的影响
方差分析的结果显示,在楠木(AM树种)人工林中,去除根系显著降低了两种凋落物的腐生真菌丰度(图3)。而在格氏栲(ECM树种)人工林中,去除根系却显著增加了两种凋落物的腐生真菌丰度(图3)。此外,在根系存在情况下,楠木凋落叶在主场时腐生真菌丰度显著高于客场;而有根情况下,格氏栲凋落叶在楠木林分中腐生真菌丰度更高(图3)。而去除根系后,不同凋落叶在主客场生境下腐生真菌丰度无显著差异(图3)。
2.4 凋落叶初始质量和腐生真菌丰度与水解酶活性的关系
冗余分析显示,有根情况下,腐生真菌丰度(P=0.001)和凋落物初始碳氮比(P=0.001)是影响降解酶活性的重要因子。根系存在的情况下, 凋落叶初始C/N比和腐生真菌丰度共同解释了酶活性的62.1%的变异(图4),且磷降解酶活性与腐生真菌的丰度呈正相关,与凋落叶C/N比呈负相关(图4)。而在菌根移除的条件下,凋落叶初始质量C/N比和腐生真菌的丰度共同解释了酶活性的31.5%的变异(图4)。

图4 凋落叶累积酶活性在有根和无根条件下的冗余分析
3 讨论
3.1 根系和菌根真菌对凋落叶分解速率的影响
结果支持了第一个假设,即楠木(AM)根系可能会加速其原生生境中的凋落叶分解率,而格氏栲(ECM)树种的凋落叶分解率在有根和无根的情况下没有明显差异(图1)。一种解释是,由于对限制性养分的竞争,在格氏栲人工林中,ECM真菌可以通过抑制根际腐生真菌的生长从而减缓了凋落物分解率,即“Gadgil效应”[30—31,40]。根系对微生物群落结构的影响主要是通过:1)以根系分泌物形式通过“激发效应”刺激微生物的活性[41—42];2)菌根真菌与土壤中其他异养微生物之间的相互作用[13,16]。这些机制的相互平衡调控着根际微生物的群落动态[12]。之前研究表明,不同菌根类型可以通过改变土壤中的腐生真菌的丰度来影响凋落物的分解速率[16]。然而,这种影响的大小和方向随菌根类型而变化。具体来说,AM根系往往可以提供比ECM根系更多的根系分泌物,通过提高土壤养分的有效性[24],来促进土壤中其它微生物的活性[13,43—44],而这些微生物从营养限制的条件下激发,可能导致分解速率短时间急剧增加。
然而,由于AM真菌本身无法合成水解酶,缺少矿化低质量底物的能力,其主要也是通过菌丝和光合产物获得能量和营养物质[45]。因此,有研究也发现,AM真菌也可能通过竞争限制性营养物质来抑制其他根际微生物的活性[46]。相比之下,由于ECM真菌和腐生真菌有着相同的进化史,其可以通过产生胞外酶水解复杂的化合物,释放生长和代谢功能所需的营养物质[47—49],因此,ECM真菌和腐生真菌更加相似的生态位导致二者竞争将更为激烈[16]。研究强调,在特定的生态系统中,菌根真菌和腐生真菌之间的不同互动机制(促进或拮抗)可能对凋落物分解产生重要影响[13]。
3.2 根系和菌根真菌对HFA效应的影响
与第二个假设相反,无论根系是否存在,楠木(AM)树种凋落物都没有显示出HFA效应(图1),而格氏栲(ECM)凋落物仅在有根的情况下显示出负的HFA效应(图1)。这一结果与以前的一些研究是一致的,比如,温带森林的研究发现,尽管凋落物生境条件发生很大的变化,但HFA效应却随凋落物质量而不同:高质量(较低的C/N)的凋落叶的分解确实受到不同生境的影响,而低质量落叶的分解率却与生境无关[14]。而亚热带的另一项互换凋落物的实验也发现阔叶树米老排(Mytilarialaosensis)凋落物表现出正的HFA效应,而针叶树杉木(Cunninghamialanceolata)凋落物表现出负的HFA效应[32]。一种解释是由于凋落物质量对分解的控制仍然占主导地位,比生境所起的作用更强。此外,功能宽度假说预测,长期生长在低质量凋落物中的微生物群落表现出广泛的功能宽度,因为低质量的底物化学成分往往更加复杂[4,50]。因此,高质量的凋落物(如本研究中的格氏栲树种凋落物)比低质量的凋落物对生境的变化更加敏感。
格氏栲凋落物只在菌根存在的情况下显示出负的HFA效应,这也是由于菌根真菌和腐生真菌之间的不同互作机制造成的[13,17]。进一步发现,楠木人工林中,根系存在情况下,两种凋落物腐生真菌的丰度显著高于根系排除,而原生生境下,阻隔菌根显著减少了楠木凋落物腐生真菌的丰度,但增加了格氏栲凋落物腐生真菌的丰度(图3)。这表明一个潜在的机制,即楠木根系(AM)和腐生真菌之间有一个净的积极的作用,而格氏栲根系(ECM)和腐生真菌之间拮抗作用占主导[13,16,28—29],导致格氏栲凋落物表现出负HFA效应。
3.3 根系和菌根通过调节腐生真菌的丰度和磷酸酶活性影响分解速率
冗余分析表明,腐生真菌的丰度是影响凋落物酶活性的一个关键因素(图4)。且根系存在情况下,磷水解酶活性与腐生真菌丰度呈正相关(图4)。分解过程中较高的磷水解酶活性表明微生物对磷的需求较高[51—52]。而腐生真菌通过水解一系列胞外酶,分解着大部分的凋落物(尤其是低质量凋落物)[53—54]。在森林中,阻断根系碳输入往往会使根际微生物群落处于营养有限的竞争环境[26,55],导致酶活性降低[30,56]。然而,研究发现,在阻隔根系后,不同生境凋落物只有磷水解酶活性降低(图2)。线性回归显示,磷酸酶活性和凋落叶分解率之间呈正相关(图3)。这些结果表明,根和菌根存在可能有利于磷酸酶活性的增加[13],而在亚热带森林中,由根系和菌根所调控的磷酸酶活性可能是植物获取有限养分的重要策略[57]。此外,研究发现在格氏栲人工林中,阻隔根系导致碳氮降解酶活性增加(图2)。这一结果表明了一个类似于“Gadgil”效应的过程,即异养微生物的代谢功能在ECM根系下可能被抑制[13,28]。此外,注意到阻隔根系的条件下,腐生真菌的丰度和氮水解酶活性正相关,这可能是由于在资源有限的环境中,底物的减少使得氮素变得更加重要,以维持微生物自身的基本代谢功能。
4 结论
研究发现,楠木(丛枝菌根)根系存在的情况下,格氏栲和楠木的凋落物均有较高的分解速率。而格氏栲(外生菌根)人工林中,根系对格氏栲凋落物分解速率无显著影响。这种结果是由于丛枝菌根系存在的情况下,腐生真菌丰度和磷降解酶活性更高。结果表明,菌根真菌和腐生真菌之间的不同互动机制(拮抗或促进)可能对特定生态系统中的凋落物的分解产生重要影响。此外,研究强调了在评估主场效应时,不同菌根类型是一个不可忽视的生物因素。值得注意的是,研究只基于一种丛枝菌根和外生菌根树种,未来的研究需要进一步的扩大树种和范围,以获得一个更为普遍的机制。
致谢:梁艺凡、王涛、张冰冰、杨军钱对野外调查和室内分析给予帮助,福建三明森林生态系统国家野外科学观测研究站提供外业调查支持。
