中医辨证施治胆管癌用药规律及药理学研究进展
2023-12-25白金钊贾立群陈冬梅刘闰平
白金钊,贾立群,陈冬梅,刘闰平*
1. 北京中医药大学中药学院,北京 100029
2. 中日友好医院 中西医结合肿瘤内科,北京 100029
胆管癌是指源于胆管系统衬覆上皮的恶性肿瘤,是第2 常见的原发性肝癌。胆管癌的发病率逐年上升,截至2019 年,中国的患病人数约为4 万人,居世界第1 位,是严重威胁我国人民健康的重大疾病[1-2]。胆管癌早期阶段症状轻微不易发现,但具有高度侵袭性,并对化疗等常规疗法不敏感,导致其预后极差。过去10 年中,研究者在胆管癌知识、诊断与治疗方面取得了一定进展,但现今胆管癌的预后仍不容乐观。手术切除是胆管癌治疗的主要手段,但术后复发率高达60%,并且手术切除技术伴随的不良反应会对人体造成不可逆转的损害,导致患者的预后不符合预期[3]。近年来,胆管癌的辅助治疗研究迅速,以系统性和局部治疗为主,旨在缩小病灶,防止或延缓复发转移,提高生存质量和生存期。包括化疗、靶向治疗、免疫治疗、放疗、经肝动脉放疗栓塞、经肝动脉灌注化疗、经肝动脉化疗栓塞和局部消融等手段。研究表明胆管癌辅助治疗可提高患者生存率,降低复发风险的成果,但无统一标准化治疗方案、缺乏数据支撑、具有争议性等问题[4]。故胆管癌新辅助治疗手段的发掘及规范化是未来研究的方向。近年来,中医凭借其在抑制癌症扩增,依从性好、治疗手段温和、不良反应小等优势被广泛应用于恶性肿瘤的辅助治疗。中医治疗体系以辨证论治为核心,因此,对胆管癌病因病机的深入研究,探讨胆管癌中医证候类型,梳理辨证论治的用药规律,对指导胆管癌的临床诊疗具有重大意义。
1 中医对胆管癌的认识
中医古籍中并无对胆管癌具体病名的记载,但仍在“黄疸”“癥瘕”“积聚”“胆胀”“胁痛”“鼓胀”等范畴中具有相关论述。《灵枢·胀论》中有:“胆胀者,胁下胀痛,口中苦,喜太息,心胁痛,不能转侧;肝胀者,胁下满而痛引少腹”的记载。《伤寒论》云:“湿热俱甚。则发身黄;两阳熏灼,其身必黄;此皆由内有热而又被火攻。以致发黄者也。”上述病证与胆管癌的症状颇为相似[5-6]。现代医学认为胆管癌的中医学认识多从肝胆经脉相互络属,构成脏腑中的表里关系。胆是“中精之腑”,储胆汁而传化水谷与糟粕,功能为通降下行。情绪不畅、寒湿不适、饮食不节、过食油腻、或虫积等,气血郁积胆腑和湿热瘀结中焦,使肝气与胆气闭塞不通。浊瘀蕴结阻滞胆络发为胀痛,肝气逆伐升降失司则痛满,肝郁气滞,胆腑不通则痛;湿蕴则发热或寒热往来,口苦咽干;湿热交蒸,胆汁外溢,浸淫肌肤,发为黄疸;瘀热不散,血瘀不行,瘀结日久,可成块成瘤。胆管癌病机复杂,证型繁多,目前尚无统一的辨证分型标准,中医治疗临床上主要以疏肝、健脾、清热、利湿、退黄为主,根据不同证候及临床症状的改变,通过传统中医临床诊断辅以现代科学临床手段进行辨证治疗,通过中西医结合的互补与配合提高患者的生存质量,延长生存时间。因中医辨证过程贯穿疾病发展始终,各证型在疾病发展过程中均可能出现,不利于中西结合辨证施治,故根据文献总结与专家建议[7-11],本文将胆管癌的主要证候根据疾病发展大致总结为5 种证型,见图1。其中癌前病变阶段以肝郁脾虚证为主,胆管癌前期常诊断为肝胆湿热证,中期多见湿热蕴蒸证与热毒炽盛证,胆管癌进展至后期时还可能诊断为脾阳虚衰证。
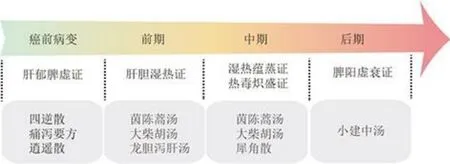
图1 胆管癌发展阶段与中医证型的关系Fig. 1 Relationship between stage of cholangiocarcinoma and traditional Chinese medicine syndrome
2 胆管癌辨证论治的用药规律
2.1 肝郁脾虚型胆管癌的辨证与常用方药
肝郁脾虚证临床以情志抑郁、胸肋胀痛、腹胀纳呆为主,兼以皮肤瘙痒、纳差、倦怠乏力、大便溏泄、腹痛欲泻、泻后痛减、舌苔白,脉弦或缓弱。此阶段尚未出现黄疸、包块等胆管癌典型症状,以实证为主,病情较轻,故中医治以疏肝理气、健脾化湿,临床以四逆散、逍遥散、痛泻要方加减为常用方药。其中四逆散注重补益肝气,相比其余经方更加柔和;逍遥散在疏肝理气之余更加注重温中健脾之效;而痛泻要方在补脾的同时更注重对消化系统的影响。
四逆散出自《伤寒论》,组方为柴胡、芍药、枳实、甘草。方中以柴胡为君药,为疏肝解郁、调和肝脾的基础方。既可疏解肝郁,亦能升清阳,使瘀热外透。李秀荣教授运用加味四逆散辅助化疗手段治疗胆管癌,运用“抑木扶土”思想有效治疗肿瘤[12]。现代药理研究表明,四逆散可选择性调控肠道菌群,进而抑制Sting 与视黄酸诱导基因-I 途径诱导的一型干扰素反应,改善小鼠结肠炎,可能通过肠-肝轴调控胆管疾病进展[13]。有研究表明四逆散可同时调节法尼醇X 受体(farnesoid X receptor,FXR)/雌激素硫酸转移酶信号通路抑制雌二醇水平与胆汁酸代谢来抑制乳腺癌的生长[14]。但是其抗胆管癌的基础研究尚未见报道。
逍遥散出自《太平惠民和剂局方》,组方为柴胡、当归、芍药、白术、茯苓、生姜、薄荷、甘草。以柴胡为君药,是疏肝解郁、养血健脾的代表方药。现代药理研究表明,逍遥散有抗精神紧张与抑郁,提高机体免疫机能的作用;逍遥散在临床中被广泛应用,并被证明辅助治疗能够有效改善肝癌患者的生存率,明显缓解其症状[15]。加味逍遥散可产生保肝作用,缓解小鼠的肝纤维化,其机制可能与抑制活性氧诱导的膜脂过氧化过程有关[16]。加味逍遥散联合脱氧胆酸在治疗原发性胆汁性胆管炎时具有良好的效果,且优于单用脱氧胆酸治疗[17]。
痛泻要方出自《景岳全书》,组方为陈皮、白术、芍药、防风。以白术为君药,该方重健脾益气、缓痛止泻,为治疗脾虚肝旺之痛泻的方药。药理研究表明,痛泻要方能够改善肠道菌群用以治疗结肠炎与克罗恩病,并通过“肝-肠”轴影响肝胆疾病[18]。
胆管癌肝郁脾虚证的临床表现以癌前病变为主,其主要治疗方剂对胆管癌患者的直接研究较少,但在胆管癌前病变如肝硬化[19]、胆石症[20-22]、胆汁淤积[23]、病毒性肝炎[24]等疾病,及胆囊癌[25]等肝胆恶性肿瘤的治疗过程中展现出良好疗效。中医手段介入相比对照组能够显著缓解症状,促进肝功能恢复,提高患者的生存质量,展现出治疗胆管癌癌前病变与早期癌症的潜力与可能性。因此,对治疗肝郁脾虚证胆管癌常用方剂的总结及关键中药的梳理,是“已病防变、已变防渐”治未病思想在癌症诊治过程中的运用与实施。
2.2 肝胆湿热型胆管癌的辨证与常用方药
肝胆湿热、肝郁气滞、胆腑淤滞而出现湿热内蕴,肝胆疏泄失常所致。临床以右上腹持续性胀痛或胁下有痞块为主,兼有身目发黄、皮肤瘙痒、口苦、口干渴、纳呆、呕恶、小便短黄、大便秘结、舌质红、舌苔黄腻、脉弦滑等症状。此阶段正虚邪实并存,湿热加重,气血湿热淤结于胆腑,阻塞肝胆之气,经络郁结是以胀痛,胆汁外溢发为黄疸。故中医治以疏肝利胆、清热利湿、软坚散结,相比肝郁脾虚更加注重清热泻火、利湿退黄。临床以茵陈蒿汤、大柴胡汤及龙胆泻肝汤加减。其中茵陈蒿汤退黄功效强于其余复方,对胆汁淤积的治疗作用也最为显著;大柴胡汤具和解少阳之功;泻火除湿功效以龙胆泻肝汤为甚[26],常被用于治疗胆结石、胆囊疾病、肝炎、黄疸等疾病[27]。
茵陈蒿汤出自《伤寒论》,组方为茵陈、栀子、大黄。以茵陈为君药,主行清热、利湿、退黄。是治疗黄疸的代表方剂[28]。黄疸是胆管癌的重要症状之一,梗阻性黄疸主要是由于胆道结石或肿瘤堵塞黄疸,导致胆汁排泄障碍,诱发皮肤黏膜发黄等症状,并能进一步发展为肝损伤、胆汁淤积、炎症、免疫功能失调等疾病,最终成为胆管癌病发的重要原因。临床随机对照试验结果显示,茵陈蒿汤联合手术治疗恶性胆管梗阻效果显著,治疗组总有效率显著高于对照组,能够显著改善黄疸病证,提高患者的生存质量[29]。刘光宪教授利用茵陈蒿汤合硝石矾石散治疗胆管癌,治疗后患者症状、体征、影像学及实验室检查结果均明显改善[30]。临床研究显示,茵陈蒿汤可显著改善恶性梗阻性黄疸患者的血流动力学与凝血功能,具有显著的临床价值。现代药理学对茵陈蒿汤的复方研究已较为深入,茵陈蒿汤能调控蛋白激酶R 样内质网激酶-C/EBP 同源蛋白-生长停滞与DNA 损害可诱导蛋白34 途径与核因子E2 相关因子2(nuclear factor E2 related factor 2,Nrf2)通路,促进Nrf2 的核易位,减轻梗阻性黄疸造成的肝损伤与氧化损伤[31-33]。一系列研究证实,茵陈蒿汤能够经由血小板衍生生长因子受体β/转化生长因子-β1(transforming growth factor-β1,TGF-β1)/Smad/细胞外信号调节激酶通路,调节胆汁酸产生与代谢,减少毒性胆汁酸的释放,恢复肝功能指标,抑制胆管上皮细胞的旁分泌,发挥保肝与抗纤维化作用,有效改善多种造模方式造成的胆汁淤积与肝纤维化[34-36]。这种作用可能与茵陈蒿汤诱导的肠道微生物群改善有关,依赖于“肝-肠”轴调节。茵陈蒿汤的主要有效成分槲皮素、山柰酚可促进人胆管癌HCCC9810 和QBC939 细胞凋亡,并能抑制QBC939 细胞异位移植模型小鼠胆管肿瘤的生长[37]。
大柴胡汤出自《伤寒论》,组方为柴胡、黄芩、芍药、半夏、生姜、枳实、大枣、大黄等。以柴胡为君药,为和解少阳、通腑泄热的方药。临床随机对照试验表明,相比单用化疗手段,加味大柴胡汤联合化疗对胆管恶性肿瘤引发的梗阻性黄疸具有更加显著的治疗效果,能够提高总体有效率,减轻不良反应及改善肝脏功能[38-40]。朱国先[41]使用大柴胡汤治疗胆管癌栓,发现患者均出现不同程度的肿瘤缩小、黄疸改善、肝功能恢复的疗效。王剑雄等[42]使用茵陈蒿汤联合大柴胡汤配合手术治疗胆管癌合并梗阻性黄疸,结果显示中药结合介入手段能显著加快退黄过程,促进肝功能恢复。现代药理研究证实,加味大柴胡汤能够激活过氧化物酶体增殖激活受体α(peroxisome proliferator-activated receptor α,PPARα)相关的c-Jun 氨基末端激酶/白细胞介素-6(interleukin-6,IL-6)/核因子-κB(nuclear factor-κB,NF-κB)/信号传导及转录激活因子 3(signal transducers and activators of transcription 3,STAT3)通路[43],并可调控胆汁酸途径,降低血清与肝脏中的牛磺胆酸和牛磺-α-鼠胆酸,增加肝脏中胆汁酸的旁分泌,恢复体内胆汁酸平衡,减弱内质网应激,抑制肝细胞凋亡,改善α-萘异硫氰酸酯(α-nephthyl isothiocyanate,ANIT)与胆管结扎(bile duct ligation,BDL)诱导的梗阻性肝损伤与胆汁淤积[44-45]。
龙胆泻肝汤出自《医方集解》,组方为龙胆草、黄芩、栀子、泽泻、木通、车前子、当归、生地黄、柴胡、甘草等,以龙胆草为君药,为泻肝胆实火、清下焦湿热的名方。现代药理研究显示,加味龙胆泻肝丸能够改善胆汁淤积大鼠的胆汁分泌,降低肝损伤与胆管损伤的程度[46],其水提物能够显著诱导人早幼粒白血病HL60 细胞与人结肠癌HT29 细胞的凋亡[27],具有抗胆管癌的潜力。
2.3 胆管癌其他证型的辨证与常用方药
除肝郁脾虚证与肝胆湿热证外,胆管癌还可能被诊断为湿热蕴蒸证、热毒炽盛证与脾阳虚衰证,由于这些证候的诊断频率不高或治疗方案重复,故进行统一阐述。其中湿热蕴蒸证是由于湿热内蕴,湿热时毒蕴结于肝胆,或熏蒸于肌肤、关节等所致。临床以身目黄染、脘腹痞胀疼痛、口干、口苦为主,兼以内心懊恼、纳差、周身困重乏力、恶心呕吐、小便短赤、大便秘结、舌质红、舌苔黄腻、脉濡数或滑数。中医治以清热散结、化瘀消积。临床以茵陈蒿汤、大柴胡汤加减为主。热毒炽盛是由于热毒壅滞肌肤、或腑气不通、温热入里、壅滞化毒、蕴结脏腑三焦所致。临床以黄疸加深、身黄如金、右上胸肋胀满疼痛、痛引肩背、发热烦渴为主,兼以神昏暗语、口干、纳差、小便短赤、大便脓血、呕血、衄血、舌质红绛、苔黄燥,脉弦数或滑。中医治以清热解毒、凉血通腑,临床以犀角散、茵陈蒿汤加减[7-8]。此阶段病证由轻症发展而来,湿热尤甚,用药与肝胆湿热证相似,但需注重却邪扶正兼顾,与前两证相比,犀角散起效快,清热凉血之功更甚,适用于清除蕴结脏腑之急。犀角散出自《千金要方》,由犀角、黄连、升麻、茵陈、栀子等组成以犀角为君药,用以清热凉血、通腑解毒,为治疗急黄的首选方剂。
当胆管癌病程进展至晚期时,体内正虚邪恋,故常诊断为脾阳虚衰证,即因久病劳损,或失治、误治等导致脾阳衰败,水湿内停所致。临床以形体消瘦,腹胀、右肋腹隐痛为主,兼以身目黄染、黄色晦暗、倦怠乏力、纳呆、畏寒、下肢水肿、大便溏泄、舌质淡胖、舌苔白、脉沉缓无力。此阶段用药以扶正为主。中医治以温中健脾,益气养血,临床以小建中汤加减[8]。此方注重温中补虚、和里缓急。小建中汤是由桂枝加芍药汤,重用饴糖组成。组方为饴糖、桂枝、芍药、生姜、大枣、炙甘草等以饴糖为君药,是温中补虚、调理脾胃的名方。
中医对于胆管癌的病因病机具有独到见解,并且积累了丰富的治疗经验,本文通过系统梳理胆管癌证型分类和对证方药,以中药综合资源数据库(http://www.megabionet.org/tcmid/)与中医智库数据库(https://www.duguji.cn/)中方剂库与古籍库作为数据来源,总结出各证型常见方剂及其基础组方[47],考虑上述各方中药物君臣佐使地位与出现频次等综合因素,筛选8 方中君药及出现频次≥2 的药物作为关键中药,以此发掘潜在的胆管癌治疗中药。根据其功效,可大致分为疏肝健脾、清热祛湿与其他功效3 类,见图2。

图2 胆管癌治疗方药中关键中药的筛选Fig. 2 Screening of key drugs in treatment of cholangiocarcinoma
3 治疗胆管癌的关键中药及其主要活性成分的药理学研究
3.1 疏肝健脾功效的关键中药
柴胡为疏肝解郁第1 要药,具有解表退热、疏肝解郁、升举阳气的功效,是四逆散与大柴胡汤中君药,并在逍遥散与龙胆泻肝汤中起到重要作用。药理学研究指明其具有抗炎、抗癌、保肝、抗病毒、免疫调节与自噬调节等作用[48-49],临床被用于治疗多种肝脏疾病。柴胡的主要成分包含三萜类皂苷、多糖、甾体化合物等。众多研究表明,柴胡皂苷可能通过调节一型干扰素途径、丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)途径与NF-κB 通路等过程,抑制促炎因子与诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧合酶-2(cyclooxygenase-2,COX-2)等炎症介质的释放[48],进而协同阻断肝炎病毒进入细胞并抑制病毒的复制过程,最终有效发挥抗病毒与保护病毒性肝炎向肝癌转归的作用[50]。柴胡皂苷的直接抗癌活性也较为明确,但是机制研究不够深入,主要集中于对于细胞周期和细胞凋亡的观察:如柴胡皂苷d 通过停滞细胞周期与激活细胞凋亡来抑制人肝癌HepG2、Hep3B 细胞与人肺癌A549 细胞的生长[51];柴胡皂苷a 通过抑制细胞周期蛋白激酶(cyclindependent kinase,CDK)抑制HepG2 细胞的生长[52],并且通过降低HepG2 细胞与人乳腺癌MCF-7 细胞中P-糖蛋白的表达,增强化疗效果[53]。柴胡皂苷是否通过其他机制,如干扰糖脂代谢和肿瘤微环境来发挥抗肿瘤作用亟待进一步研究确证。柴胡多糖能够减少肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子的释放减弱炎症,发挥抗氧化作用[54],并通过肠道菌群介导的成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)信号通路调节脂代谢,缓解肝脏脂质蓄积[55]。柴胡多糖的抗癌活性研究主要与免疫调控相关。研究表明柴胡多糖的抗肿瘤功能可通过NF-κB 通路激活巨噬细胞实现的[56]。“肝-肠”轴在胆管癌的发生发展中起到重要作用,故药物对肠道菌群的调控作用不容被忽略。研究表明柴胡多糖的抗炎、抗癌与脂代谢的调节作用依赖于肠道菌群的调控。
白术为补气健脾第1 要药,具有健脾益气、燥湿利水的功效,为痛泻要方中君药,同时在逍遥散中出现。药理学研究表明其具有抗炎、抗氧化、抗癌、保肝、抗菌与免疫调节等功能,是临床常用的治疗或辅助治疗肝癌、胃癌等消化系统肿瘤的药物[57]。内酯、多糖与挥发油类成分常被认为是白术的主要活性成分。白术内酯I 可通过Toll 样受体4(tolllike receptor 4,TLR4)/MAPK/NF-κB 等通路抑制炎症因子的产生,逆转对乙酰氨基酚诱导的氧化应激性肝损伤[58]。肝脏炎症与氧化应激造成的肝细胞损伤与代谢障碍是胆管癌诱发的重要前置因素,故对肝炎等疾病进行治疗干预有望在尚未形成恶性肿瘤的疾病早期减缓阻碍胆管癌的发生发展。此外,众多研究指出白术内酯还具有不同程度的抑制细胞增殖与诱导癌细胞凋亡特性,其抗癌机制的研究也较为广泛,为恶性肿瘤的辅助治疗与预后提供潜在助力[59]。白术内酯I、II 具有促进癌细胞凋亡、抑制癌细胞增殖与减少癌细胞转移、侵袭的作用。这种作用涉及线粒体介导的细胞凋亡途径与Janus 激酶2(Janus kinase 2,JAK2)/STAT3 与磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路,借由TLR4/髓样分化因子88(myeloid differentiation primary response protein 88,MyD88)途径抑制癌细胞迁移和侵袭,协同产生抗癌作用;白术内酯III 能升高miR-195-5p并下调成纤维细胞生长因子受体1 的表达,从而诱导肝细胞癌的凋亡,有效发挥抗肿瘤作用[60]。白术多糖的活性研究较为广泛,研究表明白术多糖能够改善肠道菌群,调节短链脂肪酸和胆汁酸的代谢水平,刺激巨噬细胞增殖与细胞因子产生,以“肝-肠”轴将胆汁酸代谢与免疫调节协同,缓解四氯化碳诱导的肝损伤,发挥保肝作用[61-63]。此外白术多糖的抗肿瘤作用较为明显,主要通过免疫调节对细胞周期产生影响[64]。研究显示白术多糖能通过诱导免疫应答,阻断细胞周期S 期发挥抗肿瘤作用,显著抑制小鼠肝细胞癌肿瘤的增殖[65],并通过抑制Wnt/β-连环蛋白通路抑制HepG2 细胞的增殖和侵袭[66]。但是白术多糖的抗肿瘤机制研究深度不足,仍需进一步研究阐明其发挥抗癌作用的原理。阿魏酸是白术中的酚酸类成分,研究表明其通过Nrf2/血红素加氧酶-1(heme oxygenase-1,HO-1)及PPARγ 通路抑制甲氨蝶呤诱导的炎症与组织损伤,发挥抗氧化作用[67]。多项研究表明,白术挥发油能够通过多种途径发挥抗炎作用,缓解完全弗氏佐剂诱导的炎症,其机制可能与氨基酸代谢相关[68]。白术挥发油被证实具有抗癌潜力,其通过调节自身免疫功能,抑制小鼠肝癌H22细胞与小鼠腹水瘤S180细胞体内外的增殖[69]。但是白术主要活性成分与胆管癌的直接研究未见报道。
枳实为破气行痰之要药,具有破气除痞、化痰消积的功效。枳实是四逆散与大柴胡汤中重要组分,具有抗炎、抗氧化、抗癌、保肝、调节胆汁酸与脂质代谢的作用[70],临床被用于治疗糖尿病、肥胖与焦虑症等疾病。柑橘黄烷酮类化合物是枳实的主要活性成分。研究表明橙皮苷与柚皮苷可能通过调节Nrf2 通路发挥抗氧化作用[71],增加过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化酶的活性,抑制炎症因子的产生,调节肝脏免疫功能,缓解因肝损伤或过氧化引起的肝病[72-73]。研究表明柚皮苷、橙皮苷与新橙皮苷能够改善肠道微生物失调,上调FXR/G蛋白偶联受体5(takeda G protein-coupled receptor 5,TGR5)通路并维护肠道菌群稳态,降低害胆汁酸的含量,通过“肝-肠”轴调节肝脏脂肪代谢与胆汁酸代谢,在改善肝脏内脂质堆积的同时减少炎症与损伤,显著缓解高脂饮食诱导的非酒精性脂肪肝炎[74]。圣草次苷通过NF-κB、MAPK 与STAT3 等信号通路显著降低炎症反应,并通过肠道菌群调节代谢,减少代谢疾病风险。枳实的抗癌活性研究主要集中于其主要成分圣草次苷对细胞周期与细胞凋亡的协同调节作用。圣草次苷通过调节凋亡标志物B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)相关X 蛋白(Bcl-2 associated X protein,Bax)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)和Caspase-9 的水平同时下调细胞周期蛋白A 与细胞周期蛋白D1 的表达,是潜在的肝癌抑制剂[75]。圣草次苷的抗癌机制研究还有待进一步深入。
3.2 清热祛湿功效的关键中药
茵陈为清利肝胆湿热之要药,具有清湿热、退黄疸的功效。茵陈为茵陈蒿汤中君药,并在犀角散中出现,用于治疗以黄疸、肝炎、过敏性皮炎等湿热证,现代常被用于治疗肝炎、胆汁淤积、肝纤维化与肝硬化等慢性肝病[76],是治疗黄疸的特效药。有机酸类、黄酮类、生物碱类与挥发油类是茵陈的主要成分,研究显示,茵陈的保肝作用可能通过增强肝脏解毒功能与抑制氧化过程改善肝脏循环来实现。众多研究表明,绿原酸能够降低胆汁酸合酶胆固 醇 7α-羟 化 酶(cholesterol 7α-hydroxylase,CYP7A1)、CYP8B1、CYP27A1 及多药耐药相关蛋白 2(multidrug resistance-associated protein 2,MRP2)、MRP3、MRP4、胆盐输出泵(bile salt export pump,BSEP)与有机溶质转运体B(organic solute transporter-β,OST-β)的表达,增加有机阳离子转运体 1(organic anion-transporting polypeptide 1,OATP1)、OATP2、牛磺胆酸钠共转运蛋白(sodium taurocholate co-transporting polypeptide,NTCP)的含量,调节胆汁酸代谢,降低胆汁酸释放,从而治疗胆汁淤积造成的胆囊损伤[76]。茵陈色原酮通过激活Nrf2/HO-1 与NF-κB/MAPKs 通路发挥抗炎与抗氧化功能,用于治疗炎症性疼痛[77]。此外,茵陈中黄酮类成分的抗癌活性也被广泛研究。对羟基苯乙酮通过激活非肌肉肌球蛋白14(myosin heavy chain 14,MYH14)来抑制胰腺癌,提示其具有抗胆管癌的潜力[78]。茵陈色原酮通过阻断STAT3 活化,抑制肿瘤的增长与侵袭[79]。然而,茵陈黄酮类成分是否通过其他机制发挥抗肿瘤作用仍需进一步深入研究。此外,莨宕碱是茵陈中生物碱成分,其通过调节巨噬细胞中的活性氧/p38/Nrf2 轴与PI3K/Akt/mTOR 通路缓解肝脏炎症,并抑制STAT3 诱导的血管平滑肌细胞增殖,同时通过抑制TGF-β/Smad 通路抑制肝星状细胞的活化,缓解肝纤维化进程[80]。茵陈中挥发油的功效也被广泛研究,研究表明桉叶油醇的抗癌机制研究与抗氧化相关,其通过调控NF-κB 与Nrf2 通路发挥抗炎与抗氧化活性,并且通过调控细胞周期,促进肝癌细胞的衰老[81]。
栀子为去火第1 要药,具有泻火除烦、清热利湿、凉血解毒功效。是茵陈蒿汤、龙胆泻肝汤与犀角散中的重要组分,具有抗炎、抗氧化、抗病毒、抗癌、调节胆汁酸代谢等作用,用于肝病、心血管疾病及多种代谢性疾病的治疗。环烯醚萜苷类、酚酸类化合物与多糖是栀子的主要活性成分。药理研究表明栀子苷是栀子中含量最多的活性成分,其能够下调STAT3 与NF-κB 通路以维持胆汁酸稳态,下调与CYP7A1、CYP8B1 和CYP27A1 降低胆汁酸合成,抑制OATP2 降低胆汁酸摄取,增加BSEP 与OSTB 增加胆汁酸分泌3 种途径,协同避免过量有毒胆汁酸在肝脏中积累,从而改善ANIT 诱导的胆汁淤积造成的肝损伤[82-83]。栀子苷的抗癌活性明确,机制研究较为深入,有报道阐释了栀子苷通过TLR4/MyD88 途径抑制STAT3/Sp1 的依赖性血管内皮生长因子(vascular endothelial growth factor,VEGF)过表达,在体内外抑制肝细胞癌生长的机制[84]。栀子苷经肠道菌群代谢为京尼平。京尼平被肠道吸收后经门静脉转移至肝脏,改善多种肝脏疾病。研究表明京尼平能够增加MRP2 在胆管中的分布,增加分解胆红素的能力,并在ANIT 诱导的胆汁淤积模型中,有效改善胆汁淤积和肝细胞坏死,发挥利胆作用[85];京尼平通过降低α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达与DNA/胶原蛋白合成,发挥抗纤维化作用,此外,京尼平的抗炎、抗氧化、免疫调节及抗癌活性也有广泛报道[86]。研究表明肝炎中的炎症因子释放能够在诱导肝纤维化的同时促进肿瘤的增殖,故肝纤维化也是诱发胆管癌的重要因素,治疗肝纤维化能够显著减少其转变为恶性肿瘤的几率。绿原酸是栀子中的主要酚酸类化合物,药理活性研究广泛。研究表明绿原酸的保肝利胆作用主要是来源于肠道菌群调控的“肝-肠”轴介导的氨基酸、葡萄糖与脂肪酸代谢的改变[87]。栀子多糖的药理活性研究也十分丰富。研究表明其能够抑制TLR4/NF-κB 通路,促进胆汁酸的代谢功能,降低肝脏中胆汁酸的水平,治疗ANIT 诱导的胆汁淤积性肝损伤,并通过粪菌移植实验验证了该活性来源于栀子多糖对肠道微生物的调控,即“肝-肠”轴可能在栀子多糖治疗胆汁淤积性肝损伤过程中起到关键作用[88]。栀子多糖可显著逆转内毒素造成的免疫应激,增加巨噬细胞产生TNF-α、γ 干扰素、IL-1β、IL-6 和粒细胞-巨噬细胞集落刺激因子的能力,发挥免疫调节作用[89]。研究表明栀子苷酸可通过调节TNF-α 的释放和Bax、Bcl-xL 蛋白的表达来抑制肝细胞凋亡,同时激活HO-1 和Nrf2,共同发挥保肝作用,改善脂多糖与氨基半乳糖诱导的急性肝衰竭造成的肝损伤[90]。栀子的直接抗癌活性研究较少,明确其是否有抗癌活性及其潜在的可能机制是未来研究的重要方向。
黄芩为清热燥湿之良药,具有清利湿热、泻火解毒、止血、安胎的功效。黄芩为大柴胡汤中君药,并在龙胆泻肝汤与犀角散中承担重要作用,研究表明,黄芩具有抗炎、抗癌、调节胆汁酸代谢、抗菌、保肝等多种作用[91],用于治疗胆汁淤积性肝损伤与肝细胞癌等肝脏疾病。环烯醚萜苷、多糖等是黄芩的主要成分。研究表明黄芩苷被肠道吸收后会很快被水解为苷元黄芩素,经体循环达到肝脏后转变回黄芩苷,这种肝肠循环过程确保黄芩苷集中于肝脏,有益于肝病的治疗。此外,黄芩水提物、黄芩苷与黄芩素均具有调节脂代谢的能力,通过降低低密度脂蛋白与三酰甘油,升高高密度脂蛋白的水平,同时抑制肝脏中CYP7A1 的表达,降低胆汁中血清总胆汁酸的水平,维护肝脏内脂质与胆汁酸平衡。这种能力源于FXR 介导的肠道菌群改变,依赖“肝-肠”轴的调控[92]。另有研究证实黄芩苷能够激活Sirtuin 1/肝细胞核因子-1α/FXR 通路,增加肝脏中CYP27a1 与Bal、Baat、Sult2a1 等酶的表达,抑制TNF-α、IL-1β、IL-6 与NF-κB 等炎症因子的产生,减少肝脏中胆汁酸积累,改善17α-乙炔雌二醇诱导的胆汁淤积性肝损伤[93]。Shen 等[94]利用BDL 模型评估黄芩苷治疗胆汁淤积性纤维化的作用与机制,结果显示黄芩苷调节Nrf2 通路降低炎症因子与氧化应激标志物的释放,同时协同降低DNA 片段化、Caspase-3 与多聚ADP 核糖聚合酶等细胞死亡标志物,改善线粒体电子传递链的功能,降低基质金属蛋白酶抑制剂1、α-SMA、I 型胶原蛋白与纤连蛋白的表达,达到抑制肝星状细胞活化,减少肝纤维化损伤的目标。黄芩苷的直接抗肿瘤活性明确,但机制研究尚未深入,现有的研究集中于细胞周期及炎症因子表达的变化。研究表明黄芩苷能够升高Bax/Bcl-2 的值,下调细胞周期蛋白A、细胞周期蛋白依赖性激酶2 及细胞周期蛋白D1 的表达以诱导癌细胞凋亡,抑制HepG2 细胞与人肝癌SMMC-7721 细胞的活力[95-96],其分子层面抗癌机制亟待继续深究。黄芩中其他成分也具显著活性,汉黄芩素可呈剂量相关性抑制乙型肝炎病毒(hepatitis B virus,HBV)转染的肝细胞系MS-G2 中HBV 抗原HBsAg 的分泌,降低HBV DNA 聚合酶活性,发挥保肝与抗病毒作用。
大黄是治疗阳明腑实之要药,为药中“将军”,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经的功效。大黄是大柴胡汤与茵陈蒿汤中的重要组分,药理学研究表明,大黄具有抗炎、抗氧化、抗癌、抗病毒、免疫调节等功能。大黄提取物可显著逆转酒精造成的炎症与氧化标志物的升高,此外,其通过抑制TLR4 的表达,同时改变肠道菌群的组成,维护肠道功能稳态,从而通过“肝-肠”轴治疗肝损伤[97]。蒽醌类化合物是大黄的主要成分,多种研究表明,大黄蒽醌类化合物对多种通路及靶点具有抑制作用,此为大黄药效的基础[98]。研究表明大黄酸、芦荟大黄素、大黄素甲醚能够保护胆管上皮细胞和肝细胞,改善ANIT 造成的胆汁淤积、细胞坏死及胆道梗阻。大黄素的抗癌功能显著,其研究具有一定深度,研究表明其通过抑制人肝细胞中的组成型与诱导型STAT3 活化,同时协同抑制c-Src、JAK1和JAK2 活化,共同下调细胞周期蛋白D1、Bcl-2、Bcl-xL、VEGF 等STAT3 下游基因的表达,加速肝癌细胞凋亡,并在小鼠原位肝癌模型中发挥显著的抑癌作用[98]。此外大黄素能够与化疗药物竞争性结合P-糖蛋白的结合位点,发挥人胆管癌多药耐药细胞QBC939/ADM 的耐药逆转作用,展现出显著的抗癌潜力,为大黄治疗恶性肿瘤提供思路与数据支持[99-101]。研究表明大黄多糖通过TLR4/NF-κB 通路激活巨噬细胞,诱导TLR4、Myd88 和NF-κB p65蛋白和基因表达,并诱导细胞因子的产生,发挥抗炎与免疫调节作用[102]。
龙胆草为治肝经湿热、实火之要药,具有清热泻火、明目、散结消肿的功效。龙胆草为龙胆泻肝汤中君药,药理学研究发现龙胆草具有抗炎、抗氧化、抗病毒、保肝、调节胆汁酸代谢等功能,临床中用于代谢性疾病、心血管疾病及恶性肿瘤的治疗[103]。龙胆草根茎中含有丰富的环烯醚萜苷,龙胆苦苷与獐牙菜苷是其中主要成分。研究表明,龙胆苦苷能够激活胆汁酸受体TGR5,上调肝脏中胆汁酸合酶CYP8b1 和CYP27a1,转运蛋白MRP4、多药耐药蛋白1(multiple drug resistance 1,MDR1)和OSTβ 及胆汁酸循环蛋白Asbt 和Fgf15 的水平,促进胆汁酸代谢,缓解ANIT 诱导的胆汁淤积[104]。此外,龙胆苦苷通过作用于Nrf2 与NF-κB 通路,同时调控线粒体自噬过程,有效减轻肝脏氧化损伤与脂肪堆积[105]。众多研究表明,獐牙菜苷能够有效改善胆汁淤积,在ANIT 诱导的胆汁淤积性肝炎中促进胆汁分泌,通过降低血清酶及胆红素的水平,逆转ANIT 改变的MRP2、OST-β、MDR1、NTCP、OATP1a1 和OATP1b 的表达,改善胆汁酸代谢紊乱。此外,獐牙菜苷对炎症因子调控的作用是其治疗胆汁淤积性肝炎的重要机制[106-107]。
3.3 其他功效的关键中药
当归为补营之圣药,具有补血调经、活血止痛、润肠通便的作用。当归是逍遥散、龙胆泻肝汤与犀角散中重要组分,其具有造血、抗氧化、抗癌、神经系统保护、免疫调节等活性。当归的活血主要体现于促进血液循环、抑制血小板聚集、血管保护、抗动脉粥样硬化等方面。丁烯基苯酞的抗肿瘤活性十分显著,众多研究已证明其对肝细胞癌的抑制作用[108],在体内、外均能诱导癌细胞的凋亡,但其抗癌机制研究不够深入,研究显示其抗癌机制可能与细胞周期抑制和外源性与内源性细胞凋亡途径有关,分子层面的药理机制研究尚有不足。
芍药为花中之相,具有养血柔肝、缓中止痛、敛阴收汗的功效。芍药在四逆散、逍遥散、痛泻要方、大柴胡汤、小建中汤中均有应用,具有抗炎、抗氧化、免疫调节等功能。众多研究表明单萜糖苷类、多酚类及有机酸类化合物是芍药的主要活性成分。芍药总苷是从芍药根部中提取出的单萜糖苷类成分,由芍药苷、芍药内酯苷、氧化芍药苷等组成[109]。芍药苷占芍药总苷含量的40%,是其发挥作用的主要成分。研究显示其能够作用于AMPK、JAK2、PI3K、G 蛋白偶联受体等通路,通过调节多种免疫细胞的功能与活化,抑制炎症因子的产生,发挥抗炎作用[110]。此外,多酚类化合物儿茶素、丹皮酚与没食子酸也在芍药中发挥重要作用。儿茶素是一种天然抗氧化剂,其机制包括消除活性氧、抑制自由基的产生和逆转脂质过氧化过程。有报道指出儿茶酚有益于癌症的预后与预防,但其机制研究尚待深入[111]。研究表表明丹皮酚及其衍生物通过抑制促炎因子生成、调节酶、蛋白质及相关信号通路,达到抗炎及神经保护作用[112]。没食子酸是一种抗氧化剂、多种研究证实了没食子酸在肠道免疫功能中的调节作用,发挥细胞保护与抗炎功能,此外没食子酸具有广谱抗菌作用,能够抑制丙型肝炎病毒的活性[113]。
4 结语与展望
胆管癌病因病机复杂,涉及证型繁多。本文着重于胆管癌各种证侯的异同,归结为肝郁脾虚证、肝胆湿热证、湿热蕴蒸证、热毒炽盛证与脾阳虚衰证5 种分型。与此同时对各证型主要方药的特点进行辨析,总结其用药规律和研究进展,以期更好地实现因证施治,发挥中医治疗恶性肿瘤的优势。结果显示,关键中药的功效集中于疏肝健脾与清热祛湿,其中疏肝健脾药物的药理作用包括调控炎症、抗氧化应激和保肝等方面;清热祛湿药物的药理作用更侧重于调节胆汁酸代谢、抗病毒、抗癌等方面;此外各药兼有调节免疫与维持肠道微生态平衡的作用。这些药理作用所调控的病理过程在胆管癌的发生发展中均扮演了关键角色,靶向抑制这些作用将对胆管癌展现较强的干预作用。但是,中药直接抗胆管癌的活性评价和机制研究相对不足,仍需进一步挖掘其潜力。此外,肠道菌群在多种致病过程中具有重要作用,肠道微生态失衡会干扰免疫过程、炎症介质的释放及代谢过程,诱发炎症免疫反应、胆汁酸疾病与糖脂代谢疾病,间接导致胆管癌的发生。临床研究表明,与健康人群相比,胆管癌患者肠道菌群丰度与构成存在显著差异,提示肠道菌群具有成为胆管癌新生物标志物的潜力[114]。而多项基础研究均揭示部分关键重要及其有效成分对肠道菌群具有显著调控作用。如栀子中的栀子多糖能够改善肠道菌群紊乱,治疗ANIT 诱导的胆汁淤积性肝损伤[88]。黄芩水提物、黄芩苷与黄芩多糖能够维护肠道菌群稳态,调控胆汁酸、短链脂肪酸、炎症因子的分泌及糖脂代谢[115-116]。芍药中没食子酸类化合物调节肠道菌群,保证其调节免疫功能与抗氧化活性[117]。枳实中的柑橘黄酮类成分通过改变肠道微生态改善炎症、氧化应激与胆汁酸代谢过程,发挥保肝作用[74]。因此,对“肝-肠”轴的研究可能为解析中药治疗胆管癌机制提供新思路,从而在未来发掘出潜在的通过靶向调节“肝-肠”轴治疗胆管癌的活性成分与药物。
综上所述,本文系统梳理了胆管癌不同发展阶段和证型的用药规律和关键中药的药理学研究进展,可以推动“辨证论治”中医理念在恶性肿瘤防治中的应用和创新中药和中药来源药物的发现。
利益冲突所有作者均声明不存在利益冲突
