人参皂苷Rg1 对心肌细胞氧化应激损伤的抑制作用
2023-12-25石洪洋崔笑天
石洪洋,董 慧,刘 嘉,崔笑天,郭 毅,洪 兰*
1. 延边大学农学院 食品与生物科学系,吉林 延吉 133002
2. 延边大学医学院 生理学与病理生理学教研室,吉林 延吉 133002
3. 长春中医药大学附属医院,吉林 长春 130000
人参为五加科植物人参PanaxginsengC. A.Mey.的干燥根和根茎,具有提高免疫力[1]、改善心血管功能[2]、缓解疲劳和抗氧化[3]等多种功效。人参皂苷Rg1是人参主要活性成分之一,具有显著的抗氧化、抗肿瘤等作用[4-6]。氧化应激是急性心肌梗死(acute myocardial infarction,AMI)发生心室重构的关键因素,最终导致线粒体功能损伤和细胞凋亡[7]。但人参皂苷Rg1对H2O2诱导心肌细胞的氧化应激是否起保护作用尚不清楚。
微小RNA(microRNA,miRNA)是由20~25个核苷酸组成的非编码RNA,具有调节基因表达等功能。研究发现,人参皂苷通过调节miRNA 的表达发挥抗氧化应激的作用,miR-499 是一类与抑制氧化应激损伤有关的RNA[8],已被证明在心血管疾病的发病和进展中发挥作用[9],包括心肌肥大[10]、缺血性心脏病[11]等。miR-499 已被确定为AMI 和心力衰竭的潜在生物标志物[12-13]。miR-499c 是和miR-499 同源的一种特殊RNA,由德克萨斯A&M 大学发现,可以将多种干细胞诱导转化为心肌细胞[14],但miR-499c 是否具有对心肌细胞的保护作用尚不清楚,并且其是否参与人参皂苷Rg1的抗氧化机制更不甚清楚。故本研究旨在探究人参皂苷Rg1对心肌细胞氧化应激损伤的抑制作用,并通过体外构建H9c2 细胞的miR-499c 转染模型,探讨人参皂苷Rg1通过miR-499c 参与氧化应激的抑制作用,以评估其在心脑血管疾病治疗中的潜在价值。
1 材料
1.1 细胞
H9c2 细胞(批号CL-0089)购自武汉普诺赛生命科技有限公司。
1.2 药品与试剂
人参皂苷Rg1(质量分数≥98%,批号SG8330)购自北京索莱宝科技有限公司;30% H2O2(批号C04045101)购自南京化学试剂股份有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(批号C0016)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号S0131S)、总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(批号S0101S)、线粒体膜电位检测试剂盒(批号C2006)均购自上海碧云天生物科技有限公司;CCK-8 试剂(批号C0037)购自美国Invigentech 公司;B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号EPR17509)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)抗体(批号E63)、剪切型半胱氨酸天冬氨酸蛋白酶-3(cleaved cysteinasparate protease-3,cleaved Caspase-3)抗体(批号EPR21032)均购自英国 Abcam 公司;cleaved Caspase-9 抗体(批号9507S)、β-actin 抗体(批号12620)、山羊抗兔IgG 二抗(批号7074)均购自美国CST 公司;Lipofiter 3.0 转染试剂(批号HB-LF3-1000)、miR-499c 转染质粒(目的基因序列3’-ACAGACTTGCTGTGANGTTCACGTGGAGAGGAGTTAAACATCACTGCAAGTCTTAACAGCCGCCCGCCCAAGGCACAGGGGACAGGGCCCCTATAGTGAGTCNTATTAAAA-5’)购自上海汉恒生物科技有限公司;DMEM 液体培养基(批号C3103-0500)、特级胎牛血清(批号C04001-050)、胰蛋白酶-EDTA(批号C3530-0100)、青链双抗(批号C3420-0100)均购自上海逍鹏生物科技有限公司;活性氧(reactive oxygen species,ROS)试剂盒(批号C3890)购自美国APE×BIO 公司;心房钠尿肽(atrial natriuretic peptide,ANP,批号D04B)购自北京北方生物技术研究所有限公司。
1.3 仪器
Forma™型直热式CO2培养箱、Heraguard™ECO型超净工作台、MicroCL 17 型微量离心机、EVOS M700 型荧光倒置显微镜、Varioskan LUX 型多功能酶标仪(美国Thermo 公司)。
2 方法
2.1 细胞培养
复苏H9c2 细胞,用含10%胎牛血清的DMEM培养液培养,当细胞融合度达80%~90%时传代。用胰蛋白酶消化细胞,1∶3 进行传代接种。继续培养,调整传代后的细胞密度为5×104个/mL,用于后续实验。
2.2 CCK-8 法测定细胞存活率
2.2.1 氧化应激模型条件 将H9c2 细胞铺于96 孔板内,每孔100 μL,培养24 h 后,分别给予0、75、150、300、600、1200 μmol/L 的H2O2处理细胞20 min[15]。每孔加入10 μL CCK-8 溶液继续培养2 h,测定吸光度(A)值,计算细胞存活率。
2.2.2 人参皂苷Rg1对H9c2 细胞存活率的影响 将H9c2 细胞铺于96 孔板内,每孔100 μL,培养24 h后,分别加入0、10、20、40、80 μmol/L 的人参皂苷Rg1处理细胞24 h。每孔加入10 μL CCK-8 溶液继续培养2 h,测定A值,计算细胞存活率。
2.2.3 人参皂苷Rg1对氧化应激模型细胞存活率的影响 将H9c2 细胞铺于96 孔板内,每孔100 μL,培养24 h。设置对照组、模型组、人参皂苷Rg1(10、20、40、80 μmol/L)组和ANP(1 nmol/L)组,人参皂苷Rg1组加入不同浓度的药物处理24 h,ANP组加入药物处理20 min;模型组和各给药再加入600 μmol/L 的H2O2处理20 min 制备氧化应激模型,对照组加入不含药物不含H2O2的培养基。每孔加入10 μL CCK-8 溶液继续培养2 h,测定A值,计算细胞存活率。
2.3 人参皂苷Rg1 对氧化应激模型细胞LDH 漏出率的影响
将H9c2 细胞铺于6 孔板内,每孔1500 μL,设置对照组、模型组和人参皂苷Rg1(10、20、40、80 μmol/L)组,按“2.2.3”项下方法给药后,取培养液上清,2500 r/min 离心5 min,取上清液25 μL,按照试剂盒说明书检测LDH 活性。
2.4 人参皂苷Rg1 对氧化应激模型细胞SOD 活性和MDA 水平的影响
将H9c2 细胞铺于6 孔板内,每孔1500 μL,按“2.3”项下方法分组和给药后,按照试剂盒说明书检测SOD 活性和MDA 水平。
2.5 人参皂苷Rg1 对氧化应激模型细胞ROS 水平的影响
将H9c2 细胞铺于6 孔板内,每孔1500 μL,按“2.2.3”项下方法分组和给药后,用稀释后的DCFHDA 重悬细胞,调节细胞密度为1×106个/mL。孵育20~30 min,每隔3~5 min 颠倒混匀1 次,使探针和细胞充分接触。选择488 nm 激发波长,525 nm发射波长,用荧光显微镜观察荧光强弱。
2.6 人参皂苷Rg1 对氧化应激模型细胞线粒体膜电位的影响
将H9c2 细胞铺于6 孔板内,每孔1500 μL,按“2.2.3”项下方法分组和给药后,各孔加入培养液和JC-1 染色工作液各1 mL,充分混匀,避光孵育20 min,加入JC-1 染色缓冲液洗涤2 次后,通过荧光显微镜观察并拍照记录。
2.7 人参皂苷Rg1 对氧化应激模型细胞凋亡相关蛋白表达的影响
将H9c2 细胞铺于6 孔板内,每孔1500 μL,按“2.3”项下方法分组和给药后,收集细胞,BCA 法测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,于5%脱脂牛奶中封闭1 h,加入一抗,4 ℃孵育过夜;加入二抗孵育1 h,ECL 化学发光,将PVDF 膜放入曝光盒中,在UVP 凝胶成像系统上观察条带并拍照。
2.8 PCR 检测miR-499c 表达
将H9c2 细胞铺于6 孔板内,每孔1500 μL,设置对照组和人参皂苷Rg1(40 μmol/L)组,给予药物干预24 h 后,使用无酶的EP 管收集细胞,于通风橱内加入1 mL Trizol,颠倒混匀。加入氯仿,混匀,室温静置。4 ℃、12 000 r/min 离心15 min。取出EP 管置于冰上,用无酶枪头将上清液小心吸取至新的EPA 管中。加入同体积异丙醇,混匀,室温静置。4 ℃、12 000 r/min 离心15 min,弃上清。加入75%乙醇,颠倒使RNA 浮起。4 ℃、12 000 r/min离心5 min,弃上清,无菌风吹干。加入10~20 μL DEPC 水,静置5 min,吹打混匀,测量RNA 浓度。
2.9 miR-499c 转染
将4 μL miR-499c 质粒稀释到250 μL DMEM 培养基中,轻轻吹打混匀。取另一离心管,加入250 μL 无血清 DMEM 培养基,再加入 10 μL Lipofiter3.0,轻轻吹打混匀,室温放置5 min。将以上2 只离心管溶液混合,吹打混匀,室温孵育20 min。将500 μL 混合溶液均匀加入到6 孔板中,“8”字摇晃均匀。培养6 h 后,更换含血清的细胞培养液继续培养。设置模型组、人参皂苷Rg1+H2O2组、miR-499c+H2O2组、人参皂苷Rg1+miR-499c+H2O2组,模型组加入600 μmol/L 的H2O2处理细胞20 min 制备氧化应激模型;人参皂苷Rg1+H2O2组加入40 μmol/L 人参皂苷Rg1处理24 h,再制备氧化应激模型;miR-499c+H2O2组将miR-499c 转染到H9c2 细胞72 h,再制备氧化应激模型;人参皂苷Rg1+miR-499c+H2O2组将miR-499c 转染到H9c2 细胞72 h,再加入40 μmol/L 人参皂苷Rg1处理24 h,最后制备氧化应激模型。按“2.5”“2.6”项下方法检测细胞ROS、线粒体膜电位水平。
2.10 统计学分析
实验数据用GraphPad Prism 9.0 软件进行统计学处理,所有数据均以±s表示。
3 结果
3.1 H9c2 氧化应激模型制备
如图1 所示,75~1200 μmol/L 的H2O2处理H9c2 细胞20 min,细胞存活率降低,并呈剂量相关性。600 μmol/L 的H2O2处理细胞20 min 后,细胞存活率显著降低至(60.39±2.87)%(P<0.001)。因此,选用600 μmol/L 的H2O2作为制备氧化应激模型条件。
3.2 人参皂苷Rg1 对H9c2 细胞氧化应激损伤的抑制作用
3.2.1 人参皂苷Rg1对氧化应激模型细胞存活率的影响 如图2-A 所示,不同浓度的人参皂苷Rg1处理H9c2 细胞24 h 后,细胞存活率无明显影响,表明人参皂苷Rg1对H9c2 细胞无毒性作用。如图2-B 所示,与对照组比较,模型组细胞存活率明显降低(P<0.001);与模型组比较,人参皂苷Rg1(40、80 μmol/L)组细胞存活率显著升高(P<0.01、0.001),且呈剂量相关性。本团队前期研究工作中发现ANP 可以抑制H9c2 细胞氧应激化损伤且具有心肌保护作用,因此利用ANP 作为阳性对照发现,ANP 对氧化应激模型H9c2 细胞存活率作用与40 μmol/L 人参皂苷Rg1的作用相近[16]。

图2 人参皂苷Rg1 对H9c2 细胞 (A)、H2O2 诱导的H9c2 细胞 (B) 存活率的影响 (±s, n = 3)Fig. 2 Effect of ginsenoside Rg1 on cell viability of H9c2 cells (A) and H2O2-induced H9c2 cells (B) (±s, n = 3)
3.2.2 人参皂苷Rg1对H2O2诱导的H9c2 细胞LDH漏出率的影响 如图3 所示,与对照组比较,模型组细胞LDH 漏出率显著升高(P<0.001);与模型组比较,各给药组LDH 漏出率均明显降低(P<0.01、0.001),且呈剂量相关性。
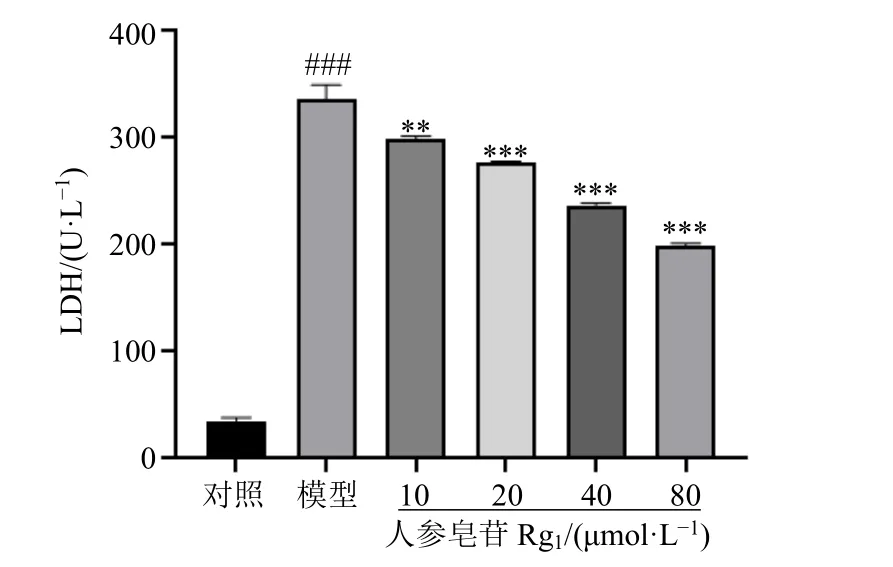
图3 人参皂苷Rg1对H2O2 诱导的H9c2 细胞LDH 漏出率的影响 (±s, n = 3)Fig. 3 Effect of ginsenoside Rg1 on leakage rate of LDH in H2O2-induced H9c2 cells (±s, n = 3)
3.2.3 人参皂苷Rg1对H2O2诱导的H9c2细胞MDA水平和SOD 活性的影响 如图4 所示,与对照组比较,模型组细胞MDA 水平显著升高(P<0.001),SOD 活性显著降低(P<0.001);与模型组比较,各给药组MDA 水平显著降低(P<0.01、0.001),人参皂苷Rg1(20、40、80 μmol/L)组SOD 活性显著升高(P<0.01、0.001),且呈剂量相关性。

图4 人参皂苷Rg1 对H2O2 诱导的H9c2 细胞MDA 水平和SOD 活性的影响 (, n = 3)Fig. 4 Effect of ginsenoside Rg1 on MDA level and SOD activity in H2O2-induced H9c2 cells (±s, n = 3)
3.2.4 人参皂苷Rg1对H2O2诱导的H9c2 细胞ROS水平的影响 如图5 所示,与对照组比较,模型组细胞ROS 水平显著升高(P<0.001);与模型组比较,人参皂苷Rg1(20、40、80 μmol/L)组和ANP组ROS 水平显著降低(P<0.05、0.01、0.001),且呈剂量相关性。
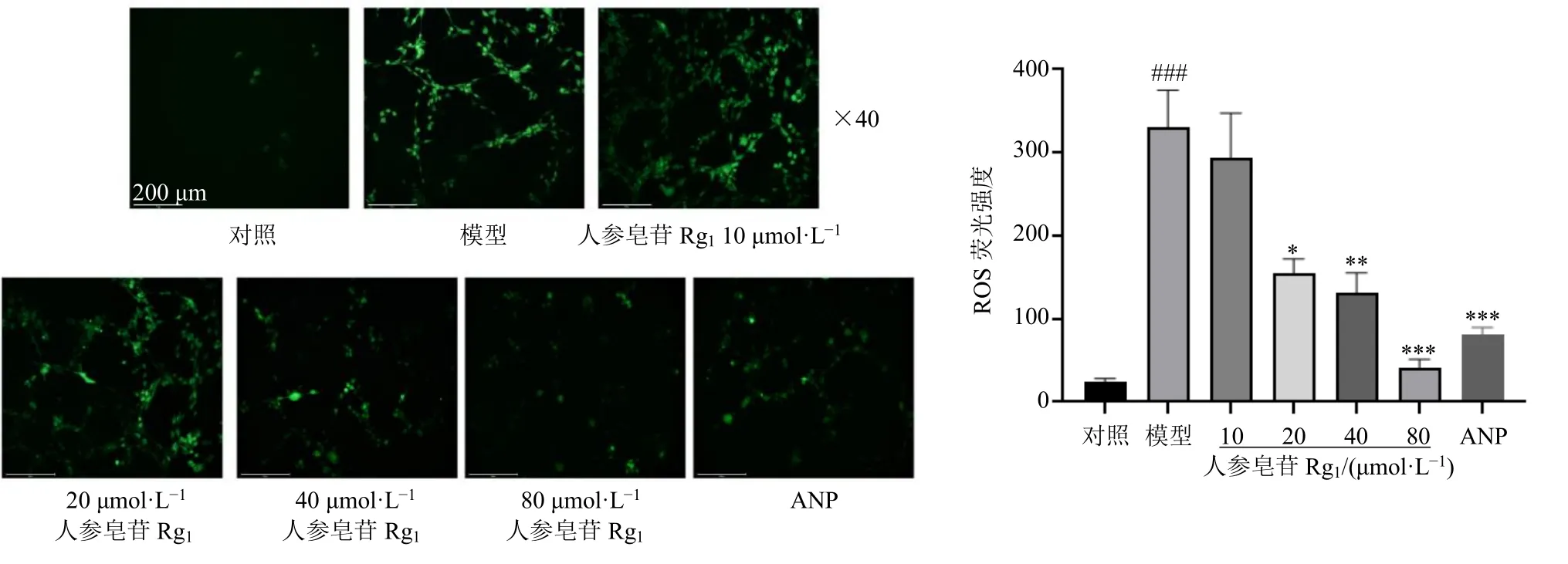
图5 人参皂苷Rg1 对H2O2 诱导的H9c2 细胞ROS 水平的影响 (±s, n = 3)Fig. 5 Effect of ginsenoside Rg1 on ROS level in H2O2-induced H9c2 cells (±s, n = 3)
3.2.5 人参皂苷Rg1对H2O2诱导的H9c2 细胞线粒体膜电位的影响 氧化应激可以引起细胞线粒体膜电位的改变,导致线粒体损伤,进而引起细胞凋亡及坏死。如图6 所示,与对照组比较,模型组细胞绿/红色荧光比值升高(P<0.001),表明H9c2 细胞线粒体膜电位降低;与模型组比较,各给药组绿/红色荧光比值显著降低(P<0.05、0.01、0.001),表明人参皂苷Rg1和ANP 均可以使H2O2引起的H9c2细胞线粒体膜电位恢复。

图6 人参皂苷Rg1 对H2O2 诱导的H9c2 细胞线粒体膜电位的影响 (±s, n = 3)Fig. 6 Effect of ginsenoside Rg1 on mitochondrial membrane potential in H2O2-induced H9c2 cells (±s, n = 3)
3.3 人参皂苷Rg1 对H2O2 诱导的H9c2 细胞凋亡相关蛋白表达的影响
如图7 所示,与对照组比较,模型组cleaved Caspase-3、cleaved Caspase-9 和Bax 蛋白表达水平均显著升高(P<0.001),Bcl-2 蛋白表达水平显著降低(P<0.001);与模型组比较,各给药组cleaved Caspase-9 和Bax 蛋白表达水平均显著降低(P<0.01、0.001),Bcl-2 蛋白表达水平显著升高(P<0.05、0.01、0.001);人参皂苷Rg1(20、40、80 μmol/L)组cleaved Caspase-3 蛋白表达水平显著降低(P<0.01、0.001)。提示人参皂苷Rg1可以减少H2O2诱导的H9c2 细胞凋亡。
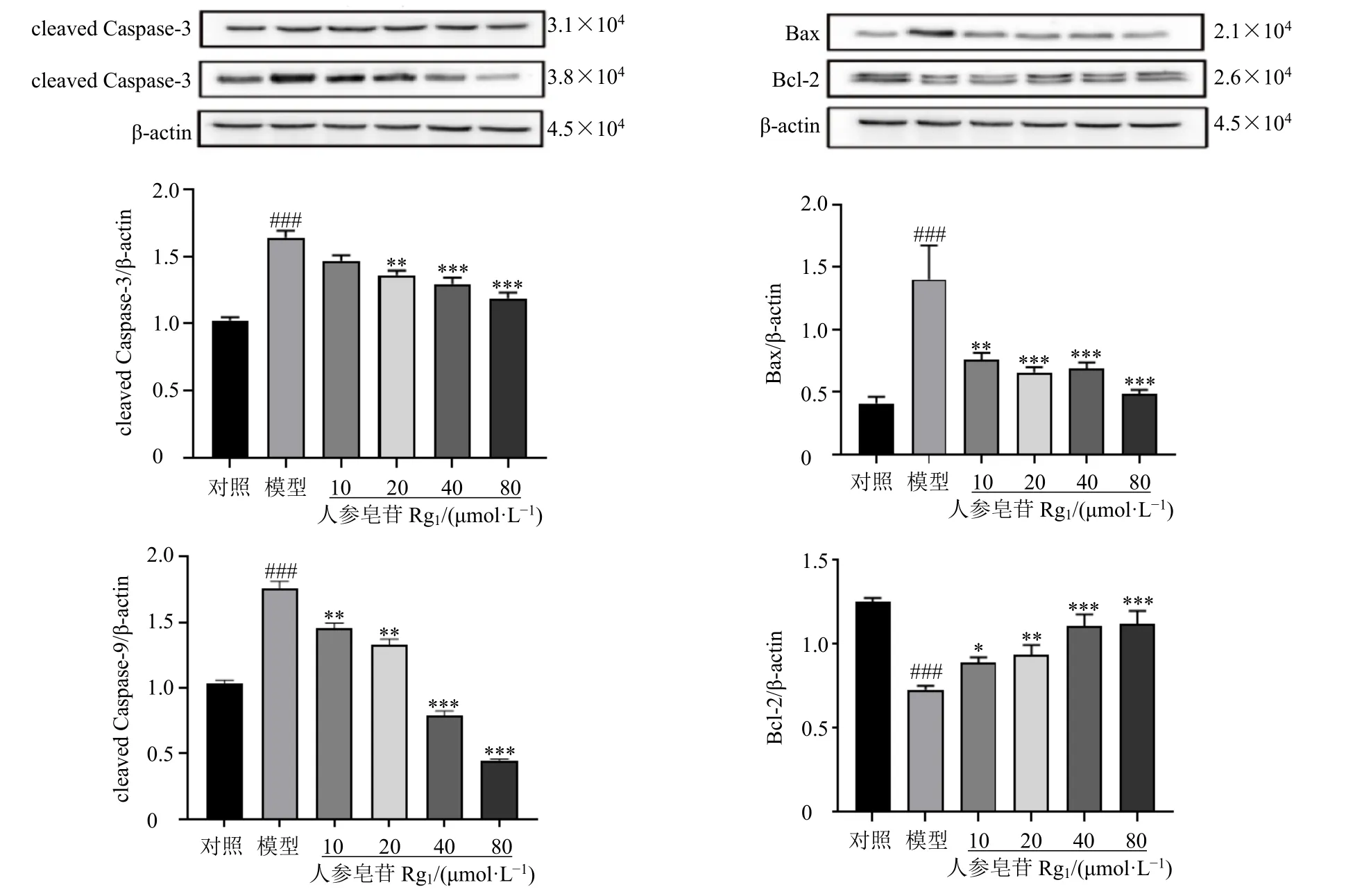
图7 人参皂苷Rg1 对H2O2 诱导的H9c2 细胞凋亡相关蛋白表达的影响 (±s, n = 3)Fig. 7 Effect of ginsenoside Rg1 on apoptosis-related protein expressions in H2O2-induced H9c2 cells (±s, n = 3)
3.4 人参皂苷Rg1 对H9c2 细胞miR-499c 表达的影响
为探讨人参皂苷Rg1对H9c2 细胞抗氧化的作用机制,首先观察人参皂苷Rg1对H9c2 细胞内miR-499c表达的影响。如图8 所示,与对照组比较,人参皂苷Rg1组miR-499c表达显著升高(P<0.05)。
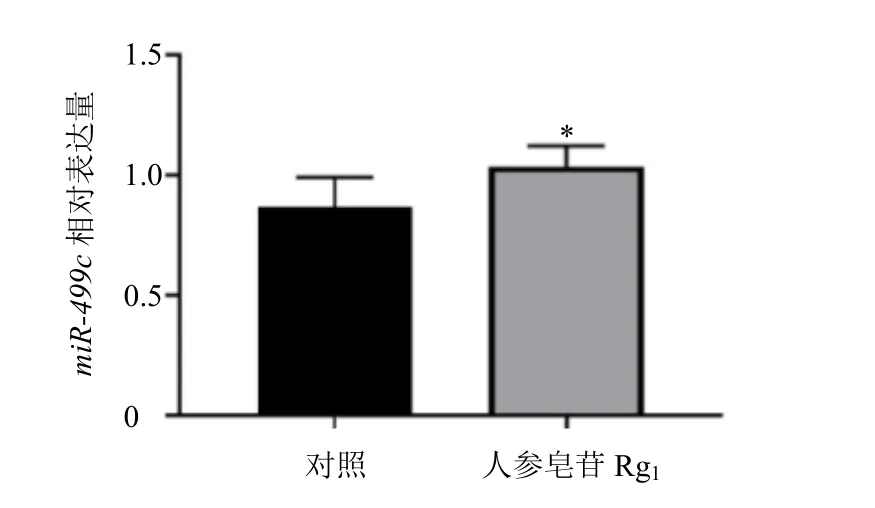
图8 人参皂苷Rg1 对H9c2 细胞miR-499c 表达的影响(±s, n = 3)Fig. 8 Effect of ginsenoside Rg1 on miR-499c expression in H9c2 cells (±s, n = 3)
3.5 miR-499c 在人参皂苷Rg1 抑制H2O2 诱导H9c2 细胞氧化应激损伤中的作用
3.5.1 miR-499c 在人参皂苷Rg1抑制H2O2诱导H9c2 细胞氧化应激时对ROS 生成的影响 如图9所示,与模型组比较,人参皂苷Rg1+H2O2组、miR-499c+H2O2组细胞中ROS 荧光强度显著降低(P<0.05、0.01),表明miR-499c 和人参皂苷Rg1均可以抑制ROS 的生成。人参皂苷Rg1+miR-499c+H2O2组ROS 荧光强度进一步降低,提示miR-499c 可能参与人参皂苷Rg1抑制细胞氧化应激损伤。
3.5.2 miR-499c在人参皂苷Rg1抑制H2O2诱导H9c2细胞MMP 降低的影响 如图10 所示,与模型组比较,人参皂苷Rg1+H2O2组、miR-499c+H2O2组绿/红色荧光比值显著降低(P<0.05、0.01),表明人参皂苷Rg1和miR-499c 均可以使H2O2引起的H9c2 细胞线粒体膜电位恢复;人参皂苷Rg1+miR-499c+H2O2组绿/红色荧光比值进一步降低,提示miR-499c可能参与人参皂苷Rg1抑制细胞氧化应激损伤。
4 讨论
在心血管疾病中,氧化应激是AMI 的重要促发因素之一。一些抗氧化剂药物已被证实可以预防和治疗AMI[17],但尚未达到满意的效果。人参皂苷Rg1是人参中的重要生物活性成分,在体内外具有抗衰老、神经保护[18]等多种生物活性。本研究重点探讨了人参皂苷Rg1对H9c2 细胞的抗氧化作用及其机制。采用H2O2诱导心肌细胞氧化应激模型是最常见的氧化应激模型制备方法,本研究发现,600 μmol/L 的H2O2诱导H9c2 细胞20 min,能达到最佳氧化应激模型,与先前的研究结果一致[19]。
正常状态下,机体内氧化与抗氧化处于一种动态平衡,但在患病或衰老等状态时会出现因自由基水平升高而导致的病理现象[20]。人体内有抗氧化防御系统,包括内源性抗氧化剂SOD。总SOD 活性可以反映机体对氧化应激的抗氧化能力,研究表明,氧化应激会引起SOD 的活性增加,但当氧化应激过度时,SOD 活性会下降[21]。当细胞受到氧化应激时,引起细胞膜损伤的氧化应激反应,MDA 迅速积累[22]。本研究发现,人参皂苷Rg1增加了H2O2诱导的H9c2 细胞中SOD 活性,同时减少MDA 水平。表明人参皂苷Rg1作为外源性抗氧化剂,通过增加内源性抗氧化剂的活性起到抗氧化作用。
ROS 是机体内最常见的自由基[23],ROS 产生过量时能引起线粒体功能障碍,表现为线粒体的形态变化和功能丧失。线粒体膜电位的破坏是线粒体功能障碍的主要标志。线粒体膜电位的丢失导致线粒体电子传递链缺陷、代谢耗氧量减少,从而抑制细胞脂质、蛋白质等的正常功能[24]。结果显示,H2O2诱导H9c2 细胞ROS 的生成和线粒体膜电位丢失,而人参皂苷Rg1降低了ROS 生成,同时抑制线粒体膜电位丢失,表明人参皂苷Rg1通过抑制自由基的生成和线粒体膜电位的丢失,从而起到抑制氧化应激损伤的作用。
Bcl-2 和Bax 是Bcl-2 家族蛋白的典型代表,它们在细胞凋亡过程中发挥重要的调节作用[25]。当细胞内Bax 高表达时,细胞对死亡信号敏感,促进细胞凋亡。当Bcl-2 高表达时,Bcl-2 与Bax 形成异源二聚体,抑制细胞凋亡[26]。所以细胞内Bax/Bcl-2 的比例对决定细胞凋亡的敏感性起到重要作用。在细胞凋亡过程中,线粒体被认为是处于凋亡调控的中心位置。在线粒体通路中,如Bax 被激活后发生寡聚化,并插入线粒体膜,引起线粒体膜通透性改变,释放线粒体内促凋亡因子,如细胞色素 C(cytochrome C,Cyt C)等。当Cyt C 释放到胞内后,形成凋亡复合体,凋亡复合体通过招募并激活Pro-Caspase-9,形成Caspase-9 全酶。Caspase-9 全酶进一步激活效应Caspase-3 和Caspase-7,启动Caspase级联反应,切割细胞中α-tubulin、Actin 等超过100种的底物,最终导致细胞凋亡[27]。Caspase 家族是细胞凋亡的重要执行者,其主要功能是促进凋亡信号的放大和传递[28]。在本研究中,人参皂苷Rg1下调Bax 和上调Bcl-2 表达,呈剂量相关性地降低Bax/Bcl-2 的比例,同时人参皂苷Rg1减少cleaved Caspase-3 和cleaved Caspase-9 蛋白表达。提示人参皂苷Rg1可能通过抑制Caspases,进而调控Bax 与Bcl-2 蛋白家族,从而抑制细胞凋亡。
研究发现,miRNA 可以调节多种基本细胞功能包括细胞凋亡和坏死,这是AMI 中的2 个关键细胞事件[29-30]。其中miRNA-499 可以保护心肌细胞免受AMI 诱导的凋亡作用[31]。其他研究也证实,miR-499通过靶向程序性细胞死亡因子4(programmed cell death 4,PDCD4)、钙凋磷酸酶和动力蛋白来保护心肌细胞免受缺血/再灌注诱导的细胞凋亡[32]。血浆miR-499 被证明通过靶向PDCD4 促进内皮炎症,PDCD14 抑制下游核因子-κB(nuclear factor-κB,NFκB)/肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)信号通路[33]。提示miR-499 可能作为治疗AMI血管炎症的潜在靶标[34]。miRNA-499c 是在前期工作中发现的一种具有将非心肌细胞诱导为心肌细胞功能的miRNA。本研究发现预处理人参皂苷Rg1可以增加H9c2 细胞miR-499c 的表达。同时转染miRNA-499c 后再预处理人参皂苷Rg1后发现,与单纯转染miR-499c 或单纯预处理人参皂苷Rg1相比,ROS 显著降低和线粒体膜电位恢复明显。提示人参皂苷Rg1可能通过miRNA-499c 对H2O2诱导的H9c2 细胞氧化应激起抑制作用。
综上,人参皂苷Rg1通过抑制H2O2诱导的H9c2细胞ROS 的生成,从而减少线粒体膜电位的丢失和线粒体氧化应激,最终抑制细胞氧化应激和细胞凋亡,此作用可能与miRNA-499c 有关。本研究为人参有效成分开发新的心脑血管疾病药物提供参考。
利益冲突所有作者均声明不存在利益冲突
