不同林龄杉木人工林细根形态性状的变化特征分析
2023-12-25郑高超苏香萍王思荣陈晓琳胡明艳鞠雯邹秉章
郑高超 苏香萍 王思荣 陈晓琳 胡明艳 鞠雯 邹秉章

鄭高超,苏香萍,王思荣,等.不同林龄杉木人工林细根形态性状的变化特征分析[J].福建农业科技,2023,54(8):17-25.
摘 要:为了探究杉木Cunninghamia lanceolata细根觅食能力随林龄和土层深度的变化特征,研究了福建省龙岩市白砂国有林场7、10、23、29和42年生杉木人工林60 cm土层内杉木细根形态性状(包括比根长、比表面积、组织密度和根平均直径)的变化特征。结果表明:(1)对于0~60 cm土层内总细根形态性状,比根长、比表面积均为7年生最大,29年生最低;组织密度7年生最小,29年生最大;根平均直径在各林龄间无显著差异。(2)杉木细根比根长、比表面积在各土层内随林龄的变化特征相似,均为7或10年生最大,29年生最低。(3)对于各林龄细根形态性状在同一土层内的平均值,杉木细根的比根长和比表面积均随着土层深度的增加而呈现先下降后增加的趋势;而且区分不同林龄时可以发现这一变化趋势在7年生时尤为明显。(4)7年生细根形态性状在各土层间的差异显著,塑性变化较为活跃;而29和42年生细根形态性状在各土层间的差异均不显著,塑性变化相对较弱。因此,在林分发育的后期,杉木细根自身觅食能力的下降,以及形态性状在各土层间可塑性的降低可能会导致杉木细根在林分发育后期的资源获取潜力下降,这可能会是导致杉木地上净初级生产力在林分发育后期下降的一个因素,这为揭示杉木人工林生产力变化机理以及杉木人工林的合理经营提供了科学依据。
关键词:杉木人工林;比根长;林龄;土层深度;径级
中图分类号:S 718.55 文献标志码:A 文章编号:0253-2301(2023)08-0017-09
DOI:10.13651/j.cnki.fjnykj.2023.08.003
Analysis of the Variation Characteristics of Fine Root Morphological Traits inCunninghamia lanceolata Plantation Forests at Different Forest Ages
ZHENG Gao-chao1, 2*, SU Xiang-ping1, 2, WANG Si-rong3, CHEN Xiao-lin1, 2,HU Ming-yan1, 2, JU Wen1, 2, ZOU Bing-zhang3
[1. School of Geographical Sciences, School of Carbon Neutrality Future Technology, Fujian Normal University,Fuzhou, Fujian 350117, China; 2.State Key Laboratory of Subtropical Mountain Ecology (Ministry of Science and Technology and Fujian Province Funded), Fujian Normal University, Fuzhou, Fujian 350117, China; 3. Baisha National Forest Farmof Fujian Province, Shanghang, Longyan, Fujian 364205, China]
Abstract:In order to explore the variation characteristics of foraging ability of Cunninghamia lanceolata fine roots with forest age and soil depth, the variation characteristics of morphological traits (including specific root length, specific surface area, tissue density and average root diameter) of Cunninghamia lanceolata fine roots in 60 cm soil layer of 7, 10, 23, 29 and 42-year-old Cunninghamia lanceolata plantation forest in Baisha State-owned Forest Farm of Longyan City in Fujian Province were studied. The results showed that: (1) For the total fine root morphological traits in the 0~60 cm soil layer, the specific root length and specific surface area were the largest at 7 years old and the lowest at 29 years old. The tissue density was the smallest at 7 years old and the largest at 29 years old. There was no significant difference in the average diameter of roots among forest ages. (2) The specific root length and specific surface area of fine roots of Cunninghamia lanceolata were similar with the changes of forest ages in each soil layer, which were both the highest at 7 or 10 years old and the lowest at 29 years old. (3) For the average values of fine root morphological traits in the same soil layer for different stand ages, the specific root length and specific surface area of Cunninghamia lanceolata fine roots both showed a trend of decreasing first and then increasing with the increase of soil depth. Moreover, it could be found that this change trend was particularly obvious at 7 years old when distinguishing different forest ages. (4) The morphological traits of 7-year-old Cunninghamia lanceolata fine roots were significantly different among different soil layers, and the plastic changes were more active. However, there was no significant difference in the morphological traits of fine roots at 29 and 42 years old among different soil layers, and the plastic change was relatively weak. Therefore, in the late stage of stand development, the decrease of self-foraging ability of Cunninghamia lanceolata fine roots and the decrease of plasticity of the morphological traits among various soil layers may lead to the decrease of resource acquisition potential of Cunninghamia lanceolata fine roots in the late stage of stand development, which may be one factor leading to the decline of aboveground net primary productivity of Cunninghamia lanceolata in the later stage of stand development. This provided scientific basis for revealing the mechanism of productivity change of Cunninghamia lanceolata plantation forests and the rational management of Cunninghamia lanceolata plantation forests.
Key words:Cunninghamia lanceolata plantation forest; Specific root length; Stand age; Soil layer depth; Diameter class
林木地上净初级生产力在林分发育后期往往会出现下降,而导致下降的原因仍然存在争议。其中养分限制假说认为,在林分发育后期,林木可能会受到养分供应的限制,从而导致林木地上净初级生产力的下降。目前关于杉木人工林的研究同样发现了生产力下降的现象,但仍然缺乏从细根形态性状的角度对其进行解释。细根(直径≤2mm)主要承担着土壤中养分、水分的吸收功能。細根的形态性状,如比根长、比表面积、组织密度和根平均直径等,可以在一定程度上反映出细根的生理活性以及对土壤养分、水分的觅食能力。通常,具有较大比根长、比表面积以及较低组织密度、根平均直径的细根的觅食能力也相对较强。而且植物可以依据自身对养分、水分的需求以及土壤中养分的变化而对细根形态性状进行可塑性调整。因此,对细根形态性状随林龄变化特征的研究可以反映出林木在不同发育阶段的觅食能力以及资源获取策略,将有助于理解林木地上净初级生产力在林分发育后期下降的可能原因。
随着林龄的增加,细根的形态性状往往会发生塑性变化,细根的觅食策略也将由获取型转为保守型。具体来说,在林分发育早期阶段,细根通常具有较强的觅食能力,表现为较大的比根长、比表面积以及较低的组织密度、根平均直径;而在林分发育后期则出现相反的情况。比如,Li等对水曲柳Fraxinus mandshurica的研究表明,细根平均直径随着林龄的增加呈增加趋势,而比根长、比表面积则呈下降趋势。Rosenvald等认为细根形态性状随林龄的塑性变化可能与林木生长发育速度的变化有关,比如在林分发育早期阶段,较快的生长发育速度产生较大的养分、水分需求,相应地细根也具有较强资源觅食潜力;而在林分发育后期阶段,林木生长速度放缓,对资源的需求降低,细根的性状也相应地更偏保守型。但是也有不同的研究结果,比如Claus等指出细根比根长随林龄的变化特征也因物种而异,比如欧洲水青冈Fagus sylvatica的细根比根长随着林龄的增加无显著变化,而欧洲云杉Piceaabies和土耳其栎Quercus cerris的细根比根长则均随林龄的增加而下降,并猜想欧洲水青冈老龄树细根的生理特性与幼树或成熟树之间可能并没有差异。Pei等对杉木的研究表明,细根组织密度随着林龄的增加而显著增加,但是比根长并未发生显著变化;而Zhu等的研究则发现,杉木细根比根长和比表面积均随林龄增加而下降,而组织密度则先增加后下降。因此,杉木细根的觅食能力随林龄的变化特征仍然需要进一步验证。而且Maurice等指出,不同土层深度内细根的形态性状随林龄的变化也可能不一致,比如比根长在表层土壤中随林龄增加而下降,而在底层土壤中随林龄增加而增加。因此,对杉木细根形态性状随林龄的变化特征,尤其是在不同土层内细根形态性状随林龄的变化特征仍然需要进一步研究。
随着土层深度的增加,养分的垂直分布情况也将引起细根形态性状的可塑性变化。一般在资源充足的表层土壤中细根的获取性也更强,而在底层土壤中则相对保守并主要承担水分的吸收和运输功能。比如Fujimaki等研究发现,日本柳杉Cryptomeria japonica细根的比根长随着土层深度的增加而下降。但是Zhou等研究发现,刺槐Robinia pseudoacacia在老龄林时的细根比根长会随着土层深度的增加而增加,因为通过伸长根系,而非增加细根直径可以减少水分获取过程中的碳投资成本。而且已有研究表明,杉木细根在发育后期的确可能会受到碳的限制。因此,杉木细根形态性状随土层深度的垂直变化特征,尤其是在不同林龄时的垂直变化特征仍然需要进一步研究。
为了分析杉木细根觅食能力随林龄和土层的变化特征,本研究以福建省龙岩市上杭县白砂国有林场为依托,分析7、10、23、29和42年生杉木人工林中0~1 mm与1~2 mm杉木细根的比根长、比表面积、组织密度和根平均直径随林龄和土层深度的变化特征,以试图分析杉木细根的资源觅食能力随林龄的动态变化,研究结果将有助于理解杉木人工林地上净初级生产力在林分发育后期下降的原因,为林业管理者提供相关的科学依据,以促进实现杉木人工林的经济与生态效益双持续的良性发展。
1 材料与方法
1.1 研究区概况
本研究样地位于福建省龙岩市上杭县白砂国有林场(25°04′~25°15′N,116°30′~116°38′E),是武夷山脉南段东坡玳瑁山延伸的低山丘陵地带,处于中亚热带向南亚热带的过渡地带。该地区气候属于亚热带季风气候,夏季炎热,冬季寒冷,春季和秋季温暖;海拔400~800 m,坡度10°~40°,年平均气温20.1℃,无霜期277 d左右;春季和夏季湿润多雨,降水多集中在5月至8月,年平均降水量达1600 mm。土壤主要是由花岗岩发育而成的红壤组成,属于氧化土,土层深厚 (>60 cm),肥力较高。本研究区域森林曾遭受严重的自然和人为破坏,而后通过人工集约化造林建立起了不同发育阶段的杉木人工林。
1.2 样地设置
采用空间代替时间的方法建立了7、10、23、29和42年生的杉木人工林年龄序列样地。在每个林地的中坡位置建设1个长30 m,宽20 m的样地,每个林龄3个重复,总计15个样地。本研究在设置样地时均选择坡度和坡向较为相似的林地中坡位置,且每个样地之间的空间距离大于500 m,以尽可能减少空间自相关;另外,样地距离农田、道路或其他类型林地的边缘大于100 m,以减少边缘效应。样地本底信息详见已发表的文献。
1.3 细根形态性状的测定
于2021年5月,在每个样地内使用根钻 (内径7 cm)法,按照“S”形随机选取9个点位,分4个土层(0~10、10~20、20~40以及40~60 cm)采集根系样品。通过水洗过筛的方法将杉木细根从土壤中分离出来,根据细根直径大小区分为不同的径级(0~1 mm和1~2 mm),并使用爱普生扫描仪 (Epson Scanner Perfection V700 Photo)对杉木细根的形态进行扫描,输出图像为600 dpi,24位全彩,TIFF格式。然后使用WinRHIZO(Pro 2005b)根系图像分析软件对扫描的图片进行分析,以获得细根平均直径 (RD,mm)、总根长 (RL,cm)、总根表面积 (RA,cm)和总根体积 (RV,cm)。最后将扫描后的细根样品装入信封中,置于烘箱内于65℃下烘至恒重,使用电子天平称取细根干重 (RM,g),精确到0.0001 g。通过以下公式计算细根形态性状指标:
比根长[Specific root lengths,(SRL,m·g)]=RL/RM×10;
比表面积[Specific root surface area,(SRA,cm·g)]=RA /RM;
组织密度[Roottissuedensity,(RTD,g·cm)]=RM /RV。
1.4 統计分析
使用SPSS 23软件进行差异显著性分析,使用Excel 2010计算平均值和标准误差,并绘制柱状图。
2 结果与分析
2.1 不同林龄杉木人工林细根形态性状的变化特征
2.1.1 0~60 cm土层内细根形态性状的总体变化特征 由图1可知,当合并整个取样土层时(即60 cm土层内总体的细根形态性状),对于0~1 mm杉木细根,比根长和比表面积均7年生最大,10年生次之,在29年生最小,总体上随林龄增加而下降,42年生比根长和比表面积均略高于29年生,但无显著差异;组织密度7年生最低,29年生最高,42年生略有下降,但无显著差异,总体上随林龄增加而增加;细根平均直径在7、10、23、29和42年生之间无显著差异。对于1~2 mm杉木细根,比根长在各林龄间无显著差异;而比表面积随林龄增加有下降趋势,即7年生最大,10年生次之,42年生最低。组织密度7年生最小,42年生最大,29年生次大,随林龄增加呈增大趋势;而根平均直径在各林龄间同样无显著差异。
2.1.2 0~60 cm不同土层内细根形态性状的变化特征 由图1可知,当区分不同的土层时,对于0~1 mm杉木细根,比根长和比表面积均与整个取样土层内(0~60 cm)总形态性状随林龄的变化特征相一致,即比根长和比表面积在各土层内均随林龄的增加而呈下降趋势;组织密度在0~10、10~20以及40~60 cm土层内随林龄的变化特征相似,均随林龄增加而增加;而在20~40 cm土层内,组织密度在各林龄间则无显著差异;根平均直径则仅在0~10 cm土层内时在各林龄间具有显著差异,即7年生最小,23年生最大;而在10~20、20~40以及40~60 cm土层内时则在各林龄间均无显著差异。对于1~2 mm杉木细根,各土层内比根长在各林龄间均无显著差异。比表面积和组织密度在10~20、20~40和40~60 cm土层内均表现出与总体形态性状相似的变化特征,其中比表面积随林龄增加而下降,组织密度随林龄的增加而增加;而在0~10 cm土层内,比表面积和组织密度在各林龄间均无显著差异;根平均直径在0~10 和40~60 cm土层内在各林龄间均无显著差异;而在10~20和20~40 cm土层内,均为7年生最大,10年生最小。
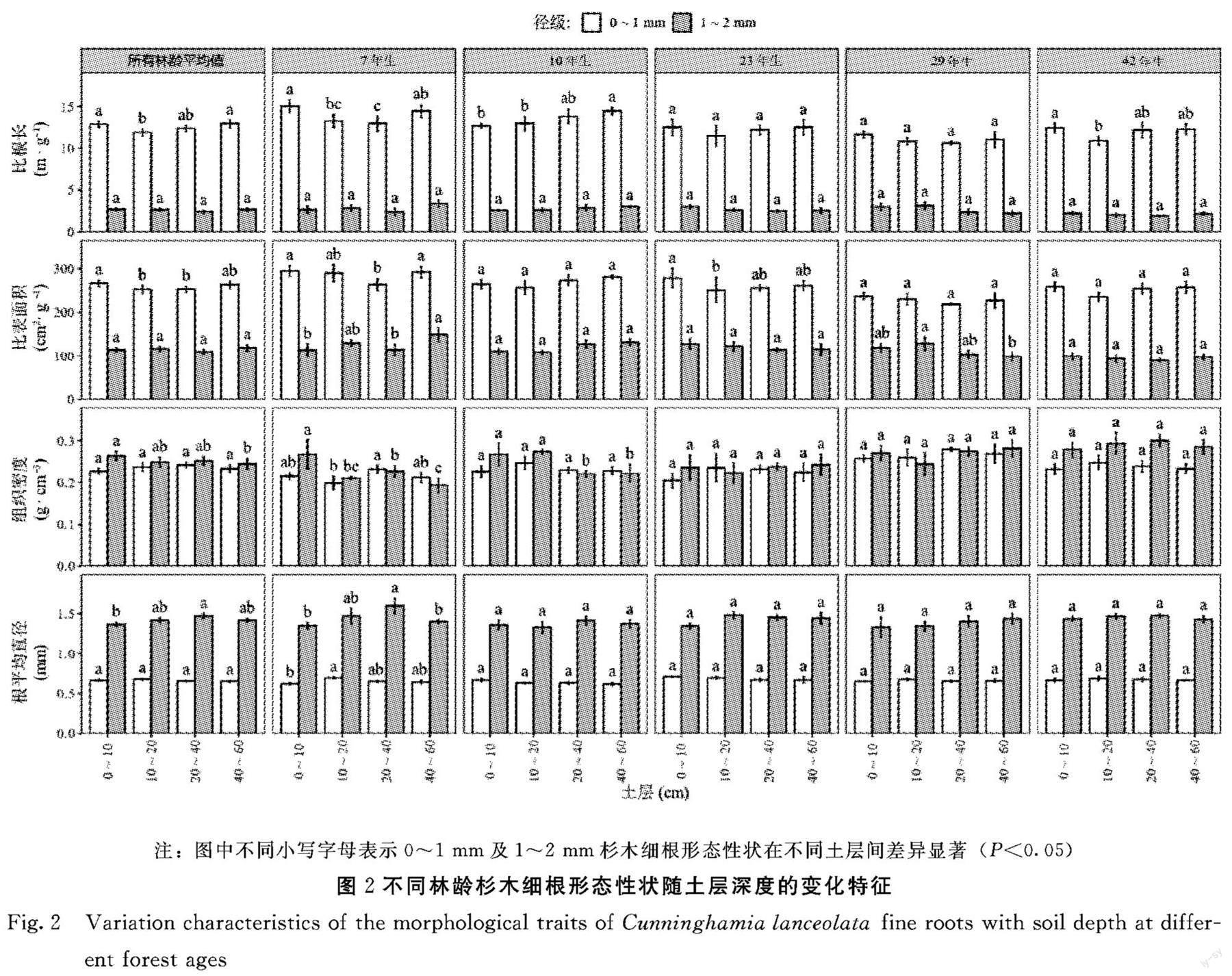
2.2 不同林龄杉木人工林细根形态性状随土层的变化特征
2.2.1 各林龄平均细根形态性状的变化特征 由图2可知,当不区分林龄时 (即各林龄细根形态性状在同一土层内的平均值),对于0~1 mm杉木细根,比根长和比表面积均为0~10 cm土层内最大,40~60 cm土层内次之,10~20 cm土层内最低,即随土层深度的增加总体上呈现先下降后增加的趋势。组织密度和根平均直径在各土层间均无显著差异。对于1~2 mm杉木细根,比根长和比表面积在各土层间均无显著差异。组织密度0~10 cm土层内最大,40~60 cm土层内最小,总体上随土层深度增加而下降。根平均直径0~10 cm土层内最小,20~40 cm土层内最大,总体上随土层深度增加而增加。
2.2.2 不同林龄细根形态性状的变化特征 由图2可知,当区分不同林龄时,对于0~1 mm杉木细根, 7年生时比根长和比表面积均在0~10 cm土层内最大,在40~60 cm土层内次之,在20~40 cm土层内最小,总体上均呈现先下降后增加的趋势;组织密度在20~40 cm土层内最大,在10~20 cm土层内最小;根平均直径在0~10 cm土层内最小,在10~20 cm土层内最大。10年生时比根长0~10 cm土层内最低,40~60 cm土层内最大,随土层深度的增加有增大趋势;而比表面积、组织密度和根平均直径在土层间均无显著差异。23年生时比表面积0~10 cm土层内最大,10~20 cm土层内最小;而比根长、组织密度和根平均直径在各土层间均无显著差异。29年生时,各形态性状在土层间均无显著差异。42年生时比根长0~10 cm土层内最大,10~20 cm土层内最小,其他形态性状在各土层间均无显著差异。对于1~2 mm杉木细根,7年生时比根长在各土层间无显著差异;比表面积在0~10 cm土层内最低,在40~60 cm土层内最大,随土层深度增加有增大趋势;相应地,组织密度0~10 cm土层最大, 40~60 cm土层内最小,随土层深度增加有下降趋势;而根平均直径20~40 cm土层内最大,且显著高于0~10 cm和40~60 cm土层,随土层深度增加有先增加后下降的趋势。10年生时组织密度0~10 cm土层内最大,40~60 cm土层内最小,呈下降趋势;而比根长、比表面积和根平均直径在各土层间均无显著差异。23年生时各形态性状在各土层间均无显著差异。在29年生时,仅比表面积10~20 cm土层内显著高于40~60 cm土层。42年生时,各形态性状在各土层间均无显著差异。
3 讨论
3.1 林龄对杉木人工林细根形态性状的影响
细根的形态性状,尤其是比根长,可以在一定程度上指示细根的觅食能力。细根的形态性状与林龄密切相关,一般认为,在林分发育的早期阶段,细根具有较大的资源获取潜力,表现为较大的比根长、比表面积和较低的组织密度、根平均直径;而随着林龄的增加,细根的觅食能力往往会呈现下降趋势,在林分发育后期更倾向于采取保守的资源获取策略,细根的形态性状也相应地表现出相反的结果。本研究发现,对于0~60 cm土层内总细根形态性状,0~1 mm杉木细根的比根长和比表面积均为7年生最大,29年生最小,相应地组织密度7年生最小,29年生最大。虽然1~2 mm杉木细根的比根长和比表面积无显著变化,但是由于直径越细小的根可能更多地承担着养分、水分的获取功能,所以仍然可以推测杉木细根的觅食能力可能在随着林龄的增加而下降,并主要表现为0~1 mm细根比根长、比表面积的下降以及组织密度的增加。而在杉木细根自身觅食能力下降的情况下,杉木在林分发育后期为了满足对养分、水分的需求,可能会加强细根与菌根真菌的合作以缓解细根自身觅食能力的下降,所以进一步研究需要纳入菌根真菌的影响。42年生0~1 mm杉木细根比根长和比表面积均略有增加,而且组织密度略有下降,这表明在发育的后期阶段(42年生)杉木细根自身的觅食能力可能也会略有增加,这与Zhu等的研究结果类似。这可能是因为在林分发育后期由于林下植被的发育引起对养分的竞争,导致杉木对形态性状做出塑性调整,并可能主要是通过增加碳成本较小的根尖的构建以提高资源竞争力。因此,虽然42年生时细根的觅食能力可能略有增加,但是总体上仍然是随着林龄的增加而呈下降的趋势,这可能不利于杉木在发育后期的养分获取,并可能是导致生产力在后期下降的一个因素。
对于不同土层,0~1 mm杉木细根比根长和比较面积在各土层内随林龄的变化特征相似,均呈下降趋势;而且虽然组织密度在20~40 cm土层内未表现出显著差异,但也有与其他土层类似的变化趋势。因此在各土层内,杉木细根的觅食能力可能均会随林龄的增加而呈现下降的趋势。本研究还发现,在组织密度随林龄增加而增加的情况下,0~1 mm与1~2 mm杉木细根的平均直径在各林龄间均无显著差异。这与先前研究不一致,以往多数研究认为组织密度与根平均直径之间存在正相关关系,即随着根平均直径的增加,组织密度往往也会增加。而本研究中出现与以往研究不一致的结果可能是因为木本植物的细根平均直径和组织密度之间其实是存在非线性关系,所以当在不同直径范围内时,根平均直径与组织密度的关系也可能会不确定,而导致这种非线性关系的原因可能是因为细根的中柱和皮层的发育速度不一致。
3.2 土层深度对杉木人工林细根形态性状的影响
细根觅食能力随土层深度的变化特征可能与土壤中养分的垂直分布有关,并反映了植物集中利用土壤资源的深度。比如,比根长随着土层深度的增加往往呈下降趋势,这表明细根更可能会集中在浅层土壤中获取养分资源。本研究发现,当不区分林龄时,总体上0~1 mm杉木细根比根长和比表面积均为0~10 cm土层内最大,这与Fujimaki等的研究结果较为类似,表明杉木可能会集中在0~10 cm土层中获取养分。这是因为表层土壤中往往也具有较丰富的养分,所以杉木会提高细根在表层土壤中的觅食能力(主要表现为较大的比根长和比表面积)以提高觅食的精度。进一步区分不同林龄时可以发现,在7年生时,细根的形态性状随土层深度的增加发生了较大幅度的变化,其中比根长和比表面积均在40~60 cm土层内显著增加,且组织密度也略有下降;但是在林分发育后期(42年生),细根的形态性状(除42年生时比根长10~20 cm土层内的显著低于0~10 cm土层外)在各土层间均未发生显著变化。这些结果表明,在林分发育的早期阶段(7年生),杉木细根形态性状的塑性变化能力可能会更强,变化更加活跃。这可能是因为此时杉木的生长速度较快,对养分的需求较大,需要细根对养分斑块具有较高的敏感性,并具有较强的形态可塑性,以更加高效地利用资源丰度的土壤斑块。但是在林分发育后期阶段(42年生),杉木细根形态性状在不同土层间的塑性变化能力可能相对更弱。这一方面可能是由于杉木自身的发育速度下降引起养分需求的下降;另一方面,也可能是因为杉木细根在发育后期受到了碳的限制,所以减少了碳成本较高的细根形态性状的塑性变化。因此,杉木在林分发育后期可能会采取较为保守的资源获取策略,在土壤垂直剖面上细根形态性状的塑性变化能力也相对较弱。但是在林分发育后期,由于凋落物的归还,养分会在土壤表层逐渐累积,而此时杉木细根却不能在养分集中的表层土壤中表现出比深层土壤更强的觅食能力,即此时细根对养分丰富土壤斑块响应的敏感性的下降将不利于杉木细根对养分的获取,这可能也是导致杉木受到养分限制,并引起生产力下降的一个因素。但是也有研究指出,在林分发育后期,树木也可能会增加菌根的定殖,以降低投资成本并保障养分的获取,所以杉木细根的觅食能力随林龄的变化特征仍然需要进一步的验证。
本研究还发现,7年生杉木细根的觅食能力在底层土壤内(40~60 cm)似乎也出现了增加的趋势,主要表现为0~1 mm细根比根长和比表面积的显著增加以及组织密度略有下降。这可能是因为杉木在林分发育初期对水分较大的需求,需要深层水分的供给,所以可能会提高底层土壤中细根的吸收能力。而且在林分發育早期,林窗较为开阔,林冠不能有效截留降水,而氮在土壤中又是易移动离子,所以土壤中养分(尤其是氮素)在雨水淋溶作用下可能会向深层土壤中迁移累积。因此,7年生时杉木可能会增加底层土壤中(40~60 cm)细根对养分、水分的觅食能力,以满足发育初期对养分、水分的需求。
4 結论
本研究结果表明,在林分发育后期,杉木细根的觅食能力可能出现下降,而且细根形态性状在各土层间的塑性变化能力可能也相对较低。这将不利于杉木细根在林分发育后期对土壤资源的获取,并可能会是导致杉木生产力在发育后期下降的一个因素。本研究结果将有助于从细根觅食能力的角度理解杉木人工林生产力在林分发育后期下降的可能原因,但未来仍需要更多研究进行验证,尤其是纳入菌根真菌的影响。
参考文献:
[1]PREGITZER K S, EUSKIRCHEN E S.Carbon cycling and storage in world forests: biome patterns related to forest age[J].Global Change Biology,2004,10(12):2052-2077.
[2]SCHOONMAKER A S, LIEFFERS V J, LANDHAUSSER S M.Viewing forests from below: fine root mass declines relative to leaf area in aging lodgepole pine stands[J].Oecologia, 2016, 181(3): 733-747.
[3]WEST P W.Do increasing respiratory costs explain the decline with age of forest growth rate?[J].Journal of Forestry Research, 2019, 31(3): 693-712.
[4]RYAN M G, BINKLEY D, FOWNES J H.Age-related decline in forest productivity: pattern and process[J].Advances in Ecological Research, 1997, 27: 213-262.
[5]YODA K, SHINOZAKI K, OGAWA H, et al.Estimation of the total mount of respiration in woody organs of trees and forest communities[J].Journal of Biology, Osaka City University, 1965, 16: 15-26.
[6]KIRA T, SHIDEI T.Primary production and turnover of organic matter in different forest ecosystems of the Western Paci[J].Japanese Journal of Ecology, 1967, 17(2): 70-87.
[7]RYAN M G, PHILLIPS N, BOND B J.The hydraulic limitation hypothesis revisited[J].Plant, Cell and Environment, 2006, 29(3): 367-381.
[8]CHEN G, YANG Z, GAO R, et al.Carbon storage in a chronosequence of Chinese fir plantations in southern China[J].Forest Ecology and Management, 2013, 300: 68-76.
[9]BI J, BLANCO J A, SEELY B, et al.Yield decline in Chinese-fir plantations: A simulation investigation with implications for model complexity[J].Canadian Journal of Forest Research, 2007, 37(9): 1615-1630.
[10]PREGITZER K S.Fine roots of trees-a new perspective[J].New Phytologist, 2002, 154(2): 267-270.
[11]RICHARDSON A E, BAREA J-M, MCNEILL A M, et al.Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J].Plant and Soil, 2009, 321(1-2): 305-339.
[12]OSTONEN I, PUTTSEPP U, BIEL C, et al.Specific root length as an indicator of environmental change[J].Plant Biosystems, 2007, 141(3): 426-442.
[13]GUO D, XIA M, WEI X, et al.Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species[J].New Phytologist, 2008, 180(3): 673-683.
[14]KONG D, MA C, ZHANG Q, et al.Leading dimensions in absorptive root trait variation across 96 subtropical forest species[J].New Phytologist, 2014, 203(3): 863-872.
[15]HODGE A.The plastic plant: root responses to heterogeneous supplies of nutrients[J].New Phytologist, 2004, 162(1): 9-24.
[16]HODGE A.Plastic plants and patchy soils[J].Journal of Experimental Botany, 2006, 57(2): 401-411.
[17]YUAN Z Y, CHEN H Y H.Fine root biomass, production, turnover rates, and nutrient contents in boreal forest ecosystems in relation to species, climate, fertility, and stand age: literature review and meta-analyses[J].Critical Reviews in Plant Sciences, 2010, 29(4): 204-221.
[18]BORJA I, DE WIT H A, STEFFENREM A, et al.Stand age and fine root biomass, distribution and morphology in a Norway spruce chronosequence in southeast Norway[J].Tree Physiology, 2008, 28(5): 773-784.
[19]LI Z, LIU Z, GAO G, et al.Shift from acquisitive to conservative root resource acquisition strategy associated with increasing tree age: A case study of Fraxinus mandshurica[J].Forests, 2021, 12(12): 1797.
[20]FUJIMAKI R, TATENO R, TOKUCHI N.Root development across a chronosequence in a Japanese cedar (Cryptomeria japonica D.Don)plantation[J].Journal of Forest Research, 2007, 12(2): 96-102.
[21]JAGODZINSKI A M, ZIOLKOWSKI J, WARNKOWSKA A, et al.Tree age effects on fine root biomass and morphology over chronosequences of Fagus sylvatica, Quercus robur and Alnus glutinosa stands[J].PLoS one, 2016, 11(2): e0148668.
[22]ROSENVALD K, OSTONEN I, URI V, et al.Tree age effect on fine-root and leaf morphology in a silver birch forest chronosequence[J].European Journal of Forest Research, 2013, 132(2): 219-230.
[23]CLAUS A, GEORGE E.Effect of stand age on fine-root biomass and biomass distribution in three European forest chronosequences[J].Canadian Journal of Forest Research, 2005, 35(7): 1617-1625.
[24]PEI Y, LEI P, XIANG W, et al.Effect of stand age on fine root biomass, production and morphology in Chinese fir plantations in subtropical China[J].Sustainability, 2018, 10(7): 2280.
[25]ZHU L, SUN J, YAO X, et al.Fine root nutrient foraging ability in relation to carbon availability along a chronosequence of Chinese fir plantations[J].Forest Ecology and Management, 2022, 507: 120003.
[26]MAURICE J, LACLAU J-P, SCORZONI RE D, et al.Fine root isotropy in Eucalyptus grandis plantations.Towards the prediction of root length densities from root counts on trench walls[J].Plant and Soil, 2010, 334(1-2): 261-275.
[27]BAKKER M R, JOLICOEUR E, TRICHET P, et al.Adaptation of fine roots to annual fertilization and irrigation in a 13-year-old Pinus pinaster stand[J].Tree Physiology, 2009, 29(2): 229-238.
[28]FORT F, CRUZ P, LECLOUX E, et al.Grassland root functional parameters vary according to a community-level resource acquisition-conservation trade-off[J].Journal of Vegetation Science, 2016, 27(4): 749-758.
[29]WANG Y, DONG X, WANG H, et al.Root tip morphology, anatomy, chemistry and potential hydraulic conductivity vary with soil depth in three temperate hardwood species[J].Tree Physiology, 2016, 36(1): 99-108.
[30]COMAS L H, BECKER S R, CRUZ V M V, et al.Root traits contributing to plant productivity under drought[J].Frontiers in Plant Science, 2013, 4: 442.
[31]ZHOU Z X, WANG Y Q, AN Z S, et al.Deep root information ″hidden in the dark″: A case study on the 21-m soil profile of Robinia pseudoacacia in the critical zone of the Chinese loess Plateau[J].Catena, 2022, 213: 106121.
[32]冉松松, 許子君, 万晓华.不同林龄的天然次生林和杉木人工林恢复过程中凋落物量变化[J].福建农业科技, 2022, 53(1): 59-65.
[33]王振宇, 傅彦榕, 邹秉章, 等.亚热带森林不同恢复模式土壤与林下植被特征的动态研究 [J].福建农业科技, 2021, 52(8):7-16.
[34]FRESCHET G T, PAGES L, IVERSEN C M, et al.A starting guide to root ecology: strengthening ecological concepts and standardising root classification, sampling, processing and trait measurements[J].New Phytologist, 2021, 232(3): 973-1122.
[35]ZANGARO W, DE ASSIS R L, ROSTIROLA L V, et al.Changes in arbuscular mycorrhizal associations and fine root traits in sites under different plant successional phases in southern Brazil[J].Mycorrhiza, 2008, 19(1): 37-45.
[36]HISHI T, TATENO R, FUKUSHIMA K, et al.Changes in the anatomy, morphology and mycorrhizal infection of fine root systems of Cryptomeria japonica in relation to stand ageing[J].Tree Physiology, 2017, 37(1): 61-70.
[37]KONG D L, WANG J J, KARDOL P, et al.Economic strategies of plant absorptive roots vary with root diameter[J].Biogeosciences, 2016, 13(2): 415-424.
[38]WEEMSTRA M, MOMMER L, VISSER E J W, et al.Towards a multidimensional root trait framework: a tree root review[J].New Phytologist, 2016, 211(4): 1159-1169.
[39]FRESCHET G T, CORNELISSEN J H C, VAN LOGTESTIJN R S P, et al.Evidence of the ′plant economics spectrum′ in a subarctic flora[J].Journal of Ecology, 2010, 98(2):362-373.
[40]REICH P B.The world-wide ′fast-slow′ plant economics spectrum: a traits manifesto[J]. Journal of Ecology, 2014, 102(2): 275-301.
[41]KONG D, WANG J, WU H, et al.Nonlinearity of root trait relationships and the root economics spectrum[J].Nature Communications, 2019, 10: 2203.
[42]YANAGISAWA N, FUJITA N.Different distribution patterns of woody species on a slope in relation to vertical root distribution and dynamics of soil moisture profiles[J].Ecological Research, 1999, 14(2): 165-177.
[43]MORENO-CHAC N M, LUSK C H.Vertical distribution of fine root biomass of emergent Nothofagus dombeyi and its canopy associates in a Chilean temperate rainforest[J].Forest Ecology and Management, 2004, 199(2-3): 177-181.
[44]WANG Y, LI Z, WANG Z, et al.Functional trait plasticity but not coordination differs in absorptive and transport fine roots in response to soil depth[J]. Forests, 2020,11(1):42.
[45]LUSK C H, REICH P B, MONTGOMERY R A, et al.Why are evergreen leaves so contrary about shade?[J].Trends in Ecology & Evolution, 2008, 23(6): 299-303.
[46]COMAS L H, BOUMA T J, EISSENSTAT D M.Linking root traits to potential growth rate in six temperate tree species[J]. Oecologia, 2002, 132(1): 34-43.
[47]CHEN W L, KOIDE R T, ADAMS T S, et al.Root morphology and mycorrhizal symbioses together shape nutrient foraging strategies of temperate trees[J].Proceedings of the National academy of Sciences of the United States of America, 2016, 113(31): 8741-8746.
[48]WASYLIW J, KARST J.Shifts in ectomycorrhizal exploration types parallel leaf and fine root area with forest age[J].Journal of Ecology, 2020, 108(6): 2270-2282.
[49]TINKER P B, NYE P.Solute movement in the rhizosphere[M].New York, Oxford: Oxford University Press, 2000.
(責任编辑:林玲娜)
收稿日期:2023-07-05
作者简介:郑高超,男,1994年生,硕士,主要从事森林碳循环研究。
基金项目:国家自然科学基金面上项目(31971548)。
