温度与水分胁迫下黄芩的渗透调节能力与交叉关系研究
2023-12-22李小玲华智锐
李小玲 华智锐

摘要:为探讨高低温和干旱交叉胁迫对黄芩幼苗生长的影响以及渗透调节物质的作用机制,以商洛市黄芩种植基地带回的黄芩幼苗为材料,在室温(25 ℃,CK)、高温(30、35 ℃)、低温(4、8 ℃)对幼苗先进行为期3 d的预处理,再待苗长至40 cm左右时,加入10%聚乙二醇(PEG)-6000用以模拟干旱处理。结果表明,干旱胁迫前,高低温预处理对黄芩生长(株高、主根长、地上部和地下部鲜质量)的影响不显著,随着胁迫时间的延长黄芩的生长指标差异愈发显著;温度与水分交叉胁迫程度的加剧也使黄芩的酶活性、可溶性糖含量、可溶性蛋白含量、游离脯氨酸含量显著增加,在干旱胁迫结束时,35 ℃预处理黄芩超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性以及游离脯氨酸含量、可溶性糖含量、可溶性蛋白质含量均显著高于对照,其中脯氨酸和可溶性糖的含量变化最为显著。因此,高温、低温预处理使黄芩幼苗具有一定的抗旱性,其适应性与其渗透调控能力的增强呈正相关关系。
关键词:黄芩;高低温胁迫;水分胁迫;交叉适应;渗透调节能力
中图分类号:S567.23+9.01文献标志码:A
文章编号:1002-1302(2023)21-0162-06
黄芩(Scutellaria baicalensis Georgi)是唇形科(Lamiaceae)黄芩属(Scutellaria Linn.)多年生草本植物,根可入药,其味苦,性凉,能清热利湿,凉血解毒,止血安胎。主要产自山西省、河南省、内蒙古自治区、河北省等[1]。黄芩与五味子、丹参、连翘、桔梗一起被誉为中国秦岭地区五大商药[2]。近年来,临床对黄芩药材的需求量迅猛增长,有限的野生资源遭到掠夺性开采,黄芩野生资源受到严重破坏。野生黄芩资源量迅速减少,部分地区濒临灭绝[3]。因此,研究干旱条件下黄芩的生长状况、生理特性和防御机制具有重要意义。
交叉适应是植物获得抗逆性的一种经济有效的方法[4]。交叉适应是指不仅能够抵抗持久或间歇性的非致命不利条件,而且能够发展对其他不利条件的抵抗力。在不同逆境条件下诱导植物交叉适应已有相关研究[5]。
温度对植物的生理功能影响较大,近几年来,全球气温急剧上升,导致植物的生存、生产力和健康发展受到了极大的限制。渗透调控是植物耐热性的一个重要生理因子,其中可溶性糖含量、脯氨酸含量是一种重要的调控因子。高温下,淀粉水解增加了植物可溶性糖的总含量,导致蛋白质水解值大于蛋白质合成和降解成亚基或氨基酸,导致游离氨基酸含量增加,尤其是脯氨酸的累积[6]。同时,低温也会严重影响黄芩幼苗的生长,因此如何提高植物对低温的抗性,提高生产效率,这是长期以来研究者们所关心的问题。低温胁迫对植物的光合作用有抑制作用,还会使细胞内蛋白质老化、降解或变性以及基因表达调控的改变,破坏细胞膜,导致细胞死亡。当外界影响造成的损害超过植物本身造成的损害时,植物会出现冻害症状[7]。
黄芩在我国的东北及华北地区有广泛的分布,抗寒、耐旱能力较强。杨兆春等的研究表明,轻微的干旱可以提高黄芩中的黄芩素含量,严重的干旱可以促进其向黄芩苷的转化[8]。利用聚乙二醇(PEG) 6000模拟干旱胁迫在许多植物中已有报道[9]。目前,国内外相关研究大多数局限于单一因素对植物生长的影响,高温和低温会影响植物初级代谢和次级代谢的水平,水分胁迫也影响着植物的生长,而高低温与水分交叉胁迫对植物的影响并未见大量研究。
因此,本研究采用不同温度梯度和10%PEG-6000模拟干旱对黄芩进行温度与水分交叉胁迫,通过测定脯氨酸、可溶性糖、可溶性蛋白的含量以及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性等指标分析研究其对黄芩幼苗生长和生理特性的影响,以期为提高黄芩抗逆能力以及选育抗逆品种提供理论基础。
1 材料与方法
1.1 试验材料
黄芩幼苗购自陕西省商洛市商州区田园富乐中药材种植合作社,为一年生植株。PEG-6000购自西安晶博生物科技有限公司,含量≥99.5%,分析纯试剂AR级。
1.2 试验方法
1.2.1 材料预培养
本试验于2022年4—6月在商洛学院丹江校区实验开放平台实验室完成。将黄芩幼苗移栽到直径为15 cm的花盆中,定期浇水,同时要注意松土,保证土壤的水分含量,使其回复到正常的生长状态。每盆3~5株,每个处理3次重复,培养时间为7 d。
1.2.2 黄芩幼苗的温度预处理
待黃芩幼苗缓苗期结束,选取生长状态一致的幼苗进行处理,将黄芩幼苗分别置于4、8、30、35 ℃的光照培养箱进行温度预处理,同时以25 ℃为对照组(CK),并保证各盆只有温度不同无其他因素影响。
1.2.3 温度胁迫不同时间处理
预处理3 d后,幼苗长至约40 cm时,用10%的PEG-6000处理以模拟干旱。在干旱处理后0、2、4、6、8、10 d采集样品,以测定生长及生理生化指标,并进行3次重复,取平均值。
1.3 测定指标及方法
从黄芩植株的相同部位取其叶片,测定相关指标。
1.3.1 生长指标的测定[10]
用直尺法测定株高(黄芩从根至主茎顶的距离);用直尺测定黄芩主根长度(黄芩根茎至主根尖的长度);用电子秤称取黄芩的地上和地下部鲜质量。
1.3.2 各项生理指标的测定
超氧化物歧化酶、过氧化物酶、过氧化氢酶活性的测定分别参照吴建慧等的氮蓝四唑(NBT)光还原法、愈创木酚显色法、紫外吸收法[11];可溶性蛋白含量的测定参照韩忠明等的考马斯亮蓝G-250法[12];可溶性糖含量的测定参照王胜等的蒽酮法[13];游离脯氨酸含量的测定参照任晓平等的茚三酮显色法[14]。
1.4 数据处理
数据处理采用微软Excel 2010标准版本,数据的显著性分析用SPSS 18.0软件。
2 结果与分析
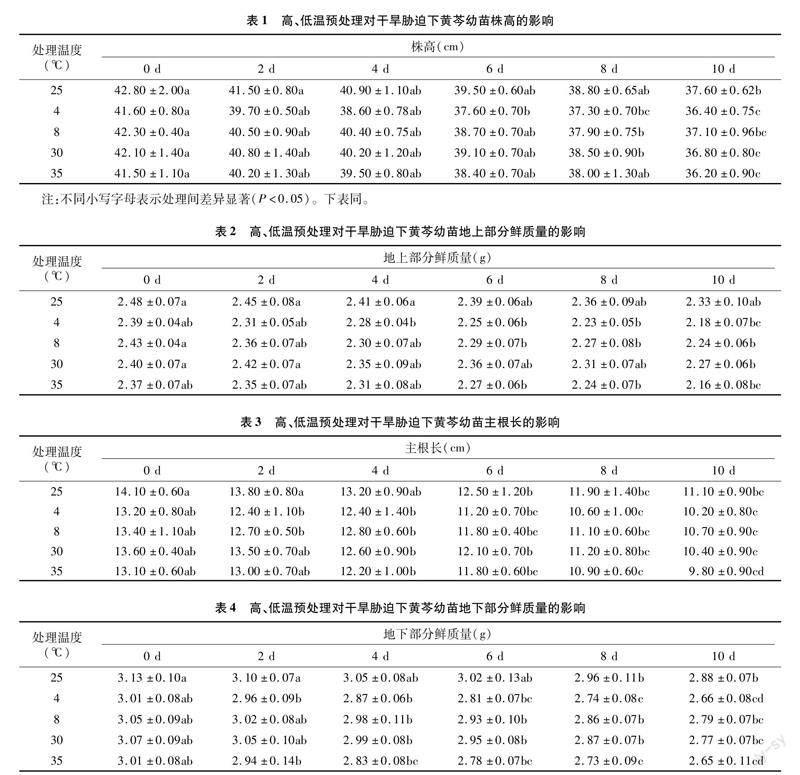
2.1 高、低温预处理对干旱胁迫下黄芩幼苗生长特性的影响
由表1可知,同一干旱条件下,与CK(25 ℃)相比,株高随着高、低温预处理水平的提高而降低。在低温预处理条件下,随着温度的降低,干旱胁迫结束(10 d)时,黄芩株高比CK分别降低1.33%(8 ℃)和3.19%(4 ℃);高温预处理后,干旱胁迫结束时,黄芩株高与CK比较分别降低2.13%(30 ℃)和3.72%(35 ℃)。通过增幅的比较,在高温、干旱交叉处理条件下,黄芩的株高更容易受到影响。地上部分鲜质量与株高变化趋势一致(表2)。黄芩通过叶片光合作用积累有机物并贮存在地上部分,株高的变化能够说明植物对此生长环境的适应程度,同时通过地上部鲜质量的改变说明植物的生长状况。由此可知,在干旱逆境条件下植物的生长受到抑制,且交叉胁迫处理更会加剧这一情况。由表3可知,在相等程度的干旱胁迫下,随着高温和低温预处理程度的提高,主根长度呈下降趋势。在低温预处理条件下,干旱胁迫结束时,随着温度的下降,黄芩主根长与CK相比,分别下降了3.60%(8 ℃)、8.11%(4 ℃);在高温预处理条件下,干旱胁迫结束时,黄芩主根长与CK相比,分别下降了6.31%(30 ℃)、11.71%(35 ℃)。从生长量的比较来看,黄芩主根的长度也更容易受到高温和干旱交叉处理的影响。黄芩地下部分的鲜质量与主根长之间存在着明显相关性,而主根的长度则是反映植株在不同胁迫条件下的生长状态,而地下部分鲜质量则是揭示其养分积累的重要依据(表4)。
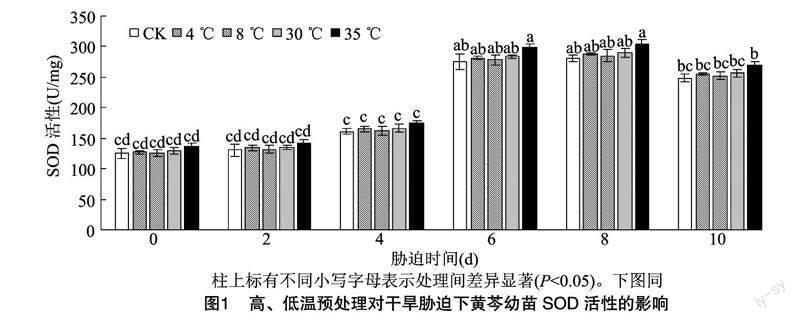
2.2 高、低温预处理对干旱胁迫下黄芩幼苗SOD活性的影响
由图1可知,随着交叉胁迫时间的延长,各处理黄芩的SOD活性均呈现出先升高后降低的趋势,在8 d时SOD活性达到最大。10 d时,高温预处理对干旱胁迫下黄芩SOD活性的影响相比CK分别增加了3.09%(30 ℃)、8.49%(35 ℃);低温预处理相比CK分别增加了2.80%(4 ℃)、1.47%(8 ℃)。
可以看出,在35 ℃高温下,SOD活性与CK的差别最大,其余处理对SOD活性的影响不显著。这表明植物会根据损伤程度增加SOD活性以维持正常生长。
2.3 高、低温预处理对干旱胁迫下黄芩幼苗POD活性的影响
由图2可知,干旱胁迫前,高、低温预处理对黄芩POD活性影响显著,干旱胁迫后POD活性的变化趋势呈波浪式曲线,但总体均比0 d时低。温度预处理后的POD活性變化趋势与CK相似。在干旱胁迫结束时,2个高温预处理的POD活性均达到了 60 U/mg 以上,35 ℃高温预处理的POD活性显著高于30 ℃高温预处理、2个低温预处理和CK,而且2个低温预处理也均达到了54 U/mg以上,高于CK。显著性分析结果表明,植物能够通过增加过氧化物酶的活性来减轻干旱和温度胁迫造成的损害。
2.4 高、低温预处理对干旱胁迫下黄芩幼苗CAT活性的影响
由图3可知,干旱胁迫前,高、低温预处理对干旱胁迫下黄芩CAT活性有显著影响。随着干旱胁迫时间增加,CAT活性总体呈先上升再下降的趋势,4 d时达到峰值。随着温度胁迫程度的加深,10 d 时,与CK相比,高温胁迫下黄芩的CAT活性增长率分别为4.69%(30 ℃)、10.81%(35 ℃);低温胁迫处理与CK相比,增幅分别为3.13%(4 ℃)、2.16%(8 ℃)。可见,虽然对黄芩的胁迫程度加剧,但CAT活性增幅很小,说明高、低温预处理对黄芩CAT活性影响很小,但它仍可通过增加CAT活性来抵御外来侵害维持其正常生长。
2.5 高、低温预处理对干旱胁迫下黄芩幼苗可溶性蛋白含量的影响
由图4可知,干旱胁迫前,与CK相比,低温预处理对黄芩叶片可溶性蛋白含量无显著影响,高温预处理有显著影响。随着干旱胁迫时间增加,各处理可溶性蛋白含量呈先降低后升高再降低的趋势,6 d时达到峰值。从干旱胁迫开始到胁迫10 d,不同处理条件下,与CK相比,可溶性蛋白含量的变化趋势基本相同,但总体上高于CK。10 d时,高温预处理的增幅分别为7.74%(30 ℃)、18.78%(35 ℃),低温预处理的增幅分别为4.61%(4 ℃)、2.47%(8 ℃)。表明2个高温预处理均对干旱胁迫下黄芩叶片可溶性蛋白含量有显著影响,而8 ℃低温预处理对可溶性蛋白含量的影响不显著。
2.6 高、低温预处理对干旱胁迫下黄芩幼苗可溶性糖和游离脯氨酸含量的影响
由图5可知,整个干旱胁迫期间,与CK相比,高、低温预处理黄芩叶片可溶性糖含量均显著增加,表明高温、低温预处理对干旱条件下黄芩叶片的可溶性糖含量有较大的影响。0 d时,高、低温预处理的可溶性糖含量与CK均差异显著,干旱胁迫后,高、低温预处理与CK的差异更加明显。CK的可溶性糖含量在干旱胁迫6 d时达到峰值(3.57 mg/g),与 0 d 时相比增长了42.23%,随后便开始下降。在干旱10 d时,随着温度的升高,高温预处理的可溶性糖含量相比对照增加了47.65%(30 ℃)、125.00%(35 ℃),低温预处理可溶性糖含量的增加率分别为32.35%(4 ℃)、11.18%(8 ℃)。结果表明,在 35 ℃ 条件下,黄芩叶片的可溶性糖含量与CK相比增幅最显著,高温处理对黄芩叶片的可溶性糖含量的影响要大于低温处理,说明高温处理比低温处理对植株的伤害更大。
由图6可知,在干旱胁迫前,黄芩在高温和低温条件下,其游离脯氨酸含量显著高于CK,CK的游离脯氨酸含量在干旱2 d后逐渐升高,到干旱胁迫 6 d 时出现峰值(291.38 μg/g),增长了22.73%,之后含量降低,降至279.15 μg/g。黄芩经过高温和低温处理后,在干旱胁迫下,其游离脯氨酸含量总体呈现先上升后下降的趋势,在干旱胁迫6 d时达到各自的峰值。其中,2种高温预处理黄芩的游离脯氨酸含量最大值均高于500 μg/g,显著高于2种低温预处理和CK,且2种低温预处理黄芩的游离脯氨酸含量均显著高于CK。显著性分析结果表明,当黄芩受到外界伤害时,其游离脯氨酸的含量会升高,细胞的渗透势下降,对黄芩的损害也会减轻,因此具有一定的抗旱能力。
3 讨论与结论
植物在进行一定的抗性训练后,不但可以提高抵抗逆境的能力,还可以提高对其他环境的抵抗力,也就是植物的交叉适应性[15]。植物在非生物胁迫下,通常会利用其自身的防御网络调节有关的代谢通路[16]。黄芩根系吸收土壤中的水分和营养,使叶子更快成长,同时叶片把光合作用所累积的有机物输送到根部,从而提高其药效[17]。在逆境胁迫下,渗透调控物质的积累是影响植物抗逆性的关键因素之一,通过稳定植物内的渗透压提高了其吸收水分的能力,从而提高了其抗性。根作为一种重要的吸收和合成器官,其生长与活力对植株地上部的养分和产量有非常重要的影响[18]。本研究结果表明,在干旱胁迫下,随着胁迫时间的延长,黄芩幼苗株高和主根长度呈下降趋势,其地上部、地下部质量呈正相关关系。同时,温度与水分交叉逆境胁迫加剧了植物生长的抑制情况,而且在双重胁迫条件下,对植物生长的抑制作用明显大于单一干旱逆境,这与杨佳骏等的研究结果[19]一致。
本试验中,干旱胁迫下黄芩幼苗SOD活性升高,经过高温和低温预处理后,黄芩的SOD活性再度升高,且SOD和POD活性的变化随着胁迫程度的增加而变得更加显著,其中35 ℃处理下效果最明显,这与Song等的研究结果[20]一致。说明植物在一定程度的逆境条件下可通过增加SOD、POD活性来保持自身的正常生长。李洁等对小麦的试验结果表明,非生物胁迫可提高CAT活性,减缓外界环境对植物的影响[21]。本试验也有相同的结果,单一干旱与干旱温度交叉处理下抗氧化酶活性均升高,且抗氧化酶活性的增加在交叉胁迫条件下显著高于单一胁迫条件下,抗性酶活性的增加可减少膜对活性氧自由基的脂质过氧化反应。
可溶性糖的累积能减少植物对逆境的渗透压,具有保持水分的功能,这是植物适应机制的一个重要标志[21]。本试验中,干旱胁迫下黄芩幼苗可溶性糖含量变化不大,但在温度和水分交叉胁迫条件下,可溶性糖含量与CK相比变化显著。说明在植物受到双重胁迫条件下,为了减少渗透压,增加水分,植株可通过积累糖分增强抗性。高温和低温预处理对干旱胁迫下黄芩可溶性蛋白含量有显著影响,其中35 ℃条件下效果最明显。程维舜等的研究表明,无论是经过干旱处理还是经过温度与干旱逆境交叉处理,黄芩幼苗中可溶性蛋白含量均比CK高,并且温度预处理后的黄芩幼苗可溶性蛋白含量又要比单一干旱处理高[22],本研究结果与之一致。本试验中,无论是单一干旱胁迫处理还是交叉胁迫处理,黄芩幼苗的游离脯氨酸含量均显著高于CK,并且交叉逆境相比单一干旱处理,也有较大升高,在35 ℃處理下,脯氨酸含量达到最高,这与Li等在油菜中的研究结果[23]一致。说明在交叉胁迫处理下,脯氨酸含量的增加促进了植物对胁迫的适应,提高了植物的抗逆性。
综上所述,干旱对黄芩幼苗生长有显著影响。高温、低温对黄芩幼苗的影响较大,其中,高温预处理对黄芩幼苗生长发育及各项生理指标的影响最大,对黄芩生长有一定的抑制作用。而高、低温预处理对干旱胁迫黄芩幼苗的可溶性糖含量、脯氨酸含量、可溶性蛋白含量及保护酶(SOD、 POD、 CAT)活性的提高作用效果显著,从而缓解了逆境胁迫对黄芩幼苗的伤害。表明高温、低温预处理使黄芩幼苗具有一定的抗旱性,其适应性与其渗透调控能力的增强呈正相关关系。
参考文献:
[1]陈 亮,崔芬芬,任艳文,等. 不同温度与光照对黄芩种子发芽特性的影响[J]. 山西农业科学,2017,45(2):208-210.
[2]李小玲,华智锐. 外源Ca2+对盐胁黄芩种子的萌发及生理特性影响[J]. 贵州农业科学,2016,44(11):145-148.
[3]杨 全,白 音,陈千良,等. 黄芩资源现状及可持续利用的研究[J]. 时珍国医国药,2006,17(7):1159-1160.
[4]张永福,黄鹤平,银立新,等. 温度与水分胁迫下玉米的交叉适应机制研究[J]. 河南农业科学,2015,44(1):19-24.
[5]朱秀红,李 职,蔡曜琦,等. 白花泡桐幼苗对盐、干旱及其交叉胁迫的生理响应[J]. 西部林业科学,2021,50(3):135-143.
[6]陈培琴,郁松林,詹妍妮,等. 植物在高温胁迫下的生理研究进展[J]. 中国农学通报,2006,22(5):223-227.
[7]李小玲,华智锐.甜菜碱对低温胁迫下黄芩幼苗生理特性的影响[J]. 贵州农业科学,2019,47(3):119-123.
[8]杨兆春,袁 媛,陈 敏,等. PEG胁迫对黄芩黄酮类有效成分积累及相关基因表达的影响[J]. 中国中药杂志,2011,36(16):2157-2161.
[9]袁 媛,李 娜,邵爱娟,等. PEG 6000处理对黄芩种子萌发和幼苗生长的影响[J]. 中草药,2008,39(2):269-272.
[10]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[11]吴建慧,范卫芳,牛 喆,等. 外源茉莉酸甲酯对干旱胁迫下狭叶黄芩光合和生理特性的影响[J]. 植物研究,2020,40(3):360-367.
[12]韩忠明,胥苗苗,王云贺,等. 干旱胁迫对防风叶片保护酶活性、渗透调节物质含量及药材品质的影响[J]. 华南农业大学学报,2016,37(6):91-97.
[13]王 胜,丁雪梅,时彦平,等. 盐胁迫对沙滩黄芩生长及其生理特性的影响[J]. 山东林业科技,2015,45(5):33-37.
[14]任晓平,张喜春,张 楠,等. 低温胁迫对番茄幼苗叶片中脯氨酸降解酶的活性及其基因表达量的影响[J]. 中国农学通报,2012,28(10):132-135.
[15]尚蓉霞,余 欣,尤翠翠,等. 水稻孕穗期干旱-高温交叉胁迫的生理适应机制[J]. 甘肃农业大学学报,2019,54(6):39-46,54.
[16]张夏燕,刘慧娜,苏江洪,等. 非生物胁迫对芍药属植物生长发育影响的研究进展[J]. 分子植物育种,2018,16(15):5072-5079.
[17]李小玲,华智锐,唐梦君. 盐旱交叉胁迫对黄芩幼苗生长及渗透调节物质的影响[J]. 江西农业学报,2019,31(9):40-45.
[18]和红云,薛 琳,田丽萍,等. 低温胁迫对甜瓜幼苗根系活力及渗透调节物质的影响[J]. 石河子大学学报(自然科学版),2008,26(5):583-586.
[19]杨佳骏,吴永波,张燕红.高温与干旱胁迫对‘南林895杨扦插苗生长和超微结构的影响[J]. 林业科学,2020,56(5):176-183.
[20]Song F N,Yang C P,Liu X M,et al. Effect of salt stress on activity of superoxide dismutase (SOD) in Ulmus pumila L.[J]. Journal of Forestry Research,2006,17(1):13-16.
[21]李 洁,武杭菊,胡景江,等. 干旱-低温交叉逆境下小麦渗透调节能力的变化与交叉适应的关系[J]. 干旱地区农业研究,2009,27(6):149-153.
[22]程维舜,曾红霞,张 娜,等. 干旱-盐胁迫对西瓜幼苗可溶性蛋白质及可溶性糖的影響[J]. 黑龙江农业科学,2014(11):91-93.
[23]Li S J,Cheng L,Peng S D,et al. Screening of drought-tolerant Brassica napus L.varieties and analysis on their physiologic and biochemical variations under drought stress[J]. Agricultural Science & Technology,2014,15(4):596-604,615.
收稿日期:2022-12-16
基金项目:陕西省科技厅农业攻关项目(编号:2021NY-066);中央引导地方科技发展专项(编号:2019ZY-FP-02)。
作者简介:李小玲(1980—),女,陕西蓝田人,硕士,副教授,主要从事植物生理生态研究。E-mail:lxlflower@163.com。
