Tmod1过表达对大鼠血管平滑肌细胞迁移和侵袭的影响
2023-12-20谢利德姚伟娟
马 杉,谢利德*,姚伟娟
(1.承德医学院基础医学院,河北承德 067000;2.北京大学医学部基础医学院)
血管再狭窄是冠状动脉血管成形术后的常见并发症,严重影响着人类生活与身体健康,血管再狭窄由多种原因造成,其中平滑肌细胞异常增殖和迁移所造成的血管内膜异常增生是动脉术后再狭窄发生的危险因素[1]。当平滑肌细胞受到外界损伤或者受到某种因子的影响时,会由分化状态转为去分化状态,其迁移能力和增殖能力增加,收缩力降低,因此平滑肌细胞的异常迁移和增生在心血管疾病中带来很大的影响。有研究发现,肌动蛋白细胞骨架的破坏介导器官培养中血管平滑肌细胞早期表型转换中应力纤维的丢失,平滑肌细胞转为去分化状态,肌动蛋白解聚增加[2]。原肌球蛋白调节蛋白1(Tropomodulin1,Tmod1)是肌动蛋白微丝的一种盖帽蛋白,在细胞中表达量的改变会直接影响肌动蛋白微丝的组装,参与肌动蛋白的延伸和解聚,从而影响着细胞骨架的结构。前期研究表明,Tmod1也表达在血管平滑肌细胞中[3],然而Tmod1对平滑肌细胞的增殖、迁移和侵袭能力的影响目前尚不明确。因此,本研究旨在通过在大鼠胸主动脉平滑肌细胞体外感染腺病毒,使Tmod1过表达后检测细胞迁移和侵袭能力的变化,从而探讨Tmod1在血管再狭窄中的临床意义。
1 材料和方法
1.1 试剂和仪器设备
雄性SD大鼠(150~180 g左右)购自北京大学医学部实验动物中心;细胞DMEM低糖培养基(中科迈晨公司);胎牛血清(Biological Indutries,Israel);鼠抗GAPDH(Santa Cruz Biotech,USA);兔抗Tmod1(京天成,北京);山羊抗兔、鼠二抗(中杉金桥,北京);Transwell小室(Falcon,DE);BCA蛋白定量(普利莱,北京);酶标仪(Bio-Rad,USA);细胞培养箱(Sanyo,Janpan);PCR扩增仪(Bio-Rad,CA,USA)。
1.2 细胞提取及培养
脱颈处死SD大鼠,用75%的酒精喷洒大鼠颈部胸部皮肤,依次剪开胸部的皮肤和肌肉;取出胸主动脉放入灭菌的PBS中;在超净台中洗血管,去除血管外组织;将血管放入二型胶原酶中消化30 min,轻刮法去除内膜,剥离外膜;将剥离的中膜置于10% FBS的低糖DMEM培养基中,放入细胞培养箱过夜;第二天,将血管中膜放入消化液中消化90 min,吹打分离,再消化30 min;加入20%胎牛血清的低糖DMEM培养基10 mL以达到停止消化的目的,1500 rpm,离心6 min;弃上清,加入4 mL的10%胎牛血清的低糖培养基重悬,6 cm培养皿进行培养,用以进行后续实验。
1.3 腺病毒感染
六孔板中分别加1 mL含有腺病毒的培养基,放回细胞培养箱。12 h后,再加入1 mL含10%胎牛血清的DMEM培养基。培养48 h后,可依据实验目的提取蛋白或RNA。
1.4 Western blot
向六孔板培养皿中加入80 uL裂解液,提取总蛋白,BCA法进行蛋白定量,加5×Loading buffer,95℃水浴锅加热10 min。转膜,用含有5%脱脂奶粉封闭2 h,一抗过夜[Tmod1(1:500,北京京天成生物有限公司);GAPDH(1:10000,proteintech)],第二天TBST洗膜3次,随后二抗孵育,室温孵育1 h,洗膜3次后进行ECL显影。
1.5 细胞RNA的提取
向六孔板培养皿中加入1 mL的TRIP RNA提取液,于样品加200 μL的氯仿,充分混合,冰中放15 min,10000 r/min离心15 min,将上清溶液吸至新的EP管中,加入等体积的异丙醇,-20℃过夜,次日进行离心,可以观察到白色沉淀,吸弃上清;75%乙醇洗RNA,洗3次,离心10 min,弃上清后,置于室温干燥,加入20μL DEPC水,55℃水浴锅中助溶2 min,测浓度。之后用以扩增及实时定量PCR。
1.6 细胞划痕实验
六孔板中铺2×105细胞,感染腺病毒48 h后,在含10%FBS的培养基中培养且生长密度大于90%,用200 μL枪头垂直于培养板底部在每孔中间划直线;弃旧的培养基,PBS缓冲液重复洗3次之后加无血清的培养基,培养0、12、24、36 h时在显微镜下观察并测量划痕间隙的宽度。
1.7 Transwell实验
感染后48 h,加入胰蛋白酶消化,细胞培养箱中消化2 min,加入含10% FBS的培养基来达到停止消化的目的,吹打混合均匀,取100 μL细胞悬液加到Transwell上室;再在下室加1 mL含20%胎牛血清的培养液,以不同血清浓度做趋化;放回CO2培养箱,培养48 h。拿出小室,吸出小室内旧的培养基,用PBS轻轻洗2次,用4%多聚甲醇来固定细胞20 min,吸出固定液,用PBS洗2次,之后用Giemsa染液染色20 min;用PBS轻轻洗弃染色液,棉签轻轻擦净表面上的细胞,静置干燥,于显微镜下(100倍)观察并拍摄,随机选取5个镜下视野且计数细胞,计算出5个视野内的细胞平均值。
1.8 统计学处理
实验数据均以均值±标准差表示,使用统计学软件SPSS 19.0对所得数据进行处理,所有组间两两进行比较,采用t检验方法,P<0.05时,即表示差异有统计学意义。
2 结果
2.1 大鼠胸主动脉平滑肌细胞的鉴定
为了鉴定所培养的大鼠胸主动脉细胞为平滑肌细胞,我们使用了收缩型平滑肌细胞标志蛋白平滑肌22α(smooth muscle 22 alpha,SM22α)的抗体对细胞进行了免疫荧光染色。结果显示(图1),DAPI标记的所有细胞核呈现椭圆形。视野中几乎所有的细胞均为SM22α阳性细胞,在平滑肌细胞的胞质中与细胞长轴平行,细丝状形状。这提示我们所分离的大鼠主动脉细胞为平滑肌细胞,且纯度较高。
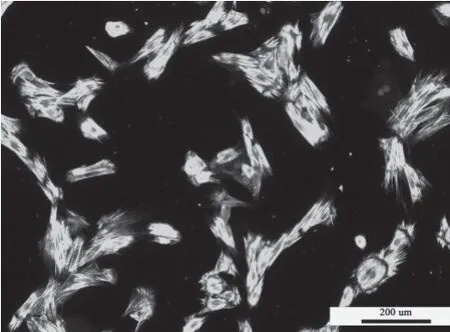
图1 免疫荧光SM22α染色鉴定平滑肌细胞
2.2 Tmod1过表达的验证
我们首先在SD大鼠胸主动脉原代平滑肌细胞中感染Ad-Null、Ad-Tmod1腺病毒,通过RT-qPCR及Western blot来检测Tmod1的蛋白表达情况及mRNA的表达情况。结果发现,当腺病毒浓度为40MOI时,可使Tmod1的蛋白水平(图2A)及mRNA水平增加(图2B)。
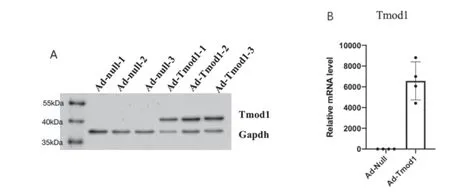
图2 Tmod1过表达验证
2.3 过表达Tmod1后平滑肌细胞迁移情况
大鼠胸主动脉平滑肌细胞感染腺病毒48 h后,进行划痕,分别在0、12、24、36 h拍照记录划痕愈合的情况。结果显示(图3),与阴性Ad-Null组比较,过表达Tmod1后细胞划痕愈合面积增加,表示过表达Tmod1组迁移能力明显上升,差异有统计学意义(P<0.05)。
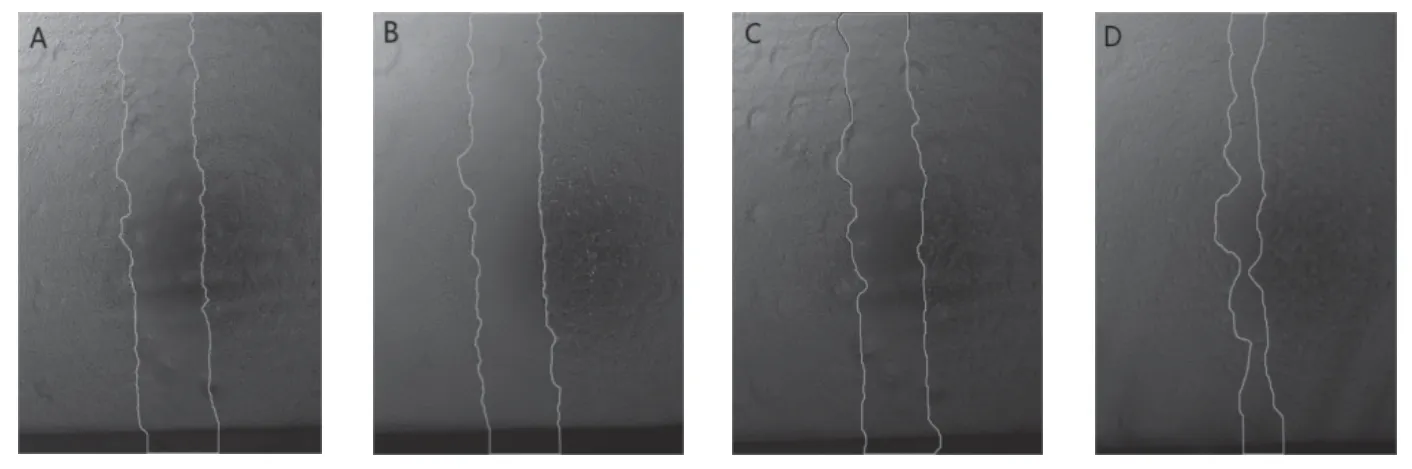
图3 平滑肌细胞过表达对照腺病毒和Tmod1后各组细胞划痕愈合情况
2.4 Tmod1过表达后细胞侵袭能力的情况
大鼠胸主动脉平滑肌细胞感染腺病毒48 h后,消化细胞,接种在Transwell小室中培养,48 h后进行固定染色拍照,结果显示(图4),与对照腺病毒组相比,过表达Tmod1组的细胞侵袭能力上调,差异有统计学意义(P<0.05)。
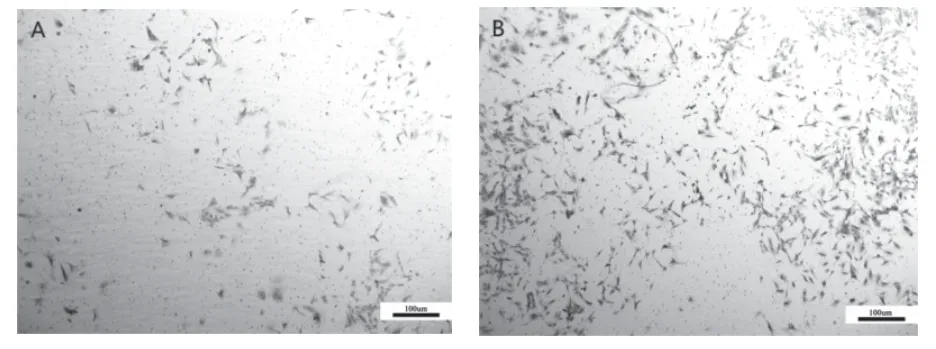
图4 各组细胞Transwell侵袭实验结果
2.5 Tmod1调节平滑肌细胞中MMP15的表达
采用RT-qPCR的方法检测过表达Tmod1与对照腺病毒处理的平滑肌细胞中检测MMP15的表达水平变化,结果显示,过表达Tmod1后的平滑肌细胞与对照腺病毒平滑肌细胞相比,MMP15的表达量明显增加,差异有统计学意义(P<0.05)。
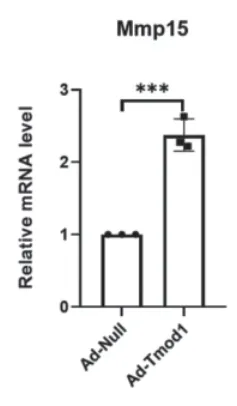
图5 MMP15的mRNA的表达变化
3 讨论
动脉粥样硬化(atherosclerosis,AS)是由多种因素参与共同发挥作用而导致的慢性炎性反应,血管平滑肌细胞迁移是AS、冠状动脉血管成形术后再狭窄等的重要病理基础,许多分子及药物已经被证明可以通过调节平滑肌细胞的迁移和侵袭,进而抑制平滑肌细胞内膜的生成,进而减慢动脉粥样硬化疾病的发生发展[4,5],因此研究平滑肌细胞迁移和侵袭的分子机制对于缓解动脉粥样硬化、高血压的治疗等至关重要。
细胞骨架由微管、肌动蛋白微丝和中间纤维组成,G-肌动蛋白单体(含ATP)可聚合为呈纤维状的F-肌动蛋白。研究发现,Tmod1的耗尽会导致肌动蛋白-肌钙蛋白丝的拆卸,应力纤维的丢失以及细胞性形态的严重缺陷[6]。在本研究中,我们发现Tmod1的表达水平与平滑肌细胞的迁移与侵袭能力正相关,对过表达Tmod1与对照腺病毒感染的平滑肌细胞进行RNAseq分析,在所获得的差异基因中,我们发现了基质金属蛋白酶家族中的MMP15。MMPs家族由于可以直接降解癌症细胞外膜基质中的蛋白成分,进而有效摧毁了癌症细胞对外入侵的防御屏障,所以它在阻止癌症细胞侵袭和转移过程中也发挥出了其重大的影响作用[7],先前的文章中已经详细研究分析了MMP15家族可能是在阻止癌症细胞的入侵过程中发挥关键性作用[8],所以认为MMP15可能是过表达Tmod1后促进细胞迁移的潜在靶点。我们的实验表明,在平滑肌细胞中过表达Tmod1后,MMP15的表达是上升的。
综上所述,过表达Tmod1可以促进平滑肌细胞的迁移和侵袭,是调节平滑肌细胞迁移的重要因子,并且可能是通过上调MMP15来实现的,接下来我们将会进一步研究揭示Tmod1是如何调节MMP15的表达从而影响平滑肌细胞迁移的。
