干旱胁迫下枯草芽孢杆菌对玉米苗期叶片的生理生化调节
2023-12-20李安舒健虹刘晓霞路雪萍焦渔王小利赵德刚
李安 舒健虹 刘晓霞 路雪萍 焦渔 王小利 赵德刚
摘 要 为探究干旱胁迫下不同枯草芽孢杆菌对玉米苗期叶片的生理调节作用,通过对干旱与正常水分下玉米根部接种R9-1、R59、R60等3 种不同植物根际的枯草芽孢杆菌及R59+R60组合菌种,测定玉米苗期叶片的抗氧化酶活性、细胞渗透物质、细胞膜氧化产物、H2O2、内源激素、相对含水量等生理生化调节物质以及叶片的K、P、N含量。通过主成分分析与相关性分析发现接种枯草芽孢杆菌主要影响玉米苗期叶片的可溶性糖、脱落酸(ABA)、磷(P)含量、超氧化歧化酶(SOD)活性、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、叶片游离脯氨酸(PRO)含量、叶片相对含水量,其中叶片相对含水量与其他生理表现因子呈显著的负相关关系。干旱胁迫下,接种枯草芽孢杆菌的玉米苗期叶片抗氧化酶活性、细胞渗透调节物质、P、N含量显著降低。接种R9-1、R59降低H2O2与ABA含量,接种R60、R59+R60提高ABA含量,接种R59、R60、R59+R60降低吲哚乙酸含量。隶属函数综合分析枯草芽孢杆菌对玉米的调节作用排名为:正常情况下R60> R59>R9-1>R59+R60>CK1;干旱胁迫下R60>R59+R60>R59>R9-1>CK2。综上所述,接种枯草芽孢杆菌玉米苗期叶片的生理表现为抗氧化酶活性、细胞渗透调节物质、P、N含量显著降低,同时R59、R60、 R59+R60均有效提升玉米苗期叶片的相对含水量,说明接种枯草芽孢杆菌玉米苗期受干旱胁迫影响程度较小,所以接种枯草芽孢杆菌具有提升玉米苗期适应干旱胁迫的调节能力,从而保证自身的生长发育。
关键词 玉米;枯草芽孢杆菌;隶属函数;干旱胁迫
玉米是中国重要的粮饲作物,在全国大面积种植,可作为工业原料、食品、牲畜饲料,在中国粮饲生产和农业产业结构方面发挥着重要作用。干旱是制约农作物生长的重要非生物因素之一,提高作物抗逆性是提高产量的一种有效方式。对于多数作物而言,干旱胁迫反应敏感的关键时期都是芽期和苗期[1],研究发现利用植物根际促生菌提升植物抗逆性是一种有效的方式,其中Bacillus megaterium、Bacillus aryabhattai、Bacillus megaterium等菌种均促进玉米种子萌发[2]。处于干旱胁迫下,B.megaterium、B.aryabhattai、B.megaterium等菌种对玉米芽期的抗氧化酶系、渗透调节物质、细胞膜氧化产物均有显著的调控作用,其中显著降低了玉米芽尖的 MDA 含量,能有效减弱玉米芽期细胞受干旱的损伤[3]。枯草芽孢杆菌(B.subtilis)是一种植物根际促生菌,其生理特征丰富多样,极易分离培养,能产生多种抗菌素和酶。因此,前人研究主要在枯草芽孢杆菌对植物病害生物防治方面的应用,目前发现枯草芽孢杆菌在黄瓜[4-5]、辣椒[6-7]、水稻[8-9]、小麦[10-12]、玉米[13-14]等农作物病害上存在较好防治效果[15]。生物防治机理是其产生的细胞素、酶类、活性蛋白质等物质能够对霉菌、酵母、细菌具有一定的抑制作用;同时可通过溶菌作用是拮抗微生物生长,主要方式为吸附在病原真菌的菌丝上,并随着菌丝生长而生长,而产生溶菌物质消解菌丝体,能使菌丝发生断裂、解体、细胞质消解,有的菌丝原生质凝结;或者是产生次生代谢产物对病原菌孢子的细胞壁产生溶解作用,致使细胞壁穿孔、畸形等现象[4]。与此同时又能产生生长激素,如生长素(Auxin,)、赤霉素(Gibberellin)、细胞分裂素(Cytokinin)、脱落酸(Abscisic acid)和乙烯(Ethylene)等,促进植物生长,继而改善农作物生长发育[16-17]。基于生長激素在植物生长发育过程中的调控作用,为此探讨枯草芽孢杆菌对玉米苗期处于干旱胁迫下的生理调节作用,为枯草芽孢杆菌作为添加剂的生物菌肥的开发与玉米抗旱性评价提供理论依据。
1 材料与方法
1.1 材 料
供试玉米(Zea mays L.)种子品种为‘金玉818,由贵州省农业科学院旱粮所提供。菌种由贵州省野外采集实验室保存及生物商品菌肥筛选而来(表1)。盆栽土壤取自贵州省农业科学院内,理化数据(贵阳)如表2。
1.2 试验方法
1.2.1 方 法
将编号为B、C、D、E 4个菌种培养扩增,调节OD600值至0.9左右用于菌种试验。将每组90粒玉米种子于10%次氯酸钠溶液下消毒20 min,再用无菌水洗涤3~5 次,自然晾干,备用。
将消毒后的玉米分别置于80 mL不同的菌液(表3)中浸泡4 h作为试验组,CK1(正常处理不接种菌)和CK2(干旱处理不接种菌)的玉米置于80 mL灭菌的菌体培养基中浸泡4 h作为对照组,然后将玉米在无菌条件下移至培养皿中,待试验组玉米表面菌液与对照组玉米表面培养基自然风干后,播种于装有灭菌土壤的同种规格的花盆中,每盆5粒,每组8个重复。玉米第1次出土时记录玉米苗出土情况,直至玉米出土期结束,将各处理的多余玉米移除,保留每盆2株玉米苗即可。待玉米三叶期时向试验组花盆中玉米根部周围每株注入20 mL OD600为0.9左右的对应菌液(B、C、D、E),对照组(CK1,CK2)花盆中玉米根部周围每株注入20 mL LB液体培养基,待玉米生长10 d后进行干旱处理。正常处理按土壤最大持水量80%,干旱处理按土壤最大持水量40%来控制水分,干旱20 d后取玉米叶片进行指标测量。测量指标分别为玉米苗期的叶片超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、叶片游离脯氨酸(PRO)含量、丙二醛(MDA)含量、可溶性糖含量、H2O2含量、1-氨基环丙烷-1-羧酸(ACC)含量、吲哚乙酸(IAA)含量、脱落酸(ABA)含量、相对含水量、钾(K)含量、磷(P)含量、氮(N)含量等。
1.2.2 指标测量方法及计算公式 SOD活性、CAT活性、POD活性、PRO含量、MDA含量、可溶性糖含量、H2O2含量等均授权苏州格锐思生物科技有限公司按表4所示试剂盒使用方法进行测定。
ACC含量、吲哚乙酸(IAA)含量、脱落酸(ABA)含量等由上海三黍生物科技有限公司采用LC-MS法测定。
相对含水量测定公式:相对含水量=(总鲜质量-干质量)/(叶片饱和吸水质量-干质量)×100%
K、P、N含量测定:采用硫酸-双氧水消解,凯氏法测定植物全氮含量,钼锑抗吸光光度法测定植物全磷含量,原子吸收分光光度计测定植物全钾含量[18]。
1.3 数据处理
试验数据采用Excel 2016进行统计分析,方差分析采用Spss 20软件分析。
式中,Xij和 Xj分别表示第i处理第j个指标的隶属值和所有株系第j 个指标的平均值; Xmin和Xmax表示第j个指标的最小值和最大值;计算隶属函数值时,若指标与耐旱性呈正相关用公式(1) ,若指标与耐旱性呈负相关用公式(2) 。
2 结果与分析
2.1 微生物菌剂对干旱胁迫下玉米叶片表型特征的影响
由图1可知,干旱条件下不同微生物菌剂对玉米表型影响各异,与对照相比,接种枯草芽孢菌剂后玉米对干旱胁迫的干旱症状明显减弱,而对照(CK2)的叶片明显萎蔫卷曲下垂,叶尖和叶基出现焦枯的症状。正常情况下接种不同枯草芽孢杆菌菌种后表型变化并不明显。
2.2 干旱胁迫与正常情况下微生物菌剂对玉米苗期叶片抗氧化酶活性的影响
如图2所示,干旱胁迫下玉米叶片SOD活性和POD含量比正常情况有一定程度的升高,接种枯草芽孢杆菌后,在干旱胁迫的情况下玉米叶片SOD、CAT和POD活性均显著(P<0.05)降低,不同菌种降低的程度不同;正常情况下与干旱胁迫不同的是除接种C显著降低CAT活性与接种E显著升高CAT活性外,其余接种的菌种对玉米苗期叶片CAT活性影响不显著,而接种的菌种仅B对玉米苗期叶片POD活性差异不显著,其余菌种均显著降低POD活性,所以不同的菌种在干旱胁迫与正常情况下对玉米抗氧化酶活性的调节存在差异,同时同种条件下不同的菌种对玉米抗氧化酶活性的调节也存在差异。
2.3 干旱胁迫下微生物菌剂对玉米苗期叶片渗透压调节物质积累的影响
如图3所示,干旱胁迫下玉米苗期叶片细胞内渗透压物质积累较正常条件下均有不同程度增加。接种枯草芽孢杆菌后均显著(P<0.05)降低玉米苗期叶片渗透物质PRO含量与可溶性糖含量的积累,不同的菌种降低程度存在差异。正常情况下接种枯草芽孢杆菌显著提升玉米苗期叶片PRO含量的累积,而对于可溶性糖积累的影响除接种D不显著外,接种B与C显著降低,接种E显著升高可溶性糖;上述可知不同的菌种在干旱胁迫与正常情况下对玉米苗期叶片渗透物质含量的调节存在差异,同时同种条件下不同的菌种对玉米苗期叶片渗透物质的调节也存在差异。
2.4 干旱胁迫下微生物菌剂对玉米苗期叶片活性氧累积的调节
由图4可知,遭遇干旱时玉米苗期叶片活性氧累积会升高,处于正常情况下,接种B、D和E时玉米苗期叶片活性氧累积显著(P<0.05)高于对照组,接种C显著降低玉米苗期叶片活性氧累积;处于干旱胁迫下接种D与E对玉米苗期叶片活性氧的影响不显著,接种B与C显著降低玉米苗期叶片活性氧累积。
2.5 干旱胁迫下微生物菌剂对玉米苗期叶片膜脂过氧化物的影响
MDA是干旱胁迫造成细胞膜脂过氧化的主要产物之一。如图5所示,干旱胁迫下玉米苗期叶片MDA含量升高,接种不同的菌种对玉米叶片MDA含量的累积呈现出不同的影响,干旱胁迫下接种B菌种对玉米苗期叶片MDA含量的累积无明显差异,接种C、D、E均显著(P<0.05)降低MDA含量的累积。正常情况下接种枯草芽孢杆菌显著降低玉米苗期叶片MDA含量的累积,且不同菌种降低程度不同。
2.6 微生物菌剂对玉米苗期叶片激素的影响
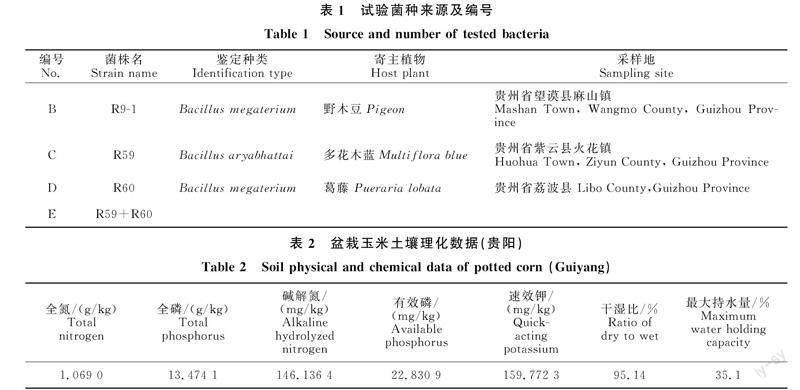
如图6所示,在干旱胁迫与正常情况下接种微生物菌剂对玉米苗期叶片激素的调节情况,干旱胁迫下玉米叶片ACC与ABA含量均升高,而对IAA的影响程度不明显。接种不同菌剂对玉米叶片ACC、ABA、IAA含量的影响程度不同。正常情况下,接种B、D、E显著提高玉米叶片ACC含量,接种C对玉米叶片ACC含量差异不显著;接种C、D、E显著降低玉米叶片IAA含量,其余处理差异不显著;接种B、E显著升高叶片ABA含量,接种C、D显著降低玉米叶片ABA含量。干旱胁迫下接种B显著提高玉米叶片ACC含量,其余处理对叶片ACC含量影响差异不显著;接种D、E两种菌种显著降低玉米IAA含量,接种B、C差异不显著;接种B、C显著升高玉米叶片ABA含量,接種D、E则显著降低IAA含量。综上所述,添加菌剂对玉米处于正常与干旱胁迫的情况下其叶片激素的含量有着不同程度的影响,存在降低与升高两种模式。
2.7 微生物菌剂对玉米苗期叶片相对含水量的影响
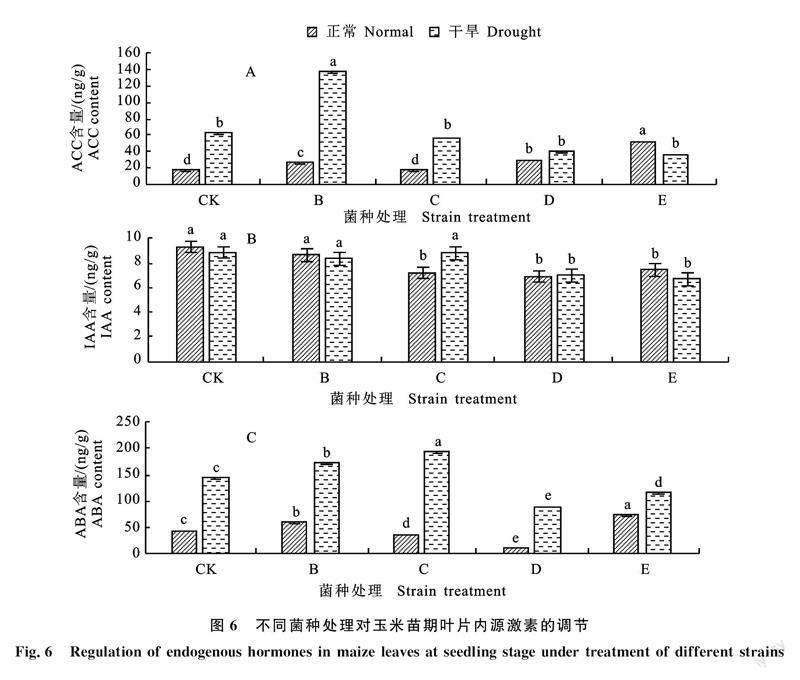
如图7所示,干旱胁迫下能够降低玉米叶片相对含水量,接种不同的菌种对玉米苗期叶片的相对含水量影响不同。正常情况下,接种枯草芽孢杆菌B显著降低玉米叶片相对含水量,其余各试验组均与对照组差异不显著。而处于干旱胁迫下,接种C、D、E 3种菌种均显著提高玉米相对含水量,接种B对玉米叶片相对含水量影响不显著,说明处于干旱胁迫时接种C、D、E 3种枯草芽孢杆菌可以调节玉米叶片相对含水量。
2.8 微生物菌剂对玉米苗期叶片K、P、N含量的影响
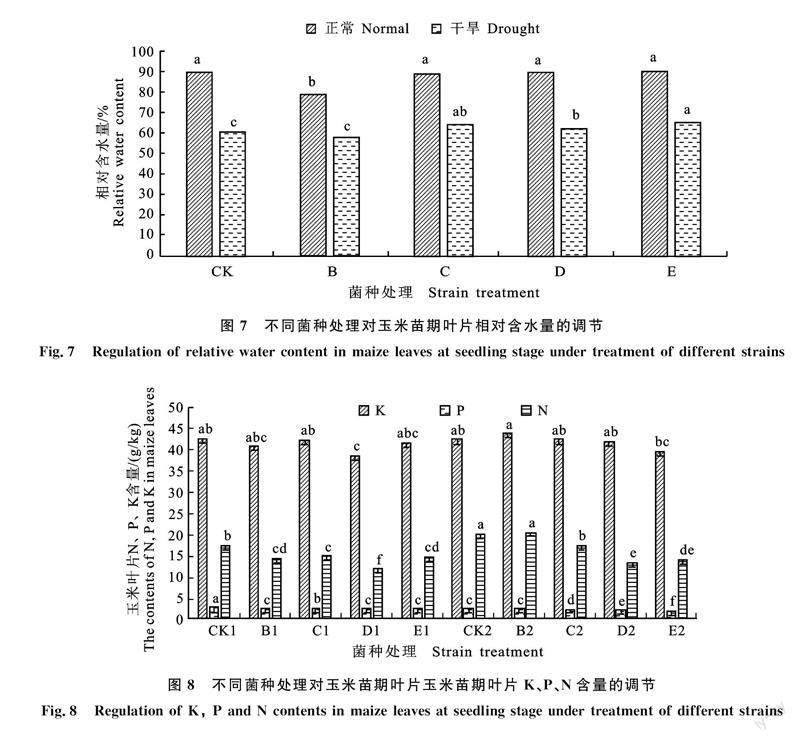
如图8所示,水分与接种枯草芽孢杆菌对玉米苗期的K含量影响不大,而干旱胁迫下玉米叶片N含量增加,接种不同的枯草芽孢杆菌对叶片N含量存在不同的影响,其中正常情况下接种枯草芽孢杆菌显著降低了玉米苗期叶片N含量,干旱胁迫下也大致呈现出相同的趋势。除干旱胁迫下接种B菌种对玉米叶片P含量影响不显著外,正常与干旱胁迫下接种枯草芽孢杆菌显著降低玉米叶片P含量。说明干旱胁迫与正常情况下接种枯草芽孢杆菌对于玉米叶片常规营养指标存在影响,特别是N和P的影响。
2.9 玉米苗期受微生物菌剂影响指标的筛选及影响因数之间的相关性分析
对玉米叶片ACC、吲哚乙酸、脱落酸、抗氧化酶活性、细胞渗透物质、细胞膜氧化产物、N、P、K等指标进行主成分分析,本试验提取3个主成分(表5和表6),其中第一主成分的特征值为 7.262,贡献率为51.868%,对应特征向量中,数量较大的指标有可溶性糖、脱落酸、CAT等。第二主成分的特征值为2.737,贡献率为 19.551%,对应的特征向量中主要表现在吲哚乙酸和P含量方面。第三主成分的特征值为1.504,贡献率为10.740%,对应的特征向量中主要表现在SOD活性、相对含水量、POD活性方面。以上3个主成分的累计贡献率为82.159%,基本包含了所测指标的全部信息。结合表7可看出,玉米苗期叶片各影响因数之间的相关性:叶片相对含水量与ACC、吲哚乙酸、脱落酸、抗氧化酶活性、细胞渗透物质以及细胞膜氧化产物等呈现显著负相关关系,与P、K和H2O2等呈现负相关关系,其余各指标间均呈现正相关关系。综合主成分分析和相关性分析结果,玉米苗期叶片的可溶性糖、脱落酸、P含量、SOD、PRO、CAT、POD、叶片相对含水量等8个指标在接种不同的枯草芽孢杆菌种容易受到影响。
2.10 枯草芽孢杆菌对玉米苗期叶片生理生化调节隶属函数综合评价
针对不同植物根际的枯草芽孢杆菌对玉米苗期的生理生化调节作用不同,通过隶属函数均值综合评价出不同植物根际的枯草芽孢杆菌对玉米苗期的生理生化调节作用(表8)。其中正常与干旱情况4组枯草芽孢杆菌均能够提高玉米生长发育能力,根据对玉米各项指标的隶属函数均值进行排名,正常情况:D1>C1>B1>E1>CK1;干旱胁迫下:D2>E2>C2>B2>CK2。
3 讨 论
处于正常水分与干旱胁迫时植物存在不同的应答机制,其中正常水分情况下植物体内活性氧代谢保持着动态平衡[19],而干旱胁迫情况下的植物活性氧代谢呈现不平衡状态。这种植物体内活性氧代谢状态部分依赖于SOD、POD、CAT等抗氧化酶与其他抗氧化物质组成的抗氧化系统的调控作用。抗旱性强的植物体内的 SOD、POD、CAT的活性一般较高,该调控作用在于有效清除植物体内活性氧,阻抑膜脂过氧化,缓解植物因干旱胁迫受到的伤害[20]。本试验中,干旱胁迫下玉米苗期叶片SOD、POD、CAT的活性均有不同程度的升高,这与前人研究一致,玉米苗期叶片SOD、POD、CAT活性在一定的程度下代表玉米受到干旱胁迫程度。处于干旱胁迫与正常情况下,玉米根部接种不同的枯草芽孢杆菌对玉米叶片抗氧化酶 SOD、POD、CAT的活性存在着不同程度的影响。根据已经证实的结论,植物根际促生菌可产生有益于植物生长的化合物[21-22],通过产生植物激素、固氮、溶磷、产铁载体能力来提高植物的生长能力。而处于干旱胁迫时,接种植物根际促生菌后能够促进根部的发育以及根部吸收的功能从而提高植物抗旱性,通过对辣椒接种植物根际促生菌后,辣椒的耐旱性明显高于对照组,其主要是通过促进根部的发育来提高植物吸收水分的能力[23]。值得注意的是,在干旱胁迫的情况下玉米根部接种不同的枯草芽孢杆菌使得玉米叶片SOD、CAT和POD活性均显著(P<0.05)降低。可以得出枯草芽孢杆菌可以促进玉米苗期对水分的吸收,从而使得玉米苗期受干旱胁迫影响度降低。所以枯草芽孢杆菌一定程度上提高了玉米苗期对于干旱的耐受范围。
植物应对干旱胁迫的另一种应答方式为细胞渗透势调节,植物可通过细胞内水分减少、细胞体积缩小、细胞内溶质增加等3种方式进行植物细胞渗透势的调节[24]。其中细胞内渗透调节物质的积累是细胞渗透势在干旱胁迫下多呈现为降低趋势的原因之一。而植物渗透调节物质其中一大类为有机溶剂,如可溶性糖、可溶性蛋白、脯氨酸等[25]。本试验发现干旱胁迫下玉米可溶性糖和脯氨酸的积累量均比正常水分高,表明植物细胞内渗透调节物质的积累是反映植物受干旱胁迫的影响程度。而接种不同枯草芽孢杆菌呈现出不同的影响结果,具体表现为干旱胁迫下接种枯草芽孢杆菌均显著(P<0.05)降低玉米苗期叶片PRO含量和可溶性糖含量的积累。而植物体内的可溶性糖含量在干旱胁迫情况下普遍上升,这是对干旱胁迫适应的一种表现[26]。本试验中干旱胁迫时接种枯草芽孢杆菌能够降低植物渗透调节物质含量,表明接种菌种后玉米受干旱胁迫的影响程度降低。
干旱胁迫促进了植物细胞膜脂过氧化作用,且随着胁迫程度的加深呈先上升后下降的趋势。这与植物体内抗氧化酶活性升高作用有关[27]。细胞内H2O2是造成植物细胞膜氧化的关键因素之一,其含量在一定程度可代表植物受到干旱胁迫的水平。本试验中,遭遇干旱时玉米苗期叶片活性氧累积升高,处于干旱胁迫下接种D与E对玉米苗期叶片活性氧的影响不显著,接种B与C显著降低玉米苗期叶片活性氧,在一定程度缓解叶片的膜脂过氧化作用。MDA是活性氧氧化植物细胞膜主要产物之一,代表着植物受干旱胁迫的程度,其含量与H2O2含量呈正相关关系,本试验中干旱胁迫下接种B菌种对玉米苗期叶片MDA含量的累积无明显差异,接种C、D、E均显著降低MDA含量的累积。正常情况下接种枯草芽孢杆菌显著降低玉米苗期叶片MDA含量的累积,且不同菌种降低程度不同,可以推断接种C、D、E能够在一定程度下避免部分玉米叶片的膜脂氧化作用,可描述为增强玉米苗期的抗旱性。
干旱胁迫影响玉米的生长发育,值得注意的是,植物内源激素中ABA、ACC和吲哚乙酸在植物的生长发育与分化方面发挥着至关重要的作用[28],如干旱胁迫下根部合成的ABA可被传递给植物叶片,减少叶片气孔开度,降低蒸腾作用,增加植株保水能力[29]。本试验为此探讨干旱胁迫下接种不同植物根际来源的枯草芽孢桿菌对玉米ABA、ACC和吲哚乙酸的影响情况。呈现出正常情况接种B、E显著升高玉米叶片ABA含量,而接种C、D则显著降低ABA含量,E由C、D组成,其显著升高玉米叶片ABA含量原因可能在于微生物间的协作关系,具体关系仍需进一步探究。鉴于植物生长发育是复杂的一系列反应,单方面因素难以评判是否对植物的生长发育的影响;而处于干旱情况时接种B、C显著升高玉米叶片ABA含量,更能够促使叶片蒸腾作用减小,鉴于ABA在植物体内的作用,接种B、C后玉米苗期根部受到干旱的影响反应较强;而接种D、E则降低ABA含量,说明接种后受到外界干旱的影响较小,推测因为接种D、E能较好地促使玉米苗期根系对水分的吸收,从而玉米苗期自身生理反应不强烈,ABA含量较低。ACC作为合成乙烯的前体物质,合成后的乙烯在植物生长发育及应对防御反应中也起着重要的调控作用,值得注意的是对于玉米应对干旱胁迫的调控反应是ACC含量的升高,接种不同的枯草芽孢杆菌使得玉米ACC含量的反应不同,其中正常情况下接种B、D、E显著提高玉米叶片ACC含量,接种C对玉米叶片ACC含量差异不显著;干旱胁迫下接种B显著提高玉米叶片ACC含量,其余处理对叶片ACC含量影响差异不显著;综上,接种枯草芽孢杆菌在植物应对外界条件胁迫时能从调控植物ABA、ACC等激素方向影响玉米应对干旱时的防御调控。本试验中接种D、E两种菌种显著降低玉米IAA含量,接种B、C差异不显著。基于张明生等[30]的研究表明,植物IAA含量随着水分下降而减少,且下降的比例与品种的抗旱性有关,抗旱性强的下降多,因此利于增强玉米苗期抗旱性。
相对含水量与自身的光合作用、蒸腾作用和水分利用效率关系密切,是衡量干旱胁迫下植物叶片水分状况与反应组织代谢活动的一个重要指标[31-32]。本研究发现,处于正常水平下的玉米叶片相对含水量受接种的枯草芽孢杆菌的影响较小,仅有B菌剂显著降低玉米叶片相对含水量;而在干旱胁迫下,接种C、D、E 3种菌剂处理显著提高玉米叶片的相对含水量,使得玉米苗期应对干旱的调节能力增强。P、K是作物生长发育不可缺少的营养元素,是作物体内许多重要有机化合物的组成部分,又以多种形式参与作物体内各种生长过程。影响作物N、P、K很多,包括土壤和作物特性,但其中最重要的是土壤水分,本研究中水分条件与接种枯草芽孢杆菌对于玉米苗期叶片K影响均较小,N和P含量受水分条件与接种枯草芽孢杆菌的影响较大。其中干旱胁迫下N和P含量分别增加与降低,此研究结果与王凯等[33]研究干旱胁迫对科尔沁沙地榆树幼苗C、N、P化学计量特征的影响结果相似。处于干旱胁迫下N素量增加可能由于植物对于N素的应用降低,而正常与干旱胁迫下接种枯草芽孢杆菌N含量显著降低,推测因素是接种枯草芽孢杆菌后促进玉米幼苗的生长,对N素的利用度增加。其次,研究表明植物内生菌对植物对N素的代谢有着重要的作用,其机制在于接种植物内生菌后,能有效增加植物硝酸还原酶(NR)与谷氨酰胺合成酶(GS)的活性[34-38],这两种酶在植物N素代谢过程中起着重要的调控作用,其活性增强能有效促进植物的生长于发育。同时植物内生菌通过分泌维生素从而影响着植物对N素的代谢。王珂等[39]研究表明维生素能提高小麦叶片硝酸还原酶的活性,从而促进植物对N素的代谢,这无疑是促进了植物的生长与发育[40]。处于干旱胁迫下P含量降低可能由于土壤干旱限制了无机磷的吸附与溶解[41],导致植物从土壤中吸收P减少;同时干旱导致木质部形成栓塞[42],P随蒸腾作用向上运输可能受阻,导致P在细根中积累,其他器官P含量下降。正常与干旱胁迫下接种枯草芽孢杆菌致使玉米苗期叶片P含量呈下降趋势,推测是由于接种枯草芽孢杆菌的玉米幼苗生长发育较快,核糖体合成蛋白质需要消耗大量P,所以接种枯草芽孢杆菌能够加强玉米在苗期的代谢,促进玉米的生长发育,至于植物促生菌对于植物P代谢方面的机制尚缺少更细致研究。
针对不同植物根际的枯草芽孢杆菌对玉米苗期的各生理生化调节作用不同。通过隶属函数均值综合评价出不同植物根际的枯草芽孢杆菌对玉米苗期的生理生化调节作用。其中正常与干旱情况4种枯草芽孢杆菌处理均能够提高玉米苗期生長发育能力,根据对玉米各项指标的隶属函数均值进行排序,正常情况:D1>C1>B1>E1>CK1;干旱胁迫下:D2>E2>C2>B2>CK2。所以接种枯草芽孢杆菌均可以增强玉米苗期抗旱性,不同根际的枯草芽孢杆菌效果不同。
综上所述,接种不同的枯草芽孢杆菌的玉米苗期叶片从抗氧化酶活性、细胞渗透物质、细胞膜氧化产物、内源激素、相对含水量以及N、P、K等各个方面调控玉米以应对干旱胁迫。
参考文献 Reference:
[1]焦志丽.马铃薯干旱危害及提高抗旱性的研究[D].黑龙江:东北林业大学,2012.
JIAO ZH L.The researchof potato drought damageand improve its drought resistance methods [D].Heilongjiang:Northeast Forestry University,2012.
[2]刘晓霞,李 安,舒健虹,等.干旱胁迫下不同枯草芽孢杆菌对玉米萌发的影响[J].耕作与栽培,2021,41(4):18-23.
LIU X X,LI A,SHU J H.et al.Effects of different Bacillus subtilis on maize germination under drought stress[J].Tillage and Cultivation,2021,41(4):18-23.
[3]李 安,舒健虹,刘晓霞,等.干旱胁迫下枯草芽孢杆菌对玉米种子抗旱性及生理指标的影响[J].作物杂志,2021(6):217-223.
LI A,SHU J H,LIU X X .et al.Effects of Bacillus subtilis on drought resistance and physiological indexes of maize seeds under drought stress[J].Crops,2021(6):217-223.
[4]李 晶.黄瓜枯萎病高效拮抗枯草芽孢杆菌的筛选及生防机制研究[D].哈尔滨:哈尔滨工业大学,2010.
LI J.Screening of antagonistic Bacillus subtilis against Fusarium oxysporium and its biocontrol mechanism [D].Harbin:Harbin Institute of Technology,2010.
[5]黄海婵,裘娟萍.枯草芽孢杆菌防治植物病害的研究进展[J].浙江农业科学,2005(14):12-13,16.
HUANG H CH,QIU J P.Research progress on the control of plant diseases by Bacillus subtilis[J].Journal of Zhejiang Agricultural Sciences,2005(14):12-13,16.
[6]刘培福.枯草芽孢杆菌D221发酵条件优化及对辣椒根腐病防治效果初探[D].哈尔滨:东北农业大学,2011.
LIU P F.Studies on optimization of fermentation conditions and biocontrol effects against fusarium solan of Bacillus subtilis D221[D].Harbin:Northeast Agricultural University,2011.
[7]肖小露.枯草芽孢桿菌BS193对辣椒疫病的生防作用及其抗菌机制初探[D].福州:福建农林大学,2017.
XIAO X L.Biological control and mechanism of Bacillussu btilis BS193 against pepper Phytophthora blight(Phytophthora capsici)[D].Fuzhou:Fujian Agriculture and Forestry University,2017.
[8]庞永彬.枯草芽孢杆菌防治水稻稻瘟病效果研究[J].农民致富之友,2017(11):88.
PANG Y B.Study on the effect of Bacillus subtilis on controlling rice blast[J].Friends of Farmers to Riches,2017(11):88.
[9]李君保,冉文秀.枯草芽孢杆菌可湿性粉剂防治水稻穗颈瘟田间试验探讨[J].农业与技术,2019,39(9):16-18.
LI J B,RAN W X.Field trials of Bacillus subtilis wettable powder for controlling rice panicle blast[J].Agriculture and Technology,2019,39(9):16-18.
[10]张 颖,尹素改,许玉彬,等.小麦内生枯草芽孢杆菌(Bacillus subtilis)T10菌株对小麦纹枯病的生防作用[J]. 河南大学学报(自然科学版),2014,44(4):456-460.
ZHANG Y,YIN S G,XU Y B,et al.Biocontrol efficacy of wheat endophytic bacteria Bacillus subtilis T10S train against wheat sharp eyespot[J].Journal of Henan University(Natural Science),2014,44(4):456-460.
[11]刘 刚.枯草芽孢杆菌NJ-18和氟酰胺联合拌种防治小麦纹枯病效果好[J].农药市场信息,2013(22):39.
LIU G.The combined seed dressing of Bacillus subtilis NJ-18 and fluoroamide is effective in preventing wheat sharp eyespot[J]. Pesticide Market Information,2013(22):39.
[12]张 军,张 凯,王向阳.井冈霉素·枯草芽孢杆菌混合剂对小麦全蚀病的防效研究[J].安徽农学通报,2013, 19(15):84,123.
ZHANG J,ZHANG K,WANG X Y.Study on the control effect of Jinggangmycin and Bacillus subtilis mixture on wheat rot disease[J].Anhui Agricultural Science Bulletin,2013,19(15):84,123.
[13]毛腾霄,叶华智,秦玉花.枯草芽孢杆菌BS-8D防治玉米纹枯病的田间试验效果及作用机理[J].湖北农业科学,2016,55(20):5252-5255.
MAO T X,YE H ZH,QIN Y H.The biocontrol of maize sheath blight and mechanism with Bacillus subtilis BS-8D strain in the field[J].Hubei Agricultural Sciences,2016,55(20):5252-5255.
[14]苏 博,顾双月,丁 婷.枯草芽孢杆菌DZSY21抗玉米纹枯病的研究[C]//中国植物病理学会2016年学术年会论文集,南京:2016:471-473.
SU B,GU SH Y,DING T.Research on the resistance of Bacillus subtilis DZSY21 to corn sheath blight[C]//Chinese Society of Phytopathology,Nanjing:2016:471-473.
[15]毛腾霄,叶华智,秦玉花.枯草芽孢杆菌防治玉米纹枯病的初步研究[J].中国农学通报,2016,32(5):44-48.
MAO T X,YE H ZH,QIN Y H. Study on biocontrol of maize sheath blight (Rhizoctonia solani) with Bacillus subtilis strain[J].Chinese Agricultural Science Bulletin,2016,32(5):44-48.
[16]刘 雪,穆常青,蒋细良,等..枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J].中国生物防治,2006(S1):179-184.
LIU X,MU CH Q,JIANG X L.,et al.Research progress of the metabolic substances produced by Bacillus subtillis and their application on biocontrol of plant disease[J].Chinese Journal of Biological Control,2006(S1):179-184.
[17]SHILTS T,ERTRK U,PATEL N J,et al.Physiologi cal regulation of biosynthesis of indole-3-acetic acid and other indole derivatives by the citrus fungal pathogen Colletotrichum acutatum[J].Journal of Biological Sciences,2005,5(2):205-210.
[18]CASSAN F,BOTTINI R,SCHNEIDER G,et al.Azospirillum brasilense and azospirillum lipoferum hydrolyze conjugates of GA20 and metabolize the resultant aglycones to GA1 in seedlings of rice dwarf mutants[J]Plant Physiol,2001,125(4):2053-2058.
[19]蔣明义,杨文英,徐 江,等.渗透胁迫下水稻幼苗中叶绿素降解的活性氧损伤作用[J].植物学报,1994(4):289-295.
JIANG M Y,YANG W Y,XU J,et al.Active oxygen damage effect of chlorophyll degradation in rice seedlings under osmotic stress[J].Journal of Integrative Plant Biology,1994(4):289-295.
[20]高爱丽,赵秀梅,秦 鑫.水分胁迫下小麦叶片渗透调节与抗旱性的关系[J].西北植物学报,1991,11(1):58-63.
GAO A L,ZHAO X M,QIN X.Relationship between osmotic ad justment and drought resistance in wheat under water stress[J].Acta Botanica Boreali-Occidentalia Sinica,1991,11(1):58-63.
[21]GUO B,WANG Y,SUN X,et al.Bioactive natural products from endophytes:a review[J].Applied Biochemistry and Microbiology,2008,44(2):136-142.
[22]MALHADAS C,MALHEIR R,PEREIRA J A,et al.Antimicrobial activity of endophytic fungi from olive tree leaves[J].Microbiol Biotechnology,2017,33(3):1-12.
[23]MARASCO R,ROLLI E,VIGANI G,et al.Are drought-resistance promoting bacteria cross-compatible with different plant models?.[J].Plant Signal,2013,8 (10):26-41.
[24]MC CUE K F,HANSON D.Drought and salt tolerance:towards understanding and application.[J].Trends Biotechnology,1990,8(90):358-362.
[25]霍仕平,晏庆九,宋光英,等.玉米抗旱鉴定的形态和生理生化指标研究进展[J].干旱地区农业研究,1995,13(3):67-73.
HUO SH P,YAN Q J,SONG G Y,et al.Progress in morphological and physiological and biochemical indexes of drought resistance identification of maize[J].Agricultural Research in the Arid Areas,1995,13(3):67-73.
[26]左文博,吴静利,杨 奇,等.干旱胁迫对小麦根系活力和可溶性糖含量的影响[J].华北农学报,2010,25(6):191-193.
ZUO W B,WU J L,YANG Q,et al.Study on the influence of root of different wheat varieties under drought stress[J].Acta Agriculturae Boreali-Sinica,2010,25(6):191-193.
[27]王 霞,侯 平,尹林克,等.土壤水分胁迫对柽柳体内膜保护酶及膜脂过氧化的影响[J].干旱区研究,2002(3):17-20.
WANG X,HOU P,YIN L K,et al.Effect of soil moisture stress on the membrane protective enzyme and the membrane liquid peroxidation of tamarix[J].Arid Zone Research,2002(3):17-20.
[28]陆 军,张吉先.植物内源激素在树木生长中的作用[J].浙江林业科技,1992,12(5):68-71.
LU J,ZHANG J X.Control on endogenous hormones in growth of trees[J].Journal of Zhejiang Forestry Science and Technology,1992,12(5):68-71.
[29]MUNNS R.A leaf elongation assey detects an unknown growth inhibitor in xylem sap from wheat and barley[J].Australian Journal of Plant Physiology,1992,19(5):127-135.
[30]張明生,谢 波,谈 锋.水分胁迫下甘薯内源激素的变化与品种抗旱性的关系[J].中国农业科学,2002,35(5):498-501.
ZHANG M SH,XIE B,TAN F.Relationship between changes on endogenous hormone of sweetpotato under water stress and drought resistance[J].Chinese Agricultural Sciences,2002,35(5):498-501
[31]SEGHATOLESLAMI M J,KAFI M,MAJIDI E .Effect of drought stress at different growth stages on yield and water use efficiency of five proso millet (Panicum miliaceum) genotypes[J].Journal of Science & Technology of Agriculture & Natural Resources,2007,11(4):1427-1432.
[32]刘义国,万雪洁,张 艳,等.干旱锻炼对小麦幼苗期形态指标的影响[J].西北农业学报,2022,31(2):157-163.
LIU Y G,WAN X J,ZHANG Y,et al.Effectof drought primingon morphological indicesof wheatSeedlings[J].Acta Agriculturae Boreali-occidentalis Sinica,2022,31(2):157-163.
[33]王 凯,沈 潮,孙 冰,等.干旱胁迫对科尔沁沙地榆树幼苗C、N、P化学计量特征的影响[J].应用生态学报,2018,29(7):2286-2294.
WANG K,SHEN CH,SUN B,et al.Effects of drought stress on C,N and P stoichiometric characteristics of elm seedlings in Horqin sandy land [J].Journal of Applied Ecology,2018,29(7):2286-2294.
[34]汤玉玮,林振武,陈敬祥.硝酸还原酶活力与作物耐肥性的相关及其在生化育种上应用的探讨[J].中国农业科学,1985,15(6):39-45.
TANG Y W,LIN ZH W,CHEN J X.Relationship between nitrate reductase activity and crop fertility tolerance and its application in biochemical breeding [J].Scientia Agricultura Sinica,1985,15(6):39-45.
[35]史应武,娄 恺,李 春.内生真菌对甜菜主要农艺性状及氮糖代谢关键酶活性的影响[J].作物学报,2009,35(5):946-951.
SHI Y W,LOU K,LI CH.Effects of endophytic fungus on sugar content and key enzymes activity in nitrogen and sugar metabolism of sugar beet (Beta vulgaris L.) [J].Acta Agronomica Sinica,2009,35(5):946-951.
[36]欧阳雪庆,罗 霆,杨丽涛,等.甘蔗内生固氮菌液浸种对甘蔗生长前期氮代谢相关酶活性的影响[J].广西农业科学,2010,41(5):416-418.
OUYANG X Q,LUO T,YANG L T,et al.Effects of sett-soaking with sugarcane endophytic diazotrophsolution on N metabolism related enzymes activities at the earlygrowth stage of sugarcane [J].Guangxi Agricultural Sciences,2010,41(5):416-418.
[37]BECKER T W,CARRAYOL E,HIREL B.Glutamine synthetase and glutamate dehydrogenase isoforms in maize leaves:localization,relative proportion and their role in ammonium assimilation or nitrogen transport[J].Planta,2000(211):800-806.
[38]GONZALEZ-MORO B,MENU-PETITE A,LACUESTA M,et al.Glutamine synthetase from mesophyll and bundle sheath maize cells:isoenzyme complement and different sensitivities to phosphino-thricin[J].Plant cell Reports,2000,19(11):1127-1134.
[39]王 珂,楊玉爱,袁可能.维生素( B,C,PP)对小麦生理特性及生长的影响[J].科技通报,1995(5):301-305.
WANG K,YANG Y A,YUAN K N.Effects of sett-soaking with sugarcane endophytic diazotrophsolution on N metabolism related enzymes activities at the earlygrowth stage of sugarcane [J].Bulletin of Science and Technology,1995(5):301-305.
[40]ZHOU D P,WU S H,JIANG Z F,et al.Functions and application-future of the endophytic fungi from orchid[J].Acta Agriculturae Shanghai,2005,21(3):110-113.
[41]BELNAP J.Biological Phosphorus Cycling in Dryland Regions[M].Springer Berlin Heidelberg,2011:371-406.
[42]RONG L I,DANG W,CAI J,et al.Relationships between xylem structure and embolism vulnerability in six species of drought tolerance trees[J].Chinese Journal of Plant Ecology,2016,40(3):255-263.
Physiological and Biochemical Regulation of Bacillus subtilis Spores on Leaves at Seedling Stage of Maize under Drought Stress
LI An1,SHU Jianhong2,LIU Xiaoxia2,LU Xueping3,JIAO Yu4,WANG Xiaoli2 and ZHAO Degang3
Abstract In order to explore the physiological regulation effects of different Bacillus subtilis on the leaves of maize seedlings under drought stress. The physiological and biochemical regulating substances,such as the antioxidant enzyme activity, cell permeation substances, cell membrane oxidation products, H2O2, endogenous hormones, relative water content, and K, P, N contents in the leaves of maize seedlings were evaluated by inoculating maize roots with different plant rhizosphere Bacillus subtilis, which include R9-1, R59, R60 and R59+R60 combination strains under drought and normal water conditions. The principal component and correlation analysis indicated that Bacillus subtilis mainly affected the soluble sugar, abscisic acid (ABA), phosphorus (P) content, superoxide dismutase (SOD) activity, catalase (CAT) activity, peroxidase (POD) activity, free proline (PRO) content, relative water content of the leaves at seedling stageof maize. Importantly, there was a significantly negative correlation between the relative water content and other physiological performance factors. Under drought stress,the antioxidant enzyme activity, cell osmotic adjustment substances, and P and N content in the leaves of maize seedlings obviously decreased after inoculated with Bacillus subtilis.By the way, the content of H2O2 and ABA reduced after R9-1, R59 inoculation, the content of ABA increased after R60, R59+R60 inoculation and the content of IAA decreased after R59, R60, and R59+R60 inoculation in the leaves of maize at seedling stage. The regulation effect of Bacillus subtilis on maize was estimated by the comprehensive analysis of membership function under different conditions. Under normal conditions,R60>R59>R9-1>R59+R60>CK1,under drought stress, R60>R59+R60>R59>R9-1>CK2. Taken together, the antioxidant enzyme activity, cell osmotic regulation substances, and P, N content of leaves at seedling of maize decreased after inoculation with Bacillus subtilis.Meanwhile, R59, R60, R59 + R60 was conducive to improve its relative water content. The results demonstrated that the maize seedling inoculated with Bacillus subtilis was less affected by drought. Therefore, the inoculation of Bacillus subtilis can enhance the adjustment ability of maize seedling to adapt drought stress and ensure its growth and development.
Key words Maize;Bacillus subtilis;Membership function;Drought stress
Received2022-02-16Returned 2022-06-05
Foundation item Guizhou High-level Innovative Talents Training Program[No.(2018)5634-2]; Guizhou Science and Technology Project[(No.2020)5005]; Guizhou Talents Training Project; Guizhou High-level Innovative Talents Training Project[No.(2016) 4003].
First author LI An, male,master student. Research area:screening of rhizosphere growth-promoting bacteria of gramineae and ecological fungus fertilizer.E-mail:1964352203@qq.com
Corresponding author ZHAO Degang, male, Ph.D,professor,doctoral supervisor. Research area:plant genetic engineering.E-mail:dgzhao@gzu.edu.cn
WANG Xiaoli, male, Ph.D,research fellow. Research area:grass molecular.E-mail:wangxiaolizhenyuan @126.com
(責任编辑:顾玉兰 Responsible editor:GU Yulan)
收稿日期:2022-02-16修回日期:2022-06-05
基金项目:贵州省高层次创新人才培养项目[黔科合平台人才(2018)5634-2];贵州省科技计划项目[黔科合平台人才(2020)5005];贵州省人才培养项目;贵州省高层次创新型人才培养项目[黔科合人才(2016)4003]。
第一作者:李 安,男,硕士研究生。研究方向为禾本科根际促生菌的筛选及生态菌肥。 E-mail:1964352203@qq.com
通信作者:赵德刚,男,博士,教授,博士生导师,研究方向为植物基因工程。E-mail:dgzhao@gzu.edu.cn
王小利,男,博士,研究员,研究方向为牧草分子。E-mail:wangxiaolizhenyuan @126.com
