山西草莓斑驳病毒cp基因克隆及遗传多样性分析
2023-12-20陈伟李志卫玉山江麦麦提聂园军李亚娟赫娟柴敏罗永平
陈伟 李志卫 玉山江?麦麦提 聂园军 李亚娟 赫娟 柴敏 罗永平
摘 要 旨在研究草莓斑驳病毒(SMoV)在山西省的分布、结构变异及遗传多样性。从山西省7个主要草莓种植区随机采取159份草莓叶片进行RT-PCR病毒检测,结合在线数据库,使用MEGA5构建系统发育树,采用SDTv 1.2软件进行序列相似性分析,运用DnaSP v5.10软件分析cp基因的遗传多样性,采用RDP v.4.31 软件检测SMoV中的重组事件。RT-PCR检测后发现,从山西省各地区收集的159份草莓叶片中有65份样品呈阳性,检出率为38.46%。这些阳性样品经过分离、测序、克隆,获得16个SMoV分离物。结合在线的19个SMoV分离物系统进化树分析显示,35个SMoV分离物被分成两组,组1包含28个分离物,均来自中国;组2包含7个分离物,分别来自加拿大、日本和美国。经选择压分析和中性检验,组1和组2 SMoV分离物之间存在显著的遗传差异,且中性检验均为负值,SMoV种群呈扩张状态。序列相似性分析表明,35株分离物的核苷酸同一性为81.34%~100%,氨基酸的一致性为94.77%~100%,呈现出较高的相似性。可见:SMoV存在较高的遗传变异,负选择压力可能是导致SMoV遗传多样性的原因。
关键词 草莓斑驳病毒;cp基因;遗传多样性
草莓(Fragaria ananasa Duch.)隶属蔷薇科草莓属,为多年生草本植物,其果实被称为“水果皇后”[1-3]。草莓含有多种维生素、胡萝卜素、果胶和丰富的膳食纤维,具有较高的营养价值。同時, 草莓还具有较高的经济价值,可以制作成各种食品,例如冻干草莓,草莓果酱等。草莓在全世界约有24个种,集中分布在欧洲、美洲、亚洲[4-5]。其中,中国有13个野生草莓资源[6-7],主要分布在西北、西南、东北及中部地区。山西作为中国草莓主产区之一,广泛分布在晋中、临汾、太原等地[8]。草莓是中国重要的经济作物,但近年来由于病毒侵染,导致草莓产量下降,经济损失巨大,阻碍了草莓产业的发展。据报道,世界上的草莓病毒有30多种,中国的草莓病毒有:草莓斑驳病毒(Strawberry mottle virus,SMoV)、草莓皱缩病毒(Strawberry mild crinkle virus,SCV)、草莓镶脉病毒(Strawberry vein boder virus,SVBV)、草莓轻型黄边病毒(Strawberry mild yellow edge virus,SMTEV)等[9]。草莓被病毒感染后的症状表现为果实小,植株矮化,生产不良,果实变少,品质差,甚至不结果[10]。草莓斑驳病毒属伴生豇豆病毒科(Secoviridae)、Sadwavirus 病毒属,病毒粒子为球形,直径 28~30 nm,存在于叶表皮、韧皮部和薄壁细胞中。在1938年,SMoV首次在英格兰凤梨草莓上发现,目前已经广泛分布于世界各地各种品种草莓上。SMoV主要通过蚜虫进行传播,棉蚜(Aphis gossypii Glover)、桃蚜(Myzus persicae)等是其主要传播介体,不能通过种子进行传播[11]。草莓感染 SMoV后主要表现为叶片褪绿或黄边、植株矮化、果小而少[12]。SMoV基因组含有2条正单链RNAs (RNA1和RNA2),其中RNA1全长为 7 008~7 043 nt,RNA2全长为5 619~6 340 nt。RNA1和RNA2均含有1个ORF,分别编码多聚蛋白P1和P2[13]。SMoV已经成为威胁中国草莓的主要病害之一,系统对其开展研究是草莓安全生产迫切需求。本研究于2019、2020年在山西省7个地区,随机采集159份草莓样品,对SMoV进行RT-PCR检测,克隆外壳蛋白基因,运用生物信息学方法对获得的SMoV序列与其相似序列进行系统发育分析和遗传多样性分析,以期为有效防控草莓病毒病害提供借鉴。
1 材料与方法
1.1 材 料
2019年和2020年在山西省晋中市、临汾市、太原市、运城市、忻州市、朔州市、大同市分别采集159份新鲜的草莓叶片,保存在冰盒内,并于24 h内带回实验室,利用 RT-PCR方法进行病毒检测。
1.2 引物设计
根据SMoV在线的基因组数据(GenBank号:SRR20013751),在保守区域利用 Primier 5.0 软件设计扩增SMoV的cp全基因引物。上游引物序列为GGACCTACGGATCTTGGAAG;下游引物为ACCCGCGCAACTTGTCGGAG。
1.3 RNA提取和RT-PCR扩增与测序
使用植物总RNA提取试剂盒(DP405- 02,BioTeke,China)提取草莓叶片样品的总RNA。使用 PrimeScript RT试剂盒(D6130,TaKaRa,Japan)合成 cDNA。以 cDNA 为模板进行 PCR 扩增,反应过程如下:94 ℃预热3 min;94 ℃变性,30 s,52 ℃退火1 min,72 ℃延伸2 min,共35次循环;72 ℃延伸10 min。PCR在25 μL的PCR混合物中进行:2 μL cDNA 模板,2.5 μL 25 mmol/L Mg2+,2.5 μL 5 mmol/L dNTPs 混合物,2.5 μL 10×聚合酶缓冲液,0.5 μL 5 U/μL热启动Taq聚合酶和2 μL 10 μmol/L 上游、下游引物。
RT-PCR产物使用2%凝胶提取试剂盒(DP204-02,BioTeke,中国)从琼脂糖凝胶中纯化阳性条带。将这些片段插入pGEM-T简单载体,克隆到大肠杆菌DH5α中。在培养基上筛选阳性菌落,并送到生物公司进行测序。每个片段至少测序3次。如果序列的任何位置存在差异,至少对片段进行4次测序以获得一致序列。
1.4 系统发育树分析
通过NCBI 网站对SMoV的cp基因核糖核酸序列进行 Blast 比对,获得 19条与本研究相似的序列。使用MEGA 5.0中的Kimura 2-parameter model和Gamma Distributed (5G)构建系统发育树并分析遗传多样性,自展值为1 000,去掉低于50%的进化数分支。
1.5 遗传多样性分析
基于cp基因核糖核酸,使用DnaSP5.exe软件对序列数(M),核苷酸平均差异数(K),单倍型(基因)多样性(Hd),分离位点的数量(S),非同义突变频率(Ka),同义突变频率(Ks),以及非同义突变与同义突变的比率(ω)进行计算。ω表示基因受到的选择压力,若ω=1,表明基因受中性选择压力[14]。如果ω <1,表明基因受负选择压力;若ω >1,基因受正选择压力。运用Tajimas D,Fu & Lis D 和Fu & Lis F的方法进行中性检验分析。中性检验的数值为正值时,表明该种群处于收缩状态,为负值时则表明该种群在一定程度上发生了扩张。其中,Tajimas D检测的目的是区分随机和非随机演变的DNA序列。
1.6 重组分析
使用RDP v.4.31软件对35个SMoV全基因组进行重组分析,使用方法包括RDP、GENECONV、BootScan、MaxChi、Chimaera、SiScan和3Seq。其中接受至少5 种不同方法检测到的 P<10-6的事件为重组事件。
2 结果与分析
2.1 RT-PCR检测及扩增产物分析
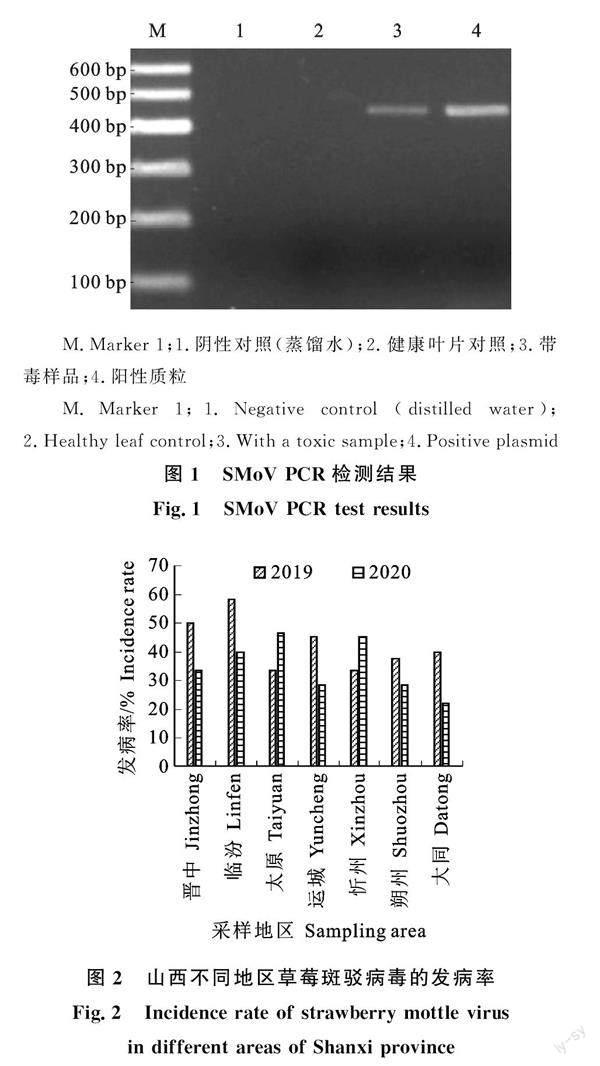
根据Primier 5.0 软件设计扩增SMoV的cp全基因引物,通过引物扩增出与目的片段相近的特异性条带,其大小为460 bp左右(图1),阳性对照条带清晰且明亮,证实SMoV的cp基因可以用于后续试验。
2.2 SMoV 的发生情况
2019-2020年在山西省晋中市、临汾市、太原市、运城市、忻州市、朔州市、大同市随机采集159份草莓新鲜叶片样品,经过 RT-PCR 检测有 65 份样品呈阳性。图2表明,临汾的发病率最高,为58.33%;大同的发病率最低,为 22.22%,其他几个地区的发病率介于两者之间。2019年的总样品数为68,阳性样品数为30,其发病率为44.11%,2020年的总样品数是91,阳性样品数是35,发病率为38.46% 。总體来看,2019年的发病率高于2020年。
2.3 系统进化树分析
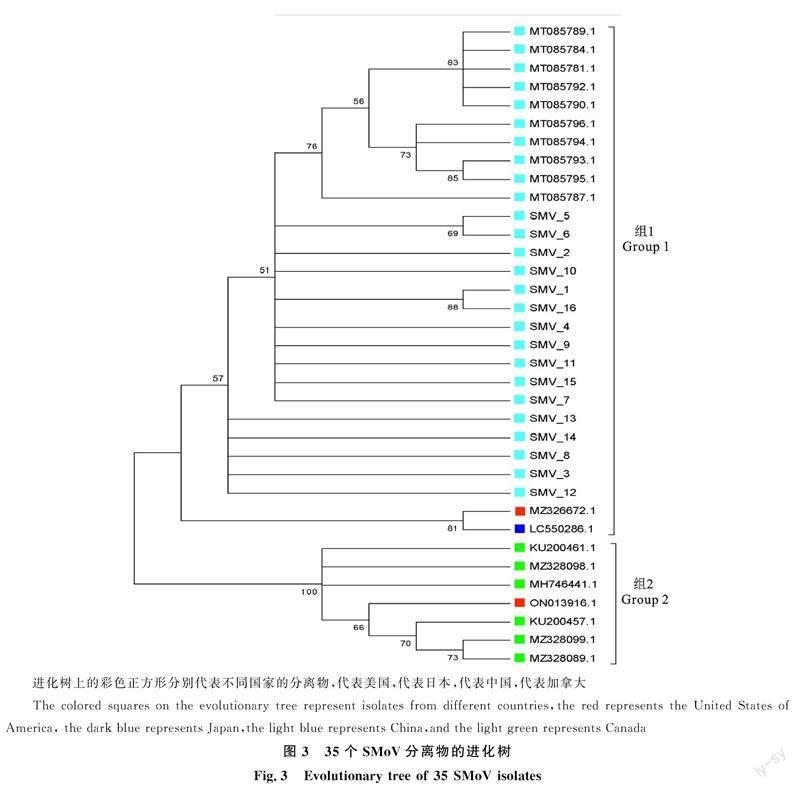
使用MEGA5软件对35个SMoV分离物(19个来自NCBI,16个是本试验测序获得)进行系统进化树分析,结果表明35个SMoV草莓分离物被分成 2组(图3)。第1组中含有28个SMoV分离物,分别来自中国(26个),美国(1个)和日本(1个)。第2组中含有7个SMoV分离物,分别来自美国(1个),加拿大(6个)。来自美国的两个分离物被分成两组,初步表明SMoV的cp基因的变异可能与地理位置无关。
进一步使用MEGA5软件计算SMoV分离物组内和组间的遗传距离,结果显示组1和组2内的平均遗传距离分别为 0.025 和0.045,组1与组2间的平均遗传距离为0.208,组1与组2间的平均净遗传距离为0.173,组间的遗传多样性高于组内的遗传多样性。
2.4 序列相似性分析
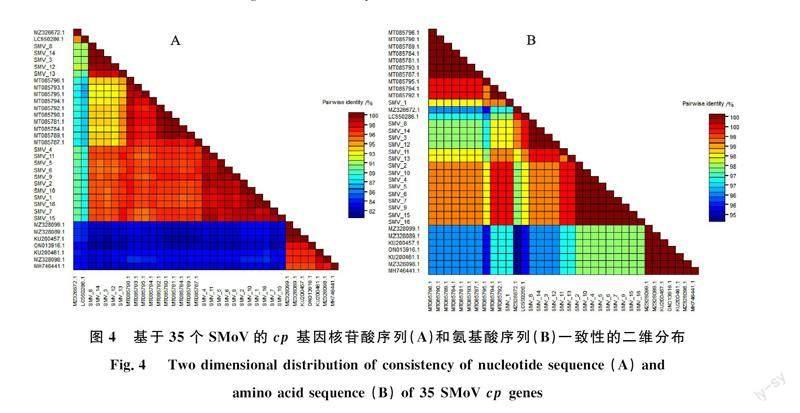
基于SMoV的cp基因核糖核酸序列,使用SDTv 1.2软件分析35株SMoV分离物的序列相似性,结果表明35株SMoV分离物的核苷酸同一性为81.34%~100%(图4-A),氨基酸的一致性为 94.77%~ 100%(图4-B),呈现出较高的相似性。SMoV分离物MT085790.1与MT085781.1和MZ328099.1与MZ328089.1的核苷酸同源性最高,为100%,SMoV分离物SMoV_3与序列ON013916.1的核苷酸同源性最低,一致率为 81.34%。分析表明cp基因在物种进化中具有高度的保守性。
2.5 遗传多样性分析
对35个SMoV的cp基因序列,使用DnaSP5.exe软件分析其遗传多样性。结果显示,组1的序列数(M)、核苷酸平均差异数(K)、单倍型(基因)多样性(Hd)、分离位点的数量(S)、非同义突变频率(Ka)、同义突变频率(Ks)、以及非同义突变与同义突变的比率(ω)明显高于组2,说明其遗传分化程度更高 。分离物基因的ω数值都小于1,表明分离物的基因受负选择压力的影响。组1和组2的Tajimas D 、 Fu&Lis D 和Fu&Li s F这3种检验的数值都小于0,表明该种群在一定程度上是扩张状态。组2的3种检验方式明显大于组1,说明组2的扩张程度更严重(表1)。
对两个组进行种群遗传分化检测,结果显示:组1和组2间的Fst数值为0.803 92,表明SMoV分离物的群体间有很大的遗传分化(表2)。
2.6 重组分析
使用RDP v.4.31软件检测35个SMoV分离物中重组事件,结果表明在35个SMoV分离物中没有发生重组,说明物种间具有高度保守性。
3 讨 论
SMoV是草莓产业构的严重威胁。在中国草莓病毒的种类有草莓皱缩病毒(SCV)、草莓斑驳病毒(SMoV)、草莓镶脉病毒(SVBV)、草莓轻型黄边病毒等病毒。在这些草莓病毒中,草莓受SMoV病毒感染的检出频率极高,Thompson等[15]报道草莓斑驳病毒可能是感染草莓的最重要病毒。本试验对山西省7个地区进行采样,经RT-PCR检测有65份样品呈阳性,发病率是38.46%。SMoV几乎分布在临汾、太原、晋中等几乎所有草莓种植区,已经成为草莓产业的严重威胁。
SMoV存在较高的遗传变异。通过网站NCBI进行Blast比对,获得19个与本研究相似的序列,加上本研究中的16个序列,总共获得35个SMoV分离物。35个SMoV分离物的核苷酸同一性为81.34%~100%,氨基酸的一致性为 94.77%~ 100%。SMoV这种高度遗传分化可能的原因是:①强烈的负向选择导致cp基因的变异。② 抗病毒化學农药的使用加速抗药病毒株系的出现,推动病毒的变异。③RNA病毒本身的RNA聚合酶缺少校正功能。④病毒的变异程度高,复制速度快。多方面的作用下,SMoV呈现出高度多样性,对未来的抗病毒育种带来很大挑战。
综合农业、化学、生物等多种防治技术是防治SMoV的有效策略。为了提高草莓的产量,增加草莓的经济效益,可以采取一些预防措施,有效抵抗病毒的危害。选择不带病毒或者高抗病的草莓苗是最直接且有效的预防病毒侵染的措施[16]。目前,草莓幼苗的脱毒技术已经比较成熟,有多种有效的脱毒技术,比如花药培养,茎尖分生组织培养,热处理等[17-19]。常用第2种和第3种方法相结合来脱毒,效果很好。通过控制传播媒介防蚜虫也能很好地控制病毒的传播,喷洒一些药剂减少蚜虫的危害。加强农田管理,及时做好农田卫生,清理草莓种植地及周围垃圾,适当施加肥料,合理利用有机肥,清除被病毒污染的植株[9-10]。运用基因工程手段,培育抗病毒植株,将病毒基因导入到草莓基因组中,获得具有抗病毒的草莓植株[20-21]。综合使用农业手段、物理手段、化学手段、分子生物学手段等有效防控SMoV非常重要,特别是研究病毒如何致病,如何复制,从而进行分子设计育种,以有效控制病毒为害。
4 结 论
草莓斑驳病毒(SMoV)是一种典型的单链RNA病毒,在不同的环境中,为了适应生存不断进行突变,本研究对SMoV分离物进行了RT-PCR检测,克隆外壳蛋白基因,对系统发育和遗传多样性进行分析,为有效防控草莓病毒病害奠定了理论。
系统发育分析表明,SMoV的遗传多样性并非直接由地理因素决定。如SMoV草莓分离物被分成 2组,其中一组来自中国、美国和日本,另一组来自美国和加拿大。通过计算非同义突变与同义突变的比值(ω),评估基因选择压力的大小。分离物基因的ω数值都小于1,表明分离物的基因受负选择压力影响。负选择性压力决定SMoV cp基因的变异。在中性检验中Tajimas D、 Fu&Lis D 和Fu&Li s F这3种检验的数值都小于0,同时结合cp基因的单倍型多样性较高和核苷酸多样性较低,表明该种群发生了扩张,且在两个群体之间存在较大的遗传差异。
参考文献 Reference:
[1]王淑珍,周历萍,余 红.13个草莓品种果实品质和抗氧化性能比较[J].安徽农业科学,2017,45(29):33-36.
WANG SH ZH,ZHOU L P,YU H.Comparison of fruit quality and antioxidant properties of 13 strawberry varieties[J].Journal of Anhui Agricultural Sciences,2017, 45(29):33-36.
[2]王晓立,韩浩章,苗昌云,等.草莓栽培现状与栽培方式概述[J].安徽农学通报,2020,26(10):36-37,116.
WANG X L,HAN H ZH,MIAO CH Y,et al.Research cultivation status and cultivation methods of Fragaria ananassa[J].Anhui Agricultural Science Bulletin,2020, 26(10):36-37,116.
[3]陈卫平.不同草莓品种果实品质的比较研究[J].江西农业学报,2010,22(9):46-48.
CHEN W P.Comparative study on fruit quality of different strawberry varieties[J].Acta Agriculturae Jiangxi,2010,22(9):46-48.
[4]雷家军,杨 高,代汉平,等.我国的草莓野生种质资源[J]. 果树科学,1997,14(3):198-200.
LEI J J,YANG G,DAI H P,et al.Wild germplasm resources of strawberry in China[J].Journal of Fruit Science,1997,14(3):198-200.
[5]雷家军,薛 莉,代汉萍,等.世界草莓属(Fragaria)植物的种类与分布[C]∥草莓研究进展(IV).北京:中国农业出版社,2015:364-375.
LEI J J,XUE L,DAI H P,et al.The species and distribution of Fragaria in the world[C]∥Advances in strawberry research (IV).Beijing:China Agriculture Press,2015:364-375.
[6]雷家军,邓明琴,吴禄平,等.新疆天山野生草莓与绿色草莓(Fragaria viridis Duch.)同一性的鉴定[J].园艺学报,2001,28(2):119-122.
LEI J J,DENG M Q,WU L P,et al.Fragaria viridis Duch. distributed in China was certified by classificatory observation and RAPD[J].Acta Horticulturae Sinica,2001,28(2):119-22.
[7]雷家军,望月龙也,邓明琴.草莓属二倍体种东北草莓(Fragariamandschurica Staudt)研究[J].果树学报,2001, 18(6):337-340.
LEI J J,TATSUYA MOCHIZUKI,DENG M Q.Studies on the diploid strawberry species Fragaria mandschurica Staudt[J].Journal of Fruit Science,2001,18(6):337-340.
[8]侯麗媛,董艳辉,聂园军,等.世界草莓属种质资源种类与分布综述[J].山西农业科学,2018,46(1):145-149.
HOU L Y,DONG Y H,NIE Y J,et al.Species and distribution of germplasm resources of world Fragaria[J].Journal of Shanxi Agricultural Sciences,2018,46(1): 145-149.
[9]杨 涵,关统伟,徐红星,等.草莓有害病毒种类与防治技术[J].现代农业科技,2020(2):88-91.
YANG H,GUAN T W,XU H X,et al.Varieties of strawberry harmful virus and its control techniques[J].Modern Agricultural Science and Technology,2020(2):88-91.
[10]李卫兵,张 伟.草莓几种常见病害的发生与防治[J]. 安徽农学通报(下半月刊),2010,16(10):117-118.
LI W B,ZHANG W.Occurrence and control of several common diseases of strawberry[J].Anhui Journal of Agronomy (Second Half of the Month),2010,16(10):117-118.
[11]夏 冰.草莓病毒病的发生及绿色防控[J].中国植保导刊,2021,41(4):61-65.
XIA B.Occurrence and green control of strawberry virus diseases[J].China Plant Protection,2021,41(4):61-65.
[12]苏代发,童江云,杨俊誉,等.草莓病毒病及其研究进展[J].云南大学学报(自然科学版),2019,41(6):1221-1237.
SU D F,TONG J Y,YANG J Y,et al.Strawberry virus disease and its research progress[J].Journal of Yunnan University(Natural Sciences Edition),2019,41(6):1221-1237.
[13]陈 道,王 新,江 山,等.福建地区草莓斑驳病毒全基因组测序和分子变异分析[J].中国农学通报,2022, 38(6):94-101.
CHEN D,WANG X,JIANG SH,et al.Strawberry mottle virus isolated in fujian:complete genome sequence and molecular variation[J].Chinese Agricultural Science Bulletin,2022, 38(6):94-101.
[14]王燕飞,玉山江·麦麦提,孙柳清,等.南瓜蚜传黄化病毒遗传多样性分析[J].植物病理学报,2021,51(3):351-358.
WANG Y F,YUSHANJIANG·MMT,SUN L Q,et al.The analysis on genetic diversity of cucurbit aphid-borne yellows virus[J].Acta Phytopathologica Sinica,2021, 51(3):351-358.
[15]THOMPSON J R,JELKMANN W.The detection and variation of strawberry mottle virus[J].Plant Disease,2003,87(4):385-390.
[16]赵密珍,王 静,袁华招,等.草莓育种新动态及发展趋势[J].植物遗传资源学报,2019,20(2):249-257.
ZHAO M ZH,WANG J,YUAN H ZH,et al.Situation and perspectives of strawberry breeding[J].Journal of Plant Genetic Resources,2019,20(2):249-257.
[17]张玉君,彭兴龙,张哲民,等.草莓组织培养与脱毒技术[J].河南林业科技,2009,29(1):73-75.
ZHANG Y J,PENG X L,ZHANG ZH M,et al.Tissue culture and virus-free technology of strawberry[J].Journal of Henan Forestry Science and Technology,2009, 29(1):73-75.
[18]呂树立,孙喜云,周玉玲,等.草莓组织培养与快速繁殖技术[J].山东农业科学,2010(3):109-110.
L SH L,SUN X Y,ZHOU Y L,et al.Tissue culture and rapid propagation of strawberry[J].Shandong Agricultural Sciences,2010(3):109-110.
[19]陈 冲,曹贵寿,王国平,等.果树脱毒技术研究进展[J].果树资源学报,2021,2(1):72-75.
CHEN CH,CAO G SH,WANG G P,et al.Research progress on virus free technique of fruit tree[J].Journal of Fruit Resources,2021,2(1):72-75.
[20]周厚成,何水涛.草莓病毒病研究进展[J].果树学报,2003,20(5):421-426.
ZHOU H CH,HE SH T.Advances in strawberry virus research[J].Journal of Fruit Sciences,2003,20(5):421-426.
[21]高清华,叶正文,张学英,等.草莓生物技术育种研究进展[J].分子植物育种,2006,4(3S):123-129.
GAO Q H,YE ZH W,ZHANG X Y,et al.Advances in research on biotechnology breeding of strawberry[J].Molecular Plant Breeding,2006,4(3S):123-129.
Genetic Diversity of Strawberry Mottle Virus Based On cp Gene
CHEN Wei1,LI Zhiwei1,YUSHANJIANG·Maimaiti2,NIE Yuanjun3,LI Yajuan4,HE Juan1,CHAI Min1 and LUO Yongping1
Abstract A systematic study of the distribution,structural variation and genetic diversity of SMoV in Shanxi will lay a theoretical foundation for the prevention and control of strawberry virus diseases.In this study,159 strawberry leaves were randomly collected from 7 major strawberry cultivation areas in Shanxi and constructed RT-PCR detection.The cp genes of positive samples were sequenced and analyzed through MEGA5,SDTv 1.2,DnaSP v5.10 and RDP v.4.31,RT-PCR detection showed that 65 samples of the 159 strawberry leaves were positive with a detection rate of 38.46%.The 65 positive samples were isolated,sequenced,and cloned to obtain 16 SMoV isolates.The phylogenetic tree analysis,using a dataset that included 19 online SMoV isolates,showed two distinct groups:Group 1,consisting of 28 isolates from China,and Group 2,comprising 7 isolates from Canada,Japan,and the United States.Selective pressure analysis and neutrality testing indicated significant genetic differences between these groups,with negative neutrality test results suggesting SMoV population expansion.Sequence similarity analysis displayed that the nucleotide identity range and the consistency range of amino acids was 81.34%-100% and 94.77%-100% respectively,which showed high similarity.This study demonstrated that SMoV has high genetic variation,and the negative selection pressure may be the cause of SMoV genetic diversity,which provides a theoretical guidance for SMoV in Shanxi.
Key words SMoV;cp gene; Genetic diversity
Received2022-11-05Returned 2022-11-21
Foundation item State Key Research and Development Plan(No.2021YFD1901102);Key Special Program of State Key Research and Development Plan“Science and Technology Help Economy 2020” (No.SQ2020YFF0425265); Applied Basic Research Program of Shanxi Province(No.201901D211403);National Natural Science Foundation of China(No.31760511) ;Project of Chinese Central Government Provides Guidelines for Local Science and Technology Development(No.2022ZY022).
First author CHEN Wei,male,associate professor.Research area:molecular mechanisms of plant-pathogen interactions.E-mail:chenweide2007@126.com
Corresponding author YUSHANJIANG·Maimaiti,male,associate research fellow.Research area:green pest control techniques for melon crops.E-mail:yusanjan418@163.com
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
收稿日期:2022-11-05修回日期:2022-11-21
基金項目:国家重点研发计划(2021YFD1901102);国家重点研发计划“科技助力经济2020”重点专项计划(SQ2020YFF0425265);山西省应用基础研究计划(201901D211403);国家自然科学基金(31760511);青海省中央引导地方科技发展资金项目(2022ZY022)。
第一作者:陈 伟,男,副教授,从事植物-病原菌互作的分子机制研究。E-mail:chenweide2007@126.com
通信作者:玉山江·麦麦提,男,副研究员,从事瓜类作物病虫害绿色防控技术研究。E-mail:yusanjan418@163.com
