利用富里酸原位制备富集铁修复石油污染土壤研究
2023-12-20徐金兰李峰森曹泽壮许开慧白文广代佳楠
徐金兰,李峰森,曹泽壮,许开慧,赵 炎,白文广,刘 璐,代佳楠
1. 西安建筑科技大学环境与市政工程学院,陕西 西安 710055
2. 陕西省环境工程重点实验室,陕西 西安 710055
随着石油开采量的不断提高,石油污染土壤问题日趋严重,尤其是在油田区最为突出[1-3]. 污染土壤中石油的主要成分为烷烃、芳香烃等,这些物质均具有较大的毒性,吸附到土壤颗粒后难以去除,并且还会破坏土壤理化特性,有可能还会解析到水相中[4]. 在石油污染土壤的修复技术中,高级氧化工艺(AOPs)是一种高效和广泛使用的技术[5]. 其中,原位Fenton氧化过程中产生的大量氧化电位(2.80 V)高的·OH[6],可将污染土壤中的多种污染物氧化为无机物、易降解的小分子物质. 同时Fenton 工艺操作简单,是处理石油污染土壤的最常用的方法之一[7-9].
目前,亚铁活化过氧化氢体系(简称“Fe2+/H2O2体系”)已经广泛应用于石油污染土壤修复,并取得了较好的修复效果. 但是,Fe2+/H2O2体系也存在一些不足,包括过量的Fe2+清除·OH、·OH 间的淬灭反应、·OH 的存在时间较短等,这限制了其实际应用[10]. 为了克服上述缺点,研究人员开展了大量工作,包括控制Fe2+的消耗速率,提高·OH 强度和利用率,以及延长·OH 的存在时间等. 例如:有研究表明,可以通过分批添加催化剂提高Fe2+催化效率,进而提高目标污染物的氧化率[11]. Yang 等[12]发现,通过增加·OH 的强度和产量(105 mmol/L),可将TPH 的氧化率提高到36.05%,高于较低条件(21 mmol/L)下的相应值(33.16%). 此外,一些螯合剂也被用于维持Fe2+在中性和碱性条件下的溶解度,以稳定游离亚铁离子,进而提高自由基存在时间[13-15]. 例如,有报道[16]发现,添加β-环糊精会形成一种TPH/β-环糊精/Fe2+三元包合物,进而提高了TPH 氧化率(55.6%)和氧化剂的分解时间(50 min). 然而上述研究还存在过氧化氢利用率低、操作步骤繁琐、外加螯合剂会增强其对土壤的危害等不足. 因此,亟需一种新型的环境友好型修复技术解决上述问题.
为了克服Fenton 技术中的不足,改性Fenton 技术逐渐应用于石油污染土壤修复[17]. 研究发现,有机物可以作为交联剂,促进Fe2+向固相转移[18],进而有效提高·OH 的产量并延长其存在时间. 土壤中的有机官能团,如C=O 键,可能与固相铁的结构有关,并影响烷烃的氧化[19]. 前期研究表明,土壤有机质(SOM)中的腐殖酸可以通过羧酸盐、多酚和含氮等表面或内部官能团与金属离子绑定[20]. 同时,富里酸(FA)相对于腐殖酸(HA) 具有更多的羟基(—OH)、羧基(—COOH)和酚羟基(—Ph—OH)等含氧官能团,并且具有更多的极性结构和更高的表面位点密度,可以为金属离子的络合提供更多的活性位点[21].
因此,该研究采用西安市两种背景土壤分别添加不同质量比的FA 来促进溶解性铁转移到固相,探索在相近固相铁含量条件下富集铁组相比非富集铁组高效氧化TPH 的机理,并进一步探究不同SOM 含量的土壤制备富集铁对TPH 氧化效果的影响. 同时,利用EPR、XPS、FTIR、3D-EEM 等表征手段探究溶解性铁在固相中的富集特征以及富集铁组对催化过氧化氢分解的影响,以期为高效修复石油污染土壤提供一种经济的方法.
1 材料与方法
1.1 土壤材料样品特征
原土样品分别取自西安北郊(编号为OS1)和西安东郊(编号为OS2). 实验前,土壤经过碎散,去除杂质,过2 mm 的细筛后,混匀,置于冰箱中密闭保存.土壤的理化性质如表1 所示.
1.2 实验方法
为了探明富集铁Fenton 氧化原油的效果和机制,分别进行铁转移实验和富集铁Fenton 氧化原油实验.
1.2.1 铁转移实验
实验采用OS1 和OS2 为背景土样(具体实验方案见表2),分别取5 g 土样放入250 mL 的锥形瓶中,在每个锥形瓶中外加不同质量比(0%、5%、10%、15%、20%)的FA,均匀混合;然后加入适量的30%的H2O2和柠檬酸-硫酸亚铁溶液及蒸馏水,保证体系为60 mL;用1 mmol/L 的NaOH 溶液调整体系pH=7.0左右,摇匀并放入摇床上振荡直至H2O2分解完全,离心后去除上清液,并用蒸馏水去除吸附在土壤中的铁离子;将土样常温下风干,碾磨成粉末状,备用.
预先对石油污染土壤S1、S2 进行氧化实验,探讨其在铁含量相近情况下氧化量相差较大的机制. 因此,将TPH 氧化量高的组命名为富集铁组,氧化量较低的为非富集铁组Ⅰ,同时空白对照组也命名为非富集铁组Ⅱ. 详细命名规则见表2.
1.2.2 Fenton 氧化原油实验
1.2.2.1 实验土样的染油实验
取1.2.1 节制备好的土样5 g 放入250 mL 的锥形瓶中,用移液管量取定量的原油(来自同一油井同一批取样)放入2000 mL 的容量瓶中,用二氯甲烷洗净移液管壁上的原油,摇匀容量瓶中的原油使其充分溶解,然后用二氯甲烷定容. 分别用移液管从容量瓶中量取15 mL 混合液倒入250 mL 的锥形瓶中,并将其放在摇床上充分振荡(175 r/min)摇匀,使二氯甲烷在通风橱中挥发,配成原油污染土样.
1.2.2.2 Fenton 氧化实验
称取1.2.2.1 节配制好的共计10 组原油污染土样各5 g 分别放入150 mL 的锥形瓶中,加入54.6 mL蒸馏水和5.4 mL H2O2(保持60 mL 体系),H2O2浓度为900 mmol/L; 同时用5 mol/L 的NaOH 溶液调成pH=7.0,在室温〔(22±2)℃〕下进行氧化实验,利用制备固相铁催化H2O2产生的·OH 氧化TPH. 利用碘量法测定H2O2残留量. 待分解完,测定土样中残留的总烷烃及各烷烃的含量. 空白对照组只加入60 mL蒸馏水. 每个实验做3 个平行.
为了研究其氧化机制,再重复上述氧化实验,定时测定残留H2O2的浓度,并计算H2O2的分解速率.每个实验做3 个平行样.
1.3 分析方法
1.3.1 土样各形态铁的提取与测定
采用Tessier 五步连续提取法对土壤中各形态铁进行提取,计算固相铁含量,具体方法参照文献[22].
1.3.2 3D-EEM 的分析方法
取待测液体,用0.45 μm 的玻璃纤维滤膜过滤,滤出液通过三维荧光光谱分析仪(F-7000,日本Hitachi公司)测定SOM 含量. 激发光源为150 W 氙弧灯,PMT 电压为700 V;激发波长(λEx) 和发射波长(λEm)的带通分别为5 nm 和10 nm;扫描波长范围λEx为200~500 nm,λEx为300~570 nm;响应时间为自动;扫描速度为12000 nm/min;扫描光谱进行仪器自动校正.
1.3.3 XPS 的分析方法
土壤中铁形态通过XPS 分析(K-Alpha,美国热电公司),测定前,所有样品均已经过冷冻干燥和研磨处理,XPS 光谱使用单色化的Al Kα X 射线源(1486.6 eV),分析室内压力低于8×10—8Pa. 对于宽扫描光谱,能量范围为0~1100 eV,通过能量为200 eV,步长为1 eV. 根据峰来进行高分辨率的窄谱扫描,通过能量为40 eV,步长为0.1 eV. 为了得到铁的形态,对Fe 2p3/2 进行分析. 使用C1s 的标准结合能(284.8 eV)作为标准进行校正,然后以结合能的形式收集Fe 2p3/2的窄谱,并使用非线性最小二乘曲线拟合程序进行拟合[23].
1.3.4 H2O2的浓度和·OH 强度的分析方法
H2O2浓度采用硫酸钛分光光度法测定[22].
·OH 强度测定方法如下:称取2 g 待测的固相铁土样置于50 mL 离心管中,分别加入对应量的蒸馏水和H2O2,形成24 mL 的反应体系,混合混匀;而后,取过膜后的20 μL 待测液置于2 mL 的离心管中,加入10 μL 150 mmol/L DMPO 后混合均匀;最后,用毛细管吸取长度约1 cm 的混合液,于电子顺磁共振波谱仪(EPR A300,德国Bruker 公司) 测定·OH 强度. EPR 波谱仪操作条件:中心磁3508 G,扫场宽度100 G,扫场时间5.01 s,微波功率2 mW,调制幅度1 G,g因子2.00000,扫描次数为5 次,每组实验做3 个平行样. ·OH 强度的计算方法参考Li 等[24]的研究.
1.3.5 TPH 的分析方法
氧化反应结束后,向待测定的土样中加入20 mL 二氯甲烷,摇匀后过夜(10 h),超声15 min,机械振荡30 min (250 r/min),然后用带聚四氟乙烯活塞的分液漏斗分离,连续萃取3 次,后2 次分别加入10 mL 二氯甲烷,萃取液过干燥无水硫酸钠(预先在105℃烘箱中烘2 h)的层析柱中干燥脱水,柱下出口处装有50 mL 锥形瓶,萃取液最终定容至50 mL[25]. 萃取液组分含量使用气相色谱仪(6890N,美国安捷伦公司)分析测定,使用FID 检测器. 色谱柱:HP-5 毛细管柱(30 m×0.25 mm×0.50 μm),分流进样,分流比5:1,进样量1 μL,进样口温度300 ℃,检测器温度300 ℃,氮气(载气) 流速30 mL/min,空气流速300 mL/min,尾吹气流速28 mL/min. 柱箱升温程序:选用三阶段升温程序,柱箱初始温度40 ℃,保持0.5 min;以15℃/min 升至150 ℃,保持2 min;再以10 ℃/min 升至290 ℃,保持5 min,总共运行28.83 min[26]. 每次采用内标(十七酸甲酯)标定,修正标准曲线(标油购自美国Sigma 公司),通过US EPA 方法,计算出TPH 的检测限为0.13 mg/L,再根据标准曲线计算萃取液的石油浓度和组分.
2 结果与讨论
2.1 石油污染土壤的烷烃组分分析
石油污染土壤(S1 和S2) 中正构烷烃组分含量如图1 所示. 在污染土壤S1 中的TPH 含量为14528.18 mg/kg,烷烃组分包括C13~C30,其中长链烷烃C25~C30和中链烷烃C19~C24占比相同(均为41%),而短链烷烃C13~C18占比仅为18%. 而在污染土壤S2中TPH 含量为16074.33 mg/kg,高于土壤S1 中的含量. 这可能是因为粉土对于石油烃的吸附能力较强(0.7765 mg/g)[27],不利于石油烃的萃取. 其中长链烷烃C25~C30和中链烷烃C19~C24占比分别为35%、45%,短链烷烃C13~C18占比仅为20%. 可见,石油污染土壤中的正构烷烃组分以中长链烷烃为主. 然而,污染土壤中的中长链烷烃的疏水性强,难以被解析到水相[28],导致其氧化效果较差. 因此,该研究使用富集铁Fenton 氧化修复石油污染土壤,探讨其对中长链烷烃的氧化效果.

图1 两种石油污染土壤的烷烃组分含量Fig.1 The concentration of alkanes in two oil-contaminated soils
2.2 富集铁组对TPH 及各烷烃组分的氧化效果
在两种石油污染土壤中添加不同质量比(0%、5%、10%、15%、20%) 的FA 会促进铁转移,其铁含量见表2. 添加FA 的处理组中铁含量明显高于未加FA 的处理组,土壤S1 和S2 中固相铁含量最高分别为5115 和2300 mg/kg. 可见,添加FA 后促进了溶解性铁的转移,导致固相铁含量升高. 利用溶解性铁转移后的染油土壤进行Fenton 修复实验,TPH 氧化效果见图2. 在土壤S1 中,富集铁组的TPH 氧化量高达7550.32 mg/kg,远大于非富集铁组(Ⅰ、Ⅱ)的相应值(6364.43、3195.56 mg/kg). 同样,在土壤S2 中,富集铁组的TPH 氧化量高达8747.78 mg/kg,远大于非富集铁组(Ⅰ、Ⅱ) 的相应值(5730.75、3260.96 mg/kg). 可见,富集铁组能够高效氧化土壤中TPH.
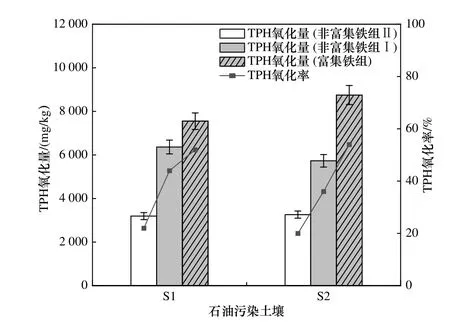
图2 两种石油污染土壤中各处理组TPH 的氧化效果Fig.2 The oxidation effect of TPH in two oilcontaminated soils by each treatment group
由于正构烷烃组分含量的不同,Fenton 氧化的效果也会受到影响. 两种石油污染土壤中各烷烃(C13~C30)的氧化效果如图3 所示:在土壤S1 中,富集铁组对各烷烃的氧化效果远高于其他组,TPH 的氧化量为7550.32 mg/kg(氧化率为52%),其中大部分烷烃的氧化率维持在50%左右,而在非富集铁组中各烷烃组分的氧化率普遍低于50%; 在土壤S2 中,富集铁组对各烷烃的氧化率同样高于非富集铁组,TPH 的氧化量高达8747.78 mg/kg(氧化率为54%),而其中大部分烷烃的氧化率高于50%. 可见,富集铁组对于各烷烃均具有良好的氧化效果. 同时,在土壤S1 中,富集铁组对中链烷烃(C19~C24) 和长链烷烃(C25~C30)的氧化效果显著,氧化率分别高达20%和22%,远大于非富集铁组Ⅰ的17%(C19~C24) 和18%(C25~C30),更远高于非富集铁组Ⅱ的8%(C19~C24)和9%(C25~C30)(见图4). Watts 等[29]研究表明,吸附在固相中的有机污染物需要更高的H2O2浓度产生超氧化物以促进疏水污染物的解吸和溶解. 这或许就是中长链烷烃氧化效果较好的原因. 而富集铁组对短链烷烃(C13~C18)的氧化率仅有9%,这可能是因为土壤中短链烷烃含量(18%)较低,导致·OH 在氧化过程中优先被占比较高的中长链烷烃、SOM 等所消耗. 相关研究[30]表明,土壤有机质、铁锰矿物等组分可消耗和竞争自由基等活性物质,导致石油烃的氧化率下降以及氧化剂的无效消耗. 同样在土壤S2 中,富集铁组对C19~C24和C25~C30的氧化率分别高达23%和20%,远高于非富集铁组Ⅰ(C19~C24,19%;C25~C30,12%)和非富集铁组Ⅱ(C19~C24,9%;C25~C30,7%). 可见,富集铁组显著提高了中长链烷烃的氧化率.

图3 各处理组中烷烃组分的氧化效果Fig.3 The oxidation effect of alkane components in each treatment group
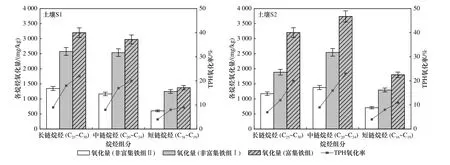
图4 各处理组中长链、中链、短链烷烃的氧化效果Fig.4 The oxidation effect of long-chain, medium-chain, short-chain alkanes in each treatment group
2.3 富集铁组Fenton 催化H2O2 的特性研究
富集铁组中H2O2分解的特性和·OH 的产生特性如图5 所示. 在土壤S1 中,在72 h 内富集铁组分解了92.56% 的H2O2,明显快于非富集铁组(Ⅰ、Ⅱ)在相同时间内的相应值(88.88%、58.22%). 同样,在土壤S2 中也发现了相同的规律,富集铁组在72 h 内分解了96.87%的H2O2,也明显高于非富集铁组(Ⅰ、Ⅱ)在相同时间内的相应值(88.69%、58.45%). 除此之外,富集铁组H2O2的分解时间也明显短于Kong 等[31]用磁铁矿(质量百分比为5%)催化H2O2分解所需时间(200 h 内只有50%的H2O2被分解). 可见,富集铁组中H2O2的分解速率比非富集铁组快. 同时,在土壤S1 中,富集铁组催化H2O2产生的·OH 持续时间长(约50 h),分别高于非富集铁组(Ⅰ、Ⅱ)的45 h 和20 h.相似的规律在土壤S2 中也可以发现,富集铁组催化H2O2产生的·OH 持续了约55 h,分别高于非富集铁组(Ⅰ、Ⅱ)的40 h 和15 h. 可见,较快的H2O2的分解速率和较长的·OH 存在时间是富集铁组高效氧化TPH 的原因. Tsai 等[32]通过实验考察了H2O2停留时间对TPH 氧化的影响,结果显示,H2O2的停留时间从40 h 缩短到5 h,TPH 的氧化效率从76% 降至58%. 综上,富集铁组能够加快双氧水的分解速率、延长·OH 的存在时间,从而提高对H2O2的利用效率.

图5 各处理组中羟基自由基瞬时强度和H2O2 分解率Fig.5 Instantaneous intensity of ∙OH and decomposition rate of H2O2 in each treatment group
在土壤S1 中,富集铁组的总羟基自由基强度高达36.61 a.u.,远高于非富集铁组的相应值(Ⅰ,27.78 a.u.;Ⅱ,3.36 a.u.). 同样,在土壤S2 中,富集铁组的总羟基自由基强度高达16.06 a.u.,远高于非富集铁的相应值(Ⅰ,7.11 a.u.;Ⅱ,0.65 a.u.). 可见,富集铁组不仅可以加快双氧水的分解,还产生了大量的羟基自由基. 综上,较高的总羟基自由基强度是富集铁组高效氧化土壤中TPH 的原因. 该测定结果与Watts 等[33]的研究结果一致,表明对于高疏水性且强烈吸附在土壤表面的污染物的氧化,在土壤修复中往往需要高强度的羟基自由基.
2.4 富集铁组的结构特性分析
在土壤S1 中,富集铁组中FeOOH(711.6 eV 处)和α-FeOOH(713.1 eV 处)[34]的峰面积分别高达503.52和399.40(见图6),高于非富集铁组Ⅰ的相应指标(FeOOH,398.59;α-FeOOH,474.80). 同样在土壤S2 中,富集铁组中FeOOH 和α-FeOOH 的峰面积分别高达850.01 和769.62(见图7),高于非富集铁组Ⅰ的相应指标(FeOOH,398.59;α-FeOOH,474.80). Wang 等[35]发现针铁矿具有较高的催化活性、较大的比表面积以及高含量的表面羟基. 可见,针铁矿可极大地提高总羟基自由基强度. 同时,富集铁组中FeO(708.3 eV 处)峰面积达到86.78,而在非富集铁组中未检出. 可见,富集铁组中的FeO 促进了TPH 的氧化. 综上,富集铁组中较高峰面积的FeOOH 和α-FeOOH 是H2O2分解快、·OH 产量高的原因.
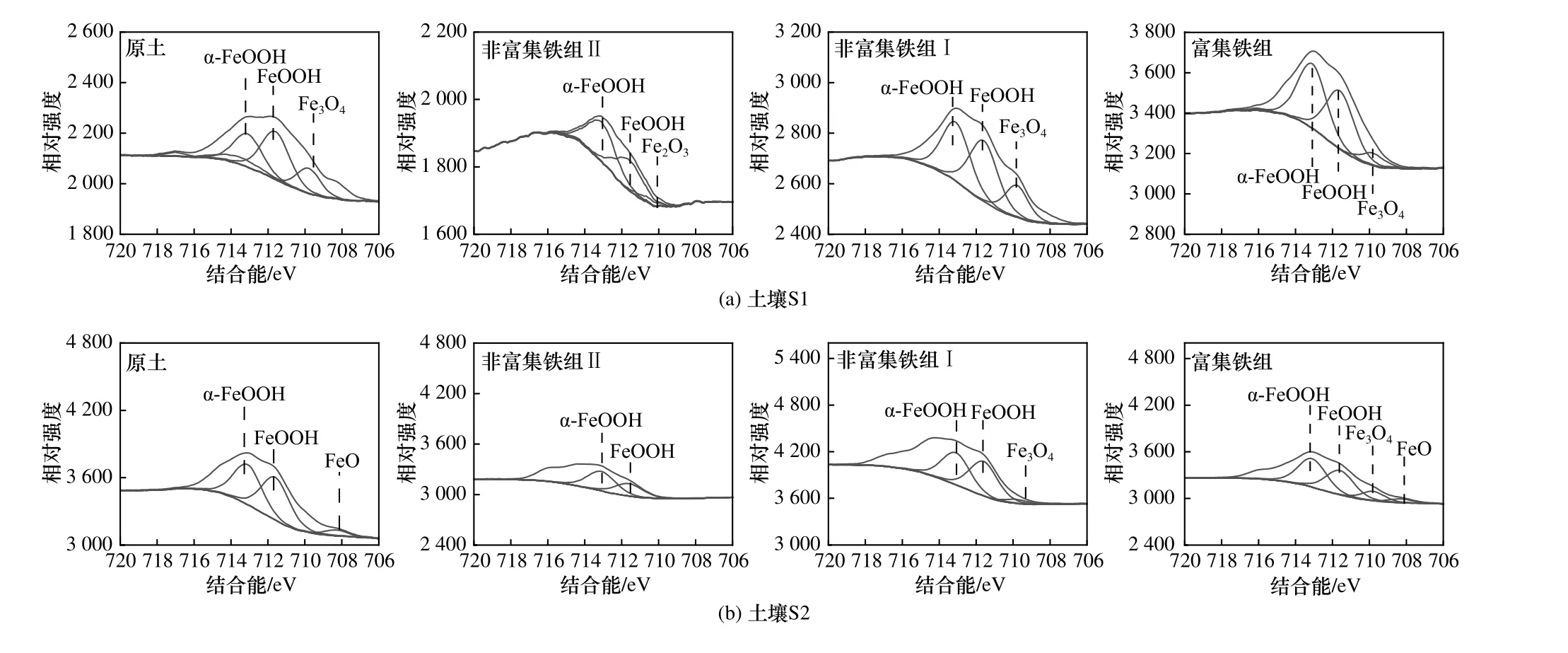
图6 土壤S1 和S2 中各处理组铁转移后的XPS 谱图Fig.6 XPS spectra of soil S1 and S2 after iron transfer in each treatment group
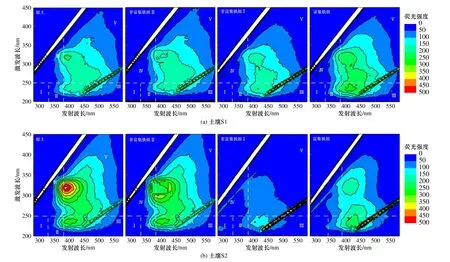
图7 土壤S1 和S2 中各处理组铁转移后的三维荧光谱图Fig.73DEEM of soil S1 and S2 after iron transfer in each treatment group
为了探究添加不同质量比的FA 对铁转移的影响,测定溶解性铁转移后的三维荧光光谱,结果如图7所示. 在土壤S1 中,富集铁组(Fe 含量为4782 mg/kg)的三维荧光光谱中类富里酸(Ⅲ区)的荧光区域标准体积高达1554 047.24 au·nm2,高于非富集铁组Ⅰ的相应指标(1100 706.21 au·nm2),约是其1.41 倍. 可见类富里酸促进了FeOOH 和α-FeOOH 在固相中的富集,进而形成了富集铁组. 同时,在土壤S2 中呈现出相似的规律〔见图7(b)〕,富集铁组(Fe 含量为2293 mg/kg)的三维荧光光谱中类富里酸(Ⅲ区)荧光区域标准体积高达1110 373.00 au·nm2,约为非富集铁组Ⅰ(716069.98 au·nm2)的1.55 倍. 综上,类富里酸促进了FeOOH 和α-FeOOH 在固相中的富集.
为进一步探索溶解性铁向固相转移的机制,进行了傅里叶红外光谱测定,结果见图8. 土壤样品中出现的红外吸收峰和相应的官能团包括C=O(1638 cm—1处)、C—H(1465 cm—1处) 和C—O(1000 cm—1处)[36]. 在土壤S1、S2 中,富集铁组中—C—H 键的峰面积分别高达6.56、24.57,远高于非富集铁组Ⅰ的相应值(S1,5.51;S2,13.69). 同时,富集铁组中—C—O键的峰面积达到最高(S1,40.99;S2,86.19),远高于非富集铁组Ⅰ的相应值(S1,35.92;S2,52.62),而在非富集铁组Ⅱ中仅分别为23.75(S1)、50.91(S2). 可见,富集铁组含有大量含氧官能团的有机物,而这些官能团可能来源于类富里酸. 另外,富集铁组在670 cm—1处出现了一个新的吸收峰Fe—O[37],进一步验证了类富里酸可以促进FeOOH 和α-FeOOH 在固相中的富集.
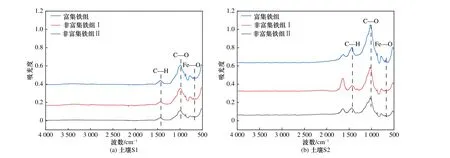
图8 各处理组铁转移后的傅里叶红外光谱图Fig.8 FTIR after iron transfer in each treatment group
3 结论
a) 富集铁组可促进H2O2分解进而高效氧化土壤中的石油烃,土壤S1、S2 中其氧化量分别高达7550.32 mg/kg(氧化率为52%) 和8747.78 mg/kg(氧化率为54%),远高于其相应非富集铁组Ⅰ的6364.43 mg/kg(氧化率为44%) 和5730.73 mg/kg(氧化率为36%).
b) 在土壤S1 中,富集铁组对C19~C24和C25~C30的氧化率分别高达20%和22%,分别高于非富集铁组Ⅰ的17%(C19~C24) 和18%(C25~C30),以及非富集铁组Ⅱ的8%(C19~C24) 和9%(C25~C30). 同样,在土壤S2中具有类似的规律. 可见,富集铁组对中长链烷烃氧化效果显著.
c) 高浓度的类富里酸促进了富集铁组中FeOOH和α-FeOOH 峰面积的升高,进而提高了H2O2的分解率. 同时,富集铁组中·OH 的持续时间(S1,50 h;S2,55 h)长于非富集铁组Ⅰ的相应值(S1,45 h;S2,40 h),富集铁组中总·OH 强度(S1,36.61 a.u.;S2,16.06 a.u.)也高于非富集铁组Ⅰ的相应指标(S1,27.78 a.u.;S2,7.11 a.u.). 因此,富集铁组可提高H2O2的分解率、延长·OH 的存在时间,进而提高总·OH 强度.
d) 高浓度的类富里酸(S1,荧光区域标准体积为1554 047.24 au·nm2;S2,荧光区域标准体积为1110 373.00 au·nm2)促进FeOOH 和α-FeOOH 在固相中的富集. 而富集铁组中—C—O 键的峰面积(S1,40.99;S2,86.19) 达到最高,远高于非富集铁组Ⅰ的相应值(S1,35.92;S2,52.62),这进一步验证了类富里酸促进了FeOOH 和α-FeOOH 在固相中的富集.
