葛根素通过抑制铁死亡改善对乙酰氨基酚诱导小鼠急性肝损伤的作用及机制研究
2023-12-20钟艾琪王奇莫友胜广州中医药大学科技创新中心广东广州50405广州中医药大学第二附属医院广东省中医院肝病科广东广州50006
钟艾琪,王奇,莫友胜(.广州中医药大学科技创新中心,广东广州 50405;. 广州中医药大学第二附属医院/广东省中医院肝病科,广东广州 50006)
药物性肝损伤(Drug-induced liver injury,DILI)是指由各种药物引起的肝损伤,严重的可导致肝功能衰竭甚至死亡。DILI 发病机制十分复杂,目前尚未完全阐明,并且缺乏诊断标志物和特异性治疗药物[1]。溶质载体家族7 成员11(SLC7A11)/谷胱甘肽过氧化物酶4(GPX4)信号通路是抑制细胞铁死亡的核心机制[2]。有研究[3]报道,铁死亡参与了对乙酰氨基酚(APAP)诱导的急性肝损伤进程。葛根素(Puerarin)是中药葛根中的类黄酮提取物,具有保肝功效,对急性肝损伤有一定治疗作用[4-5]。但葛根素是否对APAP 诱导的DILI 有防治作用尚不明确。因此,本研究拟观察葛根素对APAP 诱导急性肝损伤小鼠的保护作用,并基于SLC7A11/GPX4信号通路探讨其改善铁死亡的作用及机制。
1 材料与方法
1.1 动物SPF 级雄性C57BL/6J 小鼠,7 周龄,体质量(21±2)g,由广州中医药大学实验动物中心提供,实验动物生产许可证号:SCXK(粤)2018-0001,动物质量合格证号:44005800013127。所有小鼠分笼饲养于广州中医药大学实验动物中心实验室,小鼠自由饮食,适应性喂养1 周后开始实验。本实验经广州中医药大学实验动物伦理委员会审批,伦理批文号:20220516007。
1.2 药物及试剂葛根素(纯度为98%),天津希恩思生化科技有限公司,批号:P92932HIS1;对乙酰氨基酚(APAP),美国MCE 公司,批号:65793;谷丙转氨酶(ALT)检测试剂盒(批号:2021610)、谷草转氨酶(AST)检测试剂盒(批号:2021609)、乳酸脱氧酶(LDH)检测试剂盒(批号:20210730)、丙二醛(MDA)检测试剂盒(批号:20210820),均购自南京建成生物工程研究所;HE 染色试剂盒,北京兰杰柯科技有限公司,批号:BL700B;TUNEL 细胞凋亡检测试剂盒,南京凯基生物科技发展有限公司,批号:20210720;CellROX®Deep Red Reagent,美国赛默飞科技公司,货号:C10422;免疫染色强力通透液(批号:P0097)、山羊血清(批号:C0265)、抗荧光淬灭封片液(批号:P0131)、BCA 蛋白浓度测定试剂盒(批号:082820201027)、DEPC 水(批号:110420201107),均购自上海碧云天生物技术有限公司;EDTA抗原修复液(批号:BST16A11B23)、DAPI染色液(批号:13F11B77)、Anti-GPX4 抗体(货号:BM5231)、Anti-SLC7A11 Monoclonal Antibody(货号:BM5318),均购自武汉博士德生物工程有限公司;4-羟基壬烯醛(4-HNE)抗体,北京博奥森生物技术有限公司,货号:bs-6313R;RNAiso Plus(货号:9109)、TB Green 染料法定量试剂盒(批号:AL13568A)、PrimeScriptTM RT Master Mix(批号:AL22271A),均购自北京宝日医生物技术有限公司。
1.3 主要仪器5424R型冷冻离心机,德国Eppendorf公司;Multiskan SkyHigh 型全波长酶标仪,美国Thermo Fisher 公司; ASP200S 型组织脱水机、EG1160 型石蜡包埋机、RM2135 型病理切片机、CM3050 型冰冻切片机、DMi8 型倒置显微镜,均购自德国Leica 公司;KZ-III-F 型高速低温组织研磨仪,武汉赛维尔生物科技有限公司;T100 型PCR仪,美国BIO-RAD公司;Applied Biosystems 7500型定量PCR 仪,美国应用生物系统公司;NP80 型多功能紫外-可见分光光度计,德国IMPLEN GMBH公司。
1.4 分组、给药、模型复制及样本采集将24 只小鼠适应性喂养1周,称体质量后按随机数字表法分为4 组:正常组、模型组及葛根素低、高剂量组(50、200 mg·kg-1),每组6 只。采用预给药方式,葛根素低、高剂量组每天灌胃给药1 次,连续3 d;正常组、模型组给予等容积的0.5% CMC-Na 溶剂。末次给药1 h后,模型组及葛根素低、高剂量组腹腔注射APAP(300 mg·kg-1)[6]复制DILI 小鼠模型,正常组腹腔注射等容积的无菌生理盐水。各组小鼠禁食24 h后,称体质量;采集血液,以4 ℃、3 000 r·min-1(离心半径=10 cm)离心10 min,取上清液,保存于-80 ℃冰箱;行颈椎脱臼法处死小鼠,摘取肝脏,用生理盐水洗涤;滤纸吸尽脏器表面液体后,称定质量;将肝组织分为2份,1份用4%多聚甲醛溶液固定后用于组织病理学分析,另1 份用液氮速冻后,-80 ℃保存。
1.5 微板法检测血清ALT、AST、LDH 含量取“1.4”项下制备的血清,室温下解冻后,严格按照检测试剂盒说明书步骤操作,采用微板法测定血清ALT、AST、LDH水平。
1.6 肝脏组织HE、TUNEL 染色取“1.4”项下固定后的肝组织,经脱水、透明、包埋后切片(4 μm),切片经二甲苯脱蜡、苏木素-伊红(HE)染色,乙醇梯度脱水、二甲苯透明、中性树胶封片后,在光学显微镜下观察肝脏组织病理变化并采集图像。另外,小鼠肝脏组织切片采用TUNEL DAB 染色后,在光学显微镜下观察肝细胞凋亡情况并采集图像,呈现棕褐色的为阳性细胞即凋亡细胞。
1.7 TBA 法检测肝脏组织MDA 含量取“1.4”项下液氮速冻的肝组织适量,加入9 倍量0.9%生理盐水,充分进行组织匀浆;以4 ℃、2 500 r·min-1(离心半径=10 cm)离心10 min,取上清;使用BCA蛋白定量试剂盒检测样品的蛋白浓度;严格按照试剂盒说明书步骤操作,采用TBA法检测肝组织MDA含量。
1.8 免疫荧光法检测肝组织中活性氧(ROS)、4-HNE、GPX4 及SLC7A11 的表达水平取“1.4”项下固定后的肝组织,修剪为0.5 cm×0.5 cm×0.3 cm 的组织块;PBS 清洗3 次后,4 ℃下经30%蔗糖浸泡过夜脱水;O.C.T.包埋后制备冰冻切片(25 μm)。将各组小鼠肝组织冰冻切片放入装有PBS 的48 孔板中;吸去PBS,滴加通透剂,室温下通透20 min;吸去通透液,用PBS 洗涤3 次,每次5 min。①检测ROS表达水平:加入CellROX®Deep Red Reagent 荧光探针工作液(5 μmol·L-1),37 ℃下避光放置30 min。②检测4-HNE、GPX4 及SLC7A11 表达水平:使用封闭液在室温下封闭30 min;加入稀释后的一抗,4 ℃下孵育48 h,PBS 洗涤3 次,每次5 min;滴加荧光标记二抗,室温下避光孵育2 h。以下步骤①②相同:用PBS 洗涤3 次,每次5 min;将切片转移至载玻片上,稍晾干,滴加DAPI 染色液,室温下避光染色10 min;吸去DAPI后稍晾干,滴加封片剂封片,在荧光显微镜下(激发波长:640 nm;吸收波长:665 nm)观察拍照,并对结果进行半定量分析。
1.9 qRT-PCR 法检测肝脏组织铁死亡相关基因GPX4、TFRC、SLC11A2 mRNA 表达水平称取“1.4”项下液氮速冻的肝组织50 mg,应用RNA 提取裂解液提取总RNA,严格按照试剂盒说明书步骤操作。使用多功能紫外-可见分光光度计测定RNA 纯度及浓度。进行mRNA 逆转录酶聚合酶链反应,反应体系:4 μL 5× RT Master Mix、2 μL RNA、14 μL去离子水;反应条件:37 ℃、15 min,85 ℃、5 s,4 ℃∞。以cDNA 为模板,进行实时荧光定量PCR 扩增反应,反应体系:12.5 μL TB Green、8.5 μL 去离子水、1 μL 上游引物、1 μL 下游引物、2 μL 模板cDNA;扩增程序:95 ℃、30 s;95 ℃、5 s,60 ℃、30 s,循环40 次;95 ℃、10 s;65 ℃、5 s;95 ℃、15 s。进行熔解曲线分析,根据扩增曲线读取Ct 值,以β-actin 为内参,采用2-△△Ct法计算目的基因的相对表达水平。引物由上海生工生物工程股份有限公司合成,引物序列见表1。
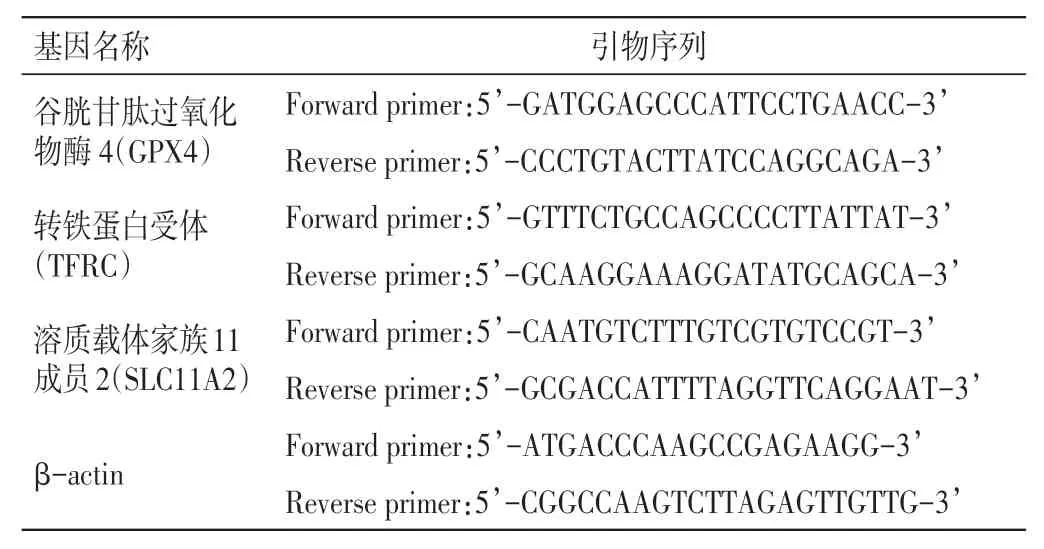
表1 PCR 引物序列Table 1 Primer sequences for PCR
1.10 统计学处理方法采用SPSS 26.0统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD检验;以P<0.05为差异有统计学意义。
2 结果
2.1 葛根素对APAP 致DILI 小鼠血清ALT、AST水平的影响结果见表2。与正常组比较,模型组小鼠的血清ALT、AST水平显著升高,差异有统计学意义(P<0.01);与模型组比较,葛根素低、高剂量组小鼠的血清AST 水平显著降低,差异有统计学意义(P<0.05,P<0.01),血清ALT水平有降低趋势,但差异无统计学意义(P>0.05)。结果表明,葛根素对APAP致DILI小鼠的肝功能具有保护作用。
表2 各组小鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)水平的变化(±s,n=6)Table 2 Changes of ALT and AST levels in serum of mice in each group(±s,n=6)

表2 各组小鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)水平的变化(±s,n=6)Table 2 Changes of ALT and AST levels in serum of mice in each group(±s,n=6)
注:与模型组比较,*P<0.05,**P<0.01
AST/(U·L-1)42.5±16.7**307.6±29.5 108.6±106.8*107.5±91.7**组别正常组模型组葛根素低剂量组葛根素高剂量组剂量/(mg·kg-1)--5 0 200 ALT/(U·L-1)116.0±38.3**796.1±106.1 495.0±415.8 448.7±386.6
2.2 葛根素对APAP 致DILI 小鼠血清LDH 水平的影响结果见表3。与正常组比较,模型组小鼠的血清LDH 水平显著升高,差异有统计学意义(P<0.01);与模型组比较,葛根素低、高剂量组小鼠的血清LDH 水平显著降低,差异有统计学意义(P<0.01)。结果表明,葛根素能抑制APAP 致DILI 小鼠的肝细胞损伤。
表3 各组小鼠血清中乳酸脱氢酶(LDH)水平的变化(±s,n=6)Table 2 Changes of LDH level in serum of mice in each group(±s,n=6)

表3 各组小鼠血清中乳酸脱氢酶(LDH)水平的变化(±s,n=6)Table 2 Changes of LDH level in serum of mice in each group(±s,n=6)
注:与模型组比较,*P<0.05,**P<0.01
LDH/(U·L-1)103.9±22.1**480.6±45.7 198.8±93.6**216.9±147.9**组别正常组模型组葛根素低剂量组葛根素高剂量组剂量/(mg·kg-1)--5 0 200
2.3 葛根素对APAP 致DILI 小鼠肝组织病理变化的影响结果见图1。HE 染色显示,正常组小鼠的肝小叶呈多面棱柱状,中央细胞核呈圆形泡状,肝细胞呈多角形并有序排列在中央静脉周围的肝板中。与正常组比较,模型组小鼠的肝小叶出现明显损伤,表现为肝细胞肿胀破裂,胞质空泡化,细胞核碎裂,肝血窦充血及炎性细胞浸润。与模型组比较,葛根素低、高剂量组小鼠的肝小叶结构较清晰,肝索呈放射状排列,肝组织坏死面积明显减少。结果表明,葛根素能改善APAP致DILI小鼠的肝组织病理损伤。

图1 各组小鼠的肝组织病理形态学变化及肝细胞凋亡情况(HE、TUNEL 染色,×400)Figure 1 The histopathologic changes and hepatocyte apoptosis of liver tissue in each group of mice(HE and TUNEL staining,×400)
2.4 葛根素对APAP 致DILI 小鼠肝细胞凋亡情况的影响结果见图1。TUNEL 染色显示,与正常组比较,模型组小鼠肝组织切片DAB 染色的深棕色面积明显增加,表明凋亡细胞增多。与模型组比较,葛根素低、高剂量组小鼠肝组织切片DAB 染色的深棕色面积(凋亡细胞)明显减少。结果表明,葛根素能减少APAP致DILI小鼠的肝细胞凋亡。
2.5 葛根素对APAP 致DILI 小鼠肝组织中MDA含量的影响结果见表4。与正常组比较,模型组小鼠肝组织中MDA 水平明显升高,差异有统计学意义(P<0.05);与模型组比较,葛根素高剂量组小鼠肝组织中MDA 水平明显降低,差异有统计学意义(P<0.05)。结果表明,葛根素能改善APAP 致DILI 小鼠肝组织的氧化损伤。
表4 各组小鼠肝组织中丙二醛(MDA)水平的变化(±s,n=6)Table 4 Changes of MDA level in liver tissue of mice in each group(±s,n=6)

表4 各组小鼠肝组织中丙二醛(MDA)水平的变化(±s,n=6)Table 4 Changes of MDA level in liver tissue of mice in each group(±s,n=6)
注:与模型组比较,*P<0.05
MDA/(nmol·mg-1)2.3±1.1*4.8±2.1 3.4±1.2 2.1±1.0*组别正常组模型组葛根素低剂量组葛根素高剂量组剂量/(mg·kg-1)--5 0 200
2.6 葛根素对APAP 致DILI 小鼠肝组织中ROS、4-HNE 表达水平的影响结果见图2、表5。与正常组比较,模型组小鼠肝组织中的ROS、4-HNE 红色荧光(阳性表达)显著增强,差异有统计学意义(P<0.05,P<0.01);与模型组比较,葛根素低、高剂量组小鼠肝组织中的ROS、4-HNE 红色荧光(阳性表达)显著减弱,差异有统计学意义(P<0.05,P<0.01)。结果表明,葛根素能降低APAP 致DILI 小鼠肝组织的脂质过氧化水平。
表5 各组小鼠肝组织中ROS 含量及4-HNE 的表达情况(±s,n=6)Table 5 Expressions of ROS and 4-HNE in liver tissue of mice in each group(±s,n=6)
注:与模型组比较,*P<0.05,**P<0.01
4-HNE相对荧光强度12.9±1.4*22.0±1.7 15.5±1.2*15.4±0.9*组别正常组模型组葛根素低剂量组葛根素高剂量组剂量/(mg·kg-1)--5 0 200 ROS相对荧光强度16.3±0.9**34.6±2.2 21.9±4.3**15.2±1.7**
2.7 葛根素对APAP 致DILI 小鼠肝组织GPX4、SLC7A11 表达水平的影响结果见图3、表6。与正常组比较,模型组小鼠肝组织中的GPX4、SLC7A11红色荧光(阳性表达)显著减弱,差异有统计学意义(P<0.01);与模型组比较,葛根素低剂量组小鼠肝组织中的GPX4、SLC7A11 红色荧光(阳性表达)明显增强,差异有统计学意义(P<0.05,P<0.01),葛根素高剂量组小鼠肝组织中的GPX4、SLC7A11 红色荧光(阳性表达)有增强趋势,但差异无统计学意义(P>0.05)。结果表明,葛根素能够上调APAP 致DILI小鼠肝组织SLC7A11、GPX4表达水平。
表6 各组小鼠肝组织中GPX4、SLC7A11 的表达情况(±s,n=6)Table 6 Expressions of GPX4 and SLC7A11 in liver tissue of mice in each group(±s,n=6)

表6 各组小鼠肝组织中GPX4、SLC7A11 的表达情况(±s,n=6)Table 6 Expressions of GPX4 and SLC7A11 in liver tissue of mice in each group(±s,n=6)
注:与模型组比较,*P<0.05,**P<0.01
SLC7A11相对荧光强度3 750.2±1 114.5**134.6±65.4 1 346.7±452.6*809.7±311.1组别正常组模型组葛根素低剂量组葛根素高剂量组剂量/(mg·kg-1)--5 0 200 GPX4相对荧光强度4 309.5±967.1**1 165.9±347.9 3 922.7±764.2**2 461.8±850.8
2.8 葛根素对APAP 致DILI 小鼠肝组织铁死亡相关基因表达的影响结果见表7。与正常组比较,模型组小鼠肝组织中的GPX4、SLC11A2 mRNA 表达均明显下调,差异有统计学意义(P<0.05),TFRC表达有下调趋势,但差异无统计学意义(P>0.05);与模型组比较,葛根素低剂量组小鼠肝组织中的GPX4、TFRC mRNA 表达明显上调,葛根素高剂量组小鼠肝组织中的GPX4、SLC11A2 mRNA 表达明显上调,差异均有统计学意义(P<0.05)。结果表明,葛根素能够上调APAP 致DILI 小鼠肝组织铁死亡相关基因GPX4、TFRC、SLC11A2的表达。
表7 各组小鼠肝组织中GPX4、TFRC、SLC11A2 mRNA表达情况(±s,n=4)Table 7 mRNA expressions of GPX4,TFRC and SLC11A2 in liver tissue of mice in each group(±s,n=4)

表7 各组小鼠肝组织中GPX4、TFRC、SLC11A2 mRNA表达情况(±s,n=4)Table 7 mRNA expressions of GPX4,TFRC and SLC11A2 in liver tissue of mice in each group(±s,n=4)
注:与模型组比较,*P<0.05,**P<0.01
SLC11A2 mRNA相对表达量1.06±0.23*0.47±0.19 0.87±0.30 1.10±0.11*组别正常组模型组葛根素低剂量组葛根素高剂量组剂量/(mg·kg-1)--5 0 200 GPX4 mRNA相对表达量1.02±0.20*0.30±0.19 0.76±0.15*0.99±0.27*TFRC mRNA相对表达量0.57±0.30 0.25±0.14 1.01±0.53*0.77±0.29
3 讨论
药物性肝损伤(DILI)是由各种药物引起的急慢性肝损伤,对乙酰氨基酚(APAP)是常见的解热镇痛药,过量或长期使用会导致严重的肝损伤[7]。本研究结果显示,经APAP 诱导后,模型组小鼠的血清ALT、AST、LDH 水平均显著升高,HE 染色显示肝组织坏死面积增加,TUNEL 染色显示肝细胞凋亡增加,表明APAP诱导DILI小鼠模型复制成功。而与模型组比较,葛根素给药组小鼠的血清ALT、AST、LDH 水平降低,肝组织病理损伤明显改善,肝细胞凋亡明显减少,表明葛根素对APAP诱导的DILI有明显的保护作用。
铁死亡是一种铁依赖的脂质过氧化的新型细胞死亡方式,在APAP 诱导DILI 发生发展中有重要作用,其中活性氧(ROS)介导的脂质过氧化是铁死亡发生的关键步骤[8]。脂质过氧化的起始阶段主要由细胞中的铁参与自由基化合物生成,其中丙二醛(MDA)和4-羟基壬烯醛(4-HNE)是脂质过氧化的主要产物,能反映组织脂质过氧化的程度。转铁蛋白受体(TFRC)和溶质载体家族11 成员2(SLC11A2)是参与铁输送的重要基因[9]。细胞铁死亡的发生分为外源性和内源性细胞通路,内源性途径可以通过下调细胞内抗氧化酶[如谷胱甘肽过氧化物酶4(GPX4)]的表达或活性来进一步激活铁死亡[10];外源性途径可通过抑制由溶质载体家族7成员11(SLC7A11)和溶质载体家族3 成员2(SLC3A2)组成的胱氨酸/谷氨酸反向转运体(System Xc-)[11],或通过诱导掌管细胞内外铁运输的转铁蛋白及膜铁转运蛋白来启动铁死亡。
有研究[12]证实,葛根素能够调节铁稳态,抑制铁过载,从而抑制细胞铁死亡,但其对APAP诱导DILI的治疗作用及铁死亡机制尚未阐明。本研究结果显示,葛根素能明显降低APAP致DILI小鼠肝组织中的MDA含量,下调ROS水平和4-HNE蛋白表达,上调SLC7A11、GPX4蛋白表达及GPX4、TFRC、SLC11A2基因表达,从而发挥对肝细胞铁死亡的保护作用。
综上所述,葛根素对APAP诱导的DILI小鼠有明显的保护作用,可能与其通过SLC7A11/GPX4通路抑制细胞铁死亡有关。本研究结果可为DILI 的临床防治及葛根素的药理作用研究提供新的思路。但本研究也存在一定局限性,由于葛根素水溶性差,生物利用度低,本研究中葛根素给药沿用了辅助混悬剂0.5% CMC-Na,后续将加入新型载药系统研究,以提高葛根素的生物利用度。
