苏木酮A 通过抑制JAK2-STAT3 信号通路发挥抗炎作用
2023-12-20邓成杰马洪星张华茜胡月周黄静孙世芹辛萍哈尔滨医科大学大庆校区药学院黑龙江大庆69江苏省南京市溧水区人民医院检验科江苏南京00江苏省南京市溧水区人民医院科教科江苏南京00
邓成杰,马洪星,张华茜,胡月周,黄静,孙世芹,辛萍(. 哈尔滨医科大学大庆校区药学院,黑龙江大庆 69;. 江苏省南京市溧水区人民医院检验科,江苏南京 00;. 江苏省南京市溧水区人民医院科教科,江苏南京 00)
炎症反应是对组织损伤和病原体入侵和感染的快速防御反应。巨噬细胞及其它吞噬细胞是宿主抵御微生物入侵的首要防线,可以吞噬炎症反应产生的有害物质并维持体内平衡,也是调节炎症反应的关键免疫细胞[1]。巨噬细胞的持续活化会分泌肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6和IL-1β等大量的炎症介质,这些介质不受控制的产生或过量分泌与许多疾病的发生发展有关[2-4]。巨噬细胞表面的TLR-4 受体的激活会启动胞内下游炎症信号通路,包括JAK-STAT、MAPK 和PI3K-AKT 等[5-7]。目前,临床上JAK-STAT 抑制剂在治疗包括类风湿性关节炎、炎症性肠病等炎症相关疾病方面显示出很大的优势,持续激活的JAK-STAT信号通路在某些病理条件下,经常引起慢性炎症和炎症介导的癌症[8]。在炎症状态下,细胞膜表面的细胞因子与受体和配体相结合产生二聚化从而激活下游信号通路JAK2-STAT3[9]。已有研究[10]表明,抑制JAK2-STAT3蛋白激酶的磷酸化能够减少促炎性细胞因子TNF-α、IL-1β和IL-6的分泌和表达,进而有效抑制炎症反应。
苏木酮A(Sappanone A,SA)属于高异黄酮类化合物,是从豆科云实属植物苏木(CaesalpiniasappanL.)的心材中分离出来的单体[11]。苏木主要分布于东南亚,具有活血祛瘀、消肿止痛的作用。现代药理学研究[12-14]表明,苏木酮A具有多种生物活性,如抗神经炎、抗肿瘤、抗氧化和免疫抑制等活性。然而,苏木酮A的抗炎活性及其潜在的分子机制尚不清楚。因此,本研究拟采用脂多糖(LPS)诱导RAW264.7细胞产生炎症反应,以评价苏木酮A的抗炎活性并探讨其作用机制。
1 材料与方法
1.1 细胞及培养小鼠单核巨噬RAW264.7 细胞购自中国科学院干细胞库,培养在含有10%FBS 的高糖DMEM培养液中,细胞密度约达到80%,并取对数生长期的细胞用于实验。
1.2 药物及试剂苏木酮A(纯度≥98%),赫利森生物科技有限公司,批号:HS030-10-04;AG490(JAK2 特异性抑制剂),美国Selleck&bimake 公司,批号:S114303;脂多糖(LPS),北京索莱宝科技有限公司,批号:462H031;胎牛血清(FBS)浙江天杭生物科技股份有限公司,批号:19070704;DMEM高糖培养基,美国GE 公司,批号:AD20616263;MTT,北京伊塔生物科技有限公司,批号:EZ2811B347;小鼠IL-6 ELISA 试剂盒,北京欣博盛生物科技有限公司,批号:M180327-004a;总RNA提取试剂盒,上海普洛麦格生物产品有限公司,批号:0000278076;SYBR@Green Realtime PCR Master Mix 试剂盒,上海东洋纺生物科技有限公司,批号:841500;BCA 蛋白浓度测定试剂盒,碧云天生物技术有限公司,批号:052319190910;JAK2(批号:H08233592)、p-JAK2(批号:G04152997)、STAT3(批号: G07143207)、 p- STAT3(批号:G04153001)一抗,均购自万类生物科技有限公司;β-actin 一抗(批号:191050722)、兔二抗(批号:139931),均购自北京中杉金桥生物技术有限公司。
1.3 主要仪器Airstream®Gen 3 ESCO 超净工作台,深圳市赛亚泰科仪器设备公司;BioTekSynergyHT 多功能酶标仪,美国BioTek 公司;AE2000 倒置显微镜,上海光学仪器厂;Centrifuge 5430R 超低温高速离心机,德国Eppendorf 公司;LightCycler 480 PCR仪,瑞士Roche 公司;AI600 超灵敏多功能成像仪,美国GE公司。
1.4 MTT 法测定细胞存活率将RAW264.7 细胞以1.5×104个·孔-1接种于96 孔培养板中,每孔200 μL,每组平行设置5个复孔,培养24 h;弃掉培养液,用不同浓度梯度SA、LPS、AG490 分别处理20 h 后;然后每孔加入200 μL 的0.5 mg·mL-1MTT 溶液,在5% CO2的37 ℃培养箱中避光培养4 h;吸去上清液,每孔加入150 μL的二甲基亚砜(DMSO),用酶标仪在492 nm处检测各孔吸光度(OD)值。细胞存活率(%)=实验孔OD值/空白孔OD值×100%。
1.5 ELISA法检测细胞IL-6分泌水平将2×105个·mL-1RAW264.7 细胞悬液接种于24 孔培养板中,每孔1 mL。培养20 h 后,除空白组外,其余各孔均加入100 ng·mL-1LPS 刺激。设置LPS 模型组,苏木酮A低、中、高剂量组(1.25,2.5、5 μg·mL-1),苏木酮A中剂量联合抑制剂组(2.5 μg·mL-1苏木酮A+10 μg·mL-1AG490)、苏木酮A 高剂量联合抑制剂组(5 μg·mL-1苏木酮A+10 μg·mL-1AG490),处理细胞20 h。收集上清液,按ELISA试剂盒说明书操作,用酶标仪检测IL-6分泌水平。
1.6 RT-qPCR 法检测细胞IL-6、JAK2、STAT3 mRNA 表达水平将4×105个·mL-1RAW264.7 细胞悬液接种于6 孔培养板中,每孔2 mL。培养20 h后,除空白组外,其余各孔均加入100 ng·mL-1LPS刺激。设置LPS模型组、高剂量(5 μg·mL-1)苏木酮A组、苏木酮A高剂量联合抑制剂组(5 μg·mL-1苏木酮A+10 μg·mL-1AG490),处理细胞20 h。使用EastepSuper 总RNA 提取试剂盒提取RAW264.7 细胞总RNA,进行定量,并逆转录成cDNA。使用SYBR Green PCR master mix 试剂盒对其进行扩增,阶段1:95 ℃、30 s;阶段2:95 ℃、5 s;55 ℃、10 s;72 ℃、15 s,共40个循环。以GAPDH作内参,运用2-△△Ct法计算各组间mRNA 表达水平差异并归一化处理。所使用的引物序列如表1所示,引物由赛默飞科技(中国)有限公司合成。

表1 RT-qPCR 引物序列Table 1 Primer sequences of Real-Time qPCR
1.7 Western Blot 法检测细胞JAK2、STAT3 蛋白水平的表达将4×105个·mL-1RAW264.7细胞悬液接种于6 孔培养板中,每孔2 mL,细胞培养、分组及给药同“1.6”项下。向6 孔板中加入含有1%蛋白酶和磷酸酶抑制剂的RIPA 裂解液,提取总蛋白。采用BCA蛋白定量试剂盒测定蛋白浓度;上样量30 μg蛋白,经8%~15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转移到聚偏氟乙烯(PVDF)膜;5%的脱脂牛奶封闭1 h后,用0.1%的Tween 20(T-TBS)洗涤。孵育一抗,于4 ℃过夜;第2 天,取出用TTBS 洗涤,在室温下孵育二抗1 h 后,用T-TBS 洗涤,ECL荧光剂将蛋白可视化,在超灵敏多功能成像仪AI600 进行显影。使用ImageJ 软件进行灰度值分析,以β-actin为内参,计算目的蛋白的相对表达量。
1.8 统计学处理方法采用SPSS 17.0 软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析和t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 苏木酮A、LPS 和AG490 对RAW264.7 细胞存活率的影响采用MTT 法进行检测,结果见表2~表4。以5、10、 20、40和80 μg·mL-1苏木酮A处理RAW264.7细胞,结果显示与空白组比较,5 μg·mL-1苏木酮A 对RAW264.7 细胞存活率无影响(P>0.05),故选取1.25、2.5、5 μg·mL-1苏木酮A 作为炎性细胞因子IL-6 的处理浓度。与空白组比较,50、100、500 ng·mL-1LPS 处理的RAW264.7 细胞对细胞存活能力无影响(P>0.05),1 000 ng·mL-1LPS 可明显降低RAW264.7 细胞的存活率(P<0.05),故选取100 ng·mL-1LPS来建立RAW264.7细胞炎性模型。以浓度为5、10、15、20、25 μg·mL-1的AG490 处理RAW264.7 细胞,结果显示与空白组比较,5 和10 μg·mL-1AG490对RAW264.7细胞存活无影响(P>0.05),故选取浓度为10 μg·mL-1的AG490 进行后续分子水平研究。
表2 苏木酮A(SA)对RAW264.7 细胞存活率的影响(±s,n=5)Table 2 Effect of sappanone A(SA)on the survival rate of RAW264.7 cells(±s,n=5)
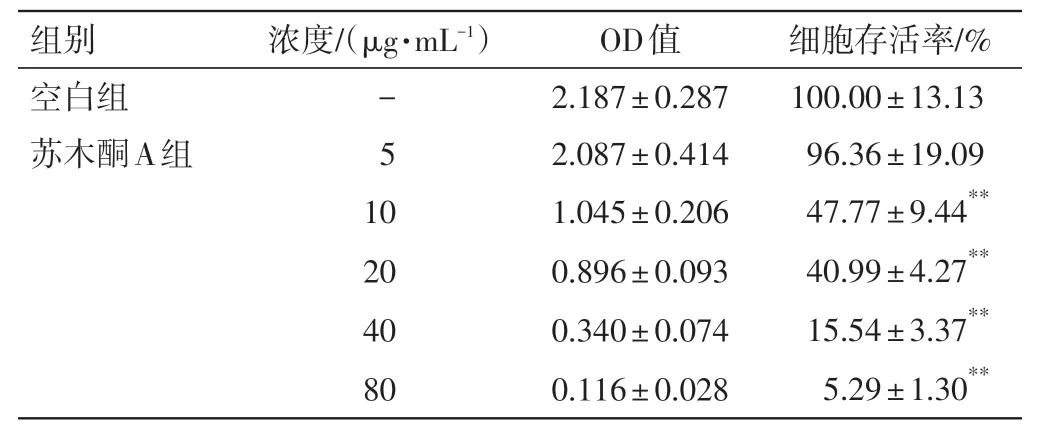
表2 苏木酮A(SA)对RAW264.7 细胞存活率的影响(±s,n=5)Table 2 Effect of sappanone A(SA)on the survival rate of RAW264.7 cells(±s,n=5)
注:与空白组比较,**P<0.01
细胞存活率/%100.00±13.13 96.36±19.09 47.77±9.44**40.99±4.27**15.54±3.37**5.29±1.30**组别空白组苏木酮A组浓度/(μg·mL-1)-5 10 20 40 80 OD值2.187±0.287 2.087±0.414 1.045±0.206 0.896±0.093 0.340±0.074 0.116±0.028
表3 脂多糖(LPS)对RAW264.7 细胞存活率的影响(±s,n=5)Table 3 Effect of lipopolysaccharide(LPS)on the survival rate of RAW264.7 cells(±s,n=5)

表3 脂多糖(LPS)对RAW264.7 细胞存活率的影响(±s,n=5)Table 3 Effect of lipopolysaccharide(LPS)on the survival rate of RAW264.7 cells(±s,n=5)
注:与空白组比较,*P<0.05
细胞存活率/%100.00±1.46 97.69±2.94 95.36±5.51 98.89±11.16 88.27±10.10*组别空白组LPS组浓度/(ng·mL-1)-50 100 500 1 000 OD值1.873±0.027 1.830±0.055 1.786±0.103 1.852±0.209 1.594±0.064
表4 AG490 对RAW264.7 细胞存活率的影响(±s,n=5)Table 4 Effect of AG490 on the survival rate of RAW264.7 cells(±s,n=5)

表4 AG490 对RAW264.7 细胞存活率的影响(±s,n=5)Table 4 Effect of AG490 on the survival rate of RAW264.7 cells(±s,n=5)
注:与空白组比较,*P<0.05,**P<0.01
细胞存活率/%100.00±4.25 94.36±13.81 98.37±15.25 91.29±10.00*79.51±5.15**68.34±3.04**组别空白组AG490组浓度/(μg·mL-1)-5 10 15 20 25 OD值1.933±0.082 1.791±0.206 1.902±0.295 1.765±0.193 1.537±0.100 1.321±0.059
2.2 苏木酮A 对LPS 诱导的RAW264.7 细胞IL-6水平的影响结果见图1。与空白组比,LPS 诱导RAW264.7 细胞产生IL-6 水平明显升高(P<0.01)。与模型组比,苏木酮A 低剂量组IL-6 水平与模型组的差异无统计学意义(P>0.05),中、高剂量组RAW264.7 细胞产生的IL-6 明显降低(P<0.01)。为了进一步验证苏木酮A 的抗炎效果,我们使用JAK2的特异性抑制剂AG490 与苏木酮A 联合处理,苏木酮A中剂量联合抑制剂组、苏木酮A高剂量联合抑制剂组的RAW264.7 细胞IL-6 分泌水平均明显降低(P<0.01)。
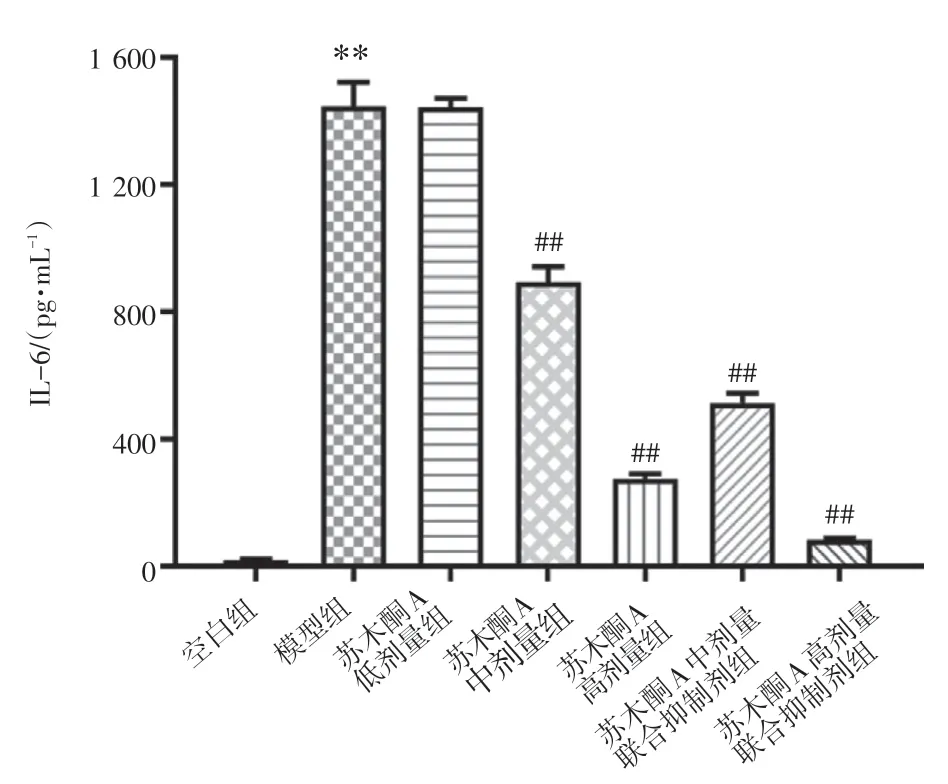
图1 苏木酮A(SA)对脂多糖(LPS)诱导的RAW264.7 细胞IL-6 水平的影响(±s,n=6)Figure 1 Effects of sappanone A(SA)on the level of IL-6 in LPS-induced RAW264.7 cells(±s,n=6)
2.3 苏木酮A 对LPS 诱导的RAW264.7 细胞IL-6、JAK2 及STAT3 mRNA 的表达的影响结果见图2。与空白组比,模型组IL-6、JAK2 及STAT3 mRNA 表达均明显上调(P<0.01)。与模型组比,苏木酮A 高剂量组及苏木酮A 高剂量联合抑制剂组的IL-6、JAK2 和STAT3 mRNA 表达均明显下调(P<0.05,P<0.01),且二者之间的差异无统计学意义(P>0.05)。
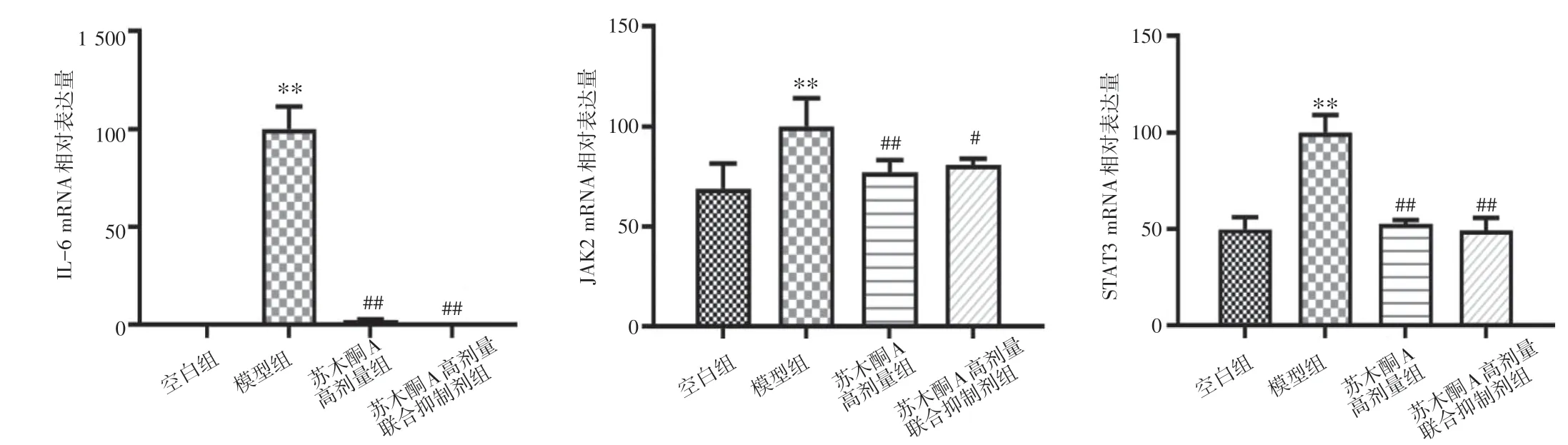
图2 苏木酮A(SA)对脂多糖(LPS)诱导的RAW264.7 细胞IL-6、JAK2、STAT3 mRNA 表达的影响(±s,n=6)Figure 2 Effects of sappanone A(SA)on the mRNA expressions of IL-6,JAK2 and STAT3 in LPS-induced RAW264.7 cells(±s,n=6)
2.4 SA 对LPS 诱导的RAW264.7 细胞p-JAK2、p-STAT3 蛋白表达的影响结果见图3。与空白组比,LPS 模型组的p-JAK2、p-STAT3 蛋白表达明显上调(P<0.01);苏木酮A 高剂量组、苏木酮A 高剂量联合抑制剂组均明显下调p-JAK2、p-STAT3 蛋白的表达(P<0.01),且二者之间的差异无统计学意义(P>0.05)。
3 讨论
炎症与大多数疾病的病理生理过程的发生发展密切相关。在炎症过程中会分泌大量的炎症细胞因子,可作用于多种细胞并引发“炎症因子风暴”,这种过度的不可控的炎症反应加剧了对细胞的损伤,最终导致多种炎症疾病破坏机体健康或死亡[15-16]。RAW264.7细胞作为机体内非常重要的免疫细胞和炎症效应细胞,在自身免疫性疾病、炎症性疾病的发病机制中发挥重要作用[17]。当外界因素刺激RAW264.7 细胞时,会导致促炎因子大量生成并释放,如TNF-α、IL-1β 和IL-6 等。因此,抑制RAW264.7细胞中促炎性因子的表达和释放被认为是预防和治疗炎症性疾病的潜在策略。Najjar 等[18]研究LPS 诱导的RAW264.7 细胞中山茱萸多酚提取物的抗炎效果,蛋白水平结果显示TNF-α、IL-1β和IL-6均明显下调。Lampiasi 等[19]利用LPS 刺激RAW264.7 细胞发现阿魏酸能够抑制IL-6 mRNA 表达。本研究结果显示,苏木酮A 或苏木酮A 联合AG490 均可抑制RAW264.7细胞中炎性因子IL-6的释放,这说明苏木酮A或苏木酮A联合AG490均能通过降低炎性因子的表达来改善LPS诱导的细胞炎症,并且苏木酮A的处理浓度越高,抑制IL-6释放越明显,抗炎作用越好。
JAK2-STAT3信号通路的持续激活与许多炎症性和免疫疾病密切相关,包括类风湿关节炎、炎症性肠病、败血症以及肿瘤性疾病等[2-4]。在炎症过程中,JAK2-STAT3 是受细胞因子调节的主要信号通路,其信号转导机制相对简单。当细胞受到外源性LPS刺激后,会分泌炎症细胞因子并与细胞表面的膜受体相结合,首先激活细胞质中JAK2激酶发生磷酸化,进而激活下游STAT3 蛋白磷酸化并活化形成二聚体。最后,细胞质中的二聚化STAT3 被转移到细胞核中,进一步促使细胞分泌一些炎症细胞因子[20]。先前的研究[21]表明,JAK2-STAT3 信号通路可在LPS刺激的RAW264.7 细胞中激活并释放炎性细胞因子,例如TNF-α、IL-1β和IL-6等。本研究中,我们研究了苏木酮A 在LPS 诱导RAW264.7 细胞中对JAK2-STAT3磷酸化蛋白表达的影响。结果发现,苏木酮A高剂量组和苏木酮A 高剂量联合抑制剂AG490 处理组均明显下调p-JAK2、p-STAT3 蛋白的表达(P<0.01),且二者的差异无统计学意义,说明苏木酮A可能是潜在的JAK2-STAT3抑制剂,但仍需进一步深入研究。以上结果表明,苏木酮A可以通过抑制LPS刺激的JAK2磷酸化,进而抑制STAT3的磷酸化,从而发挥抑制炎症作用。
使用LPS 刺激RAW264.7 细胞是构建体外炎症的经典模型,故本实验在此基础上探讨了苏木酮A的抗炎活性及作用机制。本研究结果显示,苏木酮A能够下调LPS 诱导的RAW264.7 细胞中p-JAK2 和p-STAT3 基因与蛋白表达,减少促炎因子IL-6 的分泌,进而发挥抗炎作用,可为苏木酮A在治疗炎症性疾病的药物研究提供实验依据。但在本研究中尚未涉及其他网络调控信号的探索,我们拟在后续的研究中探讨苏木酮A是否通过其他网络调控信号或靶点发挥抗炎作用,并完善其分子作用机制。
