白术内酯Ⅲ对自发性高血压大鼠脑卒中的影响及机制研究
2023-12-19李吉博冯永文吴文峰范学政李海霞
李吉博, 冯永文, 吴文峰, 范学政, 李海霞
[中国科学院大学深圳医院(光明), 1. 重症医学科, 2. 神经外科, 3. 急诊科, 广东 深圳, 518106]
脑卒中是危及人类生命健康的主要疾病之一,具有较高的致死率和致残率[1-2]。原发性高血压的临床发病率较高且发病趋于年轻化,而脑卒中是自发性高血压患者常见的并发症[3]。自发性高血压所致脑卒中目前尚无针对性的有效治疗方法,因此,开发新药物对治疗自发性高血压相关脑卒中具有重要意义。白术内酯Ⅲ(A Ⅲ)是一种天然草本生物活性化合物,具有抗炎和神经保护作用[4]。既往研究[5]发现, A Ⅲ可减轻异氟烷诱导的大鼠海马神经元损伤,表明A Ⅲ对脑具有保护作用,但A Ⅲ能否治疗自发性高血压大鼠(SHR)脑卒中尚不明确。相关研究[6-7]表明,自发性高血压患者血浆中miRNA-296-5p表达水平显著高于非自发性高血压患者,且A Ⅲ通过上调微小RNA-296-5p(miR-296-5p)而抑制人肝癌细胞生长并诱导其凋亡。本研究探讨A Ⅲ对SHR脑卒中的影响及其分子机制,现报告如下。
1 材料与方法
1.1 实验动物
雄性SPF级SD大鼠12只, 6周龄,体质量200~210 g, 购自导科医药技术(广东)有限公司,生产许可证号为SCXK(粤)2022-0060。雄性SPF级SHR共96只, 6周龄,体质量200~210 g, 购自北京维通利华实验动物技术有限公司。本研究动物实验均已获得本院动物伦理委员会审核批准。
1.2 主要试剂
A Ⅲ(规格1 g, 纯度≥98%)购自深圳虹彩祥根生物科技有限公司; miR-296-5p激动剂(miR-296-5p agomir)及其阴性对照品(agomir NC)购自百奥迈科生物技术有限公司; 尼莫地平购自北京凯诗源生物科技有限公司。
1.3 SHR脑卒中模型构建
使6周龄SHR连续2个月自由饮用0.9%氯化钠溶液,然后给予1%氯化钠溶液喂养,若SHR出现肢体抽动、瘫痪、全身震颤、软瘫甚至死亡等症状中的1种,则视为SHR脑卒中模型构建成功[8]。本实验建模成功率为100%, 建模过程中未出现大鼠死亡情况。
1.4 动物分组及处理
按照随机数字表法将模型大鼠分为模型组(Model组)、A Ⅲ低剂量组(A Ⅲ-L组)、A Ⅲ高剂量组(A Ⅲ-H组)、阳性药物尼莫地平组(Nim组)、miR-296-5p激动剂组(miR-296-5p agomir组)、agomir NC组、A Ⅲ-H+miR-296-5p agomir组、A Ⅲ-H+agomir NC组,每组12只。A Ⅲ-L组、A Ⅲ-H组大鼠分别尾静脉注射2.22、6.66 mg/kg A Ⅲ, 且腹腔注射等量生理盐水[9]; Nim组大鼠腹腔注射1 mg/kg尼莫地平,且尾静脉注射等量生理盐水[10]; agomir NC组、miR-296-5p agomir组大鼠分别尾静脉注射300 μg agomir NC、300 μg miR-296-5p agomir, 腹腔注射等量生理盐水[11]; A Ⅲ-H+agomir NC组大鼠尾静脉注射6.66 mg/kg A Ⅲ和300 μg agomir NC, 腹腔注射等量生理盐水; A Ⅲ-H+miR-296-5p agomir组大鼠尾静脉注射6.66 mg/kg A Ⅲ和300 μg miR-296-5p agomir, 腹腔注射等量生理盐水; Model组大鼠腹腔注射等量生理盐水,尾静脉注射等量生理盐水。将正常饲养的12只SD大鼠设为对照组(NC组),分别腹腔注射和尾静脉注射等量生理盐水。各组大鼠给药1次/d, 持续6周。
1.5 观察指标
1.5.1 大鼠神经症状评分: 参照文献[10]进行大鼠神经症状评分。0分表示大鼠正常; 1分表示大鼠少动或轻度激惹; 2分表示单侧前肢或头抽动,时跳时窜; 3分表示大鼠单侧肢体瘫痪,行走困难; 4分表示大鼠四肢瘫痪,不能站立。
1.5.2 大鼠平均动脉压: 将大鼠固定于血压计配套的保温套中,待血压监测界面的脉搏波趋于稳定时,使用智能无创血压计测定尾动脉血压。
1.5.3 大鼠存活时间: 从给药第1天开始,每天统计各组大鼠生存情况直至末次给药结束,若出现死亡,记录大鼠存活时间。
1.5.4 大鼠血小板黏附率: 末次处理24 h后,将所有大鼠经腹主动脉取血,收集血液,使用XSN-R型血小板黏附-体外血栓两用仪检测各组大鼠血小板黏附率。
1.5.5 大鼠脑组织海马CA1区病理变化: 采用苏木素-伊红(HE)染色法检测。于大鼠死后或卒中后6周处死后,立即取海马CA1区脑组织。各组随机选取6只大鼠的海马CA1区脑组织固定于4%多聚甲醛中,将组织标本包埋于石蜡中,用切片机切成5 μm切片后进行HE染色,使用光学显微镜观察脑组织海马CA1区病理变化。
1.5.6 大鼠脑组织海马CA1区miR-296-5p表达: 采用实时荧光定量聚合酶链反应(qRT-PCR)检测miR-296-5p表达。取各组剩余6只大鼠的海马CA1区脑组织,利用TRIzol试剂提取脑组织匀浆总RNA。将RNA逆转录为cDNA后,以cDNA为模板进行qRT-PCR[12-13]。qRT-PCR反应条件为95 ℃预变性30 s, 95 ℃变性5 s, 60 ℃退火30 s, 72 ℃延伸1 min, 共45个循环。以U6为内参基因,通过2-△△Ct法计算miR-296-5p相对表达水平。U6正向引物(5′-3′)为CTCGCTTCGGCAGCACA,反向引物(5′-3′)为AACGCTTCACGAATTTGCGT; miR-296-5p正向引物(5′-3′)为GTATCCAGTGCAGGGTCCGA, 反向引物(5′-3′)为CGACGAGGGCCCCCCCT。
1.6 统计学分析

2 结 果
2.1 A Ⅲ对大鼠神经症状评分和平均动脉压的影响
与NC组比较,Model组大鼠神经症状评分、平均动脉压升高,差异有统计学意义(P<0.05); 与Model组比较, A Ⅲ-L组、A Ⅲ-H组、Nim组大鼠神经症状评分、平均动脉压降低,差异有统计学意义(P<0.05); 与A Ⅲ-L组比较, A Ⅲ-H组、Nim组大鼠神经症状评分、平均动脉压降低,差异有统计学意义(P<0.05); 与Model组、agomir NC组比较, miR-296-5p agomir组大鼠神经症状评分、平均动脉压升高,差异有统计学意义(P<0.05); 与A Ⅲ-H组、A Ⅲ-H+agomir NC组比较, A Ⅲ-H+miR-296-5p agomir组大鼠神经症状评分、平均动脉压升高,差异有统计学意义(P<0.05), 见表1。

表1 各组大鼠神经症状评分和平均动脉压比较
2.2 A Ⅲ对大鼠存活时间和血小板黏附率的影响
与NC组比较, Model组大鼠存活时间缩短,血小板黏附率升高,差异有统计学意义(P<0.05); 与Model组比较, A Ⅲ-L组、A Ⅲ-H组、Nim组大鼠存活时间延长,血小板黏附率降低,差异有统计学意义(P<0.05); 与A Ⅲ-L组比较, A Ⅲ-H组、Nim组大鼠存活时间延长,血小板黏附率降低,差异有统计学意义(P<0.05); 与Model组、agomir NC组比较, miR-296-5p agomir组大鼠存活时间缩短,血小板黏附率升高,差异有统计学意义(P<0.05); 与A Ⅲ-H组、A Ⅲ-H+agomir NC组比较,A Ⅲ-H+miR-296-5p agomir组大鼠存活时间缩短,血小板黏附率升高,差异有统计学意义(P<0.05), 见表2。

表2 各组大鼠存活时间和血小板黏附率比较
2.3 A Ⅲ对大鼠海马CA1区病理损伤的影响
HE染色结果显示, NC组大鼠海马CA1区神经元结构正常; Model组大鼠海马CA1区神经元结构紊乱,核固缩,神经元数量减少; 与Model组比较, A Ⅲ-L组、A Ⅲ-H组、Nim组大鼠海马CA1区病理损伤减轻; 与Model组、agomir NC组比较, miR-296-5p agomir组大鼠海马CA1区病理损伤加剧; 与A Ⅲ-H组、A Ⅲ-H+agomir NC组比较, A Ⅲ-H+miR-296-5p agomir组大鼠海马CA1区病理损伤严重,见图1。
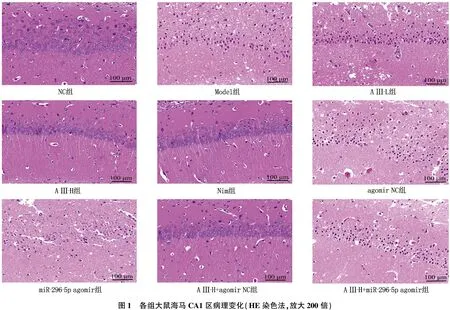
2.4 A Ⅲ对大鼠脑组织海马CA1区miR-296-5p表达的影响
与NC组比较, Model组大鼠海马CA1区miR-296-5p表达升高,差异有统计学意义(P<0.05); 与Model组比较, A Ⅲ-L组、A Ⅲ-H组、Nim组大鼠海马CA1区miR-296-5p表达降低,差异有统计学意义(P<0.05); 与A Ⅲ-L组比较, A Ⅲ-H组、Nim组大鼠海马CA1区miR-296-5p表达降低,差异有统计学意义(P<0.05); 与Model组、agomir NC组比较, miR-296-5p agomir组大鼠海马CA1区miR-296-5p表达升高,差异有统计学意义(P<0.05); 与A Ⅲ-H组、A Ⅲ-H+agomir NC组比较,A Ⅲ-H+miR-296-5p agomir组大鼠海马CA1区miR-296-5p表达升高,差异有统计学意义(P<0.05), 见表3。

表3 各组大鼠脑组织海马CA1区miR-296-5p表达比较
3 讨 论
SHR是目前国际公认的最接近于人原发性高血压的动物模型,也是药物筛选及基础研究的首选动物模型[14]。本研究通过高盐喂养SHR构建SHR脑卒中模型,结果显示,与NC组比较, Model组大鼠神经症状评分、平均动脉压升高,存活时间缩短,海马CA1区病理损伤严重,表明SHR脑卒中模型构建成功。血小板黏附是指血小板可黏附于其他异物表面的特性,在正常生理情况下,血小板不与完整的血管内皮发生黏附,病理状态下血小板则可黏附至内皮下基质中的胶原上,进而引发脑血管病变[15]。本研究发现, Model组大鼠血小板黏附率显著高于NC组,再次证实Model组大鼠存在脑血管病变。
A Ⅲ是从白术中发现的主要生物活性成分,已被证实具有抗氧化、抗肿瘤、抗过敏反应、抗菌作用和认知保护作用[16-17]。A Ⅲ可抑制脂多糖诱导的小鼠小胶质细胞炎症反应[18], 可保护原代培养的神经元免受同型半胱氨酸处理诱导的细胞凋亡[19],可减轻神经炎症而改善小鼠脑缺血情况[20]。本研究结果显示, A Ⅲ可降低脑卒中SHR的神经症状评分、平均动脉压、血小板黏附率,延长存活时间,减轻海马CA1区病理损伤,且A Ⅲ剂量越高,对应指标的变化趋势越显著,表明A Ⅲ可减轻SHR脑卒中,或可成为治疗自发性高血压诱发脑卒中的潜在有效药物。
既往研究[21]显示, A Ⅲ可通过调控miR-466c-5p表达而抑制过氧化氢诱导的大鼠骨髓间充质干细胞成脂分化。为了进一步探究A Ⅲ影响SHR脑卒中的分子机制,本研究团队对与自发性高血压相关的文献进行搜索,发现miR-296-5p表达与非洲绿猴的自发性高血压有关[22], 且脑缺血损伤可刺激miR-296表达水平逐渐上调[23], 表明miR-296-5p可能与SHR脑卒中有关。本研究结果显示, Model组大鼠脑组织海马CA1区miR-296-5p表达高于NC组,且相较于Model组、agomir NC组, miR-296-5p agomir组大鼠海马CA1区miR-296-5p表达升高,神经症状评分、平均动脉压、血小板黏附率升高,存活时间缩短,海马CA1区病理损伤加剧,表明miR-296-5p确实参与了SHR脑卒中过程。本研究还发现, A Ⅲ可抑制脑卒中SHR海马脑组织CA1区miR-296-5p表达,且A Ⅲ剂量越高,抑制作用越显著,推测A Ⅲ可能通过抑制miR-296-5p表达减轻SHR脑卒中。为了验证该猜想,本研究在高剂量A Ⅲ作用的基础上加用miR-296-5p agomir干预脑卒中SHR[24], 结果显示, miR-296-5p agomir减弱了高剂量A Ⅲ对SHR脑卒中的改善作用,证实了猜想的正确性,即A Ⅲ可能通过抑制miR-296-5p表达而减轻SHR脑卒中。
综上所述, A Ⅲ可能通过抑制miR-296-5p表达对SHR脑卒中起到治疗作用,但A Ⅲ对SHR脑卒中的改善作用可能还涉及其他通路,有待未来深入开展后续研究加以探讨。
