蒙药额日敦·乌日勒对急性脊髓损伤大鼠神经元凋亡的影响及机制研究
2023-12-19哈斯巴拉道日娜郝建彬
飞 翔, 哈斯巴拉, 道日娜, 郝建彬
(1. 内蒙古自治区鄂尔多斯市中心医院 骨科, 内蒙古 鄂尔多斯, 017000;2. 内蒙古自治区鄂尔多斯市蒙医医院 消化病科, 内蒙古 鄂尔多斯, 017000)
急性脊髓损伤(SCI)易导致损伤平面以下的感觉、运动和自主神经功能丧失甚至瘫痪[1], 目前除了支持治疗和紧急手术以外尚无有效治疗方法,SCI后神经修复仍是医学界亟待解决的难题[2]。SCI区域炎症细胞浸润,脊髓微环境处于严重应激状态,多种不利因素导致脊髓周围神经元变性凋亡,严重影响患者肢体运动功能[3-4]。因此,挽救凋亡神经元是治疗SCI的重要策略。蒙药额尔敦·乌日勒(EW)又名珍宝丸,由多种名贵药材组成,对脑瘫、脑溢血、半身不遂、认知能力减退等神经系统疾病疗效显著,是历史悠久的代表性珍贵蒙药方剂[5]。EW具有抗炎、抑制细胞凋亡和氧化应激、促进脊髓神经元修复等药理作用,可有效干预SCI, 改善轴突生长微环境[6-7]。蛋白酪氨酸激酶(JAK)/信号转导和转录激活因子(STAT)通路是近年来备受关注的细胞内信号传导途径,多项研究[8-9]发现SCI可异常激活JAK2/STAT3信号通路,引发细胞凋亡。然而,EW是否通过抑制细胞凋亡在SCI中发挥作用目前尚未明确。本研究采用改良Allen法建立大鼠急性SCI模型,以期探讨EW对急性SCI的治疗潜力和调控机制。
1 材料与方法
1.1 实验动物
90只清洁级雄性SD大鼠, 8~10周龄,体质量240~260 g, 购自北京华阜康实验动物有限公司。将大鼠置于12 h光照与12 h黑暗交替循环的环境中(室温约25 ℃, 相对湿度约50%)自由饮食,适应性饲养1周后进行实验。本研究实验程序符合动物伦理标准,且经鄂尔多斯市中心医院伦理委员会审核批准。
1.2 仪器与试剂
额日敦·乌日勒(批号Z15020410, 内蒙古蒙药股份有限公司); JAK2抑制剂AG490(批号T3434, 美国Sigma公司); 原位缺口末端标记法(TUNEL)细胞凋亡检测试剂盒(批号11684817910, 瑞士Roche Applied Science公司); BCA蛋白定量试剂盒(批号CW0014, 上海碧云天); 苏木素-伊红(HE)染色试剂盒(批号G1120, 北京索莱宝); 抗Cleaved caspase-3、B淋巴细胞瘤-2(Bcl-2)、Bcl-2关联X蛋白(Bax)、磷酸化(p)-JAK2、p-STAT3抗体(批号分别为9661S、3498S、14796S、3776S、9145S, 美国CST公司); 抗β-actin抗体(批号A5441, Sigma公司); 辣根过氧化物酶(HPR, 批号PAB150011, 美国Bio-swamp公司)。正置光学显微镜(型号Ni-E, 日本尼康),数码显微成像系统(型号DS-Ri1-U3,日本尼康)。
1.3 方法
1.3.1 动物分组及SCI模型制备: 将实验大鼠随机分为假手术组(sham组)、SCI组、EW低剂量组、EW中剂量组、EW高剂量组和EW高剂量+AG490组,每组15只。将大鼠术前禁食12 h, 以2.5%戊巴比妥钠腹腔注射麻醉,俯卧位固定于小动物手术台上,背部中线纵向切口暴露T9~T11节段棘突,显微镜下剥离椎旁肌肉,暴露棘突与椎板,切除T10椎板。采用改良Allen法构建大鼠SCI模型[10],固定脊柱后,将10 g砝码从3 cm高度自由落体损伤T10节段,脊髓出血、后肢伸直延迟和尾摆动提示模型建立成功。sham组大鼠仅切开椎板后缝合。SCI模型建立成功后,EW低剂量组、EW中剂量组、EW高剂量组分别于术后给予EW混悬液0.32、0.63、1.26 g/kg灌胃, sham组、SCI组仅给予等量蒸馏水灌胃, 2次/d, 连续给药2周。药物剂量根据临床使用EW剂量确定[11], EW中剂量是人类剂量的7倍, EW低剂量是EW中剂量的0.5倍, EW高剂量是EW中剂量的2倍。
1.3.2 脊髓损伤运动评分法(BBB)评估大鼠后肢运动功能: 分别于SCI术后1、3、7、14 d通过BBB量表对各组大鼠损伤后神经功能恢复情况进行评分[12]。将大鼠后肢运动分为22个等级,评分范围为0分(完全瘫痪)~21分(运动正常)。双盲模式下对每只大鼠进行评分,时间为4 min, 2名实验者对照评分表独立评分后取平均值。
1.3.3 脊髓含水量检测: 处死大鼠,取骨髓组织,称得湿质量后,立即置于65 ℃烘箱中,烘烤48 h, 称得干质量,每个样本连续称量3次,取平均值,计算损伤节段脊髓湿质量/干质量比值。
1.3.4 脊髓病理学观察: 分离大鼠脊髓组织,室温下用10%多聚甲醛固定24 h, 石蜡包埋后制备5 μm切片。室温下用二甲苯和乙醇(70%、90%、100%)依次脱蜡水合,苏木素染色5 min, 流水反蓝,伊红染色1 min。用70%乙醇冲洗,光镜下评估脊髓形态学变化。
1.3.5 TUNEL染色法检测神经元凋亡情况: 采用TUNEL凋亡检测试剂盒检测脊髓组织中凋亡细胞,组织切片用Triton-X 100洗涤并渗透,然后用磷酸盐缓冲液(PBS)洗涤。将脊髓组织切片浸入TUNEL检测反应混合液中,室温孵育。荧光显微镜下观察凋亡细胞的局部绿色荧光。
1.3.6 蛋白质印迹法(Western blot)检测脊髓组织Cleaved caspase-3、Bax、Bcl-2、JAK2/STAT3蛋白表达: 使用RIPA蛋白裂解液裂解脊髓组织,并使用二喹啉甲酸(BCA)蛋白检测试剂盒进行浓度定量。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离40 μg蛋白,湿转至聚偏氟乙烯(PVDF)膜上,5%脱脂牛奶封闭1 h; 分别加入Cleaved caspase-3(1∶200)、Bax(1∶200)、Bcl-2(1∶200)、p-JAK2(1∶300)、p-STAT3(1∶300)和β-actin(1∶1 000)一抗4 ℃孵育过夜。次日,加入HRP山羊抗兔IgG二抗(1∶10 000)37 ℃孵育1 h, 然后使用红外成像扫描仪对条带进行可视化分析。
1.4 统计学分析

2 结 果
2.1 各组大鼠运动功能恢复情况比较
术后各时点, SCI组、EW低剂量组、EW中剂量组、EW高剂量组大鼠BBB评分均低于sham组,差异有统计学意义(P<0.05); 术后1 d时,EW低剂量组、EW中剂量组、EW高剂量组大鼠BBB评分与SCI组比较,差异均无统计学意义(P>0.05); 术后3 d时, EW中剂量组、EW高剂量组BBB评分均高于SCI组、EW低剂量组,且EW高剂量组BBB评分高于EW中剂量组,差异有统计学意义(P<0.05); 术后7、14 d时,EW低剂量组、EW中剂量组、EW高剂量组大鼠BBB评分均高于SCI组,且BBB评分升高具有剂量依赖性,差异有统计学意义(P<0.05), 见表1。

表1 各组大鼠脊髓损伤运动评分法评分比较 分
2.2 各组大鼠脊髓含水量情况比较
SCI组大鼠脊髓组织湿质量/干质量比值大于sham组,差异有统计学意义(P<0.01); EW低剂量组、EW中剂量组、EW高剂量组大鼠脊髓组织湿质量/干质量比值均小于SCI组,差异有统计学意义(P<0.05或P<0.01), 见表2。

表2 各组大鼠脊髓湿质量/干质量比值比较
2.3 各组大鼠脊髓组织病理形态学比较
HE染色结果显示, sham组脊髓结构完整,神经元形态正常; 与sham组相比, SCI组大鼠脊髓的损伤程度严重,结构紊乱,水肿、出血和中性粒细胞浸润明显; EW低剂量组、EW中剂量组、EW高剂量组神经元变性数量减少,组织相对完整,且脊髓的损伤程度随着EW剂量增加而逐渐减轻,见图1。
2.4 各组大鼠脊髓组织神经元细胞凋亡情况比较
SCI组大鼠脊髓神经元细胞凋亡率高于sham组,差异有统计学意义(P<0.01); EW低剂量组、EW中剂量组、EW高剂量组大鼠脊髓神经元细胞凋亡率均低于SCI组,差异有统计学意义(P<0.01), 见图2。


A: TUNEL实验结果(TUNEL染色法,放大400倍; 凋亡阳性细胞核呈绿色荧光,正常细胞核呈蓝色); B: 各组大鼠(每组5只)脊髓神经元细胞凋亡率比较(与SCI组比较, ∗∗P<0.01; 与sham组比较, ##P<0.01)。图2 各组大鼠脊髓组织神经元细胞凋亡情况比较
2.5 各组大鼠脊髓组织凋亡相关蛋白表达比较
Western blot检测结果显示,与sham组相比, SCI组大鼠脊髓组织Cleaved caspase-3、Bax蛋白表达升高, Bcl-2蛋白表达降低,差异有统计学意义(P<0.01); 相较于SCI组, EW低剂量组、EW中剂量组、EW高剂量组Cleaved caspase-3、Bax蛋白表达逐渐降低, Bcl-2蛋白表达逐渐升高,差异有统计学意义(P<0.01),见图3、表3。


表3 各组大鼠脊髓组织凋亡蛋白相对表达量比较

表4 各组大鼠脊髓组织p-JAK2和p-STAT3蛋白相对表达量比较
2.6 EW对SCI大鼠脊髓组织p-JAK2、p-STAT3蛋白表达的影响
Western blot检测结果显示, SCI组大鼠脊髓p-JAK2、p-STAT3蛋白表达高于sham组,差异有统计学意义(P<0.01); 相较于SCI组,EW低剂量组、EW中剂量组、EW高剂量组大鼠脊髓组织p-JAK2、p-STAT3蛋白表达逐渐降低,差异有统计学意义(P<0.01), 见图4、表4。
2.7 EW通过JAK2/STAT3信号通路抑制神经元凋亡
与sham组相比,SCI组大鼠脊髓组织p-JAK2、p-STAT3、Bax、Cleaved caspase-3蛋白表达上调, Bcl-2蛋白表达下调,差异有统计学意义(P<0.01); 与SCI组相比, EW高剂量组大鼠脊髓组织p-JAK2、p-STAT3、Bax、Cleaved caspase-3蛋白表达下调, Bcl-2蛋白表达上调,差异有统计学意义(P<0.01); 与EW高剂量组相比, EW高剂量+AG490组大鼠脊髓组织p-JAK2、p-STAT3、Bax、Cleaved caspase-3蛋白表达下调, Bcl-2蛋白表达上调,差异有统计学意义(P<0.01), 见图5、表5。
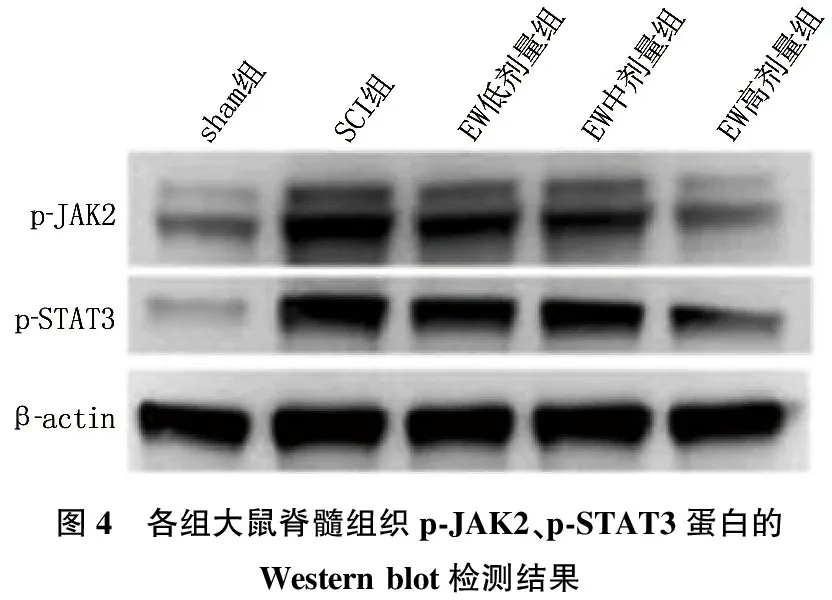

表5 各组大鼠神经元凋亡通路相关蛋白相对表达量比较
3 讨 论
急性SCI来源于脊髓的直接或间接损伤,具有较高的致残率和致死率,可给患者及其家庭和社会带来巨大负担[1]。SCI的发病机制复杂,目前尚未被完全阐明,但已有研究[13]证实SCI的发生发展过程涉及一系列分子和细胞事件,包括细胞凋亡、自噬和炎症。减轻继发性并发症是目前SCI治疗领域的研究热点之一,而可逆性神经元凋亡作为SCI的主要细胞死亡机制,与患者最终的神经功能损伤程度密切相关。本研究建立大鼠SCI模型,旨在探讨蒙药EW对SCI的治疗作用及其可能机制。

蒙医理论认为SCI属于“萨病”“白脉病”范畴,损伤使得脊髓组织局部环境发生改变,引起体内三根失调,以琪素、协日亢盛,赫依与琪素相搏,气血运行、流通障碍为基本病机,骤然上冲于脑,继而损伤脑部黑脉并引起白脉之海——脑缺血受损而致病[5]。蒙医治疗该病以调理三根、通脉活络、散瘀活血、恢复白脉为原则[14]。EW由木香、丁香、降香、紫檀香、麝香、高良姜红花等30多味蒙药组成,具有舒筋活络、安神、燥黄水、清陈旧热等功能,是目前临床治疗白脉病的首选药物[15]。多项临床和基础研究[16-19]表明EW治疗对神经系统损伤后的神经修复具有显著促进作用,但目前鲜有关于EW对急性SCI模型大鼠作用及机制的研究报道。本研究结果显示, SCI大鼠经EW灌胃治疗后运动功能逐渐恢复,且随着治疗剂量的增加和治疗时间的延长, SCI治疗组大鼠BBB评分逐渐增高, SCI程度亦逐渐减轻,提示EW治疗或可发挥一定的神经修复作用。
越来越多的研究[20-21]表明, SCI后脊髓微环境损伤甚至神经元细胞死亡可能是患者后续残疾和死亡的主要原因,其中细胞凋亡是SCI的核心因素。研究[22]发现,患者SCI 4 h后,多种损伤刺激可导致大量神经元凋亡和功能失调,并引起Bax、caspase和Bcl-2等凋亡调节蛋白表达紊乱。EMERY E等[23]对15例伤后3 h至2个月死亡患者的脊髓进行病理学检测发现,神经元凋亡参与了人SCI后的继发性损伤过程,且凋亡细胞主要集中于损伤中心的边缘和邻近的白质中。李璟璐等[24]对给予凋亡相关斑点样蛋白寡聚阻断剂的SCI小鼠进行转录组分析发现,阻断凋亡可通过抑制炎症小体相关基因的表达直接或间接导致SCI急性期基因表达受抑制。由此表明,有效抑制神经元凋亡可为防治SCI开辟一条崭新途径。本研究进一步发现, EW可减少SCI大鼠TUNEL染色阳性神经元细胞的数量,提示EW可抑制SCI大鼠的细胞凋亡。此外,经EW处理后,促凋亡蛋白Bax、Cleaved caspase-3表达下调,抗凋亡蛋白Bcl-2表达上调,提示EW治疗可显著抑制SCI后脊髓神经元凋亡,并有效调控凋亡相关蛋白的表达。
JAK/STAT信号通路参与细胞免疫、分化、死亡和肿瘤发生等过程, JAK2与其特异性底物STAT3结合形成二聚体/四聚体并穿过核膜,特异性结合DNA上的反应元件并随后转录下游靶基因,调节多种细胞活动过程[25]。研究[26]发现, SCI早期病理改变可能涉及神经元炎症反应、自噬、凋亡以及JAK2/STAT3信号通路的活化,而靶向阻断JAK2/STAT3通路可明显减轻大鼠中枢和外周神经组织创伤或缺血损伤,抑制神经元凋亡,改善神经功能。陈霄雷等[27]研究指出, SCI可异常激活JAK2/STAT3信号通路,应用JAK2磷酸化抑制剂AG490干预可抑制细胞凋亡,促进大鼠双下肢运动功能恢复。张睿等[28]发现,依达拉奉处理可抑制JAK2/STAT3信号通路激活,减少脊髓继发损伤所致细胞凋亡,起到神经保护作用。XIAO S N等[29]发现,山姜素通过靶向JAK2/STAT3信号通路而抑制SCI后神经炎症和神经细胞凋亡,提示JAK2/STAT3通路在SCI发生和发展过程中发挥重要作用。本研究检测JAK2/STAT3通路相关蛋白表达后发现, p-JAK2、p-STAT3在sham组脊髓组织中几乎不表达, SCI组大鼠脊髓组织JAK2/STAT3信号明显激活,而不同剂量EW治疗组p-JAK2、p-STAT3蛋白表达均低于SCI组且具有剂量依赖性,给予JAK2抑制剂AG490则可进一步改善EW的治疗效果,提示SCI后JAK2/STAT3信号通路激活, EW治疗则可通过抑制JAK2/STAT3信号通路而改善SCI大鼠的预后。
综上所述,蒙药EW对急性SCI大鼠神经功能具有保护作用,这可能与EW调控JAK2/STAT3信号通路而抑制神经元细胞过度凋亡有关。
