两性离子聚合物改性抗污染棉签拭子检测牛奶中的沙门氏菌
2023-12-16黄荟娴匡韵迪张馨匀贺晓云黄昆仑
黄荟娴,匡韵迪,张馨匀,贺晓云,2,黄昆仑,2,程 楠,2*
(1 中国农业大学食品科学与营养工程学院 食品质量与安全北京实验室 北京100083 2 农业农村部农业转基因生物安全评价(食用)重点实验室 北京100083 3 柳州职业技术学院 环境与食品工程学院 广西柳州 545006)
在食源性病原体中,沙门氏菌是与食源性疾病和最终死亡相关较常见的病原体之一。沙门氏菌是一种杆状革兰氏阴性菌,属于肠杆菌科,有超过2 500 种血清型,所有这些血清型都可以引起人类疾病[1]。《食品安全国家标准 预包装食品中致病菌限量》(GB 29921-2021)中明确规定25 g 或25 mL 食品样品中不得检出沙门氏菌[2]。然而,沙门氏菌极易污染肉、蛋、奶等食品,通常当沙门氏菌只有一个菌落单位形成时,即可引起人类感染,其致病限度极低,传播力强,防控难度大,这对食品沙门氏菌污染物的防控提出了更高的要求[3]。沙门氏菌检测的传统方法(GB 4789.4-2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》)[4]一般需要3~5 d,周期长,过程繁琐,有时还出现假阴性,难以适应食品检验中快速、简便、准确率高的要求。
生物传感器作为一种简便、灵敏、低成本的分析手段,为食品安全快速检测特别是病原体、蛋白质、重金属及抗生素等提供了有效的保障[5-6]。然而,在检测复杂样品过程中往往存在基质的干扰,导致生物传感器的检测灵敏度和结果科学性受到影响。近年来,采用聚乙二醇[7]、两性离子[8]、多肽[9]等抗污染材料改性生物传感器的研究受到越来越多的关注[10]。抵抗复杂样品基质中的干扰,提高传感器的检测灵敏度和特异性,保障最终检测结果的科学性和可靠性,抗污染生物传感器在快速检测领域的开发和应用显得尤为重要[11]。目前,生物传感器在检测复杂样品过程中的技术难点之一在于基质的干扰[12]。不同检测样品中的复杂性也有所不同,如食品样品中常见的干扰基质为食品成分(蛋白质、脂类、碳水化合物、水、维生素、矿物质分子、低分子添加剂等)[13]。干扰基质的存在可能导致传感器检测结果出现偏差,信号强度减弱,特异性识别反应失效等问题。为了抵抗复杂样品中的基质干扰,提高传感器的检测灵敏度和特异性,研究人员开发出基于抗污染材料的光学[14]、电化学[15]、表面等离子体共振[16]和水凝胶[17]传感器,用于快速检测复杂基质,以保障最终检测结果的科学性和可靠性。
棉签拭子作为一种易获得、易改性、成本低的快速检测元件,已被广泛应用于样品采集、靶标富集和定量检测中[18]。拭子是指小棍的一端利用棉花等纤维材料缠绕成具有吸收能力的小团,另一端可以直接手持的工具,通常用于微生物、脱落细胞或分泌物的采集和检测[19]。由于棉签拭子表面存在丰富的活性羟基基团,具备强大的化学修饰条件,因此近年来许多研究者将拭子与生物分子(如抗体[20]、适配体[21]等)修饰结合,使其作为生物传感检测的组成原件之一。拭子的易获得性、低成本性、便携性、易修饰性,已在检测致病菌[22]、病毒[23]、体液有机物[24]以及环境中危害因子[25]等方面中发挥重要作用,极大提高了现场快速检测的效率。
本研究构建基于抗污染比色拭子的检测平台,蓝色乳胶微球-适配体作为比色信号探针,通过肉眼观察棉签拭子表面颜色变化可得到定性检测结果,利用便携式色差仪配合智能手机得到定量检测结果。通过SBMA 改性棉签拭子,使其具备抗污染特性,避免实际样品检测中复杂基质的干扰,无需样品前处理即可定量检测牛奶中的沙门氏菌。为进一步提升两性离子改性棉签拭子在致病菌超灵敏和现场快检领域中的应用提供参考。
1 材料与方法
1.1 试剂
2-(甲基丙烯酰基氧基)乙基二甲基-(3-磺酸丙基)氢氧化铵(SBMA),阿拉丁公司;2-羟基-4'-(2-羟乙氧基)-2-甲基苯丙酮(Irgacure2595)、牛血清白蛋白(BSA),美国Sigma 公司;10×PBS 缓冲液、Tris-HCl 缓冲液,索莱宝公司;浓硫酸(H2SO4)、盐酸(HCl)、氯化钠(NaCl),均为分析纯级,北京化工厂;高碘酸钠(NaIO4),1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、N-羟基琥珀酰亚胺,均为分析纯级,麦克林公司;HE 琼脂培养基、缓冲蛋白胨水、营养琼脂培养基、平板计数琼脂培养基、3%氯化钠碱性蛋白胨水、沙门氏菌生化鉴定盒,北京陆桥公司;羧基蓝色微球,华泰昕生物公司;BCA 蛋白检测试剂盒,碧云天公司。
1.2 仪器与设备
透射电子显微镜TEM,美国FEI 公司;荧光分光光度计,北京普析通用仪器责任有限公司;超净工作台,苏州苏洁净化设备公司;多用途旋转摇床,海门市其林贝尔仪器制造有限公司;生物安全柜,北京东联哈尔仪器制造有限公司;MLS-3750高压蒸汽灭菌锅,日本SANYO 公司;台式离心机及恒温金属浴,美国Scilogex 公司;分析天平,德国Sartorius 公司;微量移液器,德国Eppendorf 公司;漩涡混合器,江苏其林贝尔仪器制造公司;LS170 色差仪,深圳林上科技有限公司;Mili-Q 超纯水系统,美国Millipore 公司。
1.3 适配体序列(从5'到3')
试验所用适配体信息见表1。

表1 适配体序列Table 1 Aptamer sequences
1.4 试验菌株
试验所用菌株信息见表2。

表2 菌株信息Table 2 Strain information
1.5 试验方法
1.5.1 改性拭子的制备
1.5.1.1 活化棉签 在10 mL 水中加入240 mg高碘酸钠(NaIO4)和100 μL 浓硫酸(H2SO4),混合10 min。然后,将棉签浸泡在该溶液中,在37 ℃黑暗环境中培养4 h,以激活羟基,生成醛基。用蒸馏水清洗被激活的棉签2 次,以去除多余的激活剂。然后,在烘箱中干燥并在4 ℃储存,得到活化棉签。
1.5.1.2 SBMA 棉签 将激活的棉签浸入含558 mg/mL SBMA 和1% Irgacure2595 的PBS 缓冲液中。棉签完全浸泡后,用365 nm UV 灯照射20 min,擦干后保存在4 ℃。
1.5.1.3 SBMA/Aptamer 棉签 在1 mL Tris-HCl缓冲液(pH 8.5)中加入100 μL 10 nmol/L 诱导剂SAT-NH2,将SBMA 棉签浸入该溶液中,在37 ℃下孵育4 h,用Tris-HCl 缓冲液(pH 8.5)洗涤2次。接下来,去除未结合的诱导剂,干燥并储存在4 ℃,得到SBMA/Aptamer 棉签。
1.5.2 实际样品蛋白黏附测定 将未改性棉签、活化棉签、SBMA 棉签和SBMA/Aptamer 棉签分别在牛奶样品(蛋白含量约为30 mg/mL)中浸泡10 min,蒸馏水清洗3 次后,用BCA 蛋白含量测定试剂盒测定残留在棉签上的蛋白质[29]。
1.5.3 蓝色乳胶微球/适配体的合成及表征
1.5.3.1 蓝色乳胶微球的表征 通过透射电子显微镜(TEM)图像确认蓝色乳胶微球的尺寸与形态[30]。
1.5.3.2 蓝色乳胶微球/适配体的合成 将200 μL 蓝色乳胶微球溶液移入1 mL 离心管中并用蒸馏水洗涤3 次,然后加入新制备的EDC(0.57 mg/mL)和NHS(12 mg/mL)进行偶联活化,随后用蒸馏水洗涤微球以除去过量的偶联剂。将蒸馏水中的活化的微球以10 000 r/min 的速度离心10 min后,完全吸出上清液,将20 μL 10 nmol/L 适配体SAT-NH2溶液与280 μL Tris-HCl 缓冲液(pH 8.5)混合均匀后,添加到洗涤过的活化微球中,在4 ℃下孵育过夜以帮助适配体固定在活化的纳米珠上。使用1%牛血清白蛋白(BSA)4 ℃下孵育30 min,封闭纳米颗粒的未结合位点。随后用Tris-HCl 缓冲液(pH 8.5)洗涤纳米珠以去除未连接上的BSA,制备好的蓝色乳胶微球/适配体在4 ℃保存备用。
1.5.3.3 蓝色乳胶微球-适配体的表征 用20 μL 10 nmol/L 适配体FAM-SAT-NH2加入到280 μL Tris-HCl 缓冲液(pH 8.5)中,用荧光分光光度计测定偶联前上清液荧光强度。重复1.5.3.2 节的试验操作,与适配体孵育过夜后离心(1 000 r/min,10 min)测定偶联后上清液荧光强度。得到偶联前、后上清液相对荧光强度差值,计算适配体与蓝色乳胶微球的结合效率。
1.5.4 适配体的筛选 在强亲和力96 孔板中加入100 μL 的沙门氏菌细菌悬浮液,空白组中加入100 μL 的PBS 缓冲溶液,37 ℃下孵育3 h,倒出包被液,用Tris-HCl 缓冲液(pH 8.5)洗涤3 次,除去未结合的细菌。每孔加入100 μL 1% BSA 溶液孵育30 min 封闭未结合位点,缓冲溶液洗涤3 次。加入带有荧光标记的50 μL 适配体溶液(STA1/STA2 浓度:1 μmol/L)室温孵育1 h,倒出后用缓冲液洗涤3 次。加100 μL 缓冲溶液反复吹吸孔内溶液后,吸取混匀的溶液,用荧光分析仪测定荧光强度。
1.5.5 试验条件的优化
1.5.5.1 棉签适配体浓度优化 将制备好的干燥SBMA 棉签分别放到5 管含有1 mL Tris-HCl 缓冲液(pH 8.5)的试管中,每管分别加入100 μL 适配体SAT-NH2(1,10,100,1 000,10 000 nmol/L),37 ℃下孵育4 h,用缓冲液洗涤3 次后烘干,在相同浓度的标准菌液(103CFU/mL)中孵育10 min,Tris-HCl 缓冲液(pH 8.5)清洗2 次后在相同浓度的蓝色乳胶微球/适配体悬浮液中孵育10 min,Tris-HCl 缓冲液(pH 8.5)清洗2 次,然后用色差仪测定棉签的RGB 值,计算得到不同适配体浓度棉签的灰度值变化,确定制备适配体棉签所需的适宜适配体浓度。
1.5.5.2 蓝色乳胶微球适配体浓度优化 将1.5.5.1节中优化好适配体浓度的棉签在相同浓度的标准菌液(105CFU/mL)中孵育10 min,Tris-HCl 缓 冲液(pH 8.5)清洗2 次,分别在1,10,100,1 000,10 000 nmol/L 适配体结合的蓝色乳胶微球悬浮液中孵育10 min,Tris-HCl 缓冲液(pH 8.5)清洗2次,然后用色差仪测定棉签的RGB 值,计算得到在不同适配体浓度蓝色乳胶微球中孵育棉签的灰度值变化,确定制备蓝色乳胶微球/适配体悬浮液所需的适配体浓度。
1.5.5.3 检测时间优化 将在最适适配体浓度条件下,将棉签浸没在标准菌液(106CFU/mL)中孵育5,10,15,20 min,Tris-HCl 缓冲液(pH 8.5)清洗2 次后,在蓝色乳胶微球/适配体悬浮液中孵育5,10,15,20 min,分别得到16 组不同孵育时间的检测棉签,用色差仪测定棉签的RGB 值,计算得到在孵育时间下棉签的灰度值变化,确定最优检测时间。
1.5.5.4 改性前、后对比色信号的影响 将活化棉签在最适适配体浓度条件下37 ℃孵育4 h,烘干,得到未改性棉签。未改性棉签和SBMA/Aptamer 棉签在最优试验条件下,浸没在缓冲液和标准菌液(102CFU/mL)中孵育10 min,Tris-HCl 缓冲液(pH 8.5)清洗2 次后,在蓝色乳胶微球/适配体悬浮液中孵育10 min,用色差仪测定棉签的RGB 值,计算棉签的灰度值得到改性前、后对棉签比色信号的影响。
1.5.6 检测性能分析
1.5.6.1 灵敏度 在最佳试验条件下制备检测棉签,用十倍稀释法配制不同浓度的沙门氏菌溶液,测试所制备棉签的最低检测限(Limit of detection,LOD)。
1.5.6.2 特异性 在最佳试验条件下制备检测棉签,配制菌液浓度均为105CFU/mL 的沙门氏菌、大肠杆菌、志贺氏菌、副溶血性弧菌、金黄色葡萄球菌、蜡样芽孢杆菌以及高温高压灭菌后的沙门氏菌溶液,测试所制备棉签的特异性。
1.5.6.3 牛奶样品的检测 使用从超市获得的牛奶样品,将一定浓度的菌液加入到牛奶中,用HE培养基平板计数法[4]、GB 4789.4-2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》中的检测方法[4]和本研究的比色拭子法分别对相同样品进行检测,将所得结果进行比较分析。
2 结果与分析
2.1 试验原理的设计
该试验利用抗污染比色拭子、蓝色乳胶微球、色差仪,通过夹心法构建了简单、快速、抗污染、灵敏检测牛奶中沙门氏菌的快速检测方法,试验原理见图1。首先将抗污染棉签拭子浸没在牛奶样品中孵育10 min,此时棉签上的适配体能特异性捕获样品中的沙门氏菌,而两性离子SBMA 水凝胶能有效阻碍牛奶中非特异性蛋白的靠近,从而起到抗污染的效果,接着蒸馏水清洗两次以除去未结合的细菌;然后将棉签浸没在适配体/蓝色纳米微球溶液中孵育10 min,此时蓝色纳米微球上的适配体能特异性识别棉签上携带的沙门氏菌从而使棉签肉眼可见变蓝,用蒸馏水清洗2 次以除去未结合的蓝色乳胶微球。将棉签放入暗盒中,利用便携式色差仪读取比色棉签颜色,色差仪通过蓝牙将实时检测数据传入智能手机中,得到抗污染比色棉签的RGB 值,最后通过计算灰度值得到沙门氏菌定量检测结果。
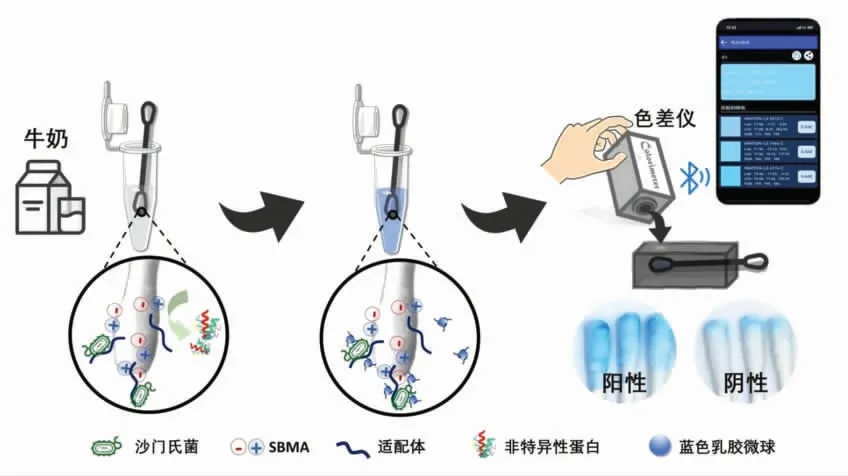
图1 基于色差仪定量的比色拭子检测沙门氏菌的原理图Fig.1 Schematic diagram of colorimetric swab detection of Salmonella based on colorimeter quantification
2.2 蓝色乳胶微球-适配体表征评价
通过TEM 电镜观察(图2),可看到蓝色乳胶微球呈球状,大小均一,平均粒径约为250 nm。

图2 蓝色乳胶微球TEM 电镜图谱Fig.2 TEM image of blue latex microspheres
通过测定偶联前、后蓝色乳胶微球/适配体上清液的荧光强度,如图3 所示,可知偶联前相对荧光强度F1 约为524.29,偶联后上清液相对荧光强度为0,说明适配体偶联成功。
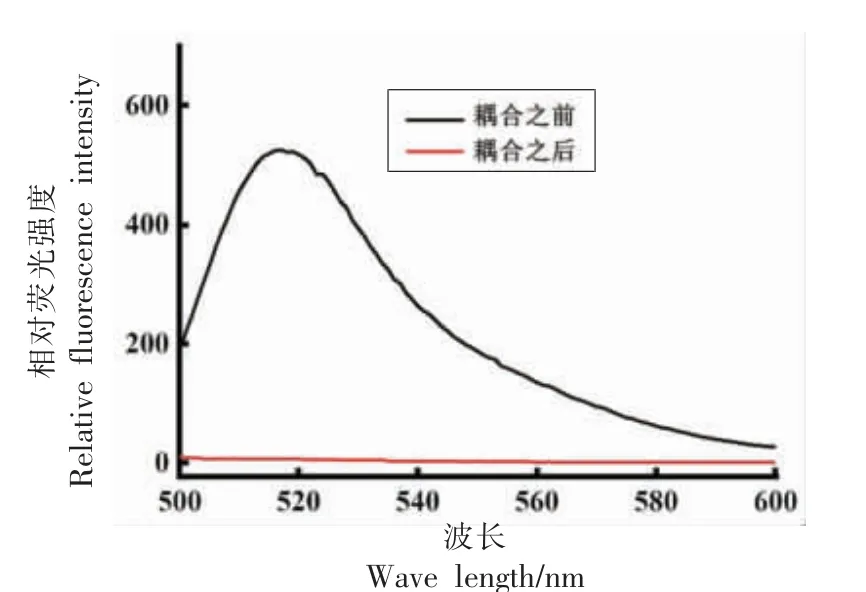
图3 荧光分光光度计分析蓝色乳胶微球-适配体偶联效果Fig.3 Analysis of blue latex microsphere-aptamer coupling effect by fluorescence spectrophotometer
2.3 适配体选择结果
根据先前文献报道[27-28],筛选出2 个沙门氏菌适配体STA1 和STA2,用96 孔板孵育沙门氏菌,通过酶联免疫法用带有荧光基团的适配体测定沙门氏菌与适配体的亲和力。STA1 的亲和结果如图4a 所示,没有孵育菌液的空白组,洗板后荧光相对强度为220.024,沙门氏菌组的相对荧光强度洗板后增加至477.993,STA1 与细菌的结合效率为53.97%。STA2 亲和结果如图4b 所示,空白组洗板后荧光相对强度为239.861,沙门氏菌组的相对荧光强度增加至379.793,结合效率为36.84%。因此,选择结合效率更高的STA1 作为沙门氏菌的识别元件。

图4 荧光分光光度计分析两种适配体与沙门氏菌的结合效果Fig.4 Analysis of the binding effect of two aptamers to Salmonella by fluorescence spectrophotometer
2.4 试验条件优化结果
综合考虑影响比色拭子传感器在检测过程中的关键点,试验中选择以下3 点要素进行体系优化:1)棉签以及蓝色乳胶微球中适配体的浓度;2)检测时间;3)检测孵育方式。试验结果见图5。
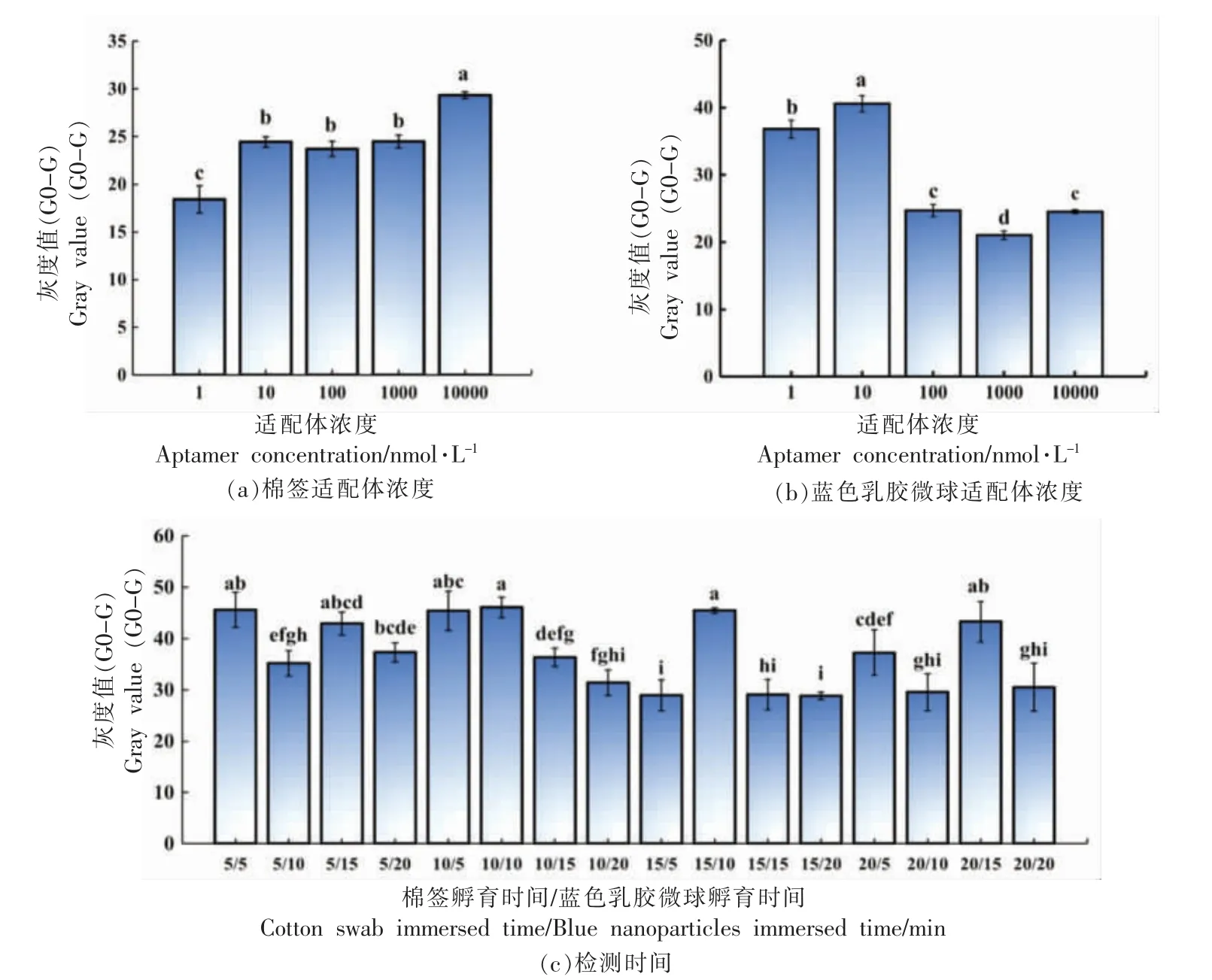
图5 棉签拭子检测沙门氏菌的试验条件优化Fig.5 Optimization of experimental conditions for detection of Salmonella by cotton swabs
对棉签和蓝色乳胶微球的适配体浓度进行优化,由图5a 可知,当棉签适配体浓度为10 nmol/L后灰度值趋于稳定,使用高浓度的适配体确实会使灰度值提高,为节约成本,择优选取低浓度高信号的检测体系。由图5b 可知,当蓝色乳胶微球的适配体浓度为10 nmol/L 时灰度值最高,原因是蓝色乳胶微球上与适配体的结合位点有限,过量的适配体无法与蓝色乳胶微球结合或使微球表面适配体接枝密度过大导致灰度值下降。
对16 组不同孵育时间检测棉签的灰度值进行比较分析,如图5c 所示,虽然5 min 孵育时间能达到较高的灰度值,但在实际试验中,较短时间孵育条件下检测棉签的显色效果肉眼观察不显著,其较低的空白组灰度值提高了整组检测灰度值结果,因此得到的检测结果存在偶然性;而孵育时间过长则达不到快速检测的要求,因此高于30 min的组合时间不予考虑。因此择优选择细菌孵育10 min,蓝色乳胶微球孵育10 min 的检测时间组合。
为了评估SBMA 改性棉签表面在食品复杂基质中的抗污染效果,选择牛奶作为检测体系,利用BCA 蛋白检测试剂盒测试了未改性棉签、活化棉签、SBMA 棉签和SBMA/Aptamer 棉签的蛋白吸附情况。结果如图6a 所示,未改性棉签的OD 值明显高于SBMA 棉签,说明未经改性的棉签中残留大量食品基质中蛋白质,而通过SBMA 改性后的棉签能有效减少检测过程中样品基质蛋白的干扰。在牛奶实际样品中SBMA 改性后的棉签与未改性棉签相比,蛋白含量分别下降41.82%,且添加适配体后均不影响其抵抗蛋白效果,蛋白含量与未改性面前相比下降39.13%,抗蛋白黏附效果显著。
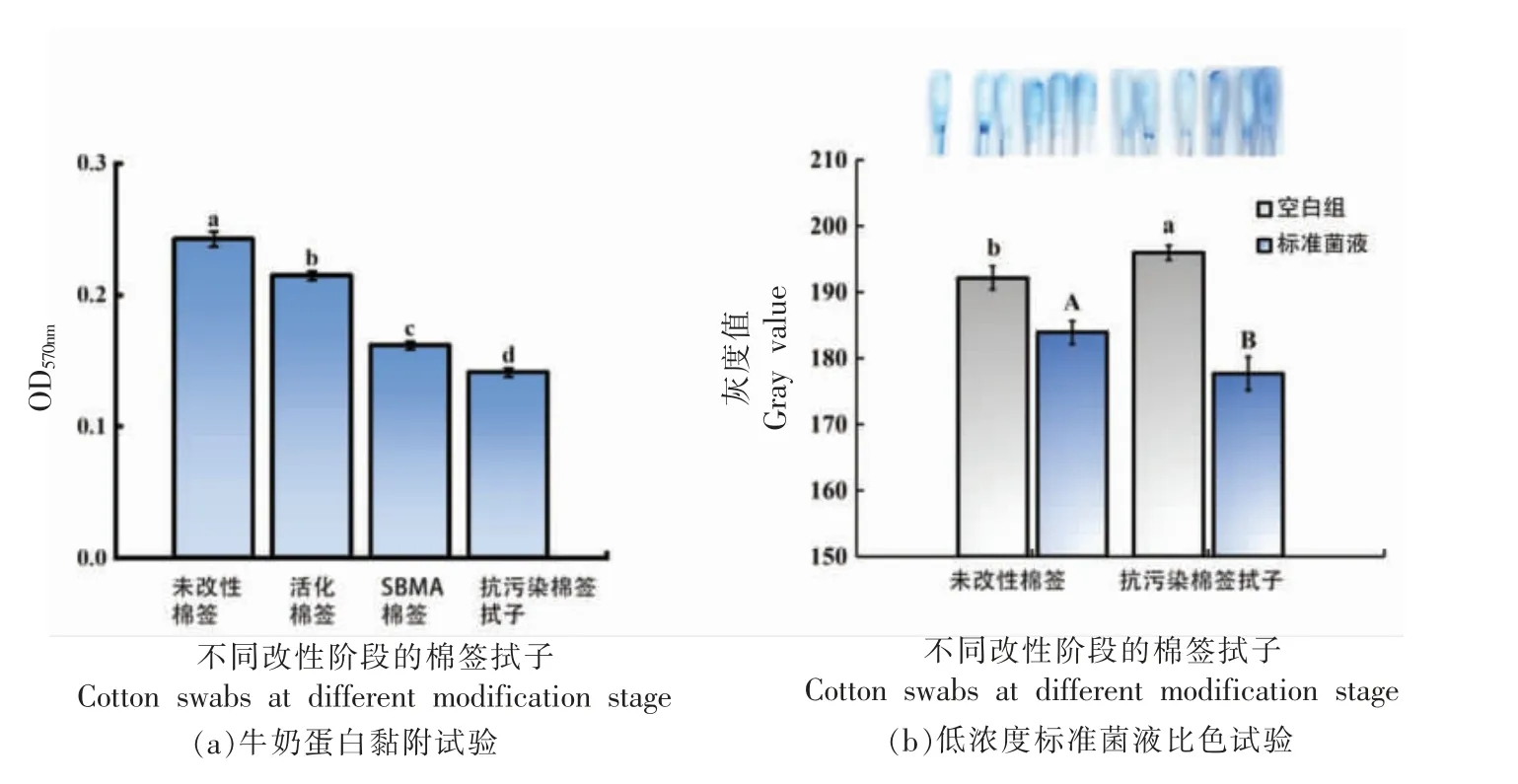
图6 SBMA 改性棉签对比色信号的影响Fig.6 The effect of SBMA modified cotton swabs on contrasting color signals
用未改性的空白棉签和SBMA/Aptamer 棉签检测低浓度标准菌液,观察改性前、后对比色信号的影响。结果由图6b 可得,未改性棉签的空白组灰度值显著低于改性后棉签,且空白组肉眼可见棉签变蓝,说明未改性的棉签易吸附蓝色乳胶微球而产生假阳性结果。检测标准菌液时,改性后的棉签产生的颜色信号显著高于未改性组,且空白组与检测组的差值显著高于未改性棉签,由此可证明,改性后棉签产生的比色信号高于未改性棉签。
2.5 检测性能分析
2.5.1 灵敏度及最低检测限 在最佳试验体系下对传感器灵敏度进行测定,由图7 可知,在细菌浓度达到107CFU/mL 后比色拭子灰度值趋于稳定。细菌浓度在103~107CFU/mL 范围呈线性相关,通过LOD=3.3×σ/S,σ 为空白组的标准差,S 为线性方程斜率,计算得到LOD 为117.80 CFU/mL。

图7 比色拭子传感器检测不同浓度沙门氏菌的灵敏度Fig.7 Sensitivity of a colorimetric swab sensor to detect different concentrations of Salmonella
2.5.2 特异性 在最佳试验体系下,分别对空白组、大肠杆菌、志贺氏菌、副溶血性弧菌、金黄色葡萄球菌、蜡样芽孢杆菌、沙门氏菌、6 种细菌混合菌液(致病菌的菌液浓度均为105CFU/mL)以及高温高压灭菌后的沙门氏菌溶液进行传感器的特异性检测。如图8 所示,传感器对沙门氏菌的响应信号远大于其它致病菌,具有良好的特异性。
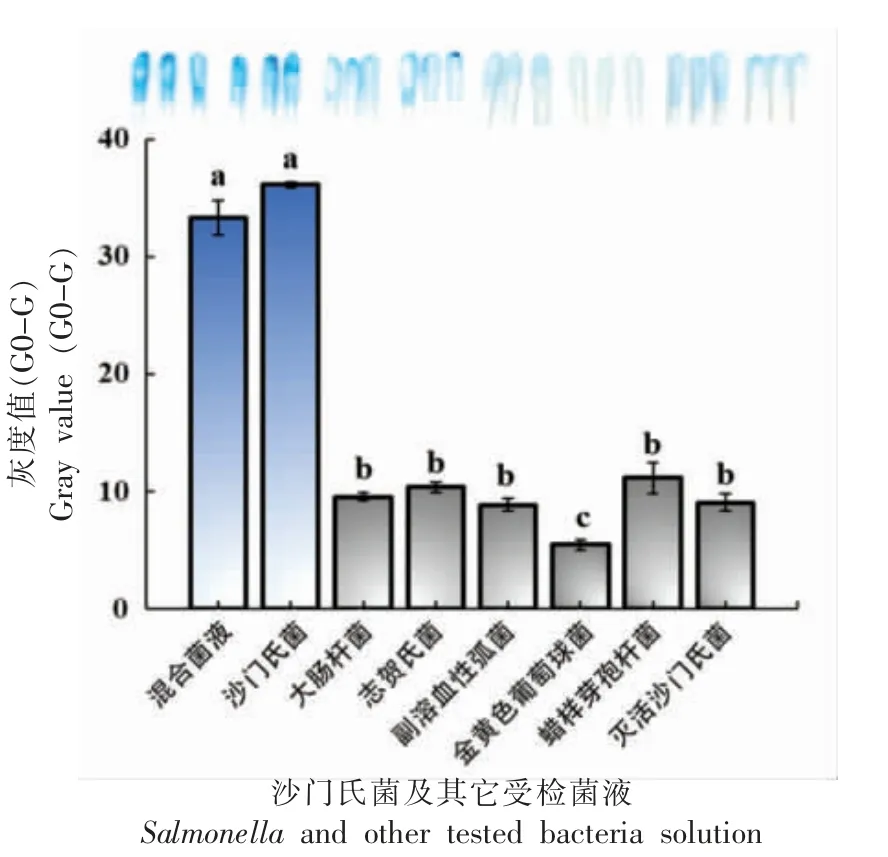
图8 比色拭子传感器检测沙门氏菌的特异性Fig.8 Specificity of a colorimetric swab sensor for detection of Salmonella
2.6 牛奶样品检测
在最佳试验体系下,采用比色拭子对实际样品测试分析。通过人工添加不同浓度沙门氏菌制成实际检测样品。首先通过本传感器进行分析,然后用HE 培养基进行平板计数对比,随后参照GB 4789.4-2016 《食品安全国家标准 食品微生物学检验 沙门氏菌检验》中的检测方法进行验证。结果如表3 所示,国标方法局限于定性检测,对于添加标准菌液的样品均能检出阳性,本方法可在检出限范围内给出具体的定量结果,回收率在94.15%~108.26%,表明该方法具有良好的准确性。

表3 不同检测方法对沙门氏菌污染的牛奶样品的检测Table 3 Detection of Salmonella-contaminated milk samples by different detection methods
3 讨论
在构建的抗污染比色拭子中,识别元件为沙门氏菌特异性适配体,比色信号为“蓝色乳胶微球/适配体”信号探针,抗污染材料为两性离子SBMA,检测过程采用夹心法,通过肉眼可以定性测定牛奶样品中的沙门氏菌,借助比色仪和智能手机作为终端定量设备可实现比色信号的快速读取和沙门氏菌的定量快速检测。本试验中通过优化试验条件,使整个检测过程能在20 min 内完成,大大缩短了检测时间。本试验运用抗污染改性棉签拭子,提升传感器的抗污染特性,避免牛奶中非特异性大分子物质干扰检测信号,无需样品前处理即可快速检测,该方法为实现现场即时快速检测提供可能性。
由于实际样品的复杂性、基质中干扰因素的多样性,在实际检测过程中抗污染棉签拭子不能完全排除非特异性物质(如牛奶中的小分子添加剂、脂质等)的干扰,检测过程中仍然会在棉签拭子头部残留蓝色信号探针,容易造成检测结果偏差。此外,比色法对于有颜色的食品样品(如黄色的蛋液、红色的番茄汁等)有一定局限性,易造成比色结果偏差,导致假阳性或假阴性的错误检测结果产生。因此,在今后的试验中应完善除蛋白质外其它非特异性物质的抗污染效果评价,以及利用其它的传感信号以解决有色食品基质中沙门氏菌的快速检测。
4 结论
本研究首先用光引发聚合法制备了两性离子SBMA 改性的抗污染棉签拭子,通过便面蛋白黏附测试验证其在牛奶基质中抵抗非特异性蛋白黏附的性能。其次,利用EDC/NHS 激活适配体与蓝色乳胶微球发生酰胺反应,形成蓝色乳胶微球/适配体偶联聚合物,形成传感检测比色信号探针。最后,通过试验条件优化,得到抗污染棉签拭子和蓝色乳胶微球集成的快速检测平台,使整个检测结果能在20 min 内完成,与传统检测法相比,检测时间更快,满足快速检测需求。利用肉眼进行定性结果测定,并配合使用便携式色差仪与智能手机结合的检测装备定量读出检测结果,操作简单,为现场快速检测执法操作提供可能。本研究建立的基于抗污染比色拭子传感平台,实现了沙门氏菌的高特异识别和高灵敏检测。对沙门氏菌的线性检测范围为103~107CFU/mL,检测限为117.80 CFU/mL。本研究还将比色拭子法与国标法和传统平板技术法进行对比,在检测范围内能够准确高效地对无需前处理的牛奶样品进行检测。比色拭子法的检测结果与国标法和平板计数法检测结果一致,回收率在94.15%~108.26%。为进一步提升两性离子改性棉签拭子在致病菌超灵敏和现场快检领域中的发展的可能。
