人工智能在制药行业的应用进展
2023-12-15万宇郑维恒蒋阅赵祥伟
万宇,郑维恒,蒋阅,赵祥伟
(东南大学数字医学工程全国重点实验室,东南大学生物科学与医学工程学院,江苏 南京 210096)
药物是保障人类健康与治疗疾病的重要手段,近年来随着科技的不断进步和全球健康需求的日益增长,制药行业正在经历前所未有的变革和发展。首先,创新药物研发作为制药行业的主导力量,正从传统的小分子药物向生物药物和细胞治疗等新型药物转变。新型药物技术针对复杂的疾病,如癌症、自身免疫性疾病和神经系统疾病等,提供了前所未有的治疗机会[1]。其次,随着数字化与自动化技术的发展,医药行业正逐步开展智能化和自动化建设。通过机器人技术和自动化系统,制药企业可以提高生产效率,降低人为错误,并确保生产过程的一致性和可追溯性。同时,利用大数据和人工智能(artificial intelligence,AI)技术,制药公司能够更深入地优化药物生产过程,减少生产周期与成本[2]。此外,随着全球健康意识的提高,药品的可及性和公平性成为制药行业的重要研究议题。为满足全球范围内的健康需求,制药公司正广泛使用数字化技术以提升药品销售推广水平。例如通过数字化营销,面向医学工作者开展专业学术推广,提高药品的经济效益和社会效益[3]。
虽然制药行业发展前景巨大,但药物研发周期长,投资金额大,回报周期长等问题依然存在。例如在生物药或化学药的研发阶段,研发成本高达几亿美元,研发周期长达10 年,药物研发失败的案例比比皆是。特别是在我国,药物进口额持续大于出口额,化学药与生物药需求旺盛。然而由于药物研发的专业人才储备不足,药物创新水平仍需大幅度提升[4]。因此,借助机器学习与AI 技术,提升药物的创新水平,已在药物研发、生产、营销等各领域出现了诸多研究成果(见图1)。

图1 AI 在制药行业中的应用Figure 1 Application of AI in the pharmaceutical industry
1 AI 在制药研发领域的应用
在药物研发阶段,传统的药物靶点识别、药物筛选、分子合成等方式周期长、成本高,因此AI 在药物研发领域的应用最为广泛。AI 可对大量现有的药物数据进行深度学习,以此分析药物的化学性质和生物活性,更快地设计新药物,预测药物的吸收、代谢和毒性等复杂过程,从而缩短药物研发时间[5](见图2)。
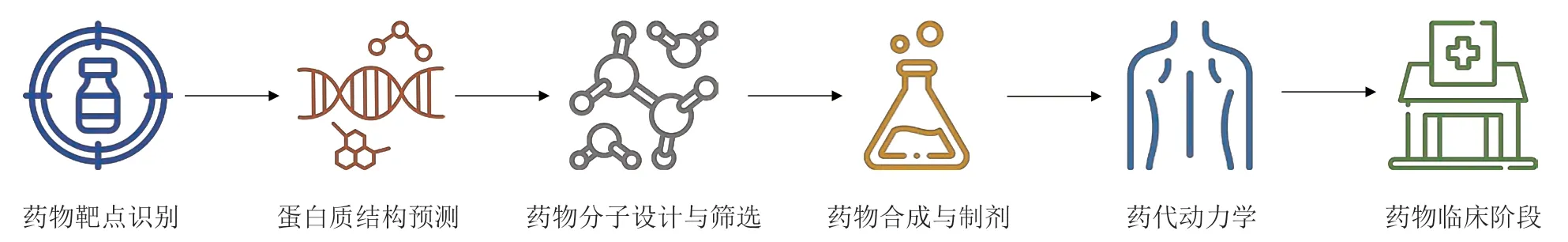
图2 AI 在药物研发中的应用Figure 2 Application of AI in drug research and development
1.1 AI 在药物靶点识别中的应用
药物靶点是指细胞膜上的受体、酶、离子通道,识别药物靶点是通常药物研发的起点[6]。药物研发可通过研究疾病的发生机制、信号传导途径等过程,识别出疾病相关的靶点,进而通过干预靶点调控疾病的进程。由于药物与特定的靶点相互作用才能发挥治疗效果,因此药物靶点的识别对于药物的研发至关重要。传统的药物靶点识别方法一般依赖于研究者的文献研究与经验积累,往往耗时较长,且准确性不高。
AI 技术能够分析药物和靶点之间相互作用的历史数据,学习已有药物与靶点的规律,使得新药物与靶点的相互作用预测更加准确。为让AI 与计算机能顺利读取靶点与药物结构,通常会将分子表示为一段序列,例如通过简化分子线性输入规 范(simplified molecular input line entry system,MILES)的方式表达[7]。当AI 使用分子序列数据进行训练时,如果仅关注当前数据,不关注数据的上下文,可能会丢失整体的分子结构信息而导致预测失败。AI 自注意力机制(self-attention)可恰当地完成数据上下文的理解与训练,避免仅关注当前序列导致分子整体特征丢失的缺陷。借助AI 自注意力机制,有研究使用BERT(bidirectional encoder representations from transformers)模型预测药物与靶标的相互作用。BERT 是一种预先训练的语言模型,可较好地理解数据的上下文,被广泛用于自然语言处理任务。在预测药物与靶点相互作用时,BERT模型可根据化学结构、蛋白质序列和生物医学文献等训练数据,发现已知药物与靶点数据的相似性,预测潜在的新药物与靶点的相互作用[8]。
类似于SMILES 的传统分子数据序列化表示方式,虽然便于AI 进行数据处理,但容易缺失分子的立体结构信息[7],导致此类AI 模型预测的准确性难以进一步提高。AI 图神经网络模型,可进一步提取立体结构数据,发掘数据规律,避免分子结构信息的缺失。有研究将药物分子和蛋白质氨基酸序列的二维结构作为AI 图神经网络模型训练的数据输入,成功提升药物与靶点亲和力预测的准确性[9]。由于当前靶点与药物相互作用(drug-drug-interaction,DDI)的数据量巨大,为避免海量数据占用过多的模型训练时间,在训练前AI 模型还可通过数据采样减少模型训练的数据量。例如通过共享最近邻(shared nearest neighbor,SNN)和模糊近似的方法,预处理训练数据,可减小AI 预测计算数据量,进一步提高预测的运行效率[10]。由此可见,AI 技术通过分析药物靶点间关系的历史数据,能够提高靶点识别的预测准确性与效率。
1.2 AI 在蛋白质结构预测中的应用
蛋白质结构预测一般基于药物靶点的结构信息,分析匹配蛋白质的结构、激活位点、预测与其他分子的相互作用,是药物发现阶段指导设计药物的化合物结构和性质的一个重要环节[11]。传统的蛋白质结构预测方式,一般是通过物理化学实验解析蛋白质晶体获得。然而,跨膜蛋白以及蛋白复合体的晶体获得成本较高,特别如G 蛋白偶联受体(G protein-coupled receptors,GPCR)等相对分子质量大、结构复杂、单晶样本难制备的蛋白,难以获得并解析结构。虽然冷冻电镜等实验方法,加强了蛋白质解析的能力,但其解析的成本高昂且周期较长[12]。
因此通过计算机辅助蛋白质结构的预测,是提升蛋白质结构分析效率的必要手段。例如, Rosetta[13]采用蒙特卡洛模拟(Monte Carlo simulation)和能量最小化(energy minimization)技术,结合实验数据来预测蛋白质结构,能够有效的对稀疏的输入数据建模。I-TASSER[14]使用层次性装配方法,将蛋白质折叠问题划分为多个步骤,即结构库搜索、序列比对、连续片段提取、能量优化、结构装配、全长模型的生成,使得模型构建更准确。虽然Rosetta 和I-TASSER 能够构建预测模型,但无法将来自多个蛋白质模板的结构信息结合起来,RosettaCM[15]结合了包括Rosetta 和I-TASSER 等多种方法,将模板迭代重组,以取得更优的建模效果,提供高质量的蛋白质结构预测,比单一方法更优。
上述方法通过学习氨基酸序列与已有蛋白质结构的关系,来预测新氨基酸序列对应的蛋白质结构。然而由于蛋白质在结构上的多样性,即使相似的氨基酸序列,一般的AI 模型也难以计算蛋白质所有可能的三维结构,在适用性和准确率方面存在不足。
为提升蛋白质结构预测的准确性,AlphaFold 作为最新的AI 蛋白质预测手段,通过多种方式提升预测效果(见图3)[11]。首先,AlphaFold 将蛋白质结构的预测视为三维空间中的图推理问题,将氨基酸及它们之间的所有相互作用视为一个图网络,以便于充分提取蛋白质结构与氨基酸序列的相关特征信息。其次,AlphaFold 通过深度学习与自注意力机制,分析所有的氨基酸相关特征信息,多次递归预测蛋白质折叠的三维结构模型,以提高预测准确性。最后,AlphaFold使用了大量的开源数据库进行模型的训练,通过强大的算力迭代优化模型。这使得AlphaFold可以生成与实验结果媲美、准确率较高的蛋白质结构模型,该方法被Nature评为2021 年度方法。以AlphaFold 为主的AI 技术通过学习氨基酸序列与已知结构的关系,提高了蛋白质结构预测的效率,生成了高质量结构模型,为蛋白质研究带来了重大突破。
图3 AlphaFold 原理流程图Figure 3 Workflow of AlphaFold
1.3 AI 在药物分子设计与筛选中的应用
根据靶点与蛋白质结构,筛选合适的候选化合物,找出具有潜在药效的候选分子,是药物研发的重要步骤[16]。传统药物分子设计方法包括高通量筛选、分子动力学、构效关系分析等,往往需要大量的实验时间和成本。传统的计算机辅助药物设计(computer aided drug design,CADD)方法,虽然可以辅助开展包括分子对接、分子动力学、虚拟筛选等过程,但由于药物筛选需考虑的吸收、代谢、毒理等因素众多,相互独立的计算机辅助药物设计方法依然需要研究者从经验与全局角度优化设计,限制了候选分子的筛选速度。
通过AI 赋能CADD 过程能够弥补传统计算方法的局限,通过学习已有药物分子的吸收、代谢、毒理数据,从多因素的角度筛选候选分子。在具体实践中,由于特定分子筛选所需的数据积累可能不足,通常使用AI 迁移学习模型,筛选先导化合物或生物类似药物[17]。迁移学习模型是一种机器学习方法,利用已训练的AI 模型,在新任务上进行微调,从而加速模型的训练过程,解决数据不足的问题。有研究使用其他肿瘤的AI 模型进行迁移学习训练,然后在非小细胞肺癌药物筛选中进行应用,成功生成了具有亲和力的6 283 种候选药物,且大大缩短了模型训练时间[18]。AI 技术赋能CADD 过程,可以从多角度学习已有药物分子的实验数据,以更高效的方式筛选候选分子。
1.4 AI 在药物合成与制剂中的应用
药物合成通常是药学研究的难点之一,其合成路径主要依赖于专业的有机合成经验,一般需要专业人员根据目标分子的结构逐步设计反应路径,但是实验方法往往成功率不高且难以控制。特别是由于药物分子复杂多样的特点,一些合成反应需要高温、高压或强酸碱条件,可能导致副反应的产生。因此,实验方法合成药物的效率与准确性有待进一步提升。
AI 能够从大量的化合物数据中学习和发现潜在的合成路径,从而构建合成数据库和知识图谱,用来预测分子性质和反应行为,辅助设计催化剂、反应条件与合成路径。有研究通过AI 迁移学习的方法,成功提高了合成分析中的反应预测准确性、底物选择准确性和反应序列准确性[19]。然而由于一个分子可能具有多个合成路径,找出其中成功率最高、反应步骤最少等最优的合成路径,是药物合成的难点。AI 可通过图探索策略筛选最优合成路线。AI 图探索策略,可以将图中每个节点代表为一个化学物质,用连接线表示它们之间的可能化学反应。AI 利用图搜索策略训练模型,搜索从某个起始物质(节点)到达目标物质(另一个节点)的最优路径。当在训练好的AI 模型中输入一个起始物质时,它会根据最优的规则,构造虚拟的化学合成图,图中包括每个合成步骤的反应物、试剂、溶剂和催化剂等信息[20]。随着AI 训练模型的成熟,可结合数字化手段,设计具备AI 能力的计算机辅助合成系统,进一步提高合成路径分析的速度和准确性[21]。
此外,为提升药物制剂的效率,AI 能够基于历史数据模拟产生最优的制剂工艺,从而避免繁琐的实验,同时确保较高的合成路径分析准确度[22]。有研究利用AI 优化脂质纳米颗粒配方方案,成功实现了用于皮肤癌治疗的新型药物递送方法,节省了时间和成本[23]。AI 技术能够预测分子性质和反应行为,寻找最优合成路径,有望提高药物合成的效率和准确性。
1.5 AI 在药代动力学领域的应用
药代动力学在药物研发的各阶段均发挥着重要作用。在临床前研究阶段,药代动力学数据有助于评估候选化合物的体内活性和可行性,确定化合物的药物代谢、体内稳定性、毒性等信息,帮助制定安全的剂量范围和给药途径[24]。在临床研究阶段,药代动力学数据用于确定药物在人体内的适当剂量,以确保药物在体内维持有效浓度的时间,评估药物在使用中的安全性和有效性。传统的药代动力学研究,通常采用多种动物、人体实验方法来评估药物在吸收、分布、代谢和排泄方面的途径和速率。例如在药物代谢实验中,通常给动物注射药物,通过采集尿液和粪便样本,分析药物及代谢产物含量,需要大量时间、实验动物等成本。
AI 可以通过大数据和机器学习算法,分析药物的动力学特性,避免大量、重复的药物动力学实验过程。例如有研究通过AI 模型,成功预测皮下输送的单克隆抗体的生物利用度,从而分析单克隆药物输送的有效性[24]。再如在预测人体静脉给药的药代动力学参数方面,有研究结合1 352 种药物的动力学数据集,训练AI模型来预测稳态分布容积(VDss)、清除率(CL)、终末半衰期(t1/2)和血浆中无结合分数(fu)等药代动力学参数。相比传统数学模型,AI 模型在交叉验证测试中表现出优异的稳定性和预测能力。然而由于创新药物的独特性,一般难以找到同类药物动力学数据进行AI 训练,导致传统AI模型应用效果不佳。为此,研究者通常利用AI 迁移学习方法,先将大型生物活性数据集作为初始训练数据集,以减少数据依赖与优化模型训练时间,降低药代动力学参数预测的误差[25]。
尽管AI 在药代动力学参数预测方面具有潜在的应用价值,但仍有数据质量问题需要进一步解决。例如,用于AI 训练的临床数据质量和可靠性并不高,且由于不同个体的代谢动力学具有差异,AI 模型难以针对不同个体进行高质量训练与预测。因此,AI在个性化的人体药代动力学参数预测方面,仍需进一步的发展。AI 技术可以通过大数据和机器学习算法,分析药物的动力学特性,提高研究效率。
1.6 AI 在药物临床阶段的应用
药物的临床研究,是验证药物安全性与有效性的有效手段[26]。其中临床的药物相互作用与不良反应,是药物上市前安全风险评估的关键要素。传统的药物相互作用与不良反应,通常在药物上市后才被发现与记录,这将导致健康风险以及高昂的药物召回成本[27]。AI 能够基于历史不良反应数据,针对药物上市后相互作用风险进行预测,从而降低潜在的安全风险。已有研究利用AI 结合药物的特性、分子结构和基因组特征,部分预测药物上市的成功率[28]。然而由于人体个体差异较大,不同药物的安全预测准确性偏差较大,预测准确率还有待于进一步提高[29]。
在个别疾病领域,有研究者通过AI 采集大量的同类药品不良反应数据库,结合患者信息,避免个体差异所导致的预测准确性问题。如图4 所示,有研究通过采集骨质疏松症和佩吉特病的类似药物不良反应数据,结合药物与患者资料,提取药物、不良反应、患者的关联特征信息进行AI 模型的训练,从而实现了较高的药物相互作用预测准确率[30]。
图4 AI 在药物相互作用中的应用Figure 4 Application of AI in drug-drug interaction
此外,AI 模型还可在药物临床阶段,对患者用药风险进行预测,避免实际用药对人体健康造成的损害。以药物性肝损伤为例,AI 模型可基于已有肝损伤的药物分子结构,预测候选药物的肝损伤情况,且比其他模型预测效果更优[26]。因此,AI 能够尽早识别肝损伤等风险,降低药代动力学开发相关的成本,可在药物安全的基础上缩短临床开发周期[29]。
新药上市后,医生可能难以及时准确地了解新药特性,导致在处方中存在新老药物联用的副作用风险。AI 还可以同时监测新药的上市信息,通过分析新批准的药物分子结构、药理毒理等特性,预测已有药物与新药物之间的相互作用,为评估处方信息修订提供依据[31]。
2 AI 在制药生产领域的应用
在生产阶段,AI 能够提高制药的效率和质量,甚至已有制药企业开始使用AI 机器人进行药品生产。精心设计的AI 机器人,可以在各种生产环境中准确无误地完成复杂的生产流程[32],不仅加速了生产过程,还确保了生产的一致性和安全性。
2.1 AI 在生产与供应链的应用
在药品生产领域,制药设备一般按照固定不变的工作流程来生产药品,避免工艺改变带来的药品生产质量风险,这导致难以通过AI 模型直接优化生产工艺与生产参数。如图5 所示,通常使用AI 模型持续检测生产过程的数据,利用AI 模型检测原材料质量,预测生产设备故障、质量风险等问题,从而保证产品质量的稳定性和一致性[33]。例如在线拉曼监测技术,可通过非侵入性的分子振动光谱分析,利用AI 模型实现药物原料、杂质、成品的快速鉴定。有研究在生物制药的生产过程中,通过拉曼设备检测培养基成分,然后使用AI 辅助分析细胞培养基等关键成分的一致性[34]。这将有助于避免将成分差异较大的培养基投入生产,减少出现不合格药物的质量问题[35]。
在药品的生产包装方面,制药企业与药品监管机构通常希望防范假药,以及未经批准的药品在市场上流通。通常假药和未经批准的药品识别,需要耗费人力进行收集、分析与鉴定。有研究利用AI图像识别技术以及自然语言处理(natural language processing,NLP)技术对药品包装上的图像和文本进行药物的精准识别,通过药物包装快速鉴别药品的生产、流通等过程信息,并且从大量文本数据中提取医学知识,帮助监管机构快速鉴别药品真伪[36]。在药品的供应链与运输方面,根据药品供应的距离远近,药品的运输周期可能较长,导致部分医院的药品存在过剩或短缺的情况。通过整合供应链的数据并应用预测分析,AI 可优化物流和库存管理,提高交货效率,确保药物供应的可靠性和安全性[37-38]。此类AI 技术的应用,可以加强药品供应链的透明度,从而提升整体药品生产和交付的质量和效率。
2.2 AI 在药物生产质量管理的应用
药物生产质量管理是确保药品质量和安全性的重要环节。传统的质量管理方法往往需要依靠人工统计与分析质量偏差,处理效率相对较低。AI 模型可以通过学习质量偏差的历史数据与偏差处理方案,根据偏差数据预测生产中的新风险,从而提高生产企业在处理质量偏差的决策效率[39]。例如有研究通过AI 技术实现对中药饮片外观质量的视觉检测,从而快速识别不合格药品,结合供应链数据快速定位不合格药品的原料批次等因素,推动中药饮片生产质量的提升[40]。
目前AI 在药物生产领域的应用,主要集中在生产过程检测、药物识别、安全评估和药物标签识别等领域,在改善生产质量与效率方面具有潜力。为确保药品生产质量,大多数国家的药品生产法规均要求计算机技术具备可解释、可验证的能力,AI模型也不例外[41]。因此AI 模型在生产领域的应用,需确保其决策过程透明可信,以满足药品生产的法规要求。
3 AI 在制药营销领域的应用
药品销售和市场营销,是医药企业获取收入的重要来源。长期以来,药品营销主要由医药代表负责药品销售任务。然而,随着医药分离政策的推动,药品营销正朝着数字化和互联网化方向快速发展,为药企带来了精准营销的新机遇(见图6)。
图6 AI 在药物营销中的应用Figure 6 Application of AI in pharmaceutical marketing
3.1 AI 在医生处方推荐中的应用
在当今医疗实践中,药物选择的准确性对于患者的疾病管理和康复至关重要。传统的医生处方可能受限于个人经验和有限的信息,在面对复杂的药物相互作用、新兴疾病治疗方案等方面存在挑战。例如,医生在开处方时,可能无法完全了解多种药物之间的相互作用,也可能无法全面考虑患者的历史病历。然而AI 能够通过大量药物数据以及患者的过往病史用药数据进行训练,运用监督学习来构建药物预测模型,以及患者对特定治疗的响应预测,形成系列药物的个性化推荐算法。有研究者结合了人口统计、疾病特征相似度等计算方法,在实验中可达到95%的药物推荐准确率,为医生开处方时的药物推荐提供了有力支持[42]。此外,还有研究通过图神经网络学习医学本体图的分类关系,再结合注意力机制的循环神经网络来捕捉患者病历信息特征。这种基于神经网络的AI 模型相比传统方法,可以更高效地分析患者病历信息特征以及药物相互作用数据,辅助医生推荐更准确的合适药物,也进一步促进了医疗智能化发展[43]。
然而,AI 模型的决策过程往往是复杂的、不透明的,缺乏可解释性,这就导致了“黑匣子”现象,即难以理解模型是如何得出特定的推荐或决策的。在医疗领域,这种不透明性可能被视为风险因素,患者更愿意理解和信任医生所做的决策。医生运用AI 模型进行辅助决策时,也倾向于使用线性回归等精度低但可解释性强的非AI 模型[44]。在我国2023年8 月,北京市卫健委制定了《北京市互联网诊疗监管实施办法(试行)》[45],明确规定处方应由接诊医师亲自开具,严禁使用AI 等技术自动生成处方。
因此,AI 模型在处方推荐的应用需透明化展现AI 推荐药物的过程。有研究者针对该问题,提出了可追溯率的评价指标来分析AI 模型可解释性,使得AI 可根据指标提供可追溯药物推荐的推理路径。通过推理路径,防止极端的预测或有错误的预测,然而该算法的溯源率仅达到67.04%,暂时无法实现真正的临床应用[41]。
3.2 AI 在患者用药推荐中的应用
随着互联网问诊与购药的兴起,越来越多的患者直接通过互联网医院进行问诊与购药。AI 可通过训练大量互联网数据,发现潜在的患者购药群体,在市场策略方面辅助制药公司做出更明智的决策。例如有研究针对药品西格列汀,运用AI 分析药物的治疗领域、价格、使用群体等因素,通过模型训练为患者构建“西格列汀购买倾向”标签,最终AI 模型成功地识别出对该药物接受程度最高的患者群体,并向其定点推送药物推荐,提高了营销成功率[46]。
然而,AI 推荐药物需要谨慎考虑安全性和合理性,不仅仅是找到适合的患者,还要结合药物的特性、患者的个体差异、药物之间的相互作用等因素,确保提供更安全的用药建议。因此,有研究通过AI分析与推荐药物的同时,结合患者档案与不良反应数据,为患者预测药物的肝损伤风险和副作用,提供更安全的用药建议[47]。在具体实践中,已有机构结合AI 模型与IT 技术,实现云辅助药物推荐系统。该推荐系统通过AI 对患者、症状和药物之间的关系进行建模和表示,向用户推荐可靠无害的药物组合[27]。该研究提到,未来仍需要结合用户的更多特征,如年龄、地理等因素来提高药物推荐模型的准确率,以确保推荐药物的安全性。
3.3 AI 在医药财务管理的应用
在医药营销领域,财务管理是企业取得盈利的关键因素之一。在传统的财务管理领域,面对庞大的数据量和繁杂的财务信息,企业人员难以从全局最优的角度,优化现金流、成本、营销等策略。AI技术能够帮助企业提高财务数据分析与决策准确性。以辉瑞制药为例,有研究使用AI 机器人构建财务报表分析流程、资金管理流程和报销流程,提升财务管理的成效。在AI 模型的支持下,辉瑞制药的资金流动性指标、资金使用效率和存货周转分析等方面有了显著提升。然而,由于传统财务系统在数据承载能力和数据安全性等方面存在局限,这些应用暂时难以大规模推广[48]。
尽管当前在医药财务管理中,AI 应用的案例较少,但辉瑞制药的人工智能财务共享中心的成功应用,显示了AI 在财务管理方面的潜力。通过分析企业内部和外部的财务数据以及用户购买记录和健康数据,AI 技术可以帮助制药企业预测财务趋势,从而优化资源配置提升营销与利润水平。
4 结语与展望
总之,人工智能技术已在制药领域产生了较多的典型应用案例。在药物研发领域,AI 能够学习和理解化学反应的模式和规律,高效地识别靶点并设计筛选候选分子,提供药物合成的策略与路径,预测药物的动力学及不良反应,从而缩短药物研发的周期。然而AI 在药品不良反应预测、药物相互作用预测等方面,面临数据质量和预测准确性不高的技术难点,且AI 技术产生的药物均尚未上市,因此AI 在研发领域的应用效果还有待于市场的检验。
在药品生产领域,通过AI 模型的分析和挖掘,企业可以提升药品生产过程检测的效率,通过采集物流与库存信息降低供应链成本,通过分析历史质量偏差提高药品生产的质量管理水平。然而根据药品生产法规的要求,AI 模型仍需在实际应用时确保其模型的可解释性、可验证性。
在药品营销领域,AI 已具备快速分析目标市场和患者画像的能力,可提供药品个性化的营销与药品推荐。在实际应用中,AI 需在满足可解释性要求基础上,才能够为医生处方和患者购买提供决策支持。
近年来,人工智能与制药和医疗结合的新兴研究逐步增多,从干细胞递送[49]到等离子体医学[50],从医疗纠纷分析[51]到AI 药房[52],甚至AI 与核医学已有相关研究成果[53]。未来,随着AI 技术的不断进步,其在制药行业的应用将更加完善。期待AI在制药领域更多的创新和突破,以更好提升人类的健康水平。
