基于缺血性脑卒中再灌注损伤机制的抗氧化纳米药物研究进展
2023-12-15刘颖黄冠宁贺利贞陈填烽
刘颖,黄冠宁,贺利贞,陈填烽
(暨南大学附属第一医院神经内科,暨南大学化学与材料学院,广东省纳米化学创新药物工程技术研究中心,广东 广州 510632)
脑卒中是一组因脑血管破裂或阻塞使脑部血液供应产生障碍而引起神经功能缺损的临床综合征,包括缺血性脑卒中和出血性脑卒中[1-3]。其中,缺血性脑卒中约占脑卒中总数的80%,好发于中老年人,具有高死亡率、高致残率等特点[4]。缺血性脑卒中的损伤机制主要与活性氧自由基(reactive oxygen species,ROS)生成增多、细胞内钙超载、神经兴奋毒性、神经炎症反应及凋亡自噬信号失衡等有关[5-6]。
目前,缺血性脑卒中的主要疗法是在发病后的4.5 h 内进行静脉溶栓或6 h 内进行介入取栓,以及时恢复血液供应[7]。然而,严格且短暂的治疗时间窗使得仅有少部分缺血性脑卒中患者能及时接受血管再通治疗。另外,如果在治疗时间窗外进行溶栓或取栓会增加血脑屏障(blood brain barrier,BBB)破坏和脑出血的风险,导致缺血性脑卒中的致残率和死亡率增加[8]。此外,恢复血流灌注的过程中诱发的一系列生化反应会引起缺血-再灌注损伤,加剧神经元坏死和凋亡,导致神经功能受损[9]。因此,根据缺血性脑卒中的发病特点,目前其临床治疗策略主要集中在2 个方面:1)改善供血,包括静脉溶栓、血管内治疗、抗血栓治疗等,以恢复缺血区血流、改善脑血循环[10-11];2)神经保护治疗,作为溶栓治疗的重要辅助手段之一,使用抗氧化剂、离子通道阻滞剂、炎症抑制剂等药物保护神经细胞免受缺血性损伤[12-14]。目前,临床上使用较多的神经保护剂依然以小分子抗氧化剂依达拉奉为主。然而,由于依达拉奉半衰期短、生物利用率低等缺点,极大限制了其疗效与临床应用[13]。近年来,许多国产自主研发药物被批准用于治疗缺血性脑卒中,并在临床应用中取得良好的疗效[15-16]。例如:我国首个在脑血管领域拥有自主知识产权的化学药物丁苯酞;中药注射剂注射用丹参多酚酸。尽管我国在脑缺血神经保护药物的研发上取得了长足的进步,但目前缺血性脑卒中的防治依然处于严峻状态。脑卒中患病率的增加和临床用药种类稀缺的矛盾表明,探索高效、低毒、生物利用率高的脑保护剂对缺血性脑卒中的治疗具有重要意义。
近年来,基于抗氧化策略的脑保护剂研究取得了较大的进展。尤其是纳米技术的高速发展为开发可克服BBB 限制、延长半衰期、提高生物利用率的创新性药物带来了新的机遇。纳米材料具有许多传统材料和小分子药物所不具备的独特的理化性质,为提高卒中患者的治疗效果提供了一种新途径。本文对脑卒中缺血-再灌注损伤的发生机制及近年来抗氧化纳米药物治疗缺血性脑卒中的研究进展进行综述,为探究缺血性脑卒中治疗新策略提供参考。
1 脑缺血-再灌注的氧化损伤机制
脑组织对缺血缺氧非常敏感,在血流供应障碍后的短时间内会发生严重的神经功能缺损[17]。缺血半暗带区由于残余小血管能维持其血液灌注,细胞功能虽受损但结构尚完好,若能及时恢复血供,其功能仍可能被挽救,从而减轻脑组织损伤[18]。然而当脑组织缺血时间较长时,神经元已经受损并开始凋亡,继续进行血流再灌注反而会加重病情,即发生脑缺血-再灌注损伤。另外,长时间的脑血流再灌注后,存活的脑组织中过氧化物堆积,坏死区域会随时间延长而扩大,进一步加重脑损伤的程度。脑缺血-再灌注损伤的发生是一个快速且复杂的级联反应过程,主要包括ROS 大量生成、细胞内钙超载、炎症反应过度激活等环节。其中,ROS 过量产生在脑缺血-再灌注损伤的发生、发展过程中占首要地位,ROS 在细胞内会引发一系列破坏细胞结构的链式反应,诱导机体发生氧化应激,进一步加剧钙超载与炎症反应。因此,深入了解脑缺血-再灌注氧化损伤的发生机制,对研制新型抗氧化剂防治脑缺血-再灌注损伤的发生和控制缺血性脑卒中的病情进展具有重要意义。
自由基(free radical)含有未配对的电子,化学性质极不稳定,易从邻近的分子上夺取电子,导致邻近分子的细胞结构被破坏,引起一系列功能障碍。人体内总自由基中95%以上属于ROS,包括超氧阴离子(superoxide anion,·O2-)、羟基自由基(hydroxyl radical,·OH)和过氧化氢(hydrogen,H2O2)等。正常情况下,适量的ROS 在体内作为一种重要的信号分子,参与多种信号通路的调节。病理状态下,过量产生的ROS 通过刺激细胞因子和黏附分子的表达来促进炎症和免疫反应,从而严重损害组织细胞[19]。人体内存在超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、 过 氧 化 氢 酶(catalase,CAT)、辣根过氧化物酶(horseradish peroxidase,HRP)以及辅酶Q、维生素E、维生素C 等抗氧化酶与抗氧化小分子,正常情况下它们会及时清除体内过量的ROS,以维持ROS 的稳态,限制其对正常细胞的损害[20]。若由于氧化物质增多而抗氧化防御降低使体内氧化与抗氧化作用失衡导致机体损伤,被称为“氧化应激”。
缺血-再灌注过程中,大量ROS 蓄积可引起脑组织细胞发生氧化应激而受损,这是缺血性脑卒中的主要病理机制之一[21-22]。缺血-再灌注引起ROS异常增多的机制主要涉及以下几个方面[23-25](见图1):1)线粒体功能障碍[26]。缺氧时细胞内氧分压下降,三磷酸腺苷(adenosine triphosphate,ATP)生成减少,细胞膜上的钠钾泵功能发生障碍,胞内高Na+引起Na+-Ca2+交换增强,促使Ca2+进入细胞且被线粒体摄取增多,引起钙超载的同时导致线粒体内的锰-超氧化物歧化酶(Mn-SOD)活性下降以及细胞色素氧化酶系统功能失调,导致再灌注期间O2大量转化为·O2-、H2O2等ROS。2)黄嘌呤氧化酶(xanthine oxidase,XO)形成增多[27]。一方面,细胞内Ca2+增多使钙依赖性蛋白水解酶被激活,黄嘌呤脱氢酶(xanthine-dehydrogenase,XD)大量转变为XO;另一方面,二磷酸腺苷(adenosine diphosphate,ADP)、单磷酸腺苷(adenosine monophosphate,AMP)、次黄嘌呤等ATP 代谢产物堆积,组织恢复氧供时,XO 催化次黄嘌呤转化为黄嘌呤和尿酸,导致大量的·O2-和H2O2产生。3)中性粒细胞的聚集及激活[28]。缺血区释放的ROS 诱导多种趋化因子和促炎因子的表达,吸引大量白细胞聚集并激活。当再灌注时组织重新获得O2,募集的白细胞耗氧量剧增,发生氧爆发,在氧化酶的作用下产生大量氧自由基。4)儿茶酚胺自氧化增加。缺血-再灌注诱导机体发生应激反应,刺激交感-肾上腺髓质系统兴奋,产生大量儿茶酚胺,在参与代偿调节时氧化产生大量的氧自由基。由此可见,血流再灌注在恢复神经元供能供氧的同时也会引起线粒体损伤、炎症反应、氧化应激等复杂的病理进程,导致ROS 等有害物质过量产生和积累。
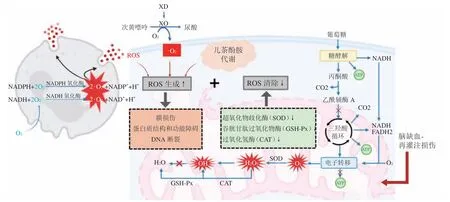
图1 脑缺血-再灌注中ROS 的诱发机制Figure 1 Mechanism of ROS production increased in cerebral ischemia-reperfusion
缺血脑区的ROS 爆发诱导强烈的氧化作用使脑血管内皮细胞和脑组织受到损伤,导致神经元结构被破坏和器官功能衰竭。ROS 蓄积主要通过以下几种方式引起神经元损伤:1)膜脂质过氧化。ROS不仅易于夺取细胞膜上的电子,破坏神经元膜结构的完整性,而且会与膜上的不饱和脂肪酸作用,使膜发生脂质过氧化反应,引起细胞膜通透性增强、线粒体膨胀等,导致神经元发生变性和坏死。同时磷脂酶被激活促进膜磷脂分解,催化花生四烯酸代谢反应释放血栓素A2、白三烯(leukotriene,LT)等活性物质,加剧缺血-再灌注损伤。此外,膜磷脂微环境的改变会导致离子泵功能异常,造成Na+、Ca2+内流增加,脑组织能量代谢紊乱。2)蛋白质功能受抑制。ROS 能氧化蛋白质的巯基形成二硫键,导致蛋白质活性降低或丧失,使氨基酸残基氧化,损伤神经元蛋白质功能,严重影响脑组织缺血性损伤的修复。脂质过氧化还会抑制膜受体、G 蛋白与效应器的偶联等功能,导致神经系统信号转导异常。3)核酸破坏及DNA 断裂。ROS 可导致核酸碱基羟化、DNA 断裂及染色体畸变,引起神经元损伤与凋亡。
综上所述,ROS 大量蓄积不仅通过链式反应引起脑组织细胞的破坏和凋亡,还会导致包括能量代谢在内的多种反应过程中断以及XO、SOD 等酶的表达和活性改变,严重影响脑组织损伤的修复。另外,过量的ROS 还可与细胞的膜磷脂、蛋白质、核酸发生反应,导致细胞结构破坏和功能障碍,引起细胞内钙超载。钙内流增加使钙依赖性蛋白激活,与之相关的代谢反应过度活化,导致严重的能量代谢障碍和ROS 进一步蓄积,形成恶性循环。同时体内氧化与抗氧化系统失衡会导致中性粒细胞炎性浸润、蛋白酶分泌增加并产生大量氧化产物。氧化应激过程中产生的促炎因子会使血管扩张,促进白细胞游走,诱发炎症反应,加重脑组织缺血性损伤。由此可见,抑制氧化应激不仅能够减少钙内流,还能够抑制炎症反应过度激活,是缓解脑缺血-再灌注损伤的关键环节。虽然体内存在抗氧化防御系统,但其不足以应对多种ROS 爆发带来的氧化损伤。因此,缓解脑缺血症状的同时联合使用高效、低毒、安全的抗氧化剂是临床治疗缺血性脑卒中的有效途径。然而,常规的抗氧化制剂普遍存在ROS 清除效率低、药物靶向能力差且细胞毒性大等缺陷,导致其临床疗效并不理想。相比之下,纳米药物在解决常规药物催化活性低、半衰期短、生物相容性差等方面表现出明显的优势,为克服缺血性脑卒中的治疗瓶颈提供了一种新途径。
2 纳米抗氧化剂
缺血性脑卒中的治疗原则是尽早恢复缺血脑区的血流灌注。血流再灌注后ROS 爆发诱导的氧化应激是引起脑组织缺血区继发性损伤的最主要病理机制[29]。因此,设计能够清除缺血性脑卒中再灌注过程中产生的ROS、减轻神经损伤的抗氧化剂是脑卒中治疗的主要目标。BBB 作为一种血液、脑组织和脑脊液之间的特殊屏障结构,在保护神经元免受神经毒性物质侵害的同时,也限制了药物进入脑缺血区的效率,成为治疗缺血性脑卒中需要面临的挑战之一[30]。考虑到脑部功能的重要性,神经保护剂的开发需同时达到高效、安全、可入脑及长效抗氧化等要求。得益于纳米技术的高速发展为开发可满足神经保护剂性能要求的创新药物带来了新的机遇(见图2)[20,31-37]。首先,基于纳米粒子催化活性与模拟抗氧化酶活性等特点制备的新型模拟酶有望解决内源性抗氧化酶活性下降等难题[38-39];其次,将功能性有机小分子与纳米制剂偶联,可以显著提高天然抗氧化剂的给药效率和抗氧化活性[40];另外,通过调控纳米颗粒尺寸、形貌、表面电荷以及靶向修饰等方式,可以提高细胞对纳米药物的内吞作用,增强纳米药物穿透BBB 的效率[41-42]。因此,整合纳米药物穿透BBB 和高效清除ROS 等优势,将有望突破缺血性脑卒中神经保护剂类药物开发的瓶颈。
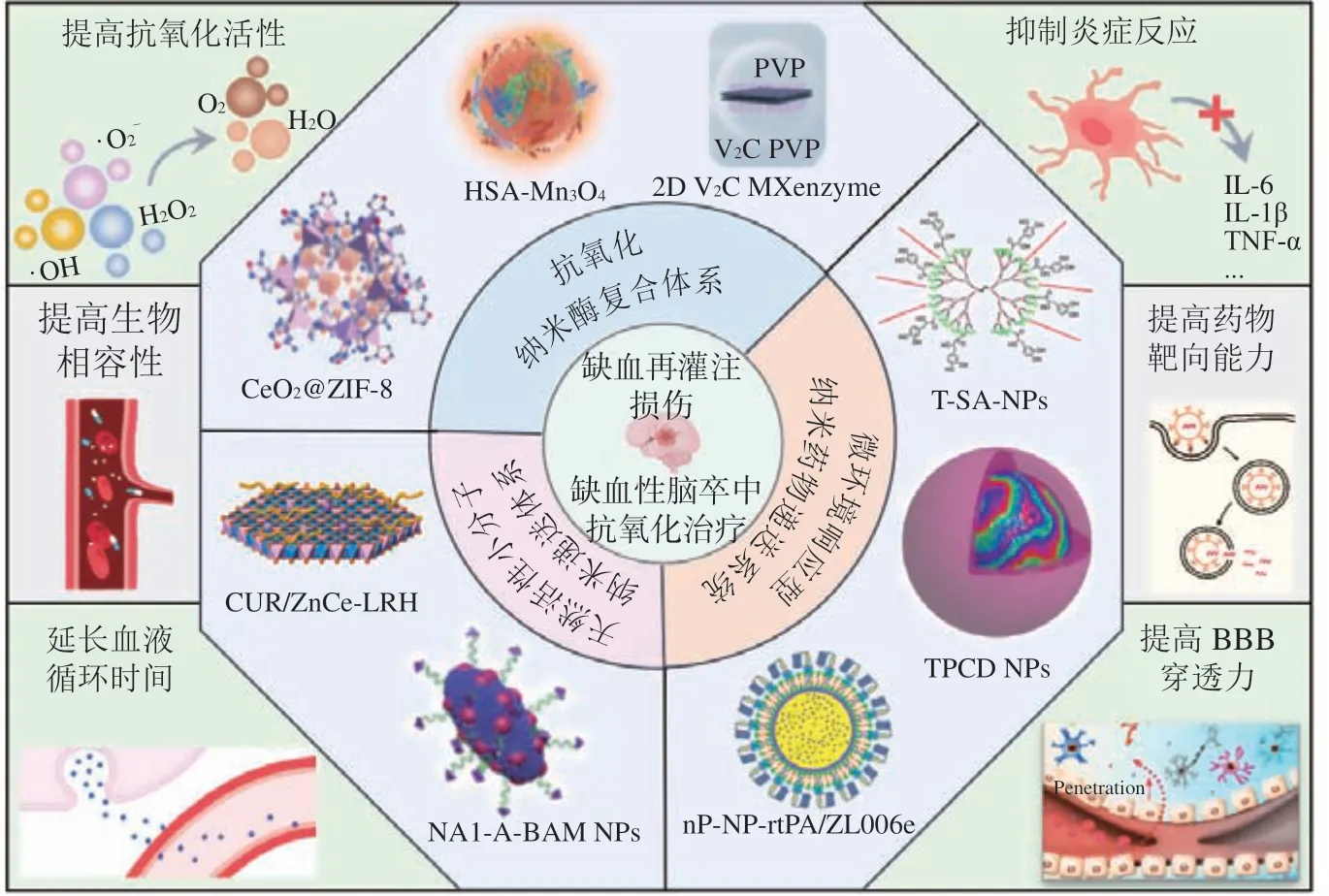
图2 纳米材料在缺血性脑卒中再灌注损伤的抗氧化治疗中的应用Figure 2 Application of nanomaterials in the antioxidant treatment of reperfusion-induced injury in ischemic stroke
2.1 纳米酶
纳米酶是一类蕴含酶学特性的纳米材料,能够在生理或极端条件下催化酶的底物,具有类似于天然酶的酶促反应动力学,可作为酶的替代品[43-44]。目前,金属氧化物、贵金属和碳基纳米材料是已被报道较多的纳米酶材料,它们通过模拟生物体内天然酶的活性清除ROS,保护细胞免受氧化损伤,例如:GSH-Px、SOD、CAT、硫氧还蛋白还原酶(thioredoxin reductase,TrxR)等。纳米酶作为一种新型模拟酶,能够用于病毒感染、癌症、脑卒中、心肌缺血、糖尿病和阿尔茨海默病等多种疾病的治疗,且均表现出良好的治疗效果[45-46]。
大量研究发现,纳米酶在缺血性脑卒中的治疗中展现出优越的应用前景。与天然酶相比,纳米酶具有功能多样性、高稳定性、易于制备等优点,这赋予纳米酶在抗氧化治疗中的独特优势。例如,CeO2纳米材料同时存在Ce3+/Ce4+的混合价态,容易失去氧和得到电子,导致氧空位的形成和价态的降低,而Ce3+和Ce4+之间的电子转移使其具有较强的抗氧化活性和重复清除ROS 的能力。CeO2纳米酶作为脑保护剂,在缺血性脑卒中的治疗中能有效减少脑组织的梗死面积。Bao 等[47]通过使用CeO2作为载体,负载抗氧化剂依达拉奉作为缺血性脑卒中的治疗药物,显著提高了药物的BBB 穿透力和神经元保护效果。然而,单独的CeO2纳米材料的临床应用受到半衰期短,易发生聚集以及在活性位点上不易直接发生催化反应的限制。He 等[31]通过在CeO2纳米粒子表面“原位合成”金属有机框架沸石咪唑框架-8(zeolitic imidazolate framework-8,ZIF-8),从而控制CeO2核的大小和表面电荷,缓慢暴露CeO2活性成分,延长了其血液循环时间,增强了纳米酶的催化和抗氧化活性;该复合纳米酶(CeO2@ZIF-8 NPs)能有效抑制大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型小鼠脑组织缺血-再灌注引起的脂质过氧化,减少了脑组织神经元的氧化损伤和凋亡;氯化三苯基四氮唑(TTC)染色显示,经CeO2@ZIF-8 治疗3 天后,MCAO 模型小鼠脑梗死面积呈剂量依赖性明显减少;通过抑制星形胶质细胞激活和促炎因子分泌,缓解了炎症和免疫反应引起的神经元损伤。因此,CeO2@ZIF-8 能同时发挥抗炎、抗氧化、抗凋亡等多种功效,在缺血性脑卒中神经保护治疗中实现了令人满意的预防和治疗效果。
虽然CeO2具有较好的生物相容性和较低的毒性,但Ce 作为稀土元素其本身不存在于人体当中,长期的使用可能对人体产生副作用,不利于纳米材料临床转化。治疗缺血性脑卒中的纳米酶不仅需要有高效稳定的抗氧化能力,而且应具有良好的生物相容性[32]。二维过渡金属碳化物(MXenes)是一类广泛用于生物医学的二维(2D)材料,具有多样化的结构和独特的理化性质。钒作为人体必需的微量元素之一,因其对经典CAT 底物的内在催化活性和长期抗生物污染能力,钒基纳米材料在纳米酶领域也受到广泛关注[48]。Hu 等[32]设计合成了二维碳化钒MXene 纳米酶(2D V2C MXenzyme),体外抗氧化实验证明其具有SOD、CAT、GSH-Px、过氧化物酶(peroxidase,POD)等多种天然酶活性,可通过清除不同的ROS(如H2O2、·O2-、·OH)对缺血性脑卒中发挥神经保护作用;在MCAO 模型大鼠中,V2C MXene 能有效降低脑组织的梗死面积,并抑制其脑组织星形胶质细胞和小胶质细胞激活,显著减少神经元细胞凋亡比例;该纳米酶不仅具有良好的生物相容性,而且在不干扰内源性抗氧化状态的情况下可重建氧化还原稳态,还可以通过良好的体内治疗作用缓解ROS 诱导的脑组织损伤;总之,V2C MXene 由于其较强的抗氧化活性以及抗凋亡和抗炎作用显著缓解了缺血性脑卒中/脑缺血-再灌注损伤引起的脑损伤和神经元的功能丧失。这一发现为利用微量元素为主的纳米酶作为治疗缺血性脑卒中的纳米平台开辟了一条新的途径。
此外,脑卒中缺血-再灌注引起大量ROS 累积的过程中,体内自身抗氧化酶系统被大量消耗于清除ROS 以缓解氧化应激。例如,由于缺血缺氧导致钙离子内流,钙离子进入线粒体致使Mn-SOD 大量减少,对ROS 的清除能力降低。因此,缺血性脑卒中的治疗策略,应以既能高效清除ROS,又能激活体内抗氧化酶的药物设计为重要方向。Huang 等[20]设计合成了人血清白蛋白修饰Mn3O4纳米酶作为ROS清除剂以达到外源性抗氧化的作用,利用该纳米酶含有的Mn 元素激活内源性Mn-SOD 酶;该纳米酶通过清除细胞内过量ROS,缓解细胞钙超载,有效维持了神经元的线粒体和内质网的完整性,抵抗神经元氧化损伤,其作用机制主要是通过抑制肌醇需求酶1α(inositol-requiring enzyme 1α,IRE1α)-Xbox 结合 蛋白-1(X box-binding protein-1,XBP1s)信号通路活化,阻止神经元在糖氧剥夺条件下引起的内质网应激反应,并通过抑制蛋白激酶R 样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)-真核翻译起始因子2α(eukaryotic initiation factor,Elf2α)-转录激酶因子4(activating transcription factor4,ATF4)-CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)信号通路以及磷酸化氨基末端蛋白 激 酶(phosphorylated c-Jun N-terminal kinase,pJNK)-丝裂原活化蛋白激酶p38(mitogen-activated protein kinases p38,p38)-门冬氨酸特异性半胱氨酸蛋白酶(caspase)信号通路活化,阻止神经元自噬与凋亡,最终达到治疗缺血性脑卒中的效果。该研究提供了一种具有高效抗氧化纳米酶构建策略,为探究其在缺血性脑卒中神经保护的疗效与作用机制提供了重要的科学依据。
2.2 微环境响应型靶向纳米药物递送系统
缺血性脑卒中患者的缺血半暗带区的微环境具有高ROS 水平、呈弱酸性、抗氧化酶活性下降、炎症因子和特异性脑损伤生物标志物表达增强等特点。纳米材料可以利用细胞膜、特异性载体、靶向分子等进行表面改性,以提高药物的精准给药效率。近年来,基于微环境响应型的靶向纳米药物递送系统可以在不同浓度的ROS、pH 和酶作用下释放其治疗药物至靶器官,有望为实现更高效的神经保护治疗提供新途径。
研究发现,许多天然化合物如丁苯酞、丹酚酸B、葛根素等在脑缺血-再灌注损伤中表现出了良好的抗氧化活性[49-51]。丹参素酸(salvianic acid A,SA)作为一种备受关注的抗氧化剂,不仅能逆转氧化应激导致的继发性神经元损伤,还能发挥增强细胞的抗氧化防御系统和保护线粒体的功能,具有潜在的神经保护作用[52],但其临床应用受到易氧化、半衰期短和BBB穿透力低的限制。聚乙二醇(polyethylene glycol,PEG)等聚合物纳米载体给药系统与治疗药物偶联能控制药物的释放,延长药物半衰期,提高药物疗效[53]。因此,具有微环境响应性特征的药物与纳米药物传递系统之间的共价相互作用为解决SA 的局限性提供了另一种策略[54]。聚酰胺-胺(polyamidoamine,PAMAM)树枝状分子衍生物具有高度可控的分子结构和良好的生物相容性[55]。研究表明,将BBB 靶向剂[如磷脂-聚乙二醇-整合素靶向环肽c(RGDyC)/PEG[56]、乳铁蛋白[57]]与PAMAM 偶联,可以改善BBB 的通透性。Li 等[33]设计合成了具有ROS 响应特性的树枝状高分子纳米颗粒,并将它们与BBB 靶向肽COG1410 和SA 偶联,形成可以靶向BBB 的ROS 响应型纳米药物递送系统PAMAM(T-SA-NPs)。体外抗氧化实验显示,T-SA-NPs 明显降低了神经元内的ROS 水平,且与SA-NPs 相比,表现出更强的氧化损伤保护能力;体内MCAO 小鼠模型实验也证明了T-SA-NPs靶向梗死区并延长梗死区域药物的半衰期,减少脑梗死面积,恢复小鼠的活动能力;此外,T-SA-NPs处理还可增加人微管相关蛋白轻链3II(microtubuleassociated protein light chain 3II,LC3II)的表达,诱导线粒体自噬,降低氧化应激。该研究为向大脑输送抗氧化剂和实现缺血性脑卒中的靶向治疗提供了一种替代策略。
脑卒中后小胶质细胞/巨噬细胞激活、促炎细胞因子分泌和ROS 产生,通常会介导缺血核心区神经元继发免疫/炎症反应[23]。Yuan 等[34]通过将清除ROS 的化合物(Tempol)和苯基硼酸频哪醇酯共价结合在具有强大的抗氧化和抗炎活性的β-环糊精上,制备了一种能有效穿透BBB 且具有抗氧化和抗炎活性的低聚糖纳米材料(TPCD NPs)。体外细胞实验表明,TPCD NPs 可减少氧-葡萄糖剥夺模型所诱导的氧自由基的过度生成,并增加抗氧化酶的表达,抑制小胶质细胞介导的炎症反应,从而抑制神经元凋亡;体内治疗研究表明,TPCD NPs 可显著降低MCAO 小鼠的脑梗死面积,并加速神经功能恢复;此外,TPCD NPs 可有效聚集在缺血性脑卒中模型的脑缺血损伤部位,并通过具有抗炎作用的多肽Ac2-26 抑制炎症反应进程。这一具有抗氧化、抗凋亡等多重生理作用且能被炎症调控释放的纳米递药系统有望发展为靶向治疗缺血性卒中的有效策略。
脑缺血-再灌注损伤的机制研究表明,除了神经保护外,及时恢复血流也是治疗缺血性脑卒中的关键步骤。如果能针对血栓靶点联合使用溶栓剂和脑保护剂,可达到溶栓和神经保护双重效果。静脉组织纤溶酶原激活剂可以快速溶解血栓,帮助缺血脑区恢复血供,是目前治疗缺血性脑卒中的一线药物[58]。基于血小板与凝血酶在血栓形成中的作用,Xu 等[35]开发了一种凝血酶响应性的血小板仿生纳米平台(tP-NP-rtPA/ZL006e),用于将重组组织纤溶酶原激活剂(rtPA)和神经保护剂(ZL006e)特异性递送至血栓和缺血半暗带处。该研究显示,经静脉注射后,tP-NP-rtPA/ZL006e 可以通过血小板膜介导的靶向作用黏附在血栓部位,使血栓周围上调的凝血酶触发rtPA 释放,将纤溶酶原转化为纤溶酶,诱导血栓溶解,随后,tP-NP-rtPA/ZL006e 可以在血流的高剪切力下溶解,原位暴露的细胞穿膜肽TAT(YGRKKRRQRRR)介导“纳米血小板”通过BBB 进入缺血大脑,实现了对ZL006e 的位点特异性递送;体外神经保护作用评估发现,tPNP-rtPA/ZL006e 治疗组的细胞存活率明显提高,且对BBB的毒性可以忽略不计;体内实验发现,tPNP-rtPA/ZL006e 显著降低了缺血脑区的梗死面积,同时使ROS水平下降了72%。该凝血酶响应型“纳米血小板”平台具有对血栓和BBB 的顺序靶向能力,可提高药物利用率,增强神经保护作用和抗氧化活性,减少并发症的发生,提高缺血性脑卒中的治疗效果。
2.3 天然活性小分子纳米递送体系
通过分离提纯天然产物可获得大量天然小分子抗氧化剂。这类小分子抗氧化剂均具有较好的抗氧化性能,且与天然酶相比催化效率更高[37],但由于其BBB 穿透力有限、水溶性较差且半衰期短,对缺血性脑卒中的疗效并不理想。此外,脑卒中治疗涉及多个互补靶点,单一药物治疗是不充足的[59]。随着纳米技术的发展,将天然活性小分子进行纳米化以提高生物利用率成为一种有前景的小分子药物改造策略。
Zhang 等[36]筛选出了桦木酸(betulinic acid,BA)、羽扇豆醇(lupeol,LP)、甘草酸(glycyrrhizinic acid,GA)、熊果酸(ursolic acid,UA)等一系列药用天然产物小分子化合物,通过自组装方法合成药用天然产物小分子化合物纳米粒子,发现均具有良好的水溶性、血液稳定性和BBB 穿透力。其中,BA 是治疗脑卒中最有效的抗氧化剂之一,但桦木胺纳米粒子(BA NPs)在生理pH 下释放有效载荷的速度缓慢[40]。该研究团队应用化学合成技术,将BA 转化为白桦胺(betamine,BAM),发现由BAM 组成的NPs 在酸性卒中微环境中可快速释放药物[36]。趋化因子受体4(chemokine receptor 4,CXCR4)是一种缺血性损伤后在大脑中高度表达的趋化因子受体。在白桦胺纳米粒子(BAM NPs)表面修饰CXCR4 的拮抗剂AMD3100(A-BAM NPs),可增强药物对缺血脑区的靶向能力。荧光染色定量发现,A-BAM NPs 在缺血区域的累积量分别是BA NPs、BAM NPs 和含PEG 的BAM NPs 的3.2倍、2.5 倍和1.7 倍;体内动物实验表明,经A-BAM NPs 治疗组MCAO 模型小鼠脑梗死面积减少了57.1%,小鼠的存活率明显提升,神经功能缺损得到明显改善;通过包载神经保护肽NA1,A-BAM NPs给药既可以增强NA1 的疗效,又可以使NA1 治疗与tPA 输注兼容(脑梗死面积减少了69.8%);纳米化后的天然小分子抗氧化剂A-BAM NPs 还具有抗病毒、降糖、抗高血脂和抗炎活性等多种功能,无论是作为治疗药物还是作为卒中治疗的药物载体,均有望实现临床转化。
姜黄素(curcumin,CUR)是一种天然食品添加剂,具有良好的抗氧化性能,但现阶段其临床应用受到生物半衰期短、化学性质不稳定以及生物利用度低等限制[60]。层状稀土氢氧化物(laminated rare hydroxide,LRH)是一类由类水镁石阳离子层和层间可交换阴离子组成的二维无机层状材料,LRH 上含有Zn2+和Ce3+。Ma 等[37]研发了一种由CUR 修饰的锌铈稀土氢氧化物(ZnCe-LRH),实现了Ce3+和Ce4+阳离子均匀分布在氢氧化物层中的目标,从而赋予ZnCe-LRH 高效电子转移的能力,与CUR 形成协同作用,实现了高效ROS 清除效率和多重ROS 捕获;体外实验证明了CUR/ZnCe-LRH 同时具有类CAT、类SOD 及清除·OH 的三重活性;体内研究证明,CUR/ZnCe-LRH 可以通过清除细胞内ROS 和抑制炎症激活,实现神经保护作用;CUR/ZnCe-LRH 治疗后脑梗死面积可减少78%,神经功能缺损评分从3.50 降至0.67。该策略为缺血-再灌注治疗提供了一种新型多功能模拟酶,阐明了神经保护对缺血-再灌注损伤的应用机制,为小分子药物抗氧化剂的开发与生物应用提供了新的思路。
3 结语与展望
脑组织梗死后导致血氧耗竭引起的损伤是缺血性脑卒中的主要危象。目前,在合理时间窗内开展静脉溶栓和血管介入治疗以恢复血供是治疗缺血性脑卒中的首要策略,但与血流再通相伴随的是缺血-再灌注损伤,可导致患者较高的致死率和致残率。在缺血性脑卒中的缺血和再灌注过程中,ROS 过量产生、钙离子超载、炎症反应激活三者几乎伴随着疾病发生、发展的全过程,而ROS 过量产生会引发病理级联效应,加重钙离子超载和炎症反应激活。因此,通过清除自由基的抗氧化治疗策略能够有效减少缺血性脑卒中的神经损伤。然而,传统的神经保护剂由于常存在生物利用率低和无法穿透血脑屏障等缺点,不能满足临床治疗缺血性脑卒中的需求。纳米技术的出现有效地改善了小分子和生物制剂类抗氧化剂的弊端。通过改造材料的结构可以赋予纳米材料更加优异的抗氧化性能、药理作用和生物利用度等,为有效治疗病理过程复杂的缺血性脑卒中提供了可能。与常规制剂相比,纳米药物在血液循环系统中可以多种方式被细胞吸收利用,且经特殊修饰后可提高药物递送的靶向性及溶解度,从而显著提高药物生物利用率和BBB 穿透率。同时,鉴于纳米药物在体内的降解速度可调控,可以延长药物的半衰期以提高疗效和降低副作用。
目前,针对治疗缺血性脑卒中纳米药物的临床试验正在广泛进行中,纳米给药系统在卒中领域的研究也处于接近临床应用阶段。尽管脑靶向纳米复合体系逐渐被人们认可,且取得了一系列技术突破,但生物利用度有限、穿透效率较低、对BBB 造成潜在损伤等问题仍限制纳米药物的进一步推广[61]。此外,目前仅能够检测纳米材料具有清除自由基的性能,但是对其性能调控机制和反应机制仍缺乏系统了解,对如何提高纳米材料清除自由基特异性和清除性能并没有一个系统性的研究策略,仅能通过实验检测材料性能的变化,这是未来针对纳米抗氧化剂设计开发必须克服的重要问题。此外,不同种类纳米制剂的适应证还需要更深入的研究,而且还存在一定的安全未知性。总而言之,抗氧化纳米药物治疗缺血性脑卒中研究仍还有巨大的发展空间。
