PLIN2在氧化型低密度脂蛋白诱导的泡沫细胞脂噬中的作用*
2023-12-15谭艳美陈三俊谭玉林蒙国照谭艳飞
谭艳美,陈三俊,谭玉林,吴 智,蒙国照,谭艳飞
(1.湘南学院基础医学院,湖南 郴州 423000;2.湘南学院生物医药微生物组学重点实验室,湖南 郴州 4230003.郴州市第一人民医院疼痛科,湖南 郴州 423000;4.郴州市第一人民医院内分泌糖尿病科,湖南 郴州 423000)
脂噬是一种选择性的自噬进程,能有效识别并调控脂质代谢,选择性地将脂滴包裹在细胞溶酶体中,脂滴在溶酶体中被酸性脂肪酶降解后送至细胞外的高密度脂蛋白(HDL)中,进而促进胆固醇流出,维持脂质代谢的稳态[1-2]。有研究发现,脂噬减弱会促进动脉粥样硬化(AS)、糖尿病等代谢性疾病的发生和发展[3],也就是说,AS的发生很有可能与细胞内脂噬的减弱有关。
围脂滴蛋白(perilipin2,PLIN2)是PAT家族中的成员之一,在AS发展进程中具有重要作用。有研究证明,PLIN2也可通过激活自噬和刺激胆固醇的外流影响人类对AS的易感性[4],同时在PLIN2缺陷的心肌细胞中,脂噬减弱引起细胞内甘油三酯蓄积[5]。
脂质的异常蓄积是AS发生发展的关键环节,因此研究脂质蓄积的机制对防治AS具有重要意义。结合课题组前期对PLIN2在AS发生发展中的作用机制研究,本研究拟探讨PLIN2在氧化型低密度脂蛋白(ox-LDL)诱导的泡沫细胞形成过程中是否有抑制脂噬的作用,以期为AS的防治和机制研究提供新思路。
1 材料与方法
1.1材料与试剂 RAW264.7巨噬细胞购自中科院上海细胞生物学研究所细胞库;DMEM 高糖培养基(Gibco,8122691);特级胎牛血清(武汉普诺赛生命科技有限公司,164210);oxLDL(广州奕元生物技术有限公司,YB-002);油红O(Sigma,SHBL1039);LC3A/B兔mAb(Cell Signaing Technology,12741);SQSTM1/p62 抗体(Cell Signaing Technology,5114);兔PLIN2的单克隆(Abcam,ab108323);GAPDH多克隆抗体(Proteintech,10494-1-AP);辣根过氧化物酶(HRP)-偶联亲和纯山羊抗兔IgG(proteintech,SA00001-2);特超敏电化学发光(ECL)试剂盒(Beyotime,P0018AM);LipofectamineTM3000(Thermo Fisher,L3000001);si-musPLIN2(HonorGene)。
1.2方法
1.2.1泡沫细胞模型建立 取对数生长期RAW264.7巨噬细胞接种于6孔板中,每孔含完全培养基2 mL,加入终浓度为100 μg/mL的ox-LDL处理12、24、48 h,油红O染色观察细胞内脂质蓄积情况。
1.2.2小干扰RNA的构建和转染 NCBI基因数据库查找鼠源 PLIN2蛋白编码区序列,设计合成小干扰 RNA,具体序列为正义链:5′-GUUCAGAAGCCGAGCAACUAU-3′;反义链5′-AUAGUUGCUCGGCUUCUGAAC-3′。
转染前1 d将细胞接种至培养板中,预计转染时细胞汇片达到70%~90%。转染时,按说明书先用无血清培养基稀释LipofectamineTM3000和siRNA,充分混匀,再在每管已稀释的LipofectamineTM3000试剂中按1∶1比例加入稀释的siRNA,室温孵育10~15 min,最后将siRNA-脂质复合物加入细胞中,孵育2~4 d,分析转染细胞。
1.2.3分组 为研究PLIN2敲减后ox-LDL诱导的泡沫细胞内脂噬基因的变化情况,将细胞分为5组,分别为对照组、空质粒组、ox-LDL处理组、siPLIN2组和siPLIN2+ox-LDL处理组。
1.2.4油红O染色 避光条件下配备油红O工作液,去离子水与油红O储备液比例为2∶3,混匀后用0.2 μm滤膜过滤3次备用。将已做处理的12孔板取出,磷酸盐缓冲液(PBS)洗涤3次,每次10 min,每孔加入4%多聚甲醛1 mL固定细胞30 min,固定完毕,PBS洗涤3次。每孔加入1 mL油红O工作液染色30 min,显微镜下观察细胞脂滴染色情况,PBS洗涤3次。每孔加入苏木素1 mL染核5 s,PBS洗涤3次,显微镜观察染核情况。载玻片滴适量甘油,取出孔板中盖玻片,待表面液体蒸发将其覆于甘油上,封片保存拍照。
1.2.5Western blot 细胞裂解法提取细胞总蛋白,BCA蛋白定量试剂盒测定蛋白浓度。聚丙烯酰胺凝胶电泳后湿转至PVDF膜上,5%脱脂牛奶封闭2 h,稀释后的一抗(PLIN2、LC3、p62、GAPDH)孵育,4 ℃过夜,TBST洗膜3次,每次10 min,HRP标记二抗室温孵育2 h,TBST洗膜3次,采用ECL试剂盒显影。
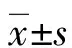
2 结 果
2.1泡沫细胞模型构建 随着ox-LDL处理时间延长,细胞内脂质颗粒逐渐增加,处理12 h脂质颗粒少量增加,处理24 h脂质颗粒增加明显,处理48 h脂质颗粒相对24 h时略多,但细胞形态也变得不规则,提示ox-LDL处理时间过长会改变细胞形态,后续泡沫细胞模型构建实验选择100 μg/mL的oxLDL处理24 h。见图1。
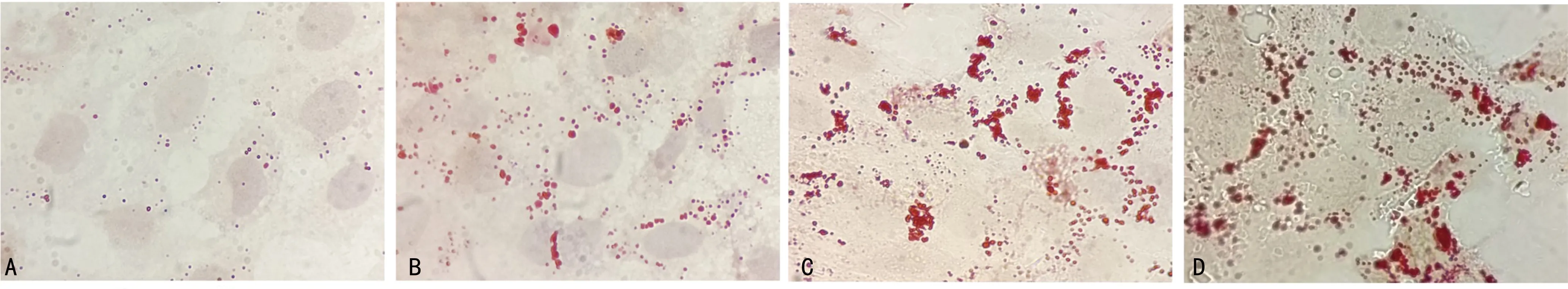
注:A.无ox-LDL处理;B.ox-LDL处理12 h;C.ox-LDL处理24 h;D.ox-LDL处理48 h。
2.2泡沫细胞内PLIN2和脂噬相关基因表达情况 PLIN2在ox-LDL处理的细胞内随着时间延长蛋白含量逐渐增加,48 h增加显著。LC3在泡沫细胞中随着脂质增加呈现递增趋势,48 h达到高峰;而p62蛋白表达量与对照组相比是下降的,在ox-LDL处理24 h时降至最低,48 h略有增加。见图2。也就是说,随着泡沫细胞内脂质的增多,PLIN2和LC3在细胞内的蛋白表达量也是增加的,而p62则呈先下降后增加的趋势,提示脂噬在泡沫细胞形成时随着细胞内脂质蓄积增多是先增强后减弱的。
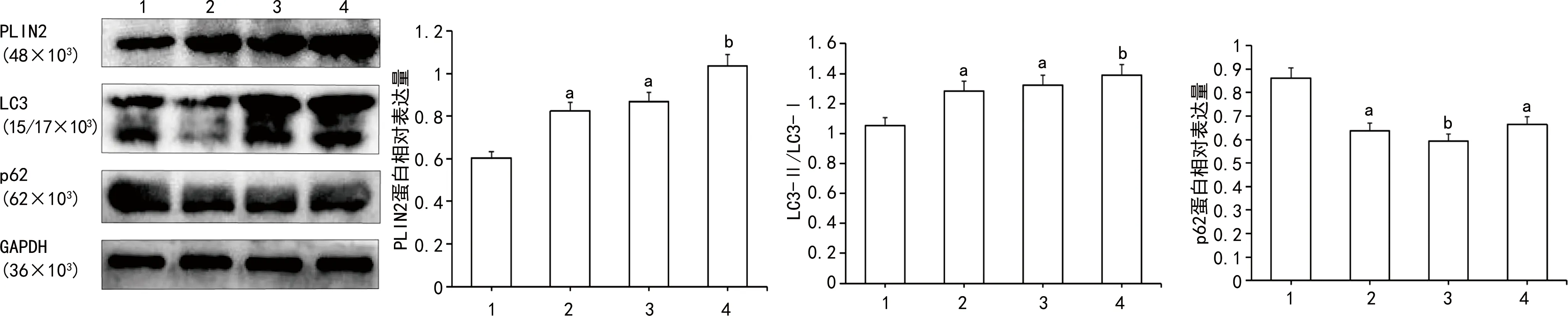
注:1为对照组;2为ox-LDL处理12 h;3为ox-LDL处理24 h;4为ox-LDL处理48 h。与对照组比较,aP<0.05,bP<0.01。
2.3转染 按步骤转染siPLIN2后48 h检测细胞内PLIN2蛋白含量,当转染浓度为30 pmol/μL时转染效率最高,达到60%以上;当转染浓度为20 pmol/μL和50 pmol/μL时,转染效率在50%以下,见图3。说明转染浓度为30 pmol/μL时,PLIN2基因在RAW264.7细胞内沉默效果最佳。

注:1为对照组;2为20 pmol/μL(siPLIN2);3为30 pmol/μL(siPLIN2);4为50 pmol/μL(siPLIN2)。与对照组比较,aP<0.01,bP<0.001。
2.4沉默PLIN2脂噬相关基因变化 PLIN2基因敲除的巨噬细胞内LC3的蛋白表达量明显降低,但在PLIN2基因敲除的泡沫细胞内LC3并没有明显的变化。然而,p62在PLIN2敲除的巨噬细胞内没有明显变化,但在PLIN2敲除的泡沫细胞内却有明显的升高,见图4。说明PLIN2影响了泡沫细胞内脂噬基因p62的表达。
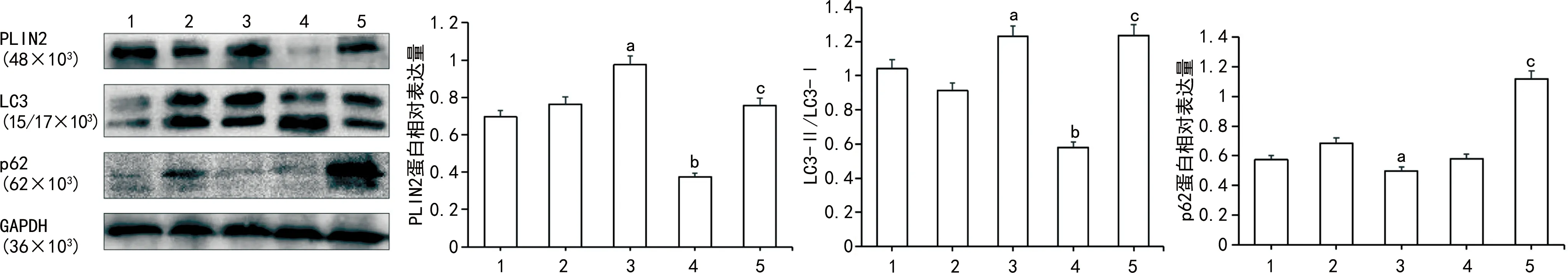
注:1为对照组;2为空质粒组;3为ox-LDL处理组;4为siPLIN2处理组;5为siPLIN2+ox-LDL处理组。与对照组比较,aP<0.05;与空质粒组比较,bP<0.05;与ox-LDL处理组比较,cP<0.05。
3 讨 论
近年来,自噬在AS发生发展中的作用得到了广泛的关注,有研究表明,促进内皮细胞自噬可延缓AS斑块的形成,进而治疗相关疾病[6]。那么,脂噬作为一种特殊类型的选择性自噬,可在细胞内选择性降解脂滴维持细胞内脂质代谢平衡,而且当细胞内的脂噬不足或过度脂噬时都会引起机体脂代谢紊乱导致疾病的发生[7]。有文献报道,在AS保护作用中脂噬在巨噬细胞自噬中发挥了重要作用[8],体内和体外选择性激活和追踪脂噬,充分了解AS中的脂噬机制,确定巨脂噬和微脂噬在AS脂代谢中的作用,发现脂噬在治疗AS相关疾病的治疗潜力是研究者的目的[9]。本研究以PLIN2与细胞内脂质蓄积的关系为切入点,初步探讨PLIN2在ox-LDL诱导的巨噬细胞源性泡沫细胞脂噬中的作用,为发现脂噬在AS中的治疗潜力提供依据。
PLIN2是JIANG等[10]在1992年利用差别杂交筛选技术在脂肪细胞中分离提取到的一种蛋白,后来发现其与脂肪代谢密切相关,不仅促使细胞内脂质蓄积,还抑制细胞内胆固醇的外流,有学者将PLIN2认为是细胞内脂质蓄积的标志物[11]。有研究表明,PLIN2在AS发展进程中一方面可促进巨噬细胞内炎症反应发生;另一方面其也可加速泡沫细胞内脂质的蓄积[12-13]。近年有文献报道,在心肌细胞中PLIN2缺乏会下调细胞内脂噬,从而引起心肌细胞胞内脂质蓄积[4],说明PLIN2与细胞内脂噬有关,那么在AS的泡沫细胞脂噬中PLIN2是否也发挥了作用。本研究表明,在ox-LDL诱导的泡沫细胞中,脂噬相关蛋白LC3的蛋白表达量会随着胞内脂质的增加而增加,此趋势与PLIN2蛋白表达量变化是一致的,而脂噬相关蛋白p62则随着脂质的增多呈先下降后增加的趋势,与LC3相反,表明在ox-LDL诱导的RAW264.7巨噬细胞源性泡沫细胞形成过程中脂噬是先增强后减弱的,这与郑舒展等[14]发现的ox-LDL诱导的THP-1巨噬细胞源性泡沫细胞形成24 h内,LC3比值升高、p62水平降低、脂噬增强,24 h后LC3比值降低、p62水平升高、脂噬减弱存在一致性。
另外,本研究还发现,在RAW264.7巨噬细胞中敲除PLIN2后LC3蛋白表达量降低,提示PLIN2可能有影响LC3表达的作用。有文献提示,在PLIN2缺乏的心肌细胞中溶酶体和脂滴共定位减少,脂噬减弱[4],这与本研究中PLIN2敲除后LC3蛋白表达量下降的结果一致,说明PLIN2有调控脂噬的作用。
同时,本研究还发现,在ox-LDL诱导的RAW264.7泡沫细胞中敲除PLIN2后LC3蛋白表达量变化不明显,但p62蛋白表达量增加,提示PLIN2在泡沫细胞脂噬中有下调p62蛋白表达,增强脂噬的作用。而有文献报道,白藜芦醇可通过上调人脂肪变性HHL-5细胞的PLIN2表达,促进脂噬相关分子LC3β和Rab7的表达,从而增强脂噬缓解细胞内脂质蓄积[15],与本研究中泡沫细胞内PLIN2增强脂噬的结果一致。但是,PLIN2调节泡沫细胞内脂噬的机制尚不清楚,有待进一步研究。
综上所述,本研究证明了在RAW264.7巨噬细胞内PLIN2有调控脂噬的作用,在ox-LDL诱导的泡沫细胞形成过程中,脂噬随着细胞内脂质增加先增强后减弱,同时,在PLIN2敲除的泡沫细胞内,p62蛋白表达量明显增加,脂噬减弱。在AS发生发展过程中,泡沫细胞的形成是重要的一环,若能通过增强脂噬,延缓泡沫细胞和AS斑块的形成速度,那么在治疗冠心病、脑血管疾病和糖尿病等AS相关疾病的方法和手段上便可以提供更多的可能。