某院临床试验用药品质量管理体系的构建
2023-12-15吕金鹏郭小彬
周 燕 吕金鹏 岳 磊 张 勇 郭小彬
内蒙古自治区人民医院药学处,内蒙古呼和浩特 010017
药物临床试验的研究对象是试验用药品,试验用药品管理是药品全生命周期管理的重要环节,对试验用药品管理贯穿于临床试验全过程。试验用药品管理其执行过程是一项极为严谨的工作,需遵循多项药物管理法规的要求,将试验用药品管理形成体系化建设,可保证试验用药品规范化管理。从内蒙古自治区人民医院(本院)实践情况来看,建立专门的临床试验药房,配置齐备的药品管理设施设备,由专职药学专业人员依据国家的法律法规、管理制度和标准操作规程集中管理试验用药品,并不断提升信息化管理水平,可有效保障受试者用药安全,确保试验结果科学可靠[1]。建立既符合法规要求又能适应本院实际情况的较为完善的临床试验用药品质量管理体系,需要长期努力、多方协调才可能达成,这个管理体系的建立和运行,也必将推动本院临床试验质量规范化管理的进程。
1 本院试验用药品质量管理体系构建的效果评价
经统计,本院临床试验药房2018—2021年共管理85项药物临床试验涉及257种试验用药品,临床试验药房各项工作量逐年增加(图1)。257种试验用药品以药品药物剂型、适应证、存储温度分别统计,发现试验用药品以口服用药为主(图2),适应证以抗肿瘤药物为主(图3)。
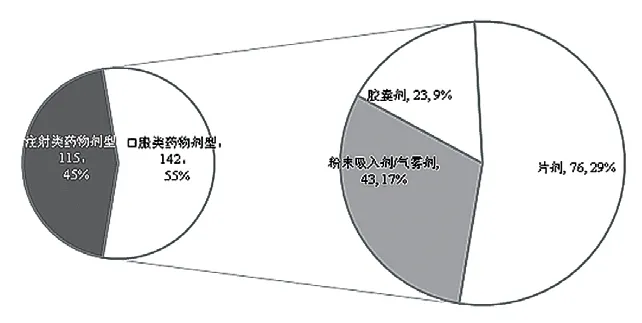
图2 本中心试验用药品剂型分类
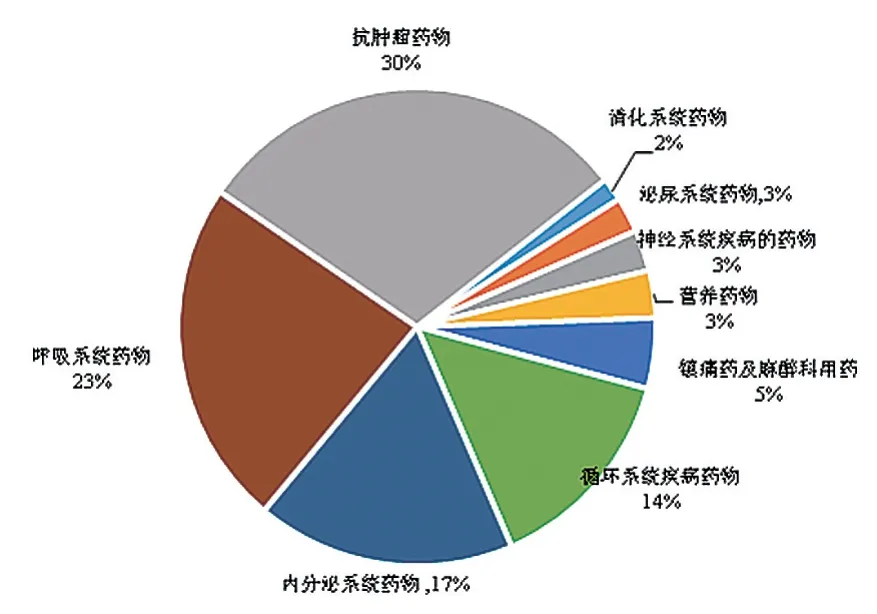
图3 本中心试验用药品适应证分类
试验用药品主要以常温保存共计135种(表1),值得注意的是试验用药品中非试验药物管理任务也很艰巨,占到工作总量的46%。这提醒申办方使用的交互式网络响应系统(interactive web response system,IWRS)并不能满足所有试验用药品的管理,机构应建立自身的管理系统强化临床试验用药品管理,使信息化管理系统覆盖到所有临床试验用药品中。
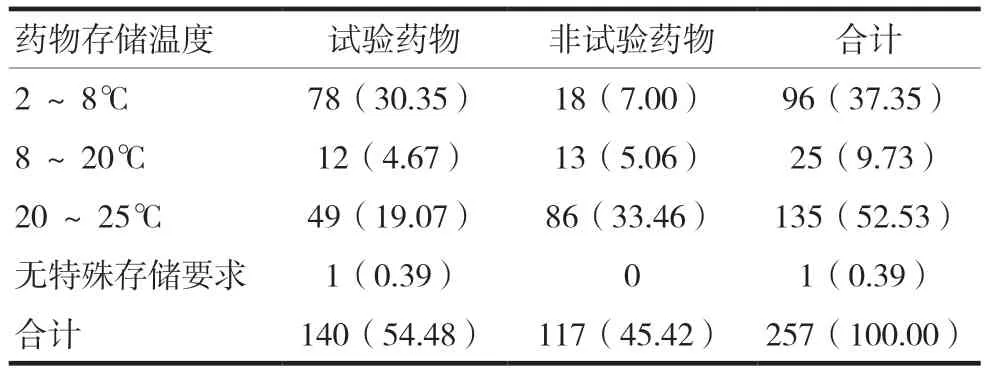
表1 本中心试验用药品存储温度分层管理情况[n(%)]
本院临床试验药房2018—2021年共接收药品/回收920批次,试验用药品管理中共发生药物不良事件37次(表2),其中申办方原因导致的药物不良事件19次。临床试验药师均在试验早期发现存在的质量风险,对试验用药品进行了退回或隔离处理。如一项抗生素Ⅲ期临床试验,试验药物包装不符合规定,试验用药品外包装未注明试验药品有效期,口服用药物外包装未注明药品规格。一项胰岛素Ⅲ期临床试验,来药与运送清单药物信息不符。一项治疗骨质疏松症的Ⅲ期临床研究,辅助用药维生素D未加贴临床试验专用标签。一项口服抗肿瘤药物Ⅲ期临床试验,药品接收时发现一盒药品药盒明显霉变。一项高血压临床试验,试验用药品粘贴附加标签覆盖原有的有效期,进行药品有效期延期,但不能提供新效期依据的药物稳定性报告。一项麻醉止痛药物临床试验,药物回收时,申办方未办理麻醉药品运输手续。以上事例说明临床试验药师的存在对试验用药品不良事件信号的发现具有重要的意义,申办方和研究机构需共同努力进一步降低试验用药品供应、存储等环节中不良事件的发生。
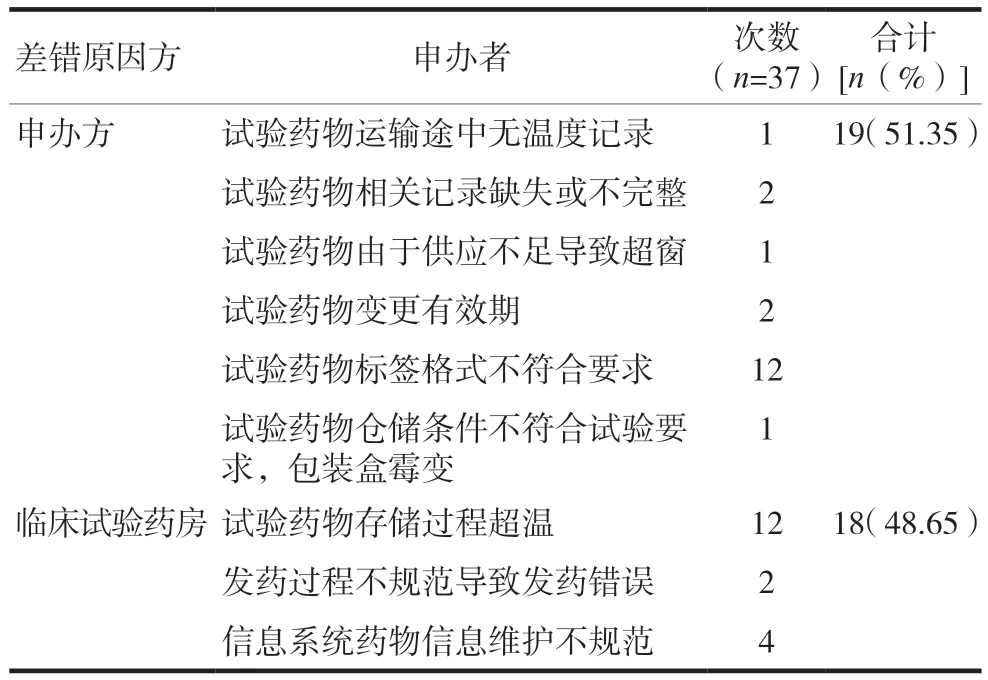
表2 临床试验药房异常事件统计
2 提升本院试验用药品质量管理体系
2.1 建立试验用药品信息化管理系统,强化过程质量控制
为确保受试者的医疗记录载入门诊或者住院病历系统,杜绝发药过程不规范引起的发药错误,我院临床试验药师提出信息化改造思路,信息工程师将临床试验药物库和临床试验药房管理系统嵌入医院信息系统(hospital information system,HIS)中,实现临床试验用药品管理全过程可溯源[2]。
临床试验药师将试验用药品信息从临床试验药库录入后,在临床试验药房申请出库意向试验用药品,该药品信息将被请领转入临床试验药房。研究者在HIS系统开具医嘱时关联临床试验药房即可实现试验用药品的随访开具。在实践中,不断细化试验用药品的维护信息,完善临床试验药房发药窗口页面(图4),使临床试验药师可获取充足的受试者发药信息,包括处方日期、处方号、患者姓名、药品名称、药品规格、本次开药数量、剂量、用法、药品产地、开药医师、发药药师等。临床试验药师在临床试验药房发药账单查询窗口(图5)可根据患者卡号、处方号、患者姓名、药品代码设定开始日期、结束日期完成发药查询,跟踪试验用药品的流水账信息,此功能可协助临床试验药师及项目监查员快速完成项目药品的监查工作。临床试验药师在临床试验药房库存查询窗口(图6)可及时进行试验用药品的库存查询,所有试验用药品的药品代码、药品名称、规格、库存量等信息均一目了然,方便日常盘点、项目监查及回收工作。通过临床试验药物库和临床试验药房管理系统实现本院临床试验药物的信息化管理,做到院内试验用药品最小药品包装单位的追溯,更好地满足临床试验数据核查的要求。
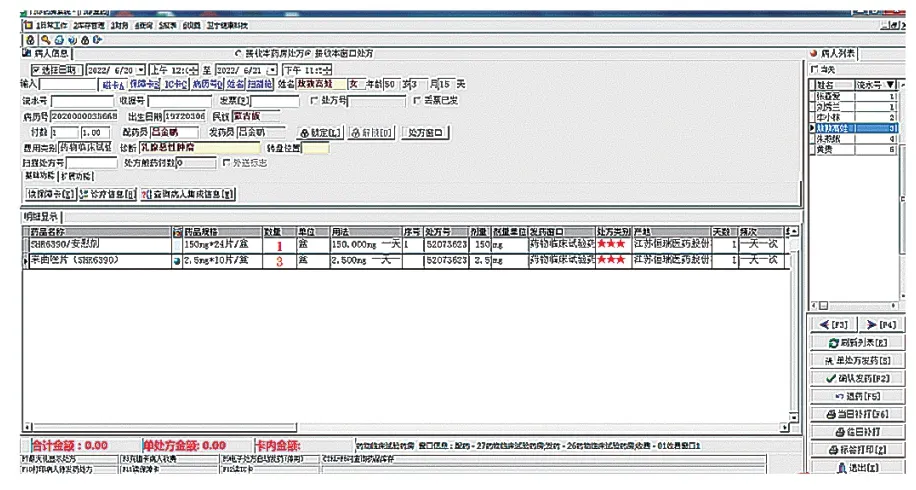
图4 临床试验药房发药窗口
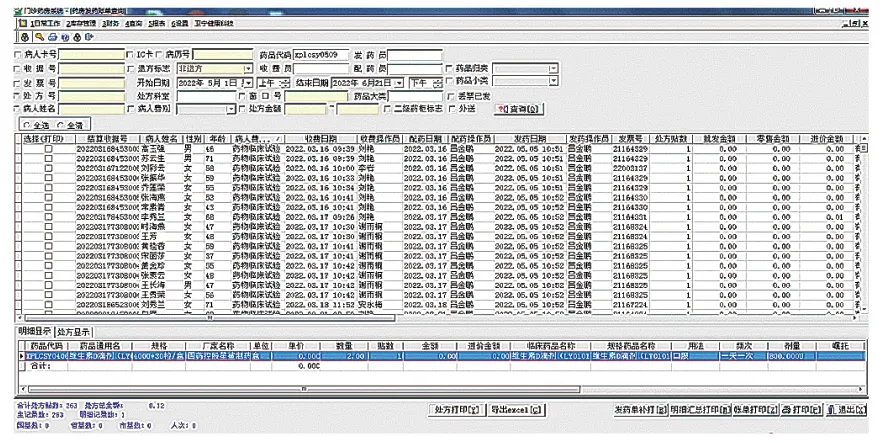
图5 临床试验药房发药账单查询窗口
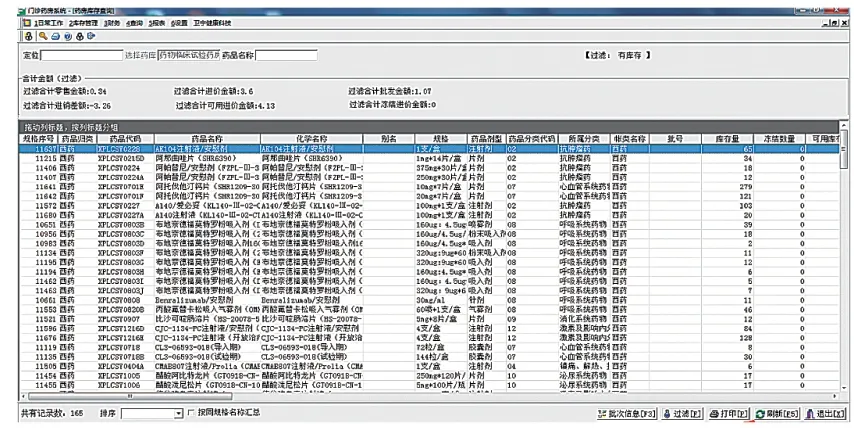
图6 临床试验药房库存查询窗口
2.2 全面升级药房硬件设施,降低试验用药品存储风险
本院临床试验药房60 m2,设有试验药物存储区、药品接收区/发放区、文档管理区及办公区,另设试验用药品回收药房17 m2。临床试验药房配备专用药架、药柜、医用冰箱,保证各项目试验用药品的存储空间;配有台式文件柜、电脑、打印机等办公设施;安装海尔冷链温控系统、ZY-4C气体灭火控制器、院内联网监控系统实现药房环境实时监控。药物管理员对试验用药品按照储存要求分区管理,目前设定3个温控储存区间可满足所有试验用药品的多种储存要求,冷藏箱(2~8 ℃)设置为4 ℃、医用阴凉柜(10~20 ℃)设置为16℃、室温(10~30 ℃)空调设置为23 ℃,完备的药房硬件设施,是降低试验用药品存储风险的保障基础。
2.3 构建机构、科室药物管理员互补模式
本院机构办公室在认真分析试验用药品管理关键环节的基础上,制定符合自身情况的试验用药品管理模式(图7)。临床试验药师是临床试验机构任命具有药师资质并经过药物临床试验质量管理规范培训的专职试验用药品管理人员,负责试验用药品在临床试验机构的收发、贮存、登记,试验用药品责任记录表等一系列处置环节,是确保受试者按方案要求使用试验用药品的重要抓手。
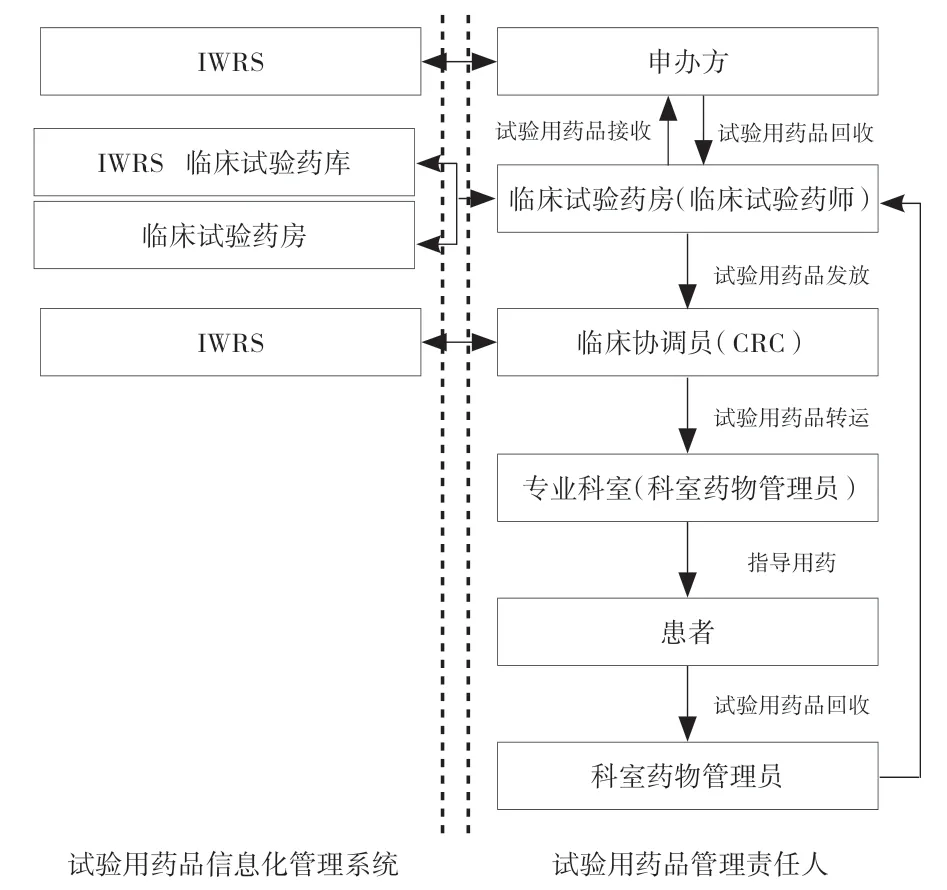
图7 试验用药品管理模式
临床试验药师和科室药物管理员分工各有侧重点,临床试验药师的配备不是取消科室药物管理员的存在,而是实现人岗相适、人事相宜。临床试验药师的管理侧重点在试验药物的质量管理,妥善管理试验用药品的接收、储存、发放、回收等过程,临床试验药师对科室药物管理员有培训的职责,不定期对科室药物管理员试验项目进行质控。科室药物管理员的管理侧重点是受试者的用药管理,监护受试者用药,负责做好试验用药品的配置、使用,对受试者的用药方法、日常生活给予指导,从而提高受试者依从性,降低受试者脱落率。
2.4 完善试验用药品管理制度
本院药物临床试验办公室依据《药品管理法》《药品注册管理办法》《药物临床试验质量管理规范》《药物临床试验机构管理规定》《药物警戒质量管理规范》《药品经营质量管理规范》《京津冀药物临床试验机构日常监督检查标准》《药物临床试验 药物管理·广东共识》《药物临床试验 实施中盲态保持·广东共识》等法规、规章、规范性文件,结合我院在实际工作中遇到的各种试验用药品管理问题(表2),开展多维度多层次试验用药品管理制度和标准操作规程(standard operating procelure,SOP)制定工作(表3),保证试验用药品管理过程中各环节的完整性。

表3 临床试验药房主要制度/标准操作规程
2.5 建立试验用药品管理服务收益机制
《ASHP临床试验用药品管理指南》[3]中指出,研究机构需对临床试验药房进行预算管理,建立资助模式支持临床试验药房的运行,本院将药物管理费纳入临床试验合同中[4],由申办方支付机构药物管理费以提供试验药房运转费用。本院临床试验药房制定药物管理费预算公式,药物管理费由药物日常养护费和试验用药品调配费两部分构成。药物日常养护费按照试验用药品保存时长收取,产生于药物管理员定期对试验用药品进行表格登记、温湿度记录、药物数量清点、近效期药品登记、药物总台账核对、药物批次接收/回收/退还/销毁、资料保管等工作。试验用药品调配费按照受试者入组例数、试验用药品发药次数收取,产生于受试者随访日药物管理员对试验药物的随机、分发、回收、表格登记等工作。药物管理费的收取使本院机构办公室在提供精细化临床试验药物管理服务的同时,为医院绩效管理提供考核依据,促进试验用药品管理水平的持续提高[5]。
3 对未来试验用药品质量管理体系构建工作的思考
3.1 带动本院药物临床试验精细化服务
临床试验药房与静脉药物调配中心(pharmacy intravenous admixture services,PIVAS)建立服务通道,PIVAS药师负责配置细胞毒性药物及需非盲态人员配置的针剂药物,在立项前由临床试验药师联系PIVAS药师,确认适合本方案的配制步骤和运输流程。启动会前PIVAS药师、转运研究护士及临床协调员接受申办方及临床试验药师的专门培训。试验用药品的配置由PIVAS药师完成,保证了细胞毒性药物配制工作的规范性,同时在空间上创造条件降低试验用药品破盲风险[6-7]。
3.2 建立药物临床试验机构办公室自身的科研服务体系
现在多个医院已将药物临床试验作为研究型医院建设和医院科研管理的重要工作内容来实施,临床试验机构办公室已逐步走向以学科建设为核心、科学管理和服务的部门。临床试验药师在实际工作中需将“科研”及“管理”结合起来。药物警戒体系建设提出药物临床试验期间需有效保护受试者,控制安全性风险。《药物警戒质量管理规范》(2021年局令第65号)自2021年12月1日起正式施行,药物警戒制度建设作为一种药品安全风险社会共治的机制,要求药物临床试验机构协同申办者开展与注册相关的上市前的临床试验药品安全性信息监测活动[8]。研究机构作为受试者安全获悉的第一主体,受试者的用药监护、药物过敏与输液反应的应急预案等工作都值得临床试验药师深入研究[9]。临床试验药师通过在实践中不断探索和完善试验用药品管理方法,制定并推荐统一的实践标准,为药师和机构提供有关试验用药品管理最佳实践的指导,并建立临床试验药学服务最佳实践模式[10-11],提高临床试验药师自身的相关职业技能,体现研究型药师的职业价值,实现机构办服务平台促进临床试验建设的目的。
3.3 助力药物临床试验监管
试验用药品管理是药物临床试验质量管理中非常重要的一个环节,是整个临床试验质量的源头[12]。探索建立结合药物发放信息化的药物临床试验质量控制模式[13],保障试验数据的真实性、完整性、规范性,构建科学化、规范化的临床试验用药品质量管理体系,从而提高临床试验机构的组织管理能力[14-15],助力药物临床试验监管水平提升。
