海洋链霉菌次级代谢产物研究进展
2023-12-14陈巧莉黄杰陈森瑜潘少婷唐灵芝洪璇
陈巧莉,黄杰,陈森瑜,潘少婷,唐灵芝,洪璇
1.厦门医学院,厦门市海洋药用天然产物资源重点实验室,福建 厦门 361023;2.厦门医学院,海洋生物医药资源福建省高校工程研究中心,福建 厦门 361023;3.厦门医学院药学系,福建 厦门 361023
链霉菌属(Streptomyces),隶属于细菌界,放线菌门,放线菌纲,放线菌亚纲,放线菌目,链霉菌亚目,链霉菌科(Sterptomycetalidae)。链霉菌具有发育良好的分枝菌丝,菌丝无横隔,分化为营养菌丝、气生菌丝和孢子链[1]。链霉菌是最高等的放线菌,在放线菌中占比最高。研究发现,链霉菌不仅广泛分布于陆地,在海洋中也多有踪迹。海洋链霉菌主要来源于海洋动物、海洋植物、海泥和海水等[2]。本文对近几年文献进行了梳理,以海洋链霉菌的次级代谢产物为核心,对其生物活性物质、选育与发酵培养进行综述,以期在海洋链霉菌的培养发酵及开发新型的海洋药物等方面提供参考和借鉴。
1 海洋链霉菌具有生物活性的次级代谢产物
与其他细菌相比,链霉菌具有较为复杂的发育分化过程,在形态分化的同时伴随着复杂的生理变化和大量的次级代谢产物合成[3]。此外,链霉菌所产生的次级代谢产物具有丰富的生物活性,可应用于医药、食品、农业等多个领域。
1.1 抗菌类
目前,大约有75%的工业抗生素来自于链霉菌。链霉菌的次级代谢产物因具有较强的抗菌活性受到人们的广泛关注。研究人员从海洋链霉菌Streptomycessp. S598 发酵液中分离纯化得到二活菌素(图1-1),其具有显著的广谱抗细菌活性,对金黄色葡萄球菌、粪肠球菌、肺炎克雷伯菌的最低抑制浓度(minimum inhibitory concentration,MIC)为5 μg·mL-1,对大肠埃希菌、鲍曼不动杆菌的MIC为2.5 μg·mL-1,对肺炎链球菌、流感嗜血菌的MIC 为0.125 μg·mL-1。此外,还具有显著的抗革兰氏阳性菌活性,其中对耐甲氧西林金黄色葡萄球菌(MRSA)28300的MIC<0.125 μg·mL-1[4]。
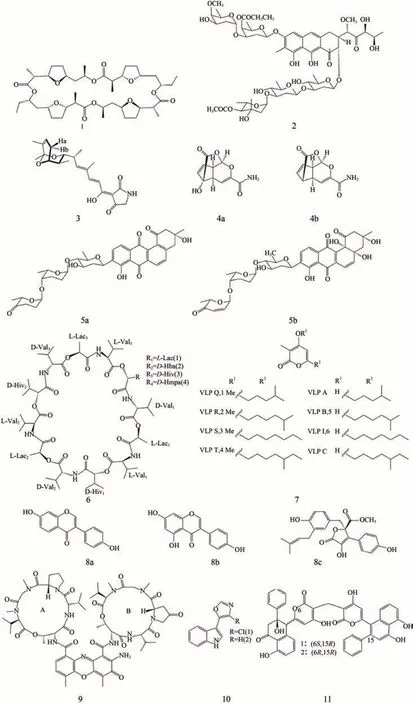
图1 化合物1~11的结构式Fig. 1 Structures of compounds 1~11
近年来,由于人们过度使用抗生素,导致多重耐药性细菌的出现。一些研究人员开始关注海洋链霉菌次级代谢产物对耐药菌的影响。Cho 等[5]从来源于海洋的链霉菌MBTI36 中提取到一种新的色霉素(图1-2),对MRSA 具有有效的抗菌活性,在21 次传代实验中观察到该色霉素对MRSA的MIC 从0.13 μg·mL-1增加到0.25 μg·mL-1,提示在21 次传代过程中未检测到耐药性(在此研究中,耐药性被定义为比初始MIC增加超过4倍)。此外,有研究从海洋链霉菌属307-9中分离出具有抑制抗万古霉素粪肠球菌活性的新型替达霉素(图1-3),这些发现有可能缓解抗生素的耐药性危机[6]。
银纳米颗粒(silver nanoparticles,SNPs)作为抗菌材料,具有化学性质稳定、耐光和耐热的特性,在医学上应用广泛且有望代替抗生素。现阶段放线菌已被确定为各种来源的金属纳米颗粒的有效合成剂,可通过微生物合成得到高效能高产量 的SNPs。2022 年,Sobhy 等[7]将 海 洋 来 源 的StreptomycesrocheiMS-37 的次级代谢物与硝酸银结合作为创建SNP 的前体,合成生态友好型SNPs。随后通过一系列活性及安全性检测证明该SNPs 对从牙龈炎标本中分离的口腔生物膜具有出色的抗菌活性,为使用海洋放线菌进行银纳米颗粒生物合成开辟了一条新途径。同年,Maha等[8]从海洋中分离出一种新的链霉菌M2,经基因鉴定后用于硝酸银绿色合成SNPs。利用刃天青微量滴定稀释法对所得的SNPs进行评估,结果表明其对多重耐药细菌具有良好的抗菌活性,其中对铜绿假单胞菌的MIC 最低,为2 μg·mL-1,对奇异变形杆菌的MIC 值最高,为64 μg·mL-1。此外,研究人员还发现将SNPs 与哌拉西林-他唑巴坦联用对实验中所有的革兰氏阴性菌具有协同抗菌活性。
1.2 抗肿瘤类
海洋链霉菌除了广泛应用于抗生素外,在抗肿瘤领域也有巨大的潜能。洪玉林等[9]从海洋放线菌Streptomycessp.中分离出新的次级代谢产物Lu01-M,结果发现Lu01-M 对前列腺癌症细胞(PC3、 DU145、 LNCaP)具有强大的抗增殖活性,其半抑制浓度(50% inhibiting concentratior,IC50)分别为1.03±0.31、2.12±0.38、1.27±0.25 μg·mL-1,在前列腺癌抗癌剂开发中具有潜力。古静燕[10]对来自胶东半岛沿海的放线菌进行抗肿瘤筛选,发现海洋白浅灰链霉菌(Streptomycesalbogriselous)A2002中代谢的一类三环缩醛内酯素类化合物具有潜在的抗肿瘤活性。其中,5-羟基三环缩醛内酯素(图1-4a)浓度为1.56 μg·mL-1时,呈典型的G2/M期抑制,并在3.16~6.25 μg·mL-1达高峰,抑制率达到57.2%;三环缩醛内酯素(图1-4b)浓度为25 μg·mL-1时表现出G2/M期抑制活性,50 μg·mL-1抑制活性最强。赖珍珠[11]对来源于南海深海的链霉菌StreptomyceslusitanusSCSIO LR32 的次级代谢产物进行探究,发现链霉菌StreptomyceslusitanusSCSIO LR32 生产的6 种角环素类化合物中化合物grincamycin J(图1-5a)和化合物A-7884(图1-5b)对5 株人肿瘤细胞(乳腺癌细胞MDA-MB -435和MDA-MB-231、人大细胞肺癌细胞NCI -H460、人结肠癌细胞HCT -116、人肝癌细胞Hep -G2)有明显的细胞毒性,对上述细胞的IC50值在0.4~6.9 μmol·L-1之间。
1.3 抗病毒类
与细菌相比,病毒的变异能力更强。一些学者也从链霉菌中提取出具有抗病毒活性的代谢产物。Nayer 等[12]使用MTT 比色法评估来自链霉菌属NFM6 提取物的抗病毒活性,结果表明提取物在无毒浓度下对单纯疱疹病毒、甲型肝炎病毒、柯萨奇B4病毒表现出良好的抗病毒活性,选择性指数分别为13.25、9.42 和8.25。Joko 等[13]检测了来自海洋黄瓜相关细菌链霉菌SV 21 产生的4 种缬氨霉素及其类似物(图1-6)的抗病毒作用,结果显示缬氨酶素(R3)及其类似物(R2和R4)具有较强的抗丙型肝炎病毒作用。Wang 等[14]研究发现海洋来源的优素菲链霉菌OUC6819 通过异源表达三型聚酮合酶基因VioA 产生了6 种紫罗兰酮(图1-7),其中所有甲基化的VLP(1-4)均显示出比非甲基化的VLP(5-6,A,C)具备更好的抗甲型流感病毒活性,其IC50值为30.6~132.4 μmol·L-1(抗H1N1活性)和45.3~150.0 μmol·L-1(抗H3N2活性)。
1.4 激素类
链霉菌次级代谢产物包括植物激素类物质,比如生长素、赤霉素等。赵韵宇等[15]从海洋链霉菌6-1 发酵液的乙酸乙酯萃取物中分离得到3 个单体化合物(图1-8a、8b、8c),其中5,7,4-三羟基异黄酮是一种酪氨酸激酶抑制剂,具有抑制免疫细胞活性,其结构与雌激素结构相似,因而具有类雌激素和抗雌激素活性的双重作用及抗骨质疏松功能。Liu 等[16]从大豆(Glycine max)及其根际土壤中分离得到链霉菌NEAU-S7GS2,并证明其具有产生植物激素吲哚乙酸(indoleacetic acida,IAA)的潜力,最大产量为17.54±0.61 μg·mL-1。麻金金等[17]从玫瑰黄链霉菌NKZ-259的发酵培养中发现其次级代谢产物IAA,通过对发酵培养基的优化,IAA 的产量比原始培养基提高了3 倍,从而为后期IAA 的分离纯化及制剂开发奠定了基础。
1.5 色素类
近年来,微生物合成的色素分子在食品和药物工业领域应用广泛,因此能够产生多种色素的链霉菌属在生物技术应用领域获得了一定关注。如Chatragadda 等[18]发现从沿海沉积物样本中分离的链霉菌BSE6,在含有2% NaCl 的Minimal 肉汤及其他培养基中产生粉红色色素。Wei 等[19]研究从海洋蓝链霉菌中分离的一种产生明亮橙黄色色素的放线菌素X2(AC.X2)(图1-9),其在染色实验中相较于棉织物、丝绸织物具有更好的颜色强度、保色性、堆积能力等天然染料活性,且经染色的丝绸织物较未染色织物具有良好的色牢度和紫外线防护能力。Selvakumar 等[20]研究从海洋海绵中分离出来的链霉菌菌株AQBWWS1,发现在荧光白光下发酵该菌可生成食品级色素类胡萝卜素,这将有利于进一步研究食品级色素的大规模生产及其作为食品着色剂和饲料添加剂的可能。Sheefaa 和Sivaperumal[21]在 海 洋 沉 积 物 中 初 步 分离出一类链霉菌属微生物,对此微生物进行总抗氧化活性、DPPH自由基测定和脂质过氧化测定,发现该微生物具有产生黑色素的能力,并显示出潜在的抗氧化特性。在DPPH浓度测定中,150 μg·mL-1的黑色素显示出93.47%的清除率。
1.6 酶类
链霉菌属能够产生很多酶类物质,如蛋白酶、几丁质酶、果胶酶等。Priyanka 等[22]从红链霉菌VITSS1 中纯化了一种纤溶蛋白酶。张宏宇等[23]从渤海湾分离的海洋链霉菌CC0208中发现了20种与纤维素降解密切相关的酶,这将有助于科研工作者破解纤维素降解机制。陈瑞勤等[24]研究了来自北极海洋的链霉菌604F卤化酶的基因特征,发现Streptomycessp. 604F能够产生新的非色氨酸卤化酶,为后续寻找目的卤化物提供了指导。链霉菌所产生的酶类化合物在食品保鲜领域也有一定的应用潜力。例如,研究人员制备了一种来自海洋链霉菌S1 的新型糖苷水解酶(glycoside hydrolases,GH)家族46 壳聚糖酶(SlCsn46),发现纯化的SlCsn46 在pH 6.0 和50 °C 下表现出最大的活性。通过调整SlCsn46 的添加量,研究人员发现SlCsn46 对其水解2%和4%胶体壳聚糖表现出更高的效率,并且能够制备聚合度2-4、2-5 和2-6 的低聚壳聚糖(chitosan oligosaccharide,COS)。这3种COS 可以有效延长预包装豆腐的保质期,在食品保鲜中有潜在的应用价值。此外,研究人员还发现二价锰离子可作为活化剂,提高SlCsn46 的稳定性[25]。
1.7 酶抑制剂类
海洋链霉菌不仅能够产生酶类次生物质,还具有抑制酶活性的代谢产物。江宏磊等[26]从海洋来源链霉菌FIM090041 中分离到2 个吲哚生物碱类活性化合物(图1-10),对神经氨酸酶具有一 定 的 抑 制 作 用,IC50分 别 为67.8 μmol·L-1和122.8 μmol·L-1,抑制常数分别为13.5 μmol·L-1和21.6 μmol·L-1。陈 正 波 等[27]从 链 霉 菌 属 OUCMDZ-3434 发酵液中发现2 个新的差向异构聚酮(图1-11),并将其命名为Wailupemycins H(1)和I(2)。实验人员利用对硝基苯基-α-D-吡喃葡萄糖苷作为底物测定化合物的α-葡萄糖苷酶抑制作用,发现这2 个化合物对α-葡萄糖苷酶具有抑制作用,且在MTT 法对小鼠小肠IEC-6 细胞系的细胞毒性研究中低于阿卡波糖对照组。这有望为合成不良反应更低的α-葡萄糖苷酶抑制剂提供新的材料[27]。
1.8 毒素类
毒素会抑制重要的细胞生理过程,包括DNA的复制、mRNA 的合成和翻译等,因此了解链霉菌产生的毒素具有重要意义。从深海来源的链霉菌SCSIO 02999 中鉴定并表征了一个新的深海抗毒素系统,并证明该系统中的VapC毒素可以交叉激活大肠杆菌中的TA 操纵子,过量VapC 的产生可以强烈抑制细胞生长,并导致大肠杆菌中含有气泡的形态[28]。杨闰英等[29]通过利用合成的寡聚核苷酸片段从质粒pOS1000中分离出具有适合克隆位点的苏云金芽孢杆菌(Bacillus thuringiensis)δ-内毒素CryIA(c),引入铅青链霉菌(Streptomyces lividans)JT46 后发现链霉菌所表达出的δ-内毒素CryIA(c)对小菜蛾有毒杀作用,致死率达57 %。目前国内外对海洋链霉菌的毒素研究较少,但毒素的潜在价值不容忽视。
2 海洋链霉菌的选育及发酵培养
近年来,国内外的研究人员从海洋中筛选出具有多样活性的链霉菌,进而从中分离提取得到丰富的代谢产物,受到业界广泛关注。然而,由于微生物的生物合成受外部影响,制约着实验后续产物分离以及活性物质的药用价值研究,所以通过发酵培养技术来改善微生物的代谢情况也是研究热点。海洋链霉菌的生长繁殖及其次级代谢产物的产生依赖于特定的生长环境,适宜的发酵条件能够提高链霉菌次级代谢产物的产率。因此,找寻能提高海洋链霉菌次级代谢产物产率的发酵条件以及发酵技术,能够为进一步实验研究提供帮助。
2.1 海洋链霉菌的筛选和育种
2.1.1 传统育种 链霉菌的发酵培养方法种类繁多,最为传统的当属从海洋环境中筛选出具有活性的菌种进行育种。经历菌种分离、初筛、复筛和大规模培育,最终得到一定规模数量和质量的海洋链霉菌。如郑红芸等[30]以广西茅尾海红树林植物根围淤泥的链霉菌作为研究对象,从中筛选得到3 株链霉菌(K57M、K51M、K131M)具有较强的抗菌活性。但传统发酵筛选育种方法,是从自然界中直接进行筛选,存在突变率低、对于所需正向活性的突变率小、筛选工作量大、培育时间长等问题,故需要新的育种技术来提高选育效率,为提取海洋链霉菌中活性成分提供帮助。
2.1.2 诱变育种 物理化学诱变育种是一种快速诱导菌种进行突变,从而筛选出具有优秀活性菌株的一种方式。通常采用化学试剂诱变或物理方式射线诱变菌株进行突变,如盖翠娟等[31]对分离自北极沉积物的海洋链霉菌(Streptomycessp.)YB-24 菌株进行紫外线与氯化锂复合诱变,获得的高产菌株代谢星形孢菌素的能力提高了342.28%。李鹏等[32]对从浙江舟山群岛海域潮间带海泥样中筛选到的1 株玫瑰暗黄链霉菌A46 进行紫外线和DES 诱变育种,得到的突变株酶活提高了213.3%。虽然诱变育种有时可大幅度提高活性,但是诱变育种所得的菌株易出现生产活性物质和次级代谢产物能力低下、致死率较高等问题,且此方法的突变没有方向性,筛选鉴定的工程量巨大,也需要快捷的筛选方法相配合。
2.1.3 原生质体融合育种 原生质体融合育种即采用遗传的活性性状不同的亲本菌株进行原生质体融合得到兼具双亲优良活性性状的融合菌株。原生质体融合育种可以对优秀的菌种进行基因组重排,从而获得具有良好活性且遗传稳定的融合菌株。如侯孝仑等[33]采用溶菌酶处理链霉菌获得原生质体,选育出了链霉菌高产菌株。经原生质体融合的高产菌株的酶活力比亲本高22.4 %,经摇瓶验证产酶比对照提高了16.28 %。这说明原生质体融合技术对于已获得的2 种优良性状的菌株可以进行融合,并可获得兼备2 种优良性状的融合菌株。但对于未知菌株,此育种方式同样存在育种的不确定性、操作难度较大及过程较繁琐等问题,需要与几种育种方式结合并用。有研究对基因组重组技术进行优化升级,发明了一种高效的Genome shuffling 育种技术。与经典的诱变方法相比,Genome shuffling 技术可以对链霉菌菌株进行基因组改组,且这些菌株中多包含有多种正向突变产生活性性状,从而可筛选出具有优良性状的链霉菌菌株,在很大程度上弥补了经典诱变方法的缺陷[34]。
2.1.4 基因工程育种 基因工程育种即基因编辑技术育种,其为菌种的遗传性状改良和活性物质研究提供了新的思路。随着链霉菌的基因组测序技术以及蛋白相关工作的发展,链霉菌中许多蛋白的功能以及调控机制被逐渐挖掘,基因工程技术更广泛地运用到链霉菌的育种当中。
有学者对天蓝色链霉菌相关蛋白SCO4184进行了功能性研究,发现SCO4184 能够影响天蓝色链霉菌A3(2)的细胞壁和细胞分裂,从而影响其产孢及次级代谢过程[35]。另有学者对其功能调节基因scrX进行研究,发现scrX基因在天蓝色链霉菌的孢子形成过程中可能起到正调控作用[36]。因此,借助基因工程技术对链霉菌的孢子产生以及次级代谢产物进行正向调控,可以培育出活性更高的链霉菌菌株。
此外,在基因水平上对链霉菌进行全基因组测序,找到代谢基因簇可对编码次级代谢物可能的活性进行推测。刘象博等[37]对海洋链霉菌的次级代谢产物芳香聚酮的基因簇进行功能表达,并确定次级代谢产物与基因簇的关系。Jiang 等[38]发现沉默的生物合成基因簇被外源因子激活能够促进次级代谢产物的合成。研究表明,链霉菌在实验室正常培养条件下,大多数次级代谢物生物合成基因簇(SM-BGC)是沉默的,而含霉菌酸细菌与链霉菌菌株进行共培养可以激活放线菌中的隐性SM-BGC[39]。
目前,海洋链霉菌次级代谢产物基因工程的相关研究尚不丰富。常采用转化、转导和接合转移等方式对海洋链霉菌进行研究。有研究利用遗传转化系统从次级代谢产物中分离获得了全霉素[40]。未来可通过建立完善的遗传转化系统对链霉菌基因进行改造,得到更多具有生物活性的次级代谢产物。
2.2 海洋链霉菌的发酵培养
环境是影响链霉菌生长及其次级代谢产物产量、活性的重要因素。海洋链霉菌的最适生长温度是28~30 ℃,可通过多培养因素控制变量法寻找培育海洋链霉菌的适宜条件,精准调控海洋链霉菌培育发酵条件,进而影响菌株的生长繁殖速率、次级代谢产物的生成。
常见的海洋链霉菌培养基有高氏一号培养基、马铃薯培养基、肉汤培养基、燕麦琼脂培养基等。部分海洋链霉菌生长具有一定的海洋生境依赖性,通常在具有盐分的培养基中培养。有研究从南海碳酸盐结核样本中分离出一种新型海洋链霉菌Streptomycesoceanisp. nov.,发现该菌株的生长需要添加海水或者补钠培养基(ISP 2肉汤培养基),且可在NaCl 浓度、温度范围和pH 分别为2.5%~12.5%、15~40 °C 和pH 6~8 环境生长,其中最佳条件分别为3%~5%、28~30 ℃和pH 7.5[41]。此外,有研究采用高氏一号培养基与大米固体培养基对海洋链霉菌SS17F 进行对比发酵培养,发现高氏一号作为液体培养基进行发酵时,发酵周期短,但产物较单一、产率不高;由于液体培养基采用摇床振荡,更有利于菌株的生长,然而液体培养基内营养物质有限,故采用7 d 为一个培养周期。当大米培养基作为固体培养基发酵时,代谢产物丰富、产率更高,但发酵周期相对较长;由于静止培养,培养基中营养物质消耗较慢,通常以1~3个月作为培养周期[42]。
实验室通常通过单因素试验与正交试验相结合优化原有培养基配方和发酵条件。薛一达等[43]采用单因素试验对发酵条件以及培养基配方进行优化,优化后最适培养基(高氏一号液体培养基)为:25 g·L-1玉米淀粉、1 g·L-1蛋白胨、0.3 g·L-1K2HPO4·3H2O、0.3 g·L-1MgSO4·7H2O、0.4 g·L-1CaCO3,其中MgSO4·7H2O 对活性物质的影响最大,最适发酵条件为初始发酵液pH 7.2、温度28 ℃、转速220 r·min-1、发酵时间7 d。参照此条件优化后菌株的抑菌活性提高了25.9 %。王高学等[44]通过正交试验对弗氏链霉菌的发酵条件和培养基配方进行优化,发现最佳发酵培养基为:1.5%葡萄糖、2%牛肉膏、1.5 %海盐、0.05% MgSO4·7H2O、0.05% K2HPO4和0.1% CaCO3,最佳发酵条件为温度33 ℃、初始pH 6.0、接种量10%、种子液菌龄48 h,使得代谢物的抗菌活性更加稳定。
优化发酵工艺可以提高链霉菌次级代谢产物的产量。例如,刘倩倩等[45]提取吸水链霉菌高产菌株于发酵罐中进行补料发酵培养,通过优化甘油补料浓度和pH,确定甘油补加量为2.5%、pH控制在5.6 以上为最佳发酵条件。优化后的发酵工艺使得吸水链霉菌产生的次级代谢产物子囊霉素具有最大产量。卢文玉等[46]发现对玫瑰孢链霉菌高产突变株LC-KS-54 采用恒速流加策略可以有效提高次级代谢产物达托霉素的产量且优于其他前体补料策略。
此外,可根据菌种的来源和次级代谢产物添加具有生物活性的必需因子进行优化从而获得链霉菌的最佳发酵条件。例如,有研究对链霉菌菌株F0107 的发酵条件进行优化,发现添加质量分数0.4%的吐温-80,该菌株的次级代谢产物产量提高了41%。这说明可根据特定菌株添加必需因子进行发酵制备提高次级代谢物的产量。项仁鑫等[47]采用响应面法优化链霉菌HY6-S36 发酵条件,优化后最佳培养条件为69.8 g·L-1麦芽糊精、49.6 g·L-1豆粉、0.5 g·L-1烟酸、4.0 g·L-1碳酸钙。在此优化条件下,次级代谢产物的摇瓶产量提高了177%。徐涤等[48]利用鱼、虾、贝、藻等提取物作为添加剂对链霉菌T557 进行培养,发现对照196 组粗提物TLC 在日光下没有条带,而添加了鱼粉提取物后在Rf=0.48 处出现了1 条新带;添加了紫菜提取物后在Rf=0.69处出现新带;添加了低浓度的海带提取物后在Rf=0.60处出现一条新带,而添加了高浓度的海带提取物后在Rf=0.48 同时又出现一条新带;这表明藻类提取物对链霉菌的抑菌效果有最明显的增强效果,同时添加必需因子对于链霉菌次级代谢物的产量有明显提升。
3 展望
与陆生的链霉菌相比,海洋链霉菌在形态上更加多样化,并且具有适应海洋环境的特殊生理功能。近几年来,国内外对于海洋链霉菌的研究已取得了一定进展。研究人员发现许多新的链霉菌和次级代谢产物具有巨大的生物活性潜力,特别是在抗菌和抗肿瘤方面。这些新的发现不仅为新药的开发提供了理论基础,也为医学等领域的发展提供了更多选择。同时,随着代谢组学和基因组学分析的兴起,研究人员对天然产物的研究难度大大降低。通过基因测序的方法,人们可以筛选已知的海洋链霉菌,发现尚未开发和证实的代谢产物。此外,也可利用基因工程手段与共培养等方式来激活相关基因的表达,进而产生新型次级代谢产物,提高已知次级代谢产物的产量。在海洋链霉菌的菌株发酵培养方面,通过优化培养基配方、pH、温度、通气等,也可有效获得高产高活性的链霉菌株和次级代谢产物。
目前,海洋链霉菌次级代谢产物的活性探索主要集中在抗菌与抗肿瘤方面,对其潜在的生物活性与作用机制有待进一步挖掘。相较于陆生链霉菌,海洋链霉菌所生产的抗生素大多还停留在理论基础阶段,在临床应用上远远不及。此外,在利用育种与发酵培养技术去挖掘具有较高开发价值的代谢产物以及加强其生产效率时,更需要关注产物分离优化技术的开发与优化。
