用于增强多金属氧酸盐抗肿瘤功效的靶向聚合物纳米颗粒
2023-12-14张煜英姚田子郭建辉刘钰君张赛晖
万 冬,张煜英,王 欢,姚田子,郭建辉,刘钰君,张赛晖,潘 杰
根据世界卫生组织的数据,全世界每年死于癌症的人数超过700 万,预计到2030 年将超过1 310万[1]。 癌症已成为人类健康和生命的头号敌人,给世界带来了巨大的经济负担[2]。 为了提高癌症的治疗效率,新型抗癌药物的研究仍然是一个挑战。
多金属氧酸盐(Polyoxmetalates, POMs)是一组早期过渡金属氧阴离子团簇,因其在催化、材料科学和医学等领域的潜在应用而受到越来越多的关注[3-5]。 有趣的是,大多数影响POMs 与目标生物大分子识别和反应性的分子性质,如形状、酸度、表面电荷分布、氧化还原电位和极性等,都可以通过改变反离子或引入有机基团来调整,这使得它们在医学领域的应用,特别是在抗癌方面具有极大的吸引力[6,7]。 例如, Yamase 等设计了 [NH3Pri]6[Mo7O24]·3H2O (PM-8)来对抗人类肺部小细胞癌和乳腺癌[8,9]。 此外,根据Azizullah 小组的报告,发现Na12[α-P2W15O56]·24H2O 对Hela 和MCF-7 细胞[5]具有良好的抗肿瘤活性。 尽管POMs 有这些良好的特性和应用,但其水溶性差、毒性高严重限制了POMs 作为抗癌剂的发展,导致其治疗效果较低,对正常组织器官的毒副作用严重[4,10]。 为了解决上述问题,设计一种低毒、高生物相容性和特异性靶向的新型聚合物纳米颗粒(NPs) 是一种理想的策略。
近几十年来,靶向聚合物NPs 在纳米医学领域引起了越来越多的兴趣,主要用于治疗和诊断癌症[11]。 它们被认为是具有长循环效应的纳米级给药载体,极大提高了药物的选择性,从而减少了毒副作用,提高了治疗效率。 一种方法是将聚乙二醇(mPEG1000)、D-α-生育酚聚乙二醇丁二酸(TPGS)等三维生物相容性聚合物移植或结合在NPs 表面,可避免被巨噬细胞的识别和清除[12,13]。 例如,甲氧基聚乙二醇-聚乳酸共聚物(mPEG-PLA)已被合成用于抗肿瘤药物的临床管理。 这种负载紫杉醇的NPs在体外表现出良好的立体稳定性,有望在血液循环[14]中实现长周期效应。 同时,通过修饰在NPs 表面的特定配体来实现靶向药物传递,这些配体可以识别癌细胞并介导它们与癌细胞上的受体相互作用[15]。
Sun 等在2017 年描述了近红外激光激活的带有叶酸(FOL)修饰的NPs (Pt-IV-FINPs)可以选择性地向表达叶酸受体的癌细胞传递药物,以克服铂基化疗的缺点[16,15]。
因此,我们设计了POMs 负载FOL 修饰的靶向聚合物NPs,使POMs 具有水溶性,提高POMs 的体外生物相容性和稳定性,并通过将POMs 靶向递送到肿瘤组织中来提高对肿瘤细胞的敏感性。 我们进一步报道了POMs 负载聚合物NPs 的理化性质,如粒径、电位、形貌,以及体外对MCF-7 黑色素癌细胞的细胞毒性。 在这项工作中,我们将潜在的新一代金属药物(POMs)与聚合物材料(PLA-mPEG1000/TPGS3350-FOL)结合,形成多功能聚合物NPs。 它们将能够同时实现长循环和靶向治疗的功能,成为纳米医学领域的一个新的研究热点。
1 材料与方法
1.1 材料
D-α-生育酚聚乙二醇琥珀酸酯(TPGS3350)、FOL、 戊二酸均购自于 Sigma-Aldrich。 PLAmPEG1000购自于中国山东医学仪器研究所。 在文献[17](Inorg.Chem.2002,41,6112-6117)基础上合成POMs(CTAB)7(TBAB)7[Eu(H2O)3(P2W17O61)]2。N,N′-二环己基碳二亚胺(DCC)、N-羟基琥珀酰亚胺(NHS)、4-二甲氨基吡啶(DMAP)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)乙二胺均由国药化学试剂有限公司提供。 二甲基亚砜(DMSO)、乙腈和吡啶由天津密欧化学试剂有限公司提供。三氯甲烷(TCM)、乙二胺由北京化工厂提供。 聚乙烯醇、细胞计数试剂盒-8 测定(CCK-8)、磷酸盐缓冲盐水(PBS)、胎牛血清(FBS)、杜氏改良鹰牌培养基(DMEM)、青霉素-链霉素溶液。
1.2 合成TPGS3350-FOL
按照图1 所示,将FOL 修饰的TPGS3350的制备分为2 个部分。 简单地说,将TPGS3350与DCC、戊二酸和DMAP 在10 mL DMSO 中反应,n(TPGS3350) ∶n(DCC) ∶n(戊二酸) ∶n(DMAP)= 1.0 ∶2.0 ∶2.0 ∶0.2,反应24 h 后,通过透析收集并冻干,合成TPGS3350-COOH。 然后将1 mmol FOL 溶于30 mL DMSO、2 mmol NHS 和1.2 mmol DCC 中,在避光条件中溶解6 h。 过滤后,进一步向反应体系中加入10 mmol 乙二胺,在吡啶催化下搅拌12 h。 用大量的乙腈沉淀FOL-NH2,离心收集,真空干燥。 最后,在去离子水中利用TPGS3350-COOH、NHS、DCC 和FOL-NH2, 生成 TPGS3350-FOL。 通过透析获得TPGS3350-FOL 的最终产品,并用TEA 将pH 值调整到8.0 后冻干[18]。 用1H-NMR 在300 MHz 下对溶解于DMSO-d6中的TPGS3350-FOL 进行表征(德国Bruker AVANCE AV 300)。

图1 TPGS3350-FOL 的合成路线Fig.1 The synthetic route of TPGS3350-FOL
1.3 带有FOL 装饰的POMs 负载纳米粒子的制备
POMs 负载具有FOL 修饰的NPs 的制备方法为:将10 mg TPGS3350-COOH 和40 mg PLA-mPEG1000混合在3 mL 三氯甲烷中,首先用含5 mg POMs 的2 mL 三氯甲烷活化。 接下来,将上述溶液缓慢倒入60 mL 含0.5%聚乙烯醇的水溶液中,并在25 W 下超声120 s。 通过旋转蒸发1 h 去除三氯甲烷。 之后,在10 000 r·min-1下离心15 min,并用蒸馏水洗涤3 次, 真空过滤收集 PLA-mPEG1000/TPGS3350-COOH。 将过量的EDC 和NHS 加入到10 mL 去离子水中,分散20 mg PLA-mPEG1000/TPGS3350-COOH NPs 以激活TPGS3350-COOH 的羧基。 2 h 后,加入FOL-NH2,并用三乙胺调整pH 值至8.0。 最后通过水洗得到POMs 负载的 PLA-mPEG1000/TPGS3350-FOL 纳米粒子。
此外,POMs 负载的PLA-mPEG1000NPs 的制备与上述方法一致,只是未添加TPGS3350-COOH[18,19]。
1.4 NPs 的表征
将POMs 负载的PLA-mPEG1000/TPGS3350-FOL和PLA-mPEG1000NPs 分别用适量的去离子水稀释至1 mg·mL-1。 利用Zeta 电位分析仪(ZETASIZER NANO)来测定含有或不含有TPGS3350-FOL 的POMs负载的NPs 的颗粒大小、尺寸分布和Zeta 电位。 同时,通过扫描电子显微镜(SEM,日立S4800,日本HITACHI)确认化合物的表面形态[19]。
1.5 POMs 载药量和POMs 包封率
所有的NPs 都是采用纳米沉淀法制备。 NPs 的载药量和包封率是影响纳米药物递送系统的重要因素,用荧光光谱法在393 nm 的激发波长下进行测量[18-20]。 POMs 载药量和POMs 包封率计算如式(1)和式(2)。
式(1)和式(2)中:M为NPs 和POMs 的总质量;Ma为NPs 的质量;Mb为加入的POMs 质量。
1.6 体外细胞毒性实验
通过细胞计数试剂盒(CCK-8)检测NPs 的体外细胞毒性,用酶标仪(Perkin-Elmer)进行检测。 将MCF-7 黑色素癌细胞培养约15 h。 随后根据1.5 中的药物负载情况,将负载的PLA-mPEG1000/TPGS3350-FOL 和PLA-mPEG1000NPs 分别配制成药物浓度为1、4 和10 μg·mL-1的溶液。 培养8 h 后,除去孔中含有药物的培养基,然后用PBS 缓冲溶液洗2 次。之后,加入CCK-8 测定法,将细胞培养2 h,并记录每孔的吸光度。 细胞存活率按参考文献[18,19]计算。
2 结果与讨论
2.1 TPGS3350-FOL 共聚物的表征
图2 TPGS3350-FOL 共聚物在DMSO-d6中的1HNMR 谱图。 可以看到,图2 中化学位移3.51 处的—CH2—质子的核磁峰是TPGS3350中的mPEG1000。1.09 处的峰显示了—TOS 的特征峰,TPGS3350-FOL共聚物中戊二酸和乙二胺的甲基和亚甲基的结构分别出现在1.25、1.50 ~1.80、1.90 ~2.10、2.69 和2.85 处。 FOL 的—COOH 特征峰位于11.53 处,这是该化合物的一个重要标志。 共聚物的其他质子位于6.63 和7.59 等处。 结果表明,成功合成了TPGS3350-FOL。
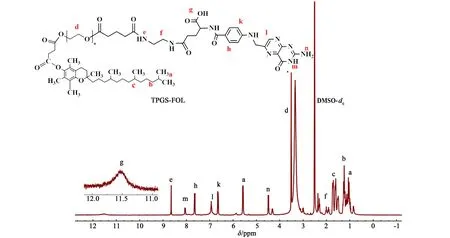
图2 TPGS3350-FOL 共聚物在DMSO-d6 中的1H-NMR 谱图Fig.2 1H-NMR spectra of the TPGS3350-FOL copolymer in DMSO-d6
2.2 NPs 的表征
胶束悬浮液的稳定性是药物递送的一个重要指标,它由NPs 的粒径和Zeta 电位决定。 长链PLA-mPEG1000/TPGS3350-FOL 作为外层的亲水结构,而POMs 作为疏水结构嵌入内层,通过靶向FOL 形成稳定的NPs。
图3 显示PLA-mPEG1000NPs 直径约为200 nm,尺寸分布较窄。 PDI (Polydispersity index) 为0.194。 结果表明PLA-mPEG1000/TPGS3350-FOL NPs的直径约为220 nm。 PDI 为0.243。 据报道,传统的抗肿瘤药物分子在细胞摄取作用下,通过包埋、吸附或共价键作用,针对特定的受体和表面被吸收到细胞中。 从而提高化疗药物的水溶性、稳定性,减少其对正常组织和器官的毒副作用[4,10,21]。 此外,抗癌纳米药物的粒径大小对靶向治疗有很大影响。 当粒径小于5 nm 时,容易被肾脏代谢掉;当粒径大于250 nm 时,容易在脾脏、肝脏和肺部的毛细血管内蓄积[22,23]。 当平均粒径在200 nm 左右时,它往往会在体内进行长时间的循环,并通过内皮细胞的活性过程而集中在肿瘤部位[24,25]。 NPs 表面较高的电荷可以产生强大的排斥力,从而阻止NPs在分散溶液中的聚集[26,27]。
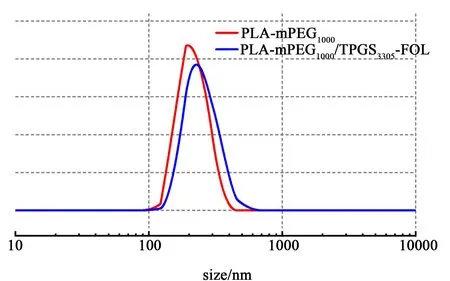
图3 NPs 的粒径Fig.3 Particle size of NPs
此外,表面电荷是影响NPs 悬浮液稳定性的重要参数。 用粒径电位仪测量出,PLA-mPEG1000NPs和PLA-mPEG1000/TPGS3350-FOL NPs 均带负电荷,它们的Zeta 电位分别为-35.3 和-18.6 mV。 认为NPs 的负电荷在体内长期循环过程中不容易与血红蛋白结合,进而被癌细胞摄取,减少了机体的毒副作用[28,29]。
同时,用FESEM 检测的粒度与激光光散射(LLS)测定的粒径具有良好的一致性(图4)。 可以看出,NPs 在这个分辨率下呈球形,表面光滑。 如图4 所示,观察到的胶束的平均粒径约为140 nm。 据报道,平均粒径小于200 nm 的NPs 在血液中的循环时间比粒径较大的NPs 更长。 它可以保证药物的长期的疗效和在体内更长的循环时间[30]。

图4 PLA-mPEG1000/TPGS3350-FOL 的POMs加载NPs 的FESEM 图像Fig.4 FESEM image of POMs-loaded NPs of PLA-mPEG1000/TPGS3350-FOL
2.3 载药量和包封率
PLA-mPEG1000NPs 和PLA-mPEG1000/TPGS3350-FOL NPs 的载药量分别为6.523%和6.134%。 药物包封率分别为(65.31 ± 0.446)% 和(61.45 ±0.586)%。 由此可见,PLA-mPEG1000NPs 表现出更高的载药量和包封率,说明TPGS3350-FOL 的引入对两者都有影响。 在本研究中,不同的材料和制备方法以及详细的给药参数都对药物包封率和载药量有很大影响。 我们选择了一种简单的纳米沉淀法,NPs 的药物包封率不高,这可能是由于在制备过程中,一些药物分子从NPs 中扩散出去,被冲走所致。
2.4 体外细胞毒性
采用CCk-8 法对PLA-mPEG1000NPs 和PLAmPEG1000/TPGS3350-FOL NPs 进行体外细胞毒性实验。 图5 分别显示了其在4、8 和24 h 的不同药物浓度下的细胞存活率,可以得出以下几个结论。
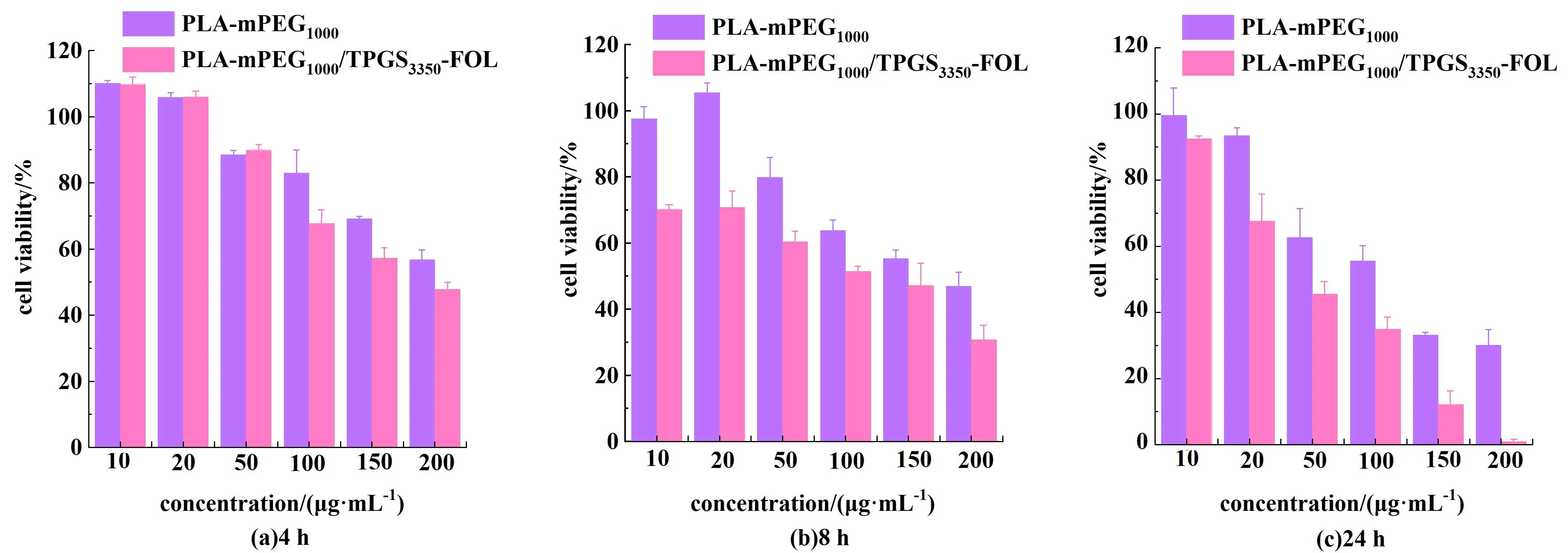
图5 PLA-mPEG1000 NPs 和PLA-mPEG1000/TPGS3350-FOL NPs 制剂在不同药物浓度下培养4 h、8 h、24 h 后MCF-7 小鼠乳腺癌细胞的体外细胞存活率Fig.5 In vitro cell viability of MCF-7 murine breast cancer cells with PLA-mPEG1000 NPs and PLA-mPEG1000/TPGS3350-FOL NPs formulations after 4 h, 8 h, 24 h incubation at various drug concentration
(1) 在相同的POMs 浓度下,PLA-mPEG1000/TPGS3350-FOL NPs 对MCF-7 细胞的细胞毒性明显高于PLA-mPEG1000NPs。 这可能与MCF-7 细胞中存在FOL 受体有关,TPGS3350-FOL 可被FOL 受体靶向识别,NPs 通过受体介导的内吞作用主动靶向癌细胞,导致癌细胞中化疗药物的数量高于未修饰FOL的NPs。 同时,说明合成的纳米药物具有较强的抗癌作用。
(2)我们还清楚地看到,随着NPs 浓度的逐渐增加,细胞活性逐渐降低,毒性逐渐增强。 例如,当纳米颗粒浓度低于50 μg·mL-1时,PLA-mPEG1000NPs 和PLA-mPEG1000/TPGS3350-FOL NPS 的细胞活性可达50%以上。
(3)培养时间越长,PLA-mPEG1000NPs 和PLAmPEG1000/TPGS3350-FOL NPs 的细胞毒性越高。 此外,PLA-mPEG1000NPs 在150 μg·mL-1培养24 h 的毒性比100 μg·mL-1时的毒性高40.46%。 PLAmPEG1000/TPGS3350-FOL NPs 的效果更为显著,其在150 μg·mL-1培养24 h 的毒性比在100 μg·mL-1培养的毒性增加了65.05%。 当NPs 在100 μg·mL-1培养24 h,PLA-mPEG1000/TPGS3350-FOL NPs 的细胞存活率比PLA-mPEG1000NPs 低1.59 倍。 当NPs 在150 μg·mL-1下培养时,PLA-mPEG1000/TPGS3350-FOL NPs 中的细胞存活率比PLA-mPEG1000NPs 低2.71倍。 当PLA-mPEG1000/TPGS3350-FOL NPs 在200 μg·mL-1下培养24 h,存活率为(0.91±0.67)%,毒性很大,细胞几乎死亡。 此外,图5 清楚地表明,细胞存活率也呈现出相同的趋势。 因此,我们可以得出结论,FOL 有助于提高细胞摄取。
3 结论
综上所述,设计了一种POMs 负载FOL 修饰的靶向聚合物NPs,用于靶向治疗癌症。 这些构建物被充分地表征出来,并对MCF-7 小鼠乳腺癌细胞进行了体外实验。 本研究设计的聚合物NPs 的结果表明,与传统的药物制剂相比,POMs 在肿瘤部位的生物活性靶向性和聚集性得到了改善,细胞内化得到了加强,从而具有显著的抗癌活性和低毒副作用。 这种新型聚合物NPs 具有广阔的临床应用前景。
