糠醛衍生物在盐酸溶液中的缓蚀性能研究
2023-12-14史雪磊王纪孝宋双双吴昌豪
史雪磊,王纪孝*,高 敏,宋双双,丛 畅,吴昌豪,王 志
酸性溶液在除锈、除垢等工业过程中被广泛应用[1],但会造成对钢铁基材的严重腐蚀,带来巨大的经济损失和安全隐患[2]。 因此,在这些过程中,需加入缓蚀剂抑制金属腐蚀过程。 缓蚀剂分为无机缓蚀剂与有机缓蚀剂,无机缓蚀剂常用于中性环境或偏碱性环境,而有机缓蚀剂常用于酸性环境[3]。 目前工业上所使用的有机缓蚀剂具有价格高,对环境有潜在影响等问题[4]。
绿色缓蚀剂如植物提取物、离子液体和氨基酸等近年来被广泛关注[5-7]。 然而,在考虑环境友好性的同时,原料价格、来源广泛度以及生产工艺的简易性也应被充分考虑[8]。 席夫碱缓蚀剂因其前体可采用绿色原料和简单的生产工艺日益成为研究热点[9,10]。 Zhang 等合成了香兰素基席夫碱,在0.5 mol·L-1的 HCl 溶液中, 当缓蚀剂浓度为2 mmol·L-1时,缓蚀效率可达91%[11]。 Haque 等介绍了壳聚糖基席夫碱,研究表明当在1 mol·L-1的盐酸溶液中,缓蚀剂浓度为150 mg·L-1时,缓蚀效率可达92%[12]。 这些席夫碱至少有1 种前体来源于生物质,然而来源于生物废料的前体并未获得足够关注。
目前,处理生物废料的普遍方法为直接焚烧或废弃,这不仅引起资源浪费,也会带来环境污染[13]。糠醛是由甘蔗渣、玉米芯等生物废料制备的芳香性杂环呋喃衍生物,被认为是来源于生物质最有前途的化学平台物质之一[14,15]。 糠醛国内市场严重供给过剩使其廉价易得[16]。 之前的研究结果表明,分子结构中含有芳香环、三嗪环、亚胺键与杂原子(如N、O、P 和S)等基团的化合物通常具有优异的缓蚀性能[17,18]。 糠醛结构中有芳香环和氧原子等吸附位点。 此外,糠醛中的醛基可与胺基反应生成亚胺键增强其在金属表面的吸附能力[19]。 另一前体三聚氰胺为富氮杂环分子,其分子中的三嗪环和胺基具有良好的吸附性能[20]。 目前以来源于生物废料的糠醛作为席夫碱缓蚀剂前体的研究鲜有报道。
本研究工作中,利用糠醛与三聚氰胺缩合制备了呋喃基席夫碱缓蚀剂FMA。 利用液质联用确定了FMA 的结构,通过静态失重法、电化学测试法、扫描电子显微镜(SEM)考察了FMA 在1.0 mol·L-1的HCl 溶液中对低碳钢的保护能力,证实了浓度为200 mg·L-1的FMA 即可对低碳钢在较宽的温度范围内产生良好的保护效果,探究了FMA 的缓蚀机理。 本研究以生物废料糠醛为原料,合成了高效的生物基缓蚀剂,为生物废料、废渣的充分利用提供了良好的应用场景,促进了生物质能源的发展和绿色缓蚀剂的应用。
1 实验材料和方法
1.1 材料
糠醛(>99.5%,质量分数,下同)购自上海阿拉丁生化科技股份有限公司,三聚氰胺、冰醋酸购自天津市大茂化学试剂厂,分析纯盐酸(37.0%)购自天津市江天化工技术有限公司。 用蒸馏水稀释质量分数为37.0%的浓盐酸制备1.0 mol·L-1HCl 溶液。 低碳钢选用Q235 钢,其组成为C:0.18%,Mn:0.65%,Si:0.3%,S:0.042%,P:0.045%和余量Fe。钢板样品用不同等级的砂纸(粒度180#,360#,600#,2000#)进行抛光后用无水乙醇脱脂,然后N2干燥,放入真空干燥器中备用。
1.2 缓蚀剂的制备与溶解性测试
FMA 的制备路径如图1 所示,取80.00 g 糠醛加入到三口烧瓶中,将温度缓慢升高至150 ℃,然后将溶有30.00 g 三聚氰胺的二甲基亚砜溶液通过恒压漏斗缓慢加入糠醛中,冰醋酸(1.10 g)作为催化剂,反应12 h 后,趁热旋蒸出二甲基亚砜,将旋蒸后固体用水溶解并过滤,旋蒸滤液,旋蒸后所得固体于60 ℃真空干燥箱中干燥24 h 后可得淡黄色固体样品FMA。
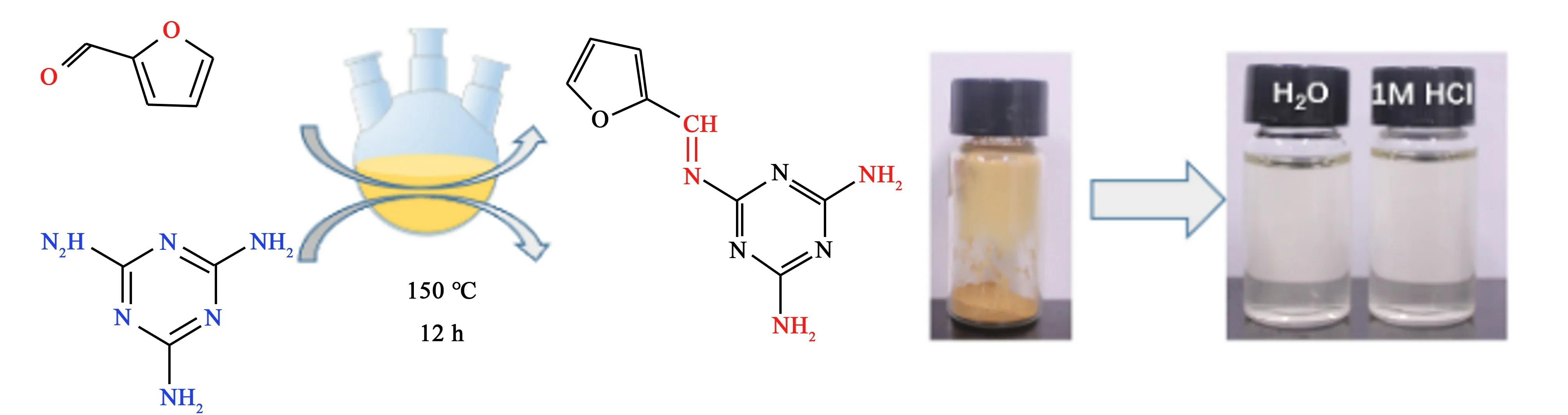
图1 FMA 的制备方法与溶解性测试Fig.1 Preparation and dissolve test of FMA
将FMA 分别溶于蒸馏水与1.0 mol·L-1HCl 溶液中,配制浓度为200 mg·L-1的溶液,静置72 h 后观察FMA 在溶液中的溶解性,由图1 看出,FMA 在水中和1.0 mol·L-1HCl 溶液中均充分溶解,形成淡黄色的均一稳定溶液,证明FMA 在溶液中溶解性良好。
1.3 FMA 的结构表征
红外吸收光谱测试:采用型号为FTIR-650 的红外光谱仪,扫描范围为4 000 ~500 cm-1,制样采用溴化钾压片法。
高效液相色谱-质谱联用测试:采用型号为Xevo TQ-XS 的高效液相色谱-质谱联用仪,将FMA 溶于甲醇溶液中制样。
1.4 静态失质量测试
静态失质量测试所用低碳钢的规格为30.0 mm×15.0 mm×1.0 mm,在钢板顶部正中位置开直径为1.0 mm 的圆孔用于悬挂。 分别测试不同FMA 浓度、温度与浸泡时间对腐蚀速率的影响。 每组实验做3 次平行测试保证实验可重复性。 在每次测试之前,低碳钢板用天平[精度(±0.01) mg]3 次称质量。 实验结束后,低碳钢板用无水乙醇清洗,N2干燥,重新称质量,腐蚀速率(υcorr)按式(1)计算:
式(1)中: ΔW为钢板在腐蚀前后的质量损失,g;S为钢板的总表面积,cm2;t为浸没时间,h。
缓蚀效率η根据公式(2)计算:
式(2)中:η代表缓蚀效率;νcorr,0与νcorr分别代表未添加缓蚀剂组与添加缓蚀剂组的低碳钢板的腐蚀速率,g·cm-2·h-1。
1.5 电化学测试
使用Gamry 电化学工作站采用传统三电极体系进行电化学测试。 工作电极、参比电极与对电极分别采用低碳钢板、饱和甘汞电极与石墨棒。 工作电极规格为10.0 mm×10.0 mm×1.0 mm,有效工作面积为2.0 cm2。 在298 K 时,工作电极在不同FMA 浓度的测试液中浸泡24 h,开路电位测试时间为30 min 以获得稳定的开路电位(EOCP),电化学阻抗测试(EIS)的干扰信号为峰值10 mV 的正弦波,频率范围为105~10-2Hz,使用Zsimpwin 软件对Nyquist 数据进行分析,根据电荷转移电阻计算缓蚀效率,如公式(3)所示:
式(3)中:Rct,0与Rct分别代表未添加缓蚀剂与添加缓蚀剂体系的电荷转移电阻,Ω·cm-2。
极化曲线的扫描范围为相对开路电位-200 ~200 mV,扫描速率为1.0 mV·s-1,由外推法求得电化学数据,缓蚀效率依据公式(4)求得:
式(4)中:Icorr,0与Icorr分别为未添加缓蚀剂组与添加缓蚀剂组的腐蚀电流密度,μA·cm-2。
1.6 表面分析
将10.0 mm×10.0 mm×1.0 mm 的钢板在纯盐酸和FMA 浓度为200 mg·L-1的测试液中浸泡6 h后取出,用无水乙醇冲洗,然后用N2干燥,保存在真空干燥器中。 用扫描电子显微镜(JSM7800F,日本)观察钢板表面形态,放大倍数为1 000 倍,加速电压为15 kV。
2 实验结果与讨论
2.1 FMA 结构分析
2.1.1 红外吸收光谱测试
图2 为三聚氰胺(MA)和糠醛-三聚氰胺席夫碱(FMA)的红外吸收光谱图。 2 者结构相似,均含有—NH2与三嗪环。

图2 原料单体MA 与合成产物FMA 的红外光谱图Fig.2 FT-IR spectra of MA and FMA
由图2 可知,MA 与FMA 具有相似的红外吸收特征峰。 其中,3 462 与3 411 cm-1对应—NH2的反对称伸缩振动,且伸缩振动谱带符合伯胺谱带尖锐的特征,1 653 cm-1附近吸收带为—NH2的弯曲振动,1 546 cm-1附近吸收带对应三嗪环中键的伸缩振动, 特别是在809 cm-1附近出现的吸收峰是三嗪环的特征吸收峰。 FMA 新引入了键和呋喃基团,新引入的键与三嗪环中原有的键特征峰在1 546 cm-1处重合,而引入的呋喃环中的特征官能团有键,其中环形振动在1 021 cm-1与MA 中的C—N 键的伸缩振动峰重合,呋喃环内的拉伸振动峰与MA 中的键的伸缩振动峰在1 546 cm-1左右重合[21]。 因此通过红外光谱无法确定糠醛引入到三聚氰胺中,故采用高效液相色谱与质谱联用进一步分析FMA 的结构。
2.1.2 液相色谱-质谱联用测试
糠醛与三聚氰胺缩合制备席夫碱的产物可能为单席夫碱(M=204 g·mol-1)、双席夫碱(M=282 g·mol-1)或三席夫碱(M=360 g·mol-1),其分子结构如图3所示。
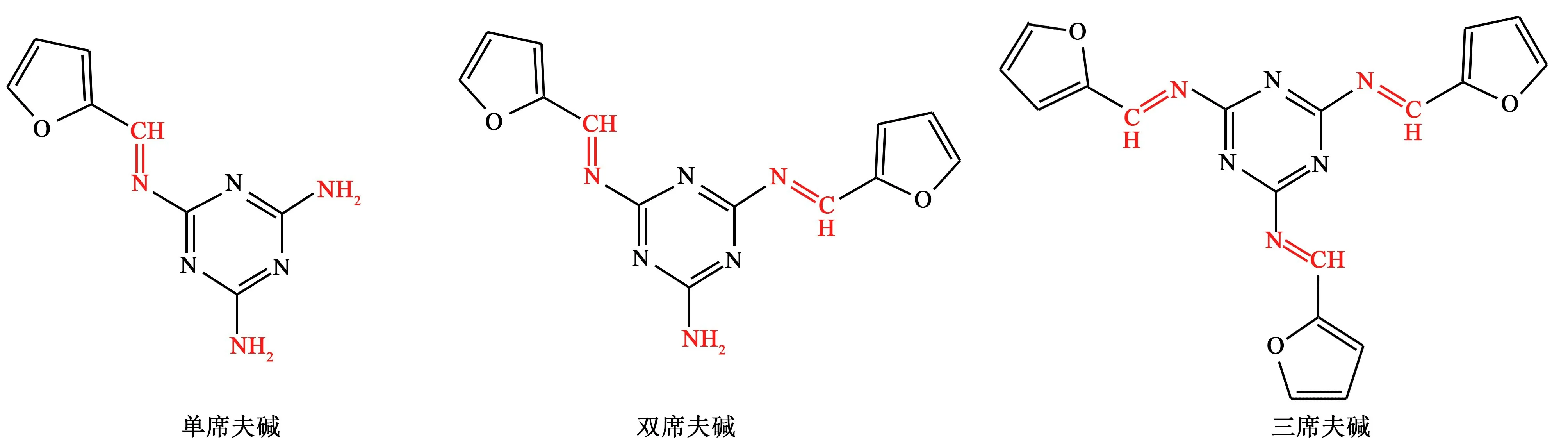
图3 产品的预测组分Fig.3 Predicted components of the product
通过液质联用确定产品的组成,FMA 的液相色谱与质谱图如图4 所示,液相色谱图中出现了2 个明显的峰,之后的鼓包为杂质峰。 在前2 个峰的质谱图中,分子离子峰主要出现在205 处。 由于单席夫碱不存在同分异构现象,故这2 峰所代表的物质并非为单席夫碱的同分异构体。 液相色谱出峰顺序与物质的极性有关,极性强的物质优先出峰。 从质谱图看出第1 个峰主要为极性较强的单席夫碱分子,相对分子质量为204 g·mol-1,第2 峰没有出现大量282 g·mol-1的物质的峰的原因为双席夫碱分子被打断成204 g·mol-1的离子片段时更加稳定。故FMA 为单席夫碱与双席夫碱的混合物。 在FMA中未观察到三席夫碱的原因为空间位阻较大,阻碍了醛基与胺基的进一步缩合。
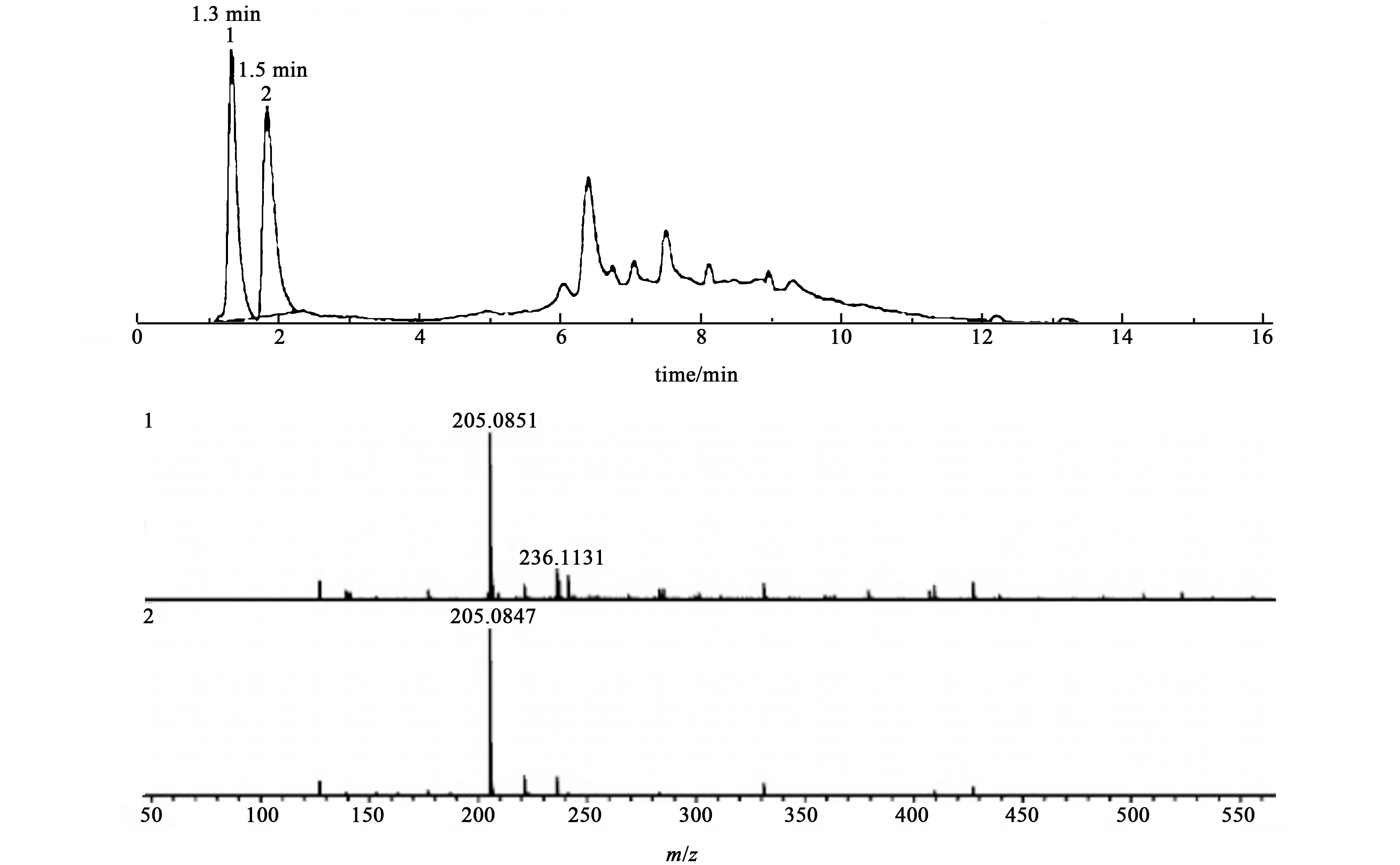
图4 FMA 的液相色谱与质谱图Fig.4 Liquid chromatography and mass spectrometry of FMA
2.2 静态失质量测试
在298 K 时,低碳钢在不同浓度 FMA 的1.0 mol·L-1HCl 溶液中浸泡24 h 的腐蚀速率结果如图5 所示。 从图5 看出,当FMA 浓度大于50 mg·L-1时,缓蚀效率可达90%以上,当浓度为200 mg·L-1时,缓蚀效率达最高值95.14%,缓蚀效率随着FMA浓度的增加而提高。

图5 钢板腐蚀速率与缓蚀效率随浓度变化图Fig.5 Corrosion rate and corrosion inhibition efficiency of mild steel change with concentration
制备未添加FMA 与FMA 浓度为200 mg·L-1的1.0 mol·L-1HCl 测试液,低碳钢在不同温度下的测试液中浸泡6 h 后腐蚀速率结果如图6 所示,当温度为298 K 时,缓蚀效率为90.96%;随着温度的升高,缓蚀效率并未有显著的下降,即使在338 K 时,其缓蚀效率仍能保持在90%以上,

图6 钢板腐蚀速率与缓蚀效率随温度变化图Fig.6 Corrosion rate and corrosion inhibition efficiency of mild steel change with temperature
高于许多同类型缓蚀剂(表1)。 表明FMA 在很宽的温度范围内仍对低碳钢具有优良的保护效果。

表1 源自至少一种生物质前体的席夫碱的缓蚀性能Table 1 Inhibition performance of Schiff bases derived from at-least one naturally available precursor
由图6 看出,随着温度的升高,未添加缓蚀剂与添加缓蚀剂的腐蚀速率随温度变化呈指数型函数,未添加缓蚀剂组的腐蚀速率随温度升高快速增长,说明提高温度明显加速盐酸对低碳钢腐蚀速率。添加缓蚀剂组的腐蚀速率增长缓慢,可归因于缓蚀剂FMA 在低碳钢板表面形成的吸附膜在高温下仍能保持相对稳定,保护了易被酸性溶液攻击的活性位点,阻碍了盐酸对钢材的腐蚀。
活化能是与腐蚀速率相关的常数,用式(5) 表示简化后的Arrhenius 方程[22]:
式(5)中:Ea为反应活化能,kJ·mol-1;R为摩尔气体常数,J·mol-1·K-1;T为绝对温度,K;A为指前因子。
以lnυcorr对1/T作图拟合求反应活化能Ea,如图7 所示,腐蚀过程的反应活化能由未添加缓蚀剂组的58.11 kJ·mol-1提升至添加缓蚀剂组的60.03 kJ·mol-1。 说明缓蚀剂通过吸附在金属表面,增加金属腐蚀反应的活化能,减缓腐蚀反应的进行。
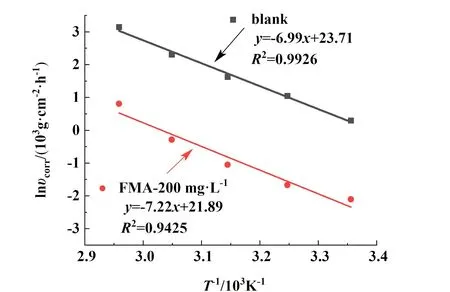
图7 在未添加FMA 与浓度为200 mg·L-1的FMA 的1.0 mol·L-1HCl 中,低碳钢的Arrhenius 曲线Fig.7 Arrhenius curve of mild steel in 1.0 mol·L-1HCl solution (absence and presence of 200 mg·L-1of FMA)
制备未添加FMA 与FMA 浓度为200 mg·L-1的1.0 mol·L-1HCl 测试液,低碳钢板在298 K 的测试液中腐蚀速率随浸泡时间变化结果如图8 所示,随着浸泡时间的延长,FMA 浓度为200 mg·L-1的实验组在浸泡时间超过12 h 后,吸附达到相对稳定阶段,腐蚀速率下降不明显。 缓蚀效率随着浸泡时间的延长而增加,当浸泡时间为24 h 时,缓蚀效率达最值95.14%。 其原因为随着腐蚀的进行,空白组的金属表面被严重破环,表面凹凸不平,与腐蚀液的接触面积增大,低碳钢表面也暴露出更多的活性位点,形成更多的微小原电池,导致电化学腐蚀加剧。 而添加有缓蚀剂的实验组的腐蚀速率随时间的延长而减少,最后趋于稳定,其原因为随着浸泡时间的延长,越来越多的FMA 分子吸附在钢板表面,阻碍了低碳钢与盐酸溶液的反应。
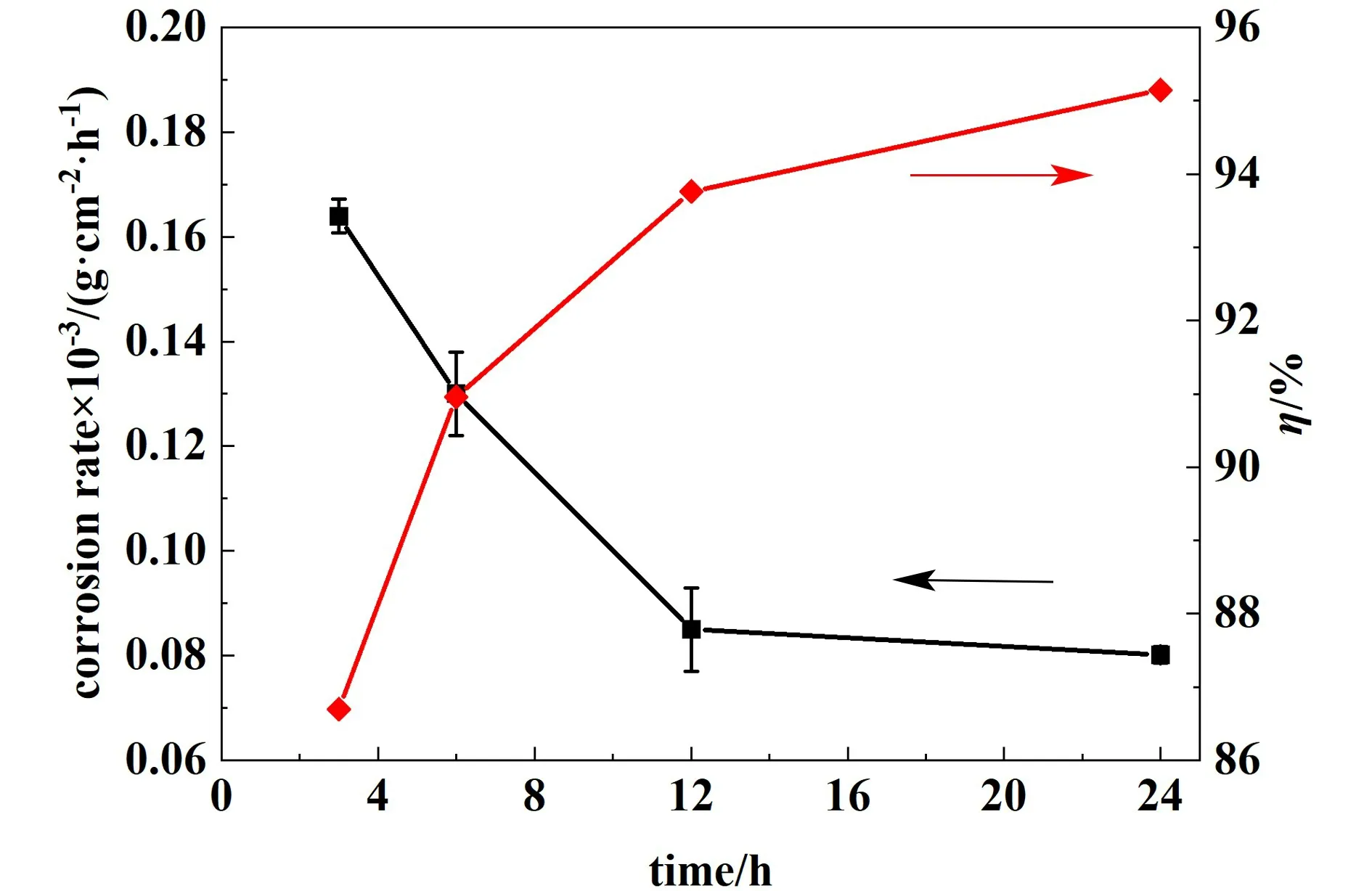
图8 钢板腐蚀速率与缓蚀效率随时间变化图Fig.8 Corrosion rate and corrosion inhibition efficiency of mild steel change with time
2.3 电化学测试
2.3.1 开路电位测试
由图9 开路电位图看出,在测试时间内,所有的OCP 曲线都保持相对稳定,即在3 min 内电位变化小于5 mV。 添加有缓蚀剂的实验组的开路电位值相对于纯盐酸组向正电位方向移动,证明 FMA 主要抑制阳极的金属溶解过程。

图9 低碳钢在添加不同FMA 浓度的1.0 mol·L-1 HCl 溶中的OCP 曲线Fig.9 OCP plots of mild steel in 1.0 mol·L-1HCl solution with FMA at different concentrations
2.3.2 塔菲尔测试
298 K 时,低碳钢在不同浓度FMA 的1.0 mol·L-1HCl 测试液中浸泡24 h 的极化参数如表2 所示,在0 ~200 mg·L-1的浓度范围内,随着缓蚀剂浓度的增加,缓蚀效率不断上升。 当FMA 浓度为200 mg·L-1时,缓蚀效率为94.68%。 与纯盐酸溶液相比,加入FMA 之后,阳极与阴极极化斜率都有所减小,阳极极化斜率ba的下降幅度大于阴极极化斜率bc下降幅度,表明FMA 使阳极金属溶解与阴极的析氢反应均受到抑制,但主要抑制阳极的低碳钢溶解过程[23]。 由图10 看出,腐蚀电位随FMA 浓度的增加而向正方向移动,最大位移值为39 mV,按照对电极过程的影响分类标准,如果腐蚀电位变化的绝对值在85 mV 以内,则该缓蚀剂为混合型缓蚀剂[24]。 因此,该缓蚀剂为主要抑制阳极过程的混合型缓蚀剂,缓蚀剂作用方式为几何覆盖效应。
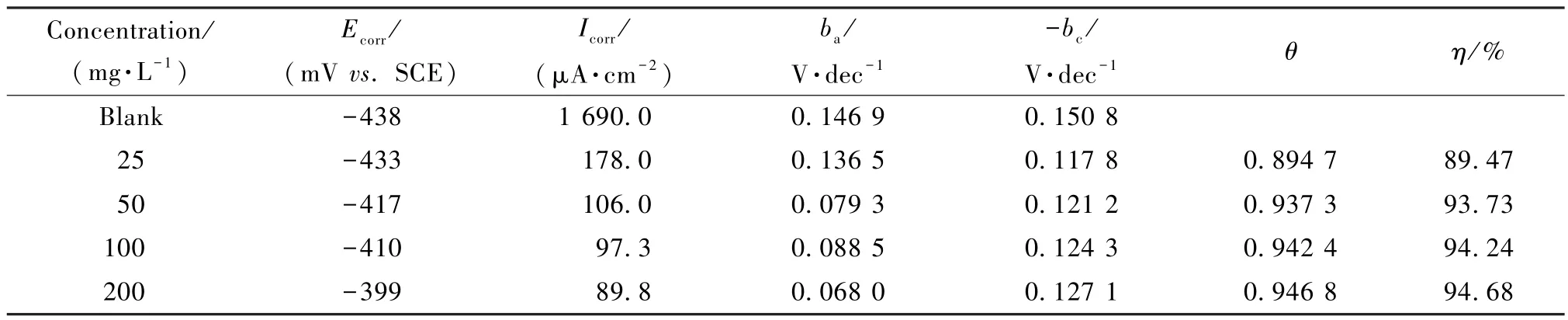
表2 低碳钢在不同浓度的FMA 的1.0 mol·L-1HCl 测试液中的极化参数Table 2 Polarization parameters of mild steel in 1.0 mol·L-1HCl solution with FMA at different concentrations
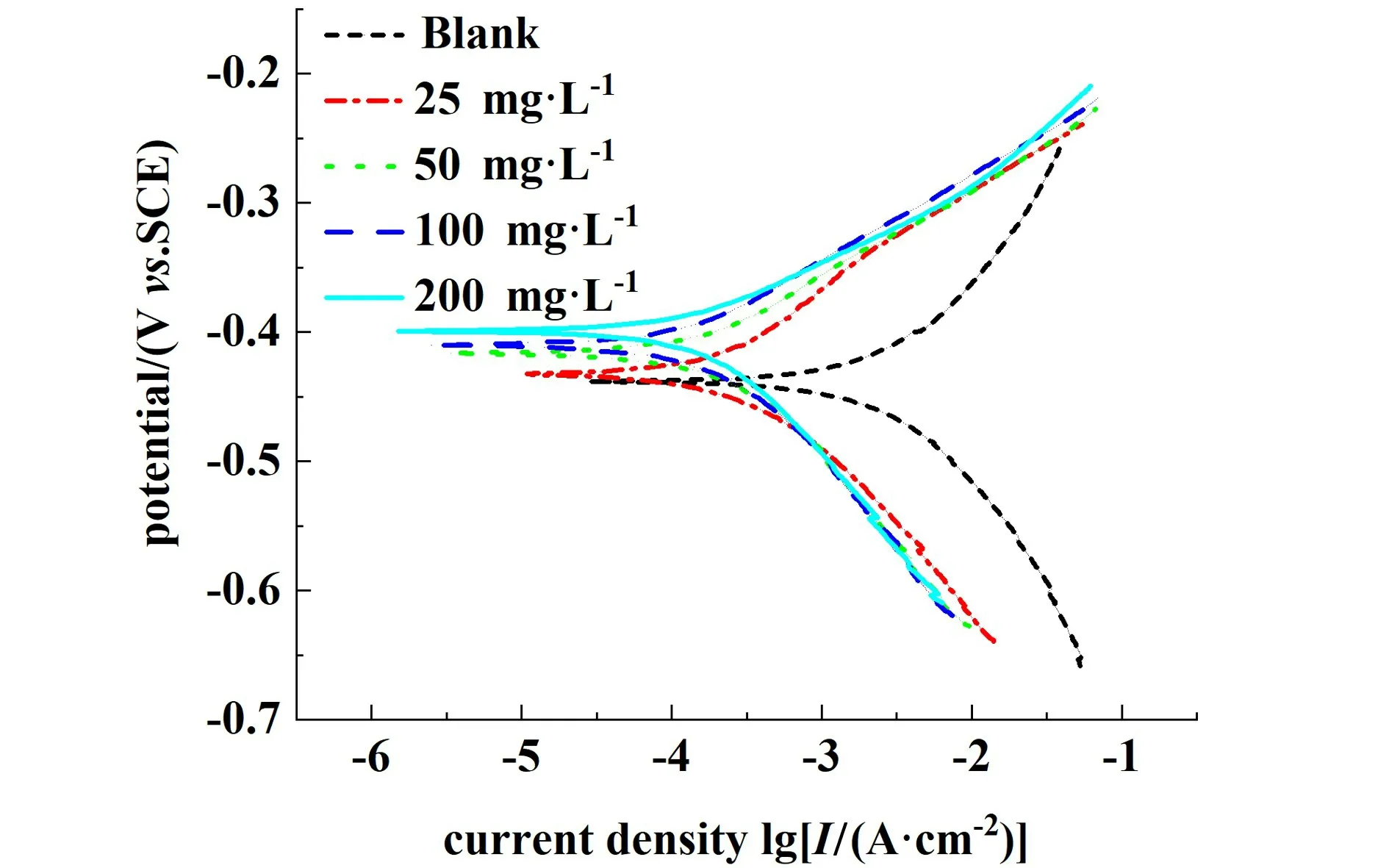
图10 低碳钢在不同浓度FMA 的1.0 mol·L-1 HCl 中的极化曲线Fig.10 Polarization curves of mild steel in 1.0 mol·L-1 HCl solution with FMA at different concentrations
2.3.3 EIS 测试
298 K 时,低碳钢在不同浓度FMA 的1.0 mol·L-1HCl 溶液中浸泡24 h 的Bode 图、相位角图与Nyquist 图如图11 所示。 |Z|0.01Hz与电极腐蚀速率成反比,由图11(a)Bode 图可知,工作电极在最低频率处的阻抗模量随FMA 测试液浓度提高而增长,由空白组的8.06 增长至144.60 Ω·cm-2,这反映出FMA 有效降低了工作电极的腐蚀速率。 此外,图11(b)中所有相位角曲线上均观察到单一时间常数,并且峰的高度随着缓蚀剂浓度的增加而增加,这意味着缓蚀剂在工作电极表面上的吸附逐渐增强[25]。图11(c)显示随着缓蚀剂浓度的增加,Nyquist 图中容抗弧的直径增加,Nyquist 图并非为严格的半圆,这可能是由于在腐蚀过程中工作电极表面形成了凹坑和裂纹,导致表面粗糙不均匀造成的[26]。 选用如图12 中的等效电路图R(QR)拟合处理,该等效电路由溶液电阻(Rs),电荷转移电阻(Rct)与恒定相位元件(CPE)组成。 CPE 的阻抗(ZCPE)用式(6)表示:

图11 低碳钢在不同浓度的FMA 的1.0 mol·L-1HCl 中的Bode 图(a)、相位角图(b)与Nyquist 图(c)Fig.11 Bode plots (a), phase plots (b), and Nyquist plots (c) of mild steel in 1.0 mol·L-1HCl with FMA at different concentrations
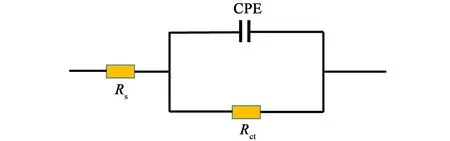
图12 电化学等效电路图Fig.12 Electrochemical equivalent circuit
式(6)中:Y0、j、w、n分别为CPE 常数、虚数、角频率和弥散指数。 当n的值为+1、0、-1 时,则C、P和E分别表示电容、电阻与电感[27]。 由表3 看出随着FMA 浓度的增加,电荷转移电阻(Rct)增加,说明腐蚀的阻力增大,反映出FMA 增加了低碳钢的防腐效果。 加入缓蚀剂后,溶液电阻(Rs)下降明显,其原因为在电化学测试前的24 h 浸泡时间内,相较于添加缓蚀剂组,空白组由于没有缓蚀剂的保护,工作电极与盐酸置换反应更充分,导致溶液中的H+浓度降低,Fe2+浓度升高,在298 K 的水溶液中,FeCl2的平均活度因子小于HCl,导致溶液整体活度降低。此外,生成的Fe2+部分聚集在工作电极表面而未溶入溶液中,空白组的导电离子浓度降低。

表3 低碳钢在不同浓度的FMA 的1.0 mol·L-1 HCl 测试液中的EIS 参数Table 3 EIS parameters of mild steel in 1.0 mol·L-1 HCl solution with FMA at different concentrations
在等效电路图中,采用了CPE(恒相位元件)来解释双电层非理想行为,CPE 常数Y0与双电层电容Cdl的关系可用式(7)与式(8)表示[28]:
式(7)和式(8) 中:Cdl为双电层电容,μF·cm-2;d为双电层厚度,cm;S为暴露在腐蚀介质中的电极面积,cm2;ε和ε0分别表示双电层与空气的介电常数,F·m-1。
随着缓蚀剂浓度的增加,Y0呈下降趋势,原因为有机分子的介电常数比水分子小,而且有机分子体积比水分子大,在吸附过程中,有机分子会置换金属与溶液界面处的水分子,因此导致双电层的介电常数ε减小,双电层厚度d增大,共同导致Cdl的数值减小,从而引起Y0数值变小[29],证明了FMA通过吸附在低碳钢表面的方式起防护作用。
2.4 表面形态分析
为了直观地观察FMA 的防腐性能,对空白组和实验组进行SEM 测试。 图13(a)所示空白组低碳钢表面损伤严重,未见划痕,呈现典型的酸溶液中均匀腐蚀形貌。 相反,图13(b)中实验组的低碳钢表面光滑平整,证明 FMA 对在HCl 溶液中的低碳钢具有良好的保护性能。 SEM 结果支持了之前的失重与电化学测试结果,表明FMA 可以通过形成吸附膜来达到防腐效果。

图13 低碳钢在纯HCl 溶液 (a)与FMA 浓度为200 mg·L-1的1.0 mol·L-1HCl 溶液中 (b)的表面腐蚀SEM 图Fig.13 SEM images of mild steel in the 1.0 mol·L-1 HCl solution without FMA (a) and with FMA at 200 mg·L-1(b)
2.5 缓蚀机理分析
Langmuir 吸附等温模型的基本假设中要求被吸附在固体表面上的分子相互之间无作用力,即气体分子吸附与解吸的难易程度,与周围是否有被吸附分子存在无关。 Langmuir 等温吸附方程式通过变形转换如式(9)所示:
式(9)中:θ为FMA 在钢板表面的表面覆盖度;C为FMA 浓度,mg·L-1;Kads为吸附平衡常数,L·g-1。
在Langmuir 吸附等温模型中,以C/θ对C作图,如图14 所示,拟合直线斜率为1.040 8,R2为0.999 9,具有良好的线性相关性,说明FMA 分子在低碳钢表面的吸附符合Langmuir 吸附等温模型,吸附平衡常数Kads为413.60 L·g-1。 拟合直线斜率1.040 8 与理论值1 稍有偏差,其原因可能是由于低碳钢表面的FMA 分子并不是理想模型所假设的相互之间无作用力,而是可能存在比较微弱的相互作用力所致[30]。Kads是与吸附自由能ΔGads相关的吸附平衡常数, 吸附自由能 ΔGads通过式(10)求得[31]:

图14 FMA 在1.0 mol·L-1 HCl 溶液中在低碳钢表面吸附的Langmuir 吸附等温线Fig.14 Langmuir adsorption isotherm plotted for the adsorption of FMA on mild steel surface in 1.0 mol·L-1HCl
式(10)中: ΔGads为吸附自由能,kJ·mol-1;R为气体常数,J·mol-1·K-1;T为绝对温度,K。
测试溶液的溶剂为水,将Kads为413.60 L·g-1带入式(10),可得ΔGads的理论值为-32.04 kJ·mol-1。吸附膜型缓蚀剂主要分为物理吸附与化学吸附,当ΔGads<-40.00 kJ·mol-1时为化学吸附, ΔGads>-20.00 kJ·mol-1时为物理吸附,当ΔGads介于2 者之间时,为物理化学吸附共同作用的结果[32]。 因此FMA 在低碳钢上的吸附为物理化学共同吸附作用的结果。
FMA 在低碳钢表面的吸附机理如图15 所示,从FMA 的分子结构分析,FMA 含有三嗪环、芳香环、亚胺基团和电负性高的杂原子(N 原子、O 原子)。 FMA 在低碳钢表面的吸附类型有如下5 种:(a)FMA 中质子化形式的胺基与金属表面阴极区之间的静电相互作用(物理吸附)。 (b)由于Cl-被吸附在阳极部分导致负电荷积累,FMA 中质子化的胺基与Cl-发生静电相互作用(物理吸附)[33]。 (c)杂原子(N 原子、O 原子)的孤对电子与金属表面Fe 的空d 轨道形成配位键(化学吸附)。 (d) 三嗪环、芳香环和亚胺键中的π电子可与Fe 的空d 轨道形成配位键(化学吸附)[34]。 (e)化学吸附引起的电子转移会导致在低碳钢表面积累过多的负电荷,这促使电子从金属的d 轨道转移到 FMA 的空反键分子轨道结合[35]。
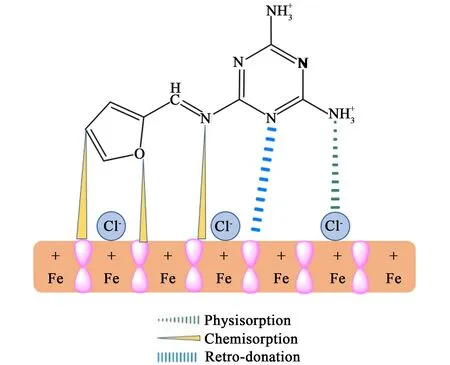
图15 FMA 在1.0 mol·L-1HCl 溶液中在低碳钢表面的吸附机理图Fig.15 Pictorial representation of the adsorption behavior of FMA on mild steel in 1.0 mol·L-1HCl solution
FMA 具有与金属相互作用的多个吸附位点,有利于FMA 在金属表面的吸附。 三聚氰胺中3 个氮原子的对称排列提供了分子在金属表面平坦取向以实现更广泛的覆盖[36]。 因此,FMA 分子在低碳钢表面形成了1 层保护膜。 除此之外,在吸附膜未覆盖到的活性位点处,胺基可通过质子化的形式吸附在钢铁表面,而FMA 分子则可向外伸展于腐蚀介质当中。 加之呋喃环疏水性质,从而有效地阻止了腐蚀介质与金属的接触,进一步加强了缓蚀的效果。
3 结论
以糠醛和三聚氰胺为原料合成了一种低价、绿色、高效的生物质呋喃基缓蚀剂FMA,评估了其在酸性溶液中的缓蚀性能并探讨了其保护机制。 主要结论如下。
(1)FMA 在较宽的温度范围内具有优异的缓蚀性能,在298 ~338 K 时缓蚀效率均保持在90%以上,缓蚀效率在298 K 时达到最高95.14%。
(2)SEM 形貌证实了FMA 可以有效抑制低碳钢在酸性溶液中的腐蚀。
(3)FMA 是一种主要抑制阳极过程的混合型缓蚀剂,通过物理和化学共同吸附作用吸附在金属表面,吸附遵循朗缪尔等温吸附。
(4)FMA 优异的缓蚀性能可归因于 FMA 分子的多个吸附位点、多种吸附类型以及分子的大覆盖面积。
