LncRNA FGD5-AS1 对口腔鳞状细胞癌细胞恶性表型的影响
2023-12-13锋刘广龙王艳卿
杨 锋刘广龙*王艳卿
(1.济宁医学院附属滕州市中心人民医院口腔科,山东 滕州 277599;2.滕州市中心人民医院手术室,山东 滕州 277599)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔常见的恶性肿瘤之一,具有高发病率、高恶性度和不良预后的特点[1-2]。 虽然在手术和放化疗方面有很大进步,但OSCC 患者的总生存率并无明显提高[3]。 癌细胞远处转移是OSCC 进展过程中的致命因素[4]。 长链非编码RNA(long noncoding RNAs,LncRNAs)在恶性肿瘤(包括OSCC)进展中发挥重要作用[5-6]。 FGD5 反义RNA1(FGD5 antisense RNA 1, FGD5-AS1) 是一个新发现的LncRNA,在喉鳞状细胞癌[7]、胶质母细胞瘤[8]、乳腺癌[9]等多种癌症中呈高表达。 最近发现,FGD5-AS1 表达在OSCC 组织和细胞中异常上调,敲低FGD5-AS1 可 抑 制OSCC 细 胞 恶 性 行 为[10]。 但FGD5-AS1 在OSCC 中的作用机制尚未完全明确。
研究显示,miR-129-5p 的表达水平在OSCC 组织中下调[11];且高迁移率族蛋白1(high-mobility group box 1,HMGB1)的3’-非翻译区(3’-UTR)与miR-129-5p 存在结合位点,miR-129-5p 可通过靶向负调节HMGB1 表达抑制癌细胞的恶性生物学行为[12]。 HMGB1 已被证实在OSCC 中呈高表达,与OSCC 的易感性和恶性进展有关[13-14]。 然而,FGD5-AS1 在OSCC 中的作用是否与miR-129-5p 和HMGB1 有关还未可知。 因此,本研究旨在探讨FGD5-AS1 对OSCC 细胞生物学行为的影响并分析潜在机制。
1 材料和方法
1.1 实验材料
1.1.1 细胞
人口腔黏膜细胞(human oral keratinocytes,HOK)和OSCC 细胞(SCC-9、HSC-4、SCC-25、CAL-27)均购自美国ATCC 公司。
1.1.2 临床样本
2018 年1 月~2021 年1 月,从滕州市中心人民医院口腔科获得30 例OSCC 患者的肿瘤组织及邻近的正常组织。 30 例OSCC 患者包括26 例男性,4例女性,年龄32 ~76 岁;TNM 分期:Ⅰ期3 例,Ⅱ期8 例,Ⅲ期9 例,Ⅳ期10 例;病理分化高17 例,病理分化低或中13 例。 纳入标准:经病理诊断结果为OSCC 患者;术前未接受抗肿瘤治疗。 排除标准:术前接受抗肿瘤治疗或放疗、化疗的患者;患有其它类型肿瘤的患者;患有免疫系统疾病的患者;有严重的心脏、肺部等系统性疾病的患者;资料不完整的患者。 本实验获得本院科研伦理审查委员会的批准。 此外,每个参与者在研究前都签署了书面知情同意书。 组织样本立即在-80℃冰箱冷冻。
1.1.3 实验动物
40 只SPF 级雄性BALB/c 裸鼠取自山东大学实验动物中心[SCXK(鲁)2019-0001],体重19 ~22 g,6 周龄,饲养于济宁医学院动物房内[SYXK(鲁)2021-0030]。
所有小鼠都被饲养在18 ~22℃、湿度20%、光照/黑暗周期12 h/12 h 的特定无病原体条件下。所有动物实验均经济宁医学院附属滕州市中心人民医院动物伦理委员会批准(H20220513),符合3R原则。
1.2 主要试剂与仪器
FGD5-AS1 小干扰RNA/过表达载体(si-FGD5-AS1/pc-FGD5-AS1) 及相应对照(si-NC/pcDNA)、miR-129-5p 模拟物/抑制物(miR-129-5p mimics/inhibitor)及相应对照(NC mimics/inhibitor)购自上海吉玛制药技术有限公司(批号: 20181019、20180511);Lipofectamine 3000 购自山东博科再生医学有限公司(批号:20190322);RevertAid 第一链互补DNA(complementary DNA,cDNA)合成试剂盒购自北京百诺威生物科技有限公司(批号:20170605);SYBR Green PCR 试剂盒购自北京毕特博生物技术有限责任公司(批号:20150627);细胞计数试剂盒8(cell counting kit-8,CCK-8)购自武汉菲恩生物科技有限公司;Annexin V-FITC/PI 细胞凋亡试剂盒购自武汉艾美捷科技有限公司(批号:20140520);双荧光素酶报告基因检测试剂盒购自上海翌圣生物科技股份有限公司(批号:20170825);HMGB1 抗体购自Abcam 公司(批号:20201123)。 FACSCalibur 流式细胞仪(美国BD 公司);ABI 7300 实时荧光定量PCR 仪(美国ABI 公司);Varioskan LUX 多功能酶标仪(美国Thermo Scientific 公司)。
1.3 实验方法
1.3.1 TANRIC 数据库分析
采用癌症非编码RNA 图谱(TANRIC)来获取和分析FGD5-AS1 在OSCC 中的表达水平。 利用来自癌症基因组图谱(the cancer genome atlas,TCGA)的大规模RNA-seq 数据集来探索LncRNAs 的功能( http:/ /bioinformatics.mdanderson.org/main/TANRIC: Overview)。
1.3.2 细胞培养
HOK 细胞和OSCC 细胞(SCC-9、HSC-4、SCC-25、CAL-27)用添加1%青霉素/链霉素和10%胎牛血清的DMEM 培养基,在37℃和5% CO2条件下培养。
1.3.3 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测FGD5-AS1 和miR-129-5p 表达水平
组织和细胞的RNA 提取采用TRIzol 试剂。 利用RevertAid 第一链cDNA 合成试剂盒将RNA 反向转录为cDNA。 用SYBR Green PCR 试剂盒在ABI 7300 实时荧光定量PCR 仪上进行PCR 扩增。GAPDH 和U6 作为内部对照,采用2-ΔΔCt方法计算目标基因的相对表达量。 引物如下:FGD5-AS1,正向 5 ’-TTTGCTGTTTGATATTGG-3’, 反 向 5 ’-TGTTTTGAGTTGTCTTCG-3’;miR-129-5p,正向5’-ACCCAGTGCGATTTGTCA-3 ’, 反 向 5 ’-ACTGTACTGGAAGATGGACC-3’; U6, 正 向 5’-GCCAGCTCCTACATCTCAGC-3 ’, 反 向 5 ’-AGCCTGACTTGCTAGTGGATTAT-3’;GAPDH,正向5’-CAGGAGGCATTGCTGATGAT-3 ’, 反 向 5 ’-GAAGGCTGGGGCTCATTT-3’。
1.3.4 细胞转染
CAL-27 细胞分为Control 组(正常培养,不转染)、si-NC 组(转染si-NC)、si-FGD5-AS1 组(转染si-FGD5-AS1)、si-FGD5-AS1+NC inhibitor 组(共转染si-FGD5-AS1 和NC inhibitor)和si-FGD5-AS1+miR-129-5p inhibitor 组(共转染si-FGD5-AS1 和miR-129-5p inhibitor),转染按照Lipofectamine 3000说明书进行。 转染48 h 后,收集细胞。
1.3.5 细胞增殖能力检测
CCK-8 法:转染后的CAL-27 细胞置于96 孔板中。 在培养24、48、72 和96 h 后用CCK-8 检测细胞活力。 最后,通过酶标仪记录450 nm 处的光密度(OD)值。 以OD 值代表细胞增殖活力(简称细胞活力)。 克隆形成实验:将细胞以每孔300 个细胞的密度接种到6 孔板中,在细胞培养箱中培养14 d。当克隆体肉眼可见时,培养终止。 弃去培养基,4%多聚甲醛固定细胞15 min,结晶紫染色15 min。 在显微镜下观察并计数细胞克隆数(>50 个细胞)。
1.3.6 流式细胞术检测细胞凋亡
将各组CAL-27 细胞重悬于100μL 结合缓冲液中,分别与5 μL FITC-Annexin V 染色液和5 μL PI染色液一起孵育10 min,使用FACSCalibur 流式细胞仪评估细胞凋亡。
1.3.7 划痕愈合实验检测细胞迁移能力
将各组CAL-27 细胞接种于6 孔板,培养24 h。当细胞铺满80%以上的板后,用无菌移液管划伤单层细胞,观察划痕并拍照。 然后,将CAL-27 细胞在无血清DMEM 培养基中继续培养24 h,再次观察划痕并拍照。 使用Image J 软件计算划痕愈合率。 划痕愈合率=(0 h 划痕宽度-24 h 划痕宽度)/0 h 划痕宽度×100%。
1.3.8 Transwell 小室检测细胞侵袭能力
将各组CAL-27 细胞重悬在无血清培养基中,取200 μL 细胞悬液(2×104个细胞)加入到预涂有基质胶的上室,下室加入600 μL 含10%胎牛血清的培养基。 孵育24 h 后,将附着在膜下表面的细胞分别用甲醇和结晶紫固定和着色。 在显微镜下随机选取5 个视野进行入侵细胞计数。
1.3.9 双荧光素酶报告实验验证FGD5-AS1 与miR-129-5p 的靶向关系
将 WT-FGD5-AS1/MUT-FGD5-AS1 克 隆 到pmirGLO 双荧光素酶载体中,构建pmirGLO-WTFGD5-AS1/MUT-FGD5-AS1 重组载体。 将pmirGLOWT-FGD5-AS1/MUT-FGD5-AS1 载体分别与miR-129-5p mimic 或NC mimic 共转染至CAL-27 细胞。采用双荧光素酶报告分析系统对荧光素酶活性进行评估。
1.3.10 Western blot 检测HMGB1 蛋白水平
从OSCC 组织和细胞中提取总蛋白。 蛋白质用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转移到聚偏二氟乙烯膜上,用5%脱脂牛奶封闭膜1 h。随后,将膜与抗HMGB1、β-actin 的一抗4℃下孵育过夜,再与二抗孵育1 h。 显影,使用ImageJ 软件计算HMGB1 蛋白表达,β-actin 为内参。
1.3.11 裸鼠移植瘤实验
将转染阴性对照(sh-NC)、sh-FGD5-AS1、miR-129-5p inhibitor 或 sh-FGD5-AS1 与 miR-129-5p inhibitor 共转染的CAL-27 细胞(5×106)皮下注射至BALB/c 裸鼠(n=5),记为sh-NC 组、sh-FGD5-AS1组、miR-129-5p inhibitor 组和sh-FGD5-AS1+miR-129-5p inhibitor 组。 每周记录移植瘤的宽度和长度,计算肿瘤体积:肿瘤体积=(长×宽2)/2。 5 周后处死小鼠,取肿瘤称重。 将肿瘤组织一部分固定后制备石蜡切片,切片经常规脱蜡后进行Ki67、HMGB1 免疫组化染色,另一部分进行匀浆检测FGD5-AS1 和miR-129-5p 表达。
1.4 统计学方法
SPSS 20.0 软件进行统计分析,计量资料符合正态分布以平均数±标准差(±s)表示。 两组间比较采用t检验,多组间比较采用单因素方差分析和SNK-q检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 TANRIC 数据库分析FGD5-AS1、miR-129-5p在OSCC 中的表达
TANRIC 平台数据挖掘显示,在OSCC 肿瘤组织中FGD5-AS1 的表达水平是正常组织的4 倍,见表1。 288 份OSCC RNA-seq 样本中,FGD5-AS1 表达与OSCC 患者G 级较差相关,见表2。
表1 TANRIC 平台获得的人类OSCC 组织和正常组织中FGD5-AS1的表达水平(±s)Table 1Expression level of FGD5-AS1 in human OSCC tissues and normal tissues obtained from TANRIC platform
组织Organization n FGD5-AS1正常组织 Normal tissue 38 0.36±0.12肿瘤组织 Tumor tissue 297 1.29±0.35 t/16.239 P /0.000
表2 不同分级OSCC组织中FGD5-AS1的表达水平(±s)Table2 Expression level of FGD5-AS1 in OSCC tissues of different grades

表2 不同分级OSCC组织中FGD5-AS1的表达水平(±s)Table2 Expression level of FGD5-AS1 in OSCC tissues of different grades
注:与G1 比较,*P<0.05。Note.Compared with G1,*P<0.05.
级别 Classification n FGD5-AS1 G1 43 0.79±0.18 G2 178 0.98±0.25*G3 62 1.32±0.41*G4 5 1.51±0.43*
2.2 FGD5-AS1、miR-129-5p 在OSCC 中的表达
与正常组织相比,肿瘤组织中FGD5-AS1 表达显著增加,miR-129-5p 表达显著减少(P<0.05),见表3。 与人口腔黏膜细胞HOK 相比,OSCC 细胞系SCC-9、HSC-4、SCC-25、CAL-27 中FGD5-AS1 表达明显升高,miR-129-5p 表达显著降低(P<0.05),且CAL-27 细胞中FGD5-AS1 表达水平最高、miR-129-5p 表达最低,因此选择CAL-27 细胞进行后续实验,见表4。
表3 FGD5-AS1、miR-129-5p 在OSCC 组织中的表达水平(±s,n=30)Table 3 Expression level of FGD5-AS1 and miR-129-5p in OSCC tissues
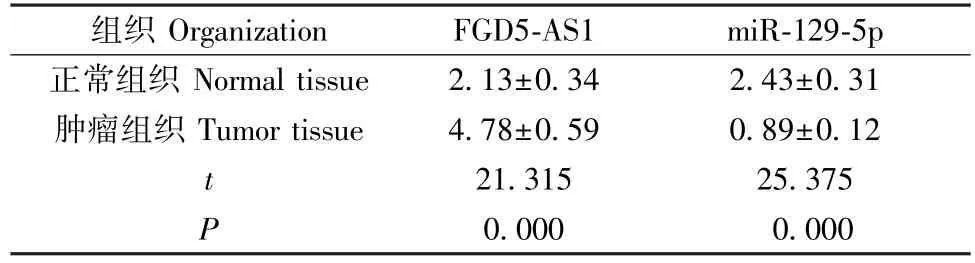
表3 FGD5-AS1、miR-129-5p 在OSCC 组织中的表达水平(±s,n=30)Table 3 Expression level of FGD5-AS1 and miR-129-5p in OSCC tissues
组织 Organization FGD5-AS1 miR-129-5p正常组织 Normal tissue 2.13±0.34 2.43±0.31肿瘤组织 Tumor tissue 4.78±0.59 0.89±0.12 t 21.315 25.375 P 0.000 0.000
表4 FGD5-AS1、miR-129-5p 在OSCC细胞系中的表达水平(±s,n=6)Table 4 Expression level of FGD5-AS1 and miR-129-5p in OSCC cell line

表4 FGD5-AS1、miR-129-5p 在OSCC细胞系中的表达水平(±s,n=6)Table 4 Expression level of FGD5-AS1 and miR-129-5p in OSCC cell line
注:与HOK 比较,*P<0.05。Note.Compared with HOK,*P<0.05.
细胞系 Cell line FGD5-AS1 miR-129-5p HOK 1.00±0.03 1.03±0.08 SCC-9 2.46±0.12* 0.45±0.04*HSC-4 3.47±0.23* 0.42±0.06*SCC-25 4.35±0.29* 0.39±0.05*CAL-27 5.12±0.34* 0.35±0.03*
2.3 干扰FGD5-AS1 对OSCC 细胞增殖的影响
si-FGD5-AS1 组CAL-27 细胞中的FGD5-AS1 表达量、OD 值(48 h、72 h、96 h)、克隆细胞数显著低于Control 组和si-NC 组(P<0.05),见表5 和图1。

图1 干扰FGD5-AS1 对OSCC 细胞克隆细胞数的影响Figure 1 Effect of interfering with FGD5-AS1 on the number of OSCC cell clones
表5 干扰FGD5-AS1 对OSCC 细胞增殖的影响(±s,n=6)Table 5 Effect of FGD5-AS1 interference on OSCC cell proliferation

表5 干扰FGD5-AS1 对OSCC 细胞增殖的影响(±s,n=6)Table 5 Effect of FGD5-AS1 interference on OSCC cell proliferation
注:与Control 组比较,*P<0.05;与si-NC 组比较,#P<0.05。Note.Compared with Control group,*P<0.05.Compared with si-NC group,#P<0.05.
组别Groups FGD5-AS1 OD 值(450 nm)OD value (450 nm)24 h 48 h 72 h 96 h克隆细胞数(n)Number of cloned cells Control 组Control group 1.00±0.06 0.46±0.03 0.75±0.09 1.16±0.13 1.40±0.25 489.52±56.23 si-NC 组si-NC group 0.99±0.05 0.49±0.05 0.78±0.11 1.14±0.15 1.42±0.23 488.94±56.12 si-FGD5-AS1 组si-FGD5-AS1 group 0.21±0.02*# 0.47±0.06 0.53±0.08*# 0.67±0.12*# 0.75±0.16*# 245.61±37.45*#
2.4 干扰FGD5-AS1 对OSCC 细胞凋亡、迁移、侵袭的影响
与Control 组和si-NC 组比较,si-FGD5-AS1 组CAL-27 细胞凋亡率明显上升,划痕愈合率明显降低,侵袭细胞数显著减少(P<0.05),见表6 和图2。
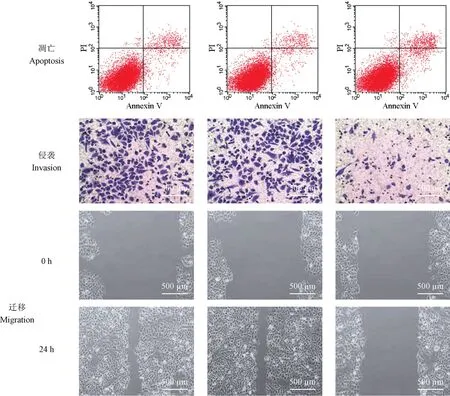
图2 干扰FGD5-AS1 对OSCC 细胞凋亡、侵袭和迁移的影响Figure 2 Interference of FGD5-AS1 on apoptosis, invasion and migration of OSCC cells
表6 干扰FGD5-AS1 对OSCC 细胞凋亡、迁移、侵袭的影响(±s,n=6)Table 6 Effect of FGD5-AS1 interference on apoptosis, migration and invasion of OSCC cells

表6 干扰FGD5-AS1 对OSCC 细胞凋亡、迁移、侵袭的影响(±s,n=6)Table 6 Effect of FGD5-AS1 interference on apoptosis, migration and invasion of OSCC cells
注:与Control 组比较,*P<0.05;与si-NC 组比较,#P<0.05。Note.Compared with Control group,*P<0.05.Compared with si-NC group,#P<0.05.
组别Groups凋亡率(%)Apoptosis rate划痕愈合率(%)Scratch healing rate侵袭细胞数(n)Number of invasive cells Control 组Control group 3.74±0.13 83.45±9.21 89.26±10.15 si-NC 组si-NC group 3.72±0.17 84.16±9.34 88.47±10.24 si-FGD5-AS1 组si-FGD5-AS1 group 8.69±0.35*# 37.58±2.57*# 28.76±1.89*#
2.5 FGD5-AS1 靶向调控miR-129-5p 表达
Starbase 软件预测显示FGD5-AS1 与miR-129-5p 可能存在相互作用关系,具体的结合位点如图3A 所示。 与NC mimics+WT-FGD5-AS1 组比较,miR-129-5p mimics+WT-FGD5-AS1 组CAL-27 细胞的相对荧光素酶活性明显降低(P<0.05),而NC mimics+MUT-FGD5-AS1组与miR-129-5p mimics+MUT-FGD5-AS1 组CAL-27 细胞的相对荧光素酶活性无明显变化(P>0.05),见图3B。 与si-NC 组比较,si-FGD5-AS1 组CAL-27 细胞中miR-129-5p 表达升高(P<0.05);与pcDNA 组比较,pc-FGD5-AS1 组CAL-27 细胞中miR-129-5p 表达降低(P<0.05),见图3C。
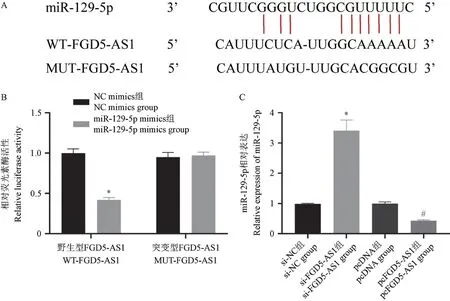
注:A:FGD5-AS1 与miR-129-5p 的结合位点;B:验证FGD5-AS1 与miR-129-5p 靶向关系的双荧光素酶活性检测结果,与NC mimics+WTFGD5-AS1 组相比,*P<0.05;C:FGD5-AS1 靶向调控miR-129-5p 表达,与si-NC 组相比,*P<0.05;与pcDNA 组相比,#P<0.05。图3 FGD5-AS1 靶向调控miR-129-5p 表达Note.A, Binding site of FGD5-AS1 and miR-129-5p.B, Results of dual luciferase activity detection to verify the targeting relationship between FGD5-AS1 and miR-129-5p.Compared with NC mimics+WT-FGD5-AS1 group,*P<0.05.C, FGD5-AS1 targeted miR-129-5p expression.Compared with si-NC group,*P<0.05.Compared with pcDNA group,#P<0.05.Figure 3 FGD5-AS1 targeted regulation of miR-129-5p expression
2.6 抑制miR-129-5p 可逆转si-FGD5-AS1 对OSCC 细胞的影响
与si-FGD5-AS1 组和si-FGD5-AS1+NC inhibitor组相比,si-FGD5-AS1+miR-129-5p inhibitor 组CAL-27 细胞中miR-129-5p 表达显著降低,48 h、72 h 和96 h 的OD 值显著升高,克隆细胞数明显增多,细胞凋亡率明显下降,划痕愈合率显著增加,侵袭细胞数显著增多(P<0.05),见图4 和表7。
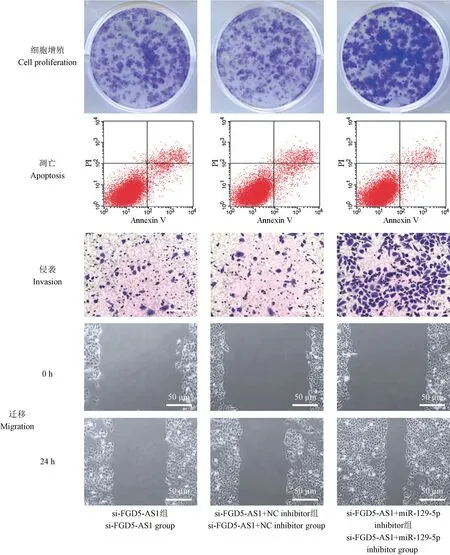
图4 抑制miR-129-5p 可逆转si-FGD5-AS1 对OSCC 细胞增殖、凋亡、侵袭和迁移的影响Figure 4 Inhibition of miR-129-5p can reverse the proliferation, apoptosis, invasion and migration of si-FGD5-AS1 on OSCC cells
表7 抑制miR-129-5p 可逆转si-FGD5-AS1 对OSCC 细胞的影响(±s,n=6)Table 7 Inhibition of miR-129-5p can reverse the effect of si-FGD5-AS1 on OSCC cells
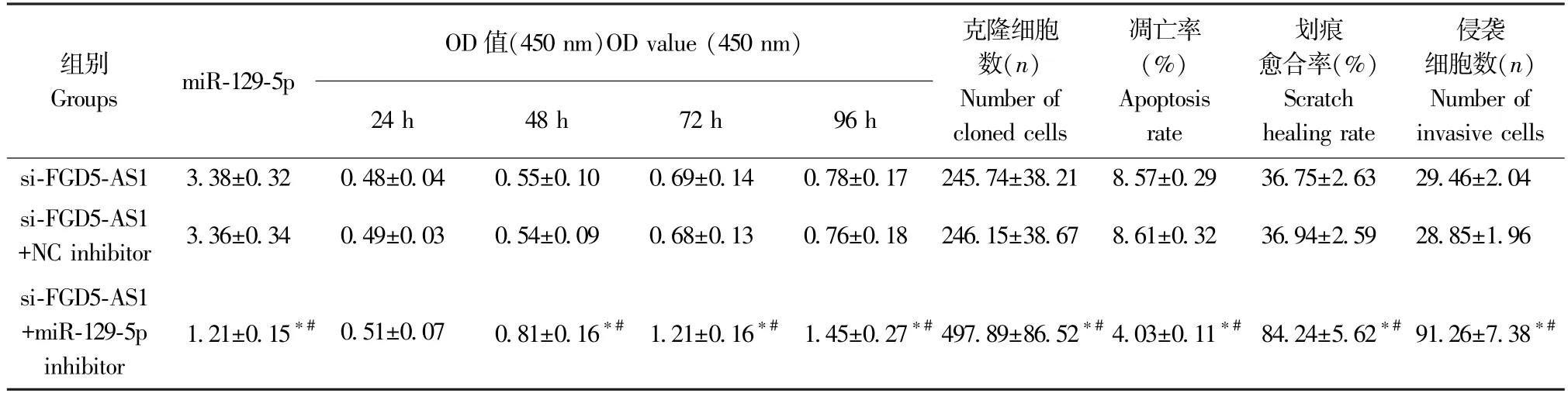
表7 抑制miR-129-5p 可逆转si-FGD5-AS1 对OSCC 细胞的影响(±s,n=6)Table 7 Inhibition of miR-129-5p can reverse the effect of si-FGD5-AS1 on OSCC cells
注:与si-FGD5-AS1 组相比,*P<0.05;与si-FGD5-AS1+NC inhibitor 组相比,#P<0.05。Note.Compared with si-FGD5-AS1 group,*P<0.05.Compared with si-FGD5-AS1+NC inhibitor group,#P<0.05.
组别Groups miR-129-5p OD 值(450 nm)OD value (450 nm)24 h 48 h 72 h 96 h克隆细胞数(n)Number of cloned cells凋亡率(%)Apoptosis rate划痕愈合率(%)Scratch healing rate侵袭细胞数(n)Number of invasive cells si-FGD5-AS1 3.38±0.32 0.48±0.04 0.55±0.10 0.69±0.14 0.78±0.17 245.74±38.21 8.57±0.29 36.75±2.63 29.46±2.04 si-FGD5-AS1+NC inhibitor 3.36±0.34 0.49±0.03 0.54±0.09 0.68±0.13 0.76±0.18 246.15±38.67 8.61±0.32 36.94±2.59 28.85±1.96 si-FGD5-AS1+miR-129-5p inhibitor 1.21±0.15*# 0.51±0.07 0.81±0.16*# 1.21±0.16*# 1.45±0.27*# 497.89±86.52*# 4.03±0.11*# 84.24±5.62*# 91.26±7.38*#
2.7 FGD5-AS1 通过miR-129-5p 调控HMGB1 蛋白表达
与Control 组和si-NC 组相比,si-FGD5-AS1 组CAL-27 细胞中HMGB1 蛋白表达显著降低(P<0.05); 与 si-FGD5-AS1 组 和 si-FGD5-AS1 + NC inhibitor 组相比,si-FGD5-AS1+miR-129-5p inhibitor组CAL-27 细胞中HMGB1 蛋白表达显著升高(P<0.05),见图5。
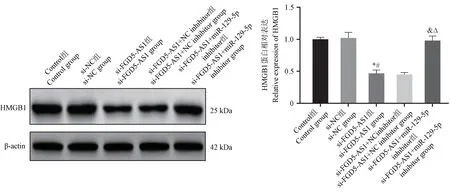
注:与Control 组相比,*P <0.05;与si-NC 组相比,#P <0.05;与si-FGD5-AS1 组相比,&P <0.05;与si-FGD5-AS1+NC inhibitor 组相比,△P<0.05。图5 各组OSCC 细胞中HMGB1 蛋白表达Note.Compared with Control group,*P<0.05.Compared with si-NC group,#P<0.05.Compared with si-FGD5-AS1 group,&P<0.05.Compared with si-FGD5-AS1+NC inhibitor group,△P<0.05.Figure 5 HMGB1 protein expression in OSCC cells of each group
2.8 FGD5-AS1 通过靶向miR-129-5p/HMGB1 促进体内OSCC 进展
结果如图6 所示,与sh-NC 组相比,sh-FGD5-AS1 组肿瘤重量和肿瘤体积、FGD5-AS1 表达及Ki67、HMGB1 阳性细胞比例显著降低,miR-129-5p表达显著升高(P<0.05),而miR-129-5p inhibitor 组肿瘤重量和肿瘤体积、FGD5-AS1 表达及Ki67、HMGB1 阳性细胞比例显著升高,miR-129-5p 表达显著降低(P<0.05);与sh-FGD5-AS1 组相比,sh-FGD5-AS1+miR-129-5p inhibitor 组和miR-129-5p inhibitor 组肿瘤重量和肿瘤体积、FGD5-AS1 表达及Ki67、HMGB1 阳性细胞比例显著升高,miR-129-5p表达显著降低(P<0.05)。

注:A、B:移植瘤组织中FGD5-AS1 和miR-129-5p 相对表达水平;C:不同组皮下肿瘤的代表性图像;D:肿瘤重量比较;E:肿瘤体积比较;F:免疫组化方法检测肿瘤组织中Ki67、HMGB1 阳性表达。 与sh-NC 组相比,*P<0.05;与sh-FGD5-AS1 组相比,#P<0.05。图6 FGD5-AS1 通过靶向miR-129-5p/HMGB1 促进体内OSCC 进展Note.A/B, Relative expression levels of FGD5-AS1 and miR-129-5p in transplanted tumor tissues.C, Representative images of subcutaneous tumors in different groups.D, Tumor weight comparison.E, Tumor volume comparison.F, Positive expressions of Ki67 and HMGB1 in tumor tissues were detected by immunohistochemical method.Compared with sh-NC group,*P<0.05.Compared with sh-FGD5-AS1 group,#P<0.05.Figure 6 FGD5-AS1 promotes OSCC progression in vivo by targeting miR-129-5p/HMGB1
3 讨论
LncRNA 已被报道与OSCC 有关[15-16]。 有报道显示FGD5-AS1 为OSCC 的潜在诊断生物标志物,FGD5-AS1 的敲低可抑制OSCC 细胞的增殖、迁移和侵袭。 本研究通过TANRIC 平台的数据挖掘发现,FGD5-AS1 在OSCC 中呈高表达,且与预后不良相关[10]。 此外,本研究还发现,OSCC 组织样本和细胞系中FGD5-AS1 表达升高,敲低FGD5-AS1 后,CAL-27 细胞增殖活力、迁移和侵袭能力均受到抑制,细胞凋亡增加,这与以往的研究结果一致,提示FGD5-AS1 可能在OSCC 中起促癌基因作用[10]。
LncRNA 可以海绵吸附调节miRNA 表达,进而调控癌症进展[17]。 miR-129-5p 可作为抑癌因子阻碍胃癌、肺癌、乳腺癌等发展[18-20]。 在本研究中,miR-129-5p 在OSCC 组织和细胞中的表达均下降,这与Supic 等[14]的研究结果一致,说明miR-129-5p在OSCC 中发挥抑癌作用。 研究证实,在胶质瘤细胞中FGD5-AS1 通过调控miR-129-5p 刺激Wnt/βcatenin 信号通路进而促进细胞生长和侵袭[21]。 本研究发现miR-129-5p 与FGD5-AS1 的表达趋势相反,Starbase 软件预测miR-129-5p 可能是FGD5-AS1的靶基因。 本研究通过双荧光素酶实验和过表达/敲低FGD5-AS1 实验证实了FGD5-AS1 和miR-129-5p 的负向调控关系。 此外,抑制miR-129-5p 可减弱敲低FGD5-AS1 的肿瘤抑制作用,提示敲低FGD5-AS1 可能通过上调miR-129-5p 表达,抑制OSCC 细胞的恶性生物学行为。
本研究通过数据库预测和查阅文献发现,HMGB1 是miR-129-5p 的靶基因[12],Western blot 证实干扰FGD5-AS1 在上调miR-129-5p 表达的同时可抑制HMGB1 蛋白表达。 为了进一步验证FGD5-AS1/miR-129-5p/HMGB1 轴在OSCC 中的作用,本研究建立了体内异种移植瘤模型,发现沉默FGD5-AS1 可通过调控miR-129-5p/HMGB1 轴来减弱OSCC 细胞的肿瘤发生,与体外结果一致,提示FGD5-AS1 通 过 调 控 miR-129-5p/HMGB1 促 进OSCC 进展。 但尚需设计HMGB1 过表达以确定FGD5-AS1/miR-129-5p 在异种移植模型OSCC 中的作用。
综上所述,FGD5-AS1 在OSCC 中表达上调,干扰FGD5-AS1 可通过靶向负调控miR-129-5p 表达,抑制OSCC 细胞增殖、侵袭和迁移并促进凋亡。 本研究为FGD5-AS1 在OSCC 中的机制研究提供新依据,有望为OSCC 患者提供一种潜在的治疗策略。然而,miR-129-5p 下游的靶点众多,FGD5-AS1/miR-129-5p 能否通过其他靶基因参与OSCC 进展尚需进一步探究。 此外,本研究仅使用一种细胞系进行FGD5-AS1 功能研究,后期将通过其他OSCC 细胞来进一步验证FGD5-AS1 的致癌作用。
