抑制线粒体内膜蛋白OMA1 对Rot 诱导帕金森病细胞模型凋亡的影响
2023-12-13瑾吕玥徐婷宣婷婷杨娟杜丹丹张俊梅李海宁
石 瑾吕 玥徐 婷宣婷婷杨 娟杜丹丹张俊梅李海宁*
(1.宁夏医科大学总医院神经内科,银川 750004;2.宁夏医科大学总医院心脑血管病医院神经电生理科,银川 750004)
帕金森病(Parkinson’s disease, PD)是一种慢性不可治愈的神经退行性疾病,主要影响老年人,就患病率而言,PD 在世界上排名第二[1]。 PD 具有广泛的表型和有限的治疗[2]。 PD 患者出现运动症状及非运动症状时其体内多巴胺能神经元通常消失50%~80%[3-4]。 PD 目前是无法治愈的,有限的可用于临床干预的措施只能提供症状缓解。 目前导致PD 的确切原因仍有待探索,相关研究显示,线粒体功能障碍是PD 的主要发病机制[5]。 线粒体动力学缺陷导致线粒体功能障碍,并与神经退行性疾病有关[6-7]。
近年来,OMA1(overlapping activity with m-AAA protease,OMA1)作为一种用于调节线粒体动力学研究的内膜蛋白逐渐受到重视。 OMA1 在生理状态下活性很低,但当线粒体应激时被迅速激活,过度活跃的OMA1 是致病性的[8-9],其可过度激活视神经萎缩蛋白1(optic atrophy protein 1,OPA1),导致LOPA1(长形式)裂解增强,S-OPA1(短形式)释放增加,过量的S-OPA1 可通过其成膜特性提高Bax/Bak1 活化后的外膜通透性并促进细胞色素c的释放,促进线粒体的分裂和神经元的凋亡[10]。 另外,相关研究报道称基因消融OMA1 可防止OPA1 裂解,延迟小鼠神经退化模型中的神经元凋亡[11]。OMA1 通过激活L-OPA1 亚型从而抑制线粒体融合而诱发凋亡。 OMA1 在肿瘤方面的研究较多[12],但是OMA1 在PD 中的研究有限,因此,研究设想抑制OMA1 可能通过抑制细胞凋亡从而为以线粒体功能障碍为主要发病机制的PD 疾病提高新的治疗靶点。 本研究使用Rot 诱导人神经母细胞瘤细胞SHSY5Y 建立体外PD 细胞模型,旨在研究PD 细胞模型上OMA1 的表达水平及抑制OMA1 的表达对PD细胞模型凋亡的影响,为帕金森病的治疗提供理论依据。
1 材料和方法
1.1 细胞
人神经母细胞瘤细胞SH-SY5Y 细胞系购自武汉普诺赛生命科技有限公司(货号:CL-0208),细胞实验经宁夏医科大学总医院医学科研伦理审查委员会审核批准(KYLL-2022-0135)。
1.2 主要试剂与仪器
TUNEL 凋亡检测试剂盒(货号:KGA7073)、全蛋白提取试剂盒(货号:KGP250)、BCA 蛋白含量检测试剂盒(货号:KGPBCA)、SDS-PAGE 凝胶配制试剂盒(货号:KGP113)均购自江苏凯基生物公司;CCK-8 试剂盒(货号:C6005)购自苏州新赛美生物科技有限公司;MEM/F12 培养基(货号:PM151220)购自武汉普诺赛生命科技有限公司;DNA RNA Transfection Reagent(货号:IV1216050) 购自美国Invitrogen 公司;EDTA 含酚红胰酶胰酶(货号:T1320)购自北京索莱宝科技有限公司、胎牛血清(FBS)(货号:04-001-1ACS)购自以色列Biological Industries 公司; 鱼藤 酮(Rotenone) (货号: HYB1756-1)购自美国MCE 公司;GAPDH Ab(货号:AF7021-30)购自江苏Affity 公司;Anti-OMA1(货号:ab154949)、Anti-caspase-3(货号:ab32351-10 μL)、Anti-Bax ( 货 号: ab32503)、 Anti-Bcl-2 ( 货 号:ab32124)抗体均购自英国Abcam 公司;山羊抗兔二抗IgG-HRP 购自北京中杉金桥生物技术有限公司;OMA1 siRNA 合成序列由上海汉恒生物科技有限公司合成及提供。 细胞培养箱(型号:HF-90;Heal Force 公司);生物安全柜(型号:HFSAFE-1200;NUAIRE 公 司); 倒 置 显 微 镜( 型 号: CX51;OLYMPUS 公司);倒置荧光生物显微镜(型号:AXIO OBSERVER A1; AxioCam MRc5 公 司);Western blot 制胶设备(型号:mx1731;北京六一仪器公司);多色荧光凝胶成像系统(型号:CHEMI DOC MP;BioRad 公司)。
1.3 实验方法
1.3.1 SH-SY5Y 细胞培养及传代
从液氮罐中将冻存的SH-SY5Y 细胞取出,迅速移至提前预热的37℃水浴锅中,使其快速融化。 将细胞悬液吸至含有配制好的完全培养基(89%MEM/F12+10% FBS +1%双抗)的15 mL 离心管中,1000 r/min 离心5 min,弃上清,加入提前配制好的培养基吹打混匀,将细胞悬液吸至含有4 mL 完全培养基的60 mm 培养皿中充分混匀,然后置于5%CO2、37℃的培养箱中培养,每2 d 换液1 次。 当细胞密度达80%左右时予以胰酶消化,按1 ∶2 进行传代。
1.3.2 CCK-8 法筛选出最佳Rot 处理浓度
将SH-SY5Y 细胞用胰酶消化后按100μL 中含细胞数2×104个接种于96 孔板中,贴壁培养24 h后,加入用完全培养基稀释好不同浓度的Rot(0.05、0.1、0.2、0.3、0.4 μmol/L)轻轻混匀后继续放入培养箱中培养24 h 后,每孔加入100 μL 配制好的CCK-8 溶液(MEM/F12 90 μL+CCK-8 10 μL),继续放入培养箱中培养2 h,酶标仪检测OD450进行数据统计分析。 实验重复3 次。
1.3.3 实验分组、处理及OMA1 siRNA 转染
实验分为对照(control)组(细胞不经特殊处理)、PD 模型(PD model)组(0.2 μmol/L 的Rot 处理细胞24 h)、空载转染(negative control)组(正常对照组基础上转染OMA1-siRNA 的阴性对照序列)和OMA1 siRNA 组(0.2 μmol/L 的Rot 处理细胞24 h 后转染OMA1 siRNA)。
PD 细胞构建成功后,进行siRNA 的转染,参照Invigentech INVI DNA RNA 转染说明书,将不同序列siRNA 各15 μL 与转染试剂Invigentech INVI DNA RNA 15 μL 混合,室温静置10 ~15 min 后转染至构建好的PD 细胞模型上24 h,采用Western blot检测最佳OMA1 沉默序列。 实验重复3 次。
1.3.4 TUNEL 染色检测细胞凋亡
12 孔板中接种各处理组细胞,实验分组及处理同1.3.3,将不同处理组的细胞固定;1% TritonX-100 通透液处理5 min;在阳性片上滴加配制好的DNaseI 反 应 液(DNaseI 30 μL+DNaseI Buffer 70 μL),37℃处理30 min;滴加TdT 酶反应液,37℃避光60 min,洗涤;滴加Streptavidin-Fluorescein 标记液,再在37℃避光30 min,洗涤;DAPI 复染细胞核,再次洗涤;荧光显微镜下观察并拍照(激发波长450~500 nm,发射波长515~565 nm)。 实验重复3 次。
1.3.5 Western blot 检测OMA1、Caspase-3、Bax 和Bcl-2 蛋白表达
各个实验处理组提取总蛋白,采取BCA 法进行蛋白浓度的测定,统一各组蛋白浓度为2 μg/μL,100℃金属浴中处理蛋白5 min,使蛋白变性,上样量为30 μg,选取10% SDS-PAGE 分离胶、5%浓缩胶进行电泳,转膜至PVDF 膜上,用5%脱脂牛奶于室温下封闭1.5 h;加入对应的一抗OMA1(1 ∶1000)、Caspase-3(1 ∶5000)、Bax(1 ∶5000)、Bcl-2(1 ∶1000),GAPDH(1 ∶10 000)于4℃孵育过夜;然后用TBST 洗涤3 次,每次10 min,分别加入HRP 标记的山羊抗兔IgG(1 ∶10 000),室温孵育1 h,再次TBST洗膜3 次,配制ECL 发光液后,将目的条带置于凝胶成像仪中,进行曝光和显影。 使用Image J 软件对蛋白质相对表达量进行分析。
1.4 统计学方法
实验数据均为计量资料,结果以平均数±标准差(±s)示,应用GraphPad Prism 8.0 统计学软件进行数据分析,方差齐时,采用单因素方差分析,P<0.05 表示差异具有统计学意义。
2 结果
2.1 CCK-8 筛选出最佳Rot 浓度
如表1 所示,以对照组细胞存活率为100%计算,随着Rot 作用SH-SY5Y 细胞浓度逐渐增加(0.05、0.1、0.2、0.3、0.4 μmol/L),SH-SY5Y 细胞生存率呈浓度依赖性降低(P<0.05)。 由于在Rot作用浓度为0.2 μmol/L 时,细胞存活率为(50.00±1.01)%。 因此将0.2 μmol/L Rot 浓度设为后续实验造模最佳浓度。

表1 不同浓度Rot 对SH-SY5Y 细胞存活率的影响Table 1 Effect of different concentrations of Rot on the survival rate of SH-SY5Y cells
2.2 不同浓度Rot 诱导SH-SY5Y 细胞中OMA1及凋亡相关蛋白的表达
如图1A、1B 所示,与对照组相比,0.1 μmol/L和0.2 μmol/L Rot 诱导SH-SY5Y 细胞构建的PD细胞模型中OMA1 蛋白表达水平逐渐升高(P<0.01)。 如图1C ~1E 所示,与对照组相比,0.1 μmol/L 和0.2 μmol/L Rot 组Caspase-3 表达明显升高,Bax/Bcl-2 值明显升高(P<0.01)。 提示随着鱼藤酮浓度的升高,PD 细胞模型中OMA1 表达升高,凋亡蛋白的表达逐渐升高,抗凋亡蛋白的表达逐渐降低。

注:A:用Western blot 对不同组的代表性蛋白OMA1 图像进行分析;B:各组OMA1 蛋白表达的定量分析;C:用Western blot 对不同组的代表性蛋白Caspase-3、Bax、Bcl-2 图像进行分析;D:各组Caspase-3 蛋白表达的定量分析;E:各组Bax/Bcl-2 蛋白表达定量的比值分析。 与对照组相比, **P<0.01。图1 不同浓度Rot 诱导SH-SY5Y 细胞中OMA1 及凋亡相关蛋白表达影响Note.A, Representative protein of OMA1 image by Western blot in different groups.B, Quantitative analysis of OMA1 protein expression in each group.C, Representative protein of Caspase-3, Bax, Bcl-2 images by Western blot in different groups.D, Quantitative analysis of Caspase-3 protein expression in each groups.E, Quantitative analysis of Bax/Bcl-2 protein ratio expression in each groups.Compared with control group, **P<0.01.Figure 1 Effect of OMA1 and apoptosis-related protein expression in SH-SY5Y cells induced by different concentrations of Rot
2.3 抑制OMA1 对PD 细胞模型凋亡的影响
2.3.1 抑制OMA1 对细胞形态的影响
如图2 所示,未分化SH-SY5Y 细胞大小均一、细胞突起明显、呈梭形及多边形;给予Rot 处理后形成PD 细胞模型,其细胞形态改变、胞体变圆、突触缩短甚至消失;与PD 细胞模型组相比,OMA1 siRNA 组细胞形态逐渐恢复、突触逐渐恢复,细胞存活率升高。
2.3.2 抑制OMA1 对PD 细胞模型凋亡相关蛋白表达水平的影响
如图3 所示,与PD 模型组相比,OMA1 siRNA组中凋亡蛋白Caspase-3 表达水平降低(P<0.01),Bax/Bcl-2 值明显降低(P<0.01)。 提示抑制OMA1的表达后,可以减轻PD 细胞模型上凋亡蛋白的表达,升高抗凋亡蛋白的表达。
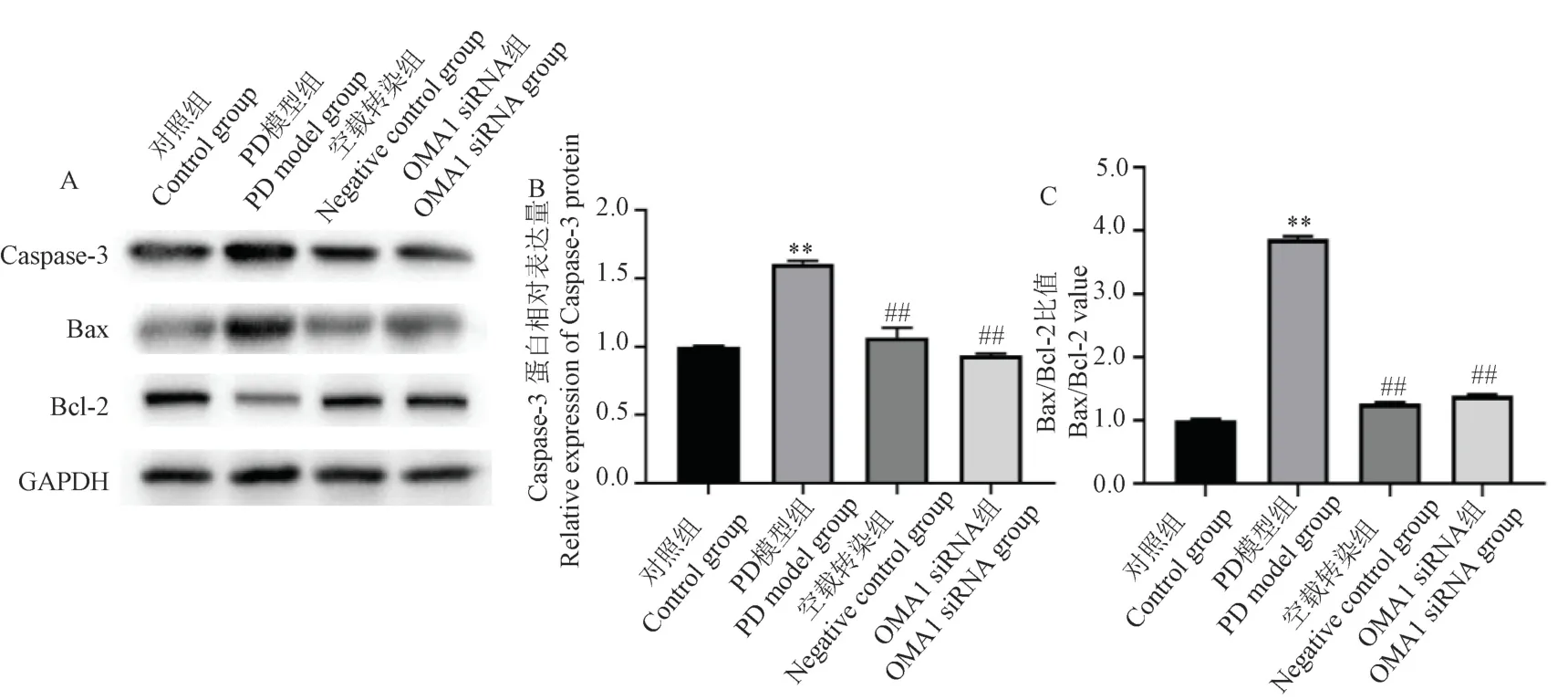
注:A:用Western blot 对不同组的代表性蛋白Caspase-3、Bax、Bcl-2 图像进行分析;B:各组Caspase-3 蛋白表达的定量分析;C:各组Bax/Bcl-2 蛋白表达定量的比值分析。 与对照组比较, **P<0.01;与PD 模型组比较, ##P<0.01。图3 抑制OMA1 在Rot 诱导SH-SY5Y 细胞中凋亡相关蛋白表达影响Note.A, Representative protein of Caspase-3, Bax, Bcl-2 images by Western blot in different groups.B, Quantitative analysis of Caspase-3 protein expression in each groups.C, Quantitative analysis of Bax/Bcl-2 protein ratio expression in each groups.Compared with control group, **P <0.01.Compared with PD model group, ##P<0.01Figure 3 Effect of inhibition of OMA1 in Rot-induced apoptosis-related protein expression in SH-SY5Y cells
2.3.3 抑制OMA1 对PD 细胞模型凋亡TUNEL 染色结果的影响
如图4 所示,通过TUNEL 染色实验进行凋亡验证,与对照组相比,PD 模型组凋亡的绿色荧光强度显著升高;与PD 模型组相比,OMA1 siRNA 组凋亡的绿色荧光强度显著降低。 提示抑制OMA1 通过TUNEL 染色显示可以减轻PD 细胞模型的凋亡。
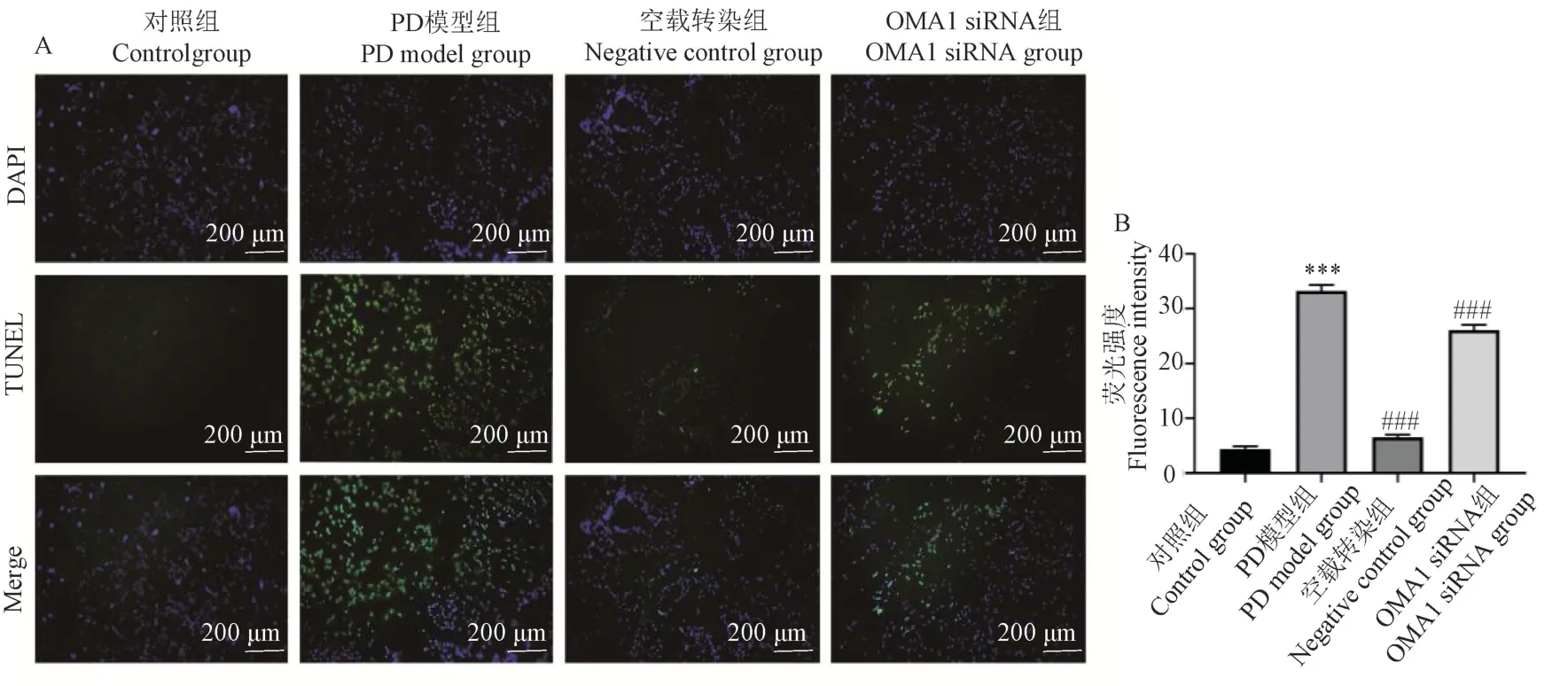
注:A:TUNEL 染色检测各组凋亡荧光强度,TUNEL:绿色荧光标记凋亡细胞;DAPI:蓝色荧光标记细胞核;Merge:TUNEL 与DAPI 合成图;B:各组荧光表达相对量。 与对照组比较, ***P<0.001;与PD 模型组比较, ###P<0.001。图4 抑制OMA1 对PD 细胞模型凋亡TUNEL 染色Note.A, TUNEL staining to detect the fluorescence intensity of apoptosis in each group, TUNEL, Green fluorescent labeling of apoptotic cells.DAPI,Blue fluorescent labeling of cell nuclei.Merge, TUNEL and DAPI synthesis chart.B, Relative amount of fluorescence expression in each group.Compared with control group, ***P<0.001.Compared with PD model group, ###P<0.001.Figure 4 Inhibition of OMA1 on apoptosis TUNEL staining in PD cell models
3 讨论
PD 致病的常见原因有黑质多巴胺能神经元的变性[13]、线粒体功能障碍、氧化应激[14]等。 Polito等[15]报道,遗传和环境因素对PD 的影响非常重要。 PD 与各种内源性和外源性毒素[16]有关,这些毒素经常被用于建立PD 的疾病模型。 Rot 是一种线粒体电子传递链复合物Ⅰ的抑制剂,具有明显的神经毒性,也具有高度亲脂性,容易越过血脑屏障,能够造成多巴胺神经元α-突触核蛋白(α-synuclein,α-syn)聚集[17],并且导致活性氧(reactive oxygen species,ROS)的过度生成,引起多巴胺能神经元的氧化应激[18],是模拟PD 病理常用的神经毒性分子[19]。 因此本研究选用Rot 作为化学诱导剂构建体外PD 细胞模型,并通过调节细胞凋亡为线粒体功能障碍性疾病PD 提供新的治疗靶点。
线粒体是细胞的能量工厂,同时也是诱导细胞死亡通路激活的重要结构。 线粒体的融合由OPA1、Mfn1、Mfn2 调 控,分 裂 则 由Drp1、Fis1 和EndoG 调节[20],在应激条件下,线粒体融合允许功能性线粒体内容物与受损线粒体的代偿性混合,从而减轻急性损伤。 因此,融合中断会加剧急性损伤,导致不可逆转的呼吸能力丧失和随后的细胞死亡。 OPA1 为线粒体形状改变和细胞生存的调控中心。 OPA1 的缺失损害了线粒体融合,干扰了嵴的形态发生,并增加了细胞的凋亡敏感性[21]。 线粒体内膜蛋白OMA1 和i-AAA 蛋白酶YME1L 分别在S1和S2 裂解OPA1[22]。 虽然YME1L 对OPA1 的加工处于代谢控制之下[23],但OMA1 在各种压力应激下被激活,导致L-OPA1 的完全降解和线粒体断裂[24-25]。 此外,培养细胞中OMA1 的缺失被发现可以防止细胞凋亡[26-27]。 相反,过度活跃的OMA1 是致病性的[8,11,28],可能通过破坏OPA1 介导的线粒体融合导致疾病发生。 有趣的是,缺乏OMA1 的小鼠表现出免受神经变性[11]、肾缺血[27]和心力衰竭[8]的保护,这强烈表明OMA1 是有希望的治疗靶标。 然而,OMA1 处理应激诱导的OPA1 在体内普遍相关,但其在PD 发病中对凋亡相关的影响报道有限。
为探究抑制OMA1 在Rot 诱导SH-SY5Y 细胞构建的体外PD 细胞模型中的表达及对凋亡的影响。 用不同浓度Rot 诱导SH-SY5Y 细胞构建体外PD 细胞模型,随着Rot 浓度的升高,OMA1 活性被激活,OMA1 蛋白的表达也逐渐升高,且凋亡蛋白表达升高,抗凋亡蛋白表达降低,实验中凋亡蛋白的表达结果与在PD 患者脑组织的检查显示相符,PD患者脑组织的检查结果显示黑质致密部活性Caspase-3 和Bax 水平升高[29-31]。 接下来设想,在PD 细胞模型上OMA1 的活性是增高的,其表达也是增加的,且凋亡蛋白的表达也是增高的,那么如果抑制OMA1 的表达后,对PD 细胞模型的凋亡会具有抑制作用吗? 在PD 细胞模型基础上抑制OMA1 的表达,首先在形态学上就可以观察到,与PD 模型组相比,抑制OMA1 后细胞存活率明显升高、形态恢复、数量增多,随后通过Western blot 检测到抑制OMA1 的表达后凋亡蛋白表达降低,抗凋亡蛋白表达升高,TUNEL 染色发现抑制OMA1 凋亡的荧光染色与PD 模型组相比减少。
综上所述,本研究发现在PD 细胞模型基础上抑制OMA1 的表达对PD 细胞模型具有保护作用和抗凋亡的作用,可能为PD 患者的治疗提供新的见解。
