小胶质细胞抑制剂Pexidartinib对小鼠遥远场景性恐惧记忆再巩固的影响
2023-12-12王来法王雪琴崔艳慧
王来法,王雪琴,邓 玲,张 辉,崔艳慧
(长沙医学院神经科学与行为学研究中心,湖南 长沙 410219)
创伤后应激障碍(post-traumatic stress disorder,PTSD)是指个体在经历重大自然灾害或生活创伤性事件之后形成的以强烈持久的恐惧反应为核心的一类精神疾病[1-2]。PTSD的主要症状是反复经历创伤、逃避、异常兴奋等情绪体验[3]。正常人群中PTSD的终生患病率为6%~8%,但在重大创伤事件如军事战斗、恐怖袭击、强奸等受害者中,20%~30%的人会发展成PTSD[4]。暴露疗法是临床上治疗PTSD的主要方法,但大多数患者治疗不彻底,缓解后易复发。有研究发现,已巩固的恐惧记忆经唤起激活后进入一种不稳定状态,需经过再次巩固才能转变为稳定的记忆即记忆的再巩固过程[5];在此期间可以对记忆进行更新、改写甚至破坏[6]。已有研究表明,采用普萘洛尔、茴香霉素等破坏记忆的再巩固,可造成记忆的缺失,从而达到治疗恐惧记忆的效果[7-8]。因此,了解恐惧记忆再巩固的过程将有助于PTSD的治疗。此外,创伤记忆往往得不到及时的治疗,大多数患者在接受治疗时记忆已处于远期[9],因此,阐明遥远恐惧再巩固的机制对于 PTSD 的治疗更具有临床意义。研究发现,神经炎症与PTSD的发生发展密切相关;小胶质细胞被认为是神经炎症的主要参与者,同时也是脑内应对PTSD主要的免疫细胞[10-11]。Pexidartinib为一种小胶质细胞抑制剂,在恐惧记忆消退过程中具有重要作用[12-13],但其在记忆再巩固中的作用尚不清楚。研究显示,溴结构域蛋白4 (bromodomain-containing protein 4,BRD4)[14]、消皮素 D(gasdermin D,GSDMD)[15]和混合谱系激酶结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)[16]是调控炎症反应的重要分子。但小胶质细胞抑制剂Pexidartinib是否影响炎症相关分子BRD4、GSDMD、MLKL水平尚不明确。本研究应用巴甫洛夫恐惧条件化小鼠模型探讨小胶质细胞抑制剂Pexidartinib 对小鼠遥远场景性恐惧记忆再巩固以及脑组织中BRD4、GSDMD、MLKL水平的影响,旨在为PTSD的治疗提供参考。
1 材料与方法
1.1 实验动物
8~10周龄健康C57BL/6雄性小鼠 12只,体质量20~25 g,购自湖南斯莱克景达有限公司,随机将小鼠分为实验组和对照组,每组6只,饲养于安静、整洁且通风良好的环境中,室温22~24 ℃,相对湿度55%~60%, 12 h光/暗循环,自由摄食饮水,适应1周后进行实验。
1.2 主要试剂与仪器
BRD4多克隆抗体、磷酸化溴结构域蛋白4 (phosphorylated bromodomain-containing protein 4,pBRD4)多克隆抗体购自美国Sigma-Aldrich公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体、GSDMD多克隆抗体购自武汉三鹰生物技术有限公司, MLKL多克隆抗体购自美国Santa Cruz Biotechnology公司,小胶质细胞的标志物离子钙结合衔接分子1(ionized calcium binding adapter 1,Iba1)单克隆抗体购自日本Wako公司,辣根过氧化物酶标记的羊抗兔二抗购自美国Jackson公司,免疫组织化学三抗购自美国Vectorlaboratories公司,辣根过氧化物酶显色试剂盒购自北京中杉金桥生物技术有限公司,蛋白质裂解液购自美国Thermo Fisher公司,Western blot二抗购自美国 LI-COR Biosciences公司,Pexidartinib制剂PLX3397购自上海超岚化工科技中心(货号:1029044-16-3);组织包埋剂购自美国樱花公司;蔗糖购自上海国药集团化学试剂有限公司;0.22 μm硝酸纤维素膜购自武汉博士德生物公司,蛋白定量试剂盒购自江苏康为世纪生物科技有限公司;FCT-100M型场景恐惧反应箱(230 mm×230 mm×300 mm,材质为不透明亚克力板,地板由24根直径为 4 mm 的铜杆构成,每2根铜杆中心的间距为 9 mm,通过导线与电刺激器相连给予电击)购自成都泰盟软件有限公司,CM1950恒温冰冻切片机、DM6B正置荧光显微镜成像系统购自德国 Leica公司,双色红外激光成像系统购自美国 LI-COR Biosciences公司。
1.3 实验方法
1.3.1 鼠粮制备及使用
将PLX3397以290 mg·kg-1的剂量加入事先粉碎的普通鼠粮中,充分搅拌混匀,然后塑形烤干,作为实验组鼠粮,于遥远恐惧记忆唤起前7 d开始持续喂食实验组小鼠,直至行为实验结束。另将普通鼠粮粉碎后塑形烤干,作为对照组鼠粮,以保持与观察组鼠粮相同的口感,于遥远恐惧记忆唤起前7 d开始持续喂食对照组小鼠,直至行为实验结束。
1.3.2 小鼠场景性恐惧模型的制备及处理
(1)场景性恐惧条件化训练:将小鼠放入FCT-100M型场景恐惧反应箱中,使其自由探索3 min后进行电击(0.45 mA,持续1 s),共给予5次电击,相邻2次电击之间间隔90 s,最后1次电击结束60 s后将小鼠从反应箱中取出放回鼠笼,至此完成场景性恐惧模型的构建;记录每次电击后小鼠的僵直时间。(2)恐惧记忆唤起:在场景性恐惧条件化训练后第16天,将小鼠重新放入场景恐惧反应箱中,无任何刺激呈现,小鼠自由探索5 min后将其取出,记录小鼠在此期间的僵直时间[17]。(3)记忆检测:在恐惧记忆唤起后24 h,将小鼠再次置于场景恐惧反应箱中,使其自由探索3 min,并记录其在该时间段所呈现的僵直时间[18],采用僵直时间百分比来表示小鼠的恐惧反应,僵直时间百分比=小鼠僵直时间/记录总时间×100%。
1.3.3 小鼠脑切片及海马组织的制备
行为实验结束后,腹腔注射戊巴比妥钠麻醉小鼠。2组各取3只小鼠,迅速打开胸腔暴露心脏,将灌注针自心尖插入左心室,迅速剪破右心耳,打开三通阀,先用生理盐水快速冲灌50 mL,待小鼠肝脏颜色变浅,右心耳中流出清亮的液体后,再使用4 ℃预冷的40 g·L-1多聚甲醛(pH=7.4)进行灌注,至小鼠全身不自主抽动消失、全身肢体僵硬为止,随后剥取出脑组织,将其浸泡于40 g·L-1多聚甲醛溶液进行固定,置于4 ℃冰箱过夜,随后依次转移至用 0.01 mol·L-1磷酸盐缓冲液(phosphate buffered saline,PBS)配制的150 g·L-1蔗糖溶液、300 g·L-1蔗糖溶液进行沉糖,然后用组织包埋剂包埋,保存于-80 ℃冰箱待用。2组其余小鼠迅速断头,快速剔除颅骨并取出脑,在冰上分离两侧海马组织,放入EP管中,迅速放入干冰盒内暂存,随后保存于-80 ℃冰箱备用。
1.3.4 免疫组织化学(immunohistochemistry,IHC)染色法检测2组小鼠海马中小胶质细胞数量
取冷冻保存的包埋脑组织,使用恒冷冰冻切片机于-20 ℃下连续冠状切片,片厚25 μm,每只小鼠挑选3张海马组织切片,置于盛有0.01 mol·L-1PBS的6孔板中,置于摇床上,50 r·min-1漂洗3次,每次 10 min;经体积分数3%过氧化氢漂洗 15 min,以去除内源性过氧化物酶,再次经0.01 mol·L-1PBS漂洗后采用牛血清白蛋白室温封闭1 h,随后加入Iba1一抗(滴度为11 000),4 ℃冰箱孵育过夜;次日漂洗后滴加辣根过氧化物酶标记的二抗(滴度为1200),室温孵育2 h,漂洗后滴加三抗(滴度为1200),室温孵育1 h;采用辣根过氧化物酶显色试剂盒进行染色,当可清晰观察到小胶质细胞的胞体和突起时停止染色,贴片晾干,经梯度乙醇脱水,二甲苯溶液透明后,滴加中性树脂封片,置于显微镜下观察并拍照,海马部位呈棕色、有胞体和突起表现者为小胶质细胞,应用 Image J软件分析海马CA1、CA3和DG区小胶质细胞的数量。
1.3.5 Western blot法检测小鼠海马组织中pBRD4、GSDMD和MLKL蛋白表达
取2组小鼠一侧海马组织,分别加入80 μL裂解液(蛋白酶和磷酸酶抑制剂混合剂组织蛋白提取液=1100)匀浆40 s,4 ℃、12 000 r·min-1离心20 min,取上清液,加蛋白定量试剂盒中A液和B液,37 ℃孵育30 min后测定上清液蛋白浓度,沸水浴10 min使蛋白充分变性,取40 μg蛋白用体积分数9%分离胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,将分离的蛋白质电转移至0.22 μm硝酸纤维素膜上,使用脱脂奶粉室温封闭1 h,滴加pBRD4一抗(滴度为11 000)、BRD4一抗(滴度为11 000)、GSDMD一抗(滴度为11 000)、MLKL一抗(滴度为11 000)、GAPDH一抗(滴度为14 000),4 ℃孵育过夜,使用荧光标记的二抗(滴度为120 000)室温孵育70 min;应用双色红外激光成像系统成像分析并采集图像,Image J软件分析灰度值,以GAPDH为内参蛋白,GSDMD和MLKL蛋白相对表达量以其蛋白灰度值与GAPDH蛋白灰度值的比值表示;pBRD4蛋白相对表达量以pBRD4灰度值与总BRD4(磷酸化和未磷酸化之和)灰度值的比值表示。
1.4 统计学处理
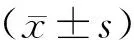
2 结果
2.1 2组小鼠场景性恐惧不同阶段僵直时间百分比比较
在场景性恐惧条件化训练阶段,2组小鼠的僵直时间百分比均随足底电击次数的增加而逐渐升高,第2、3、4、5次电击后的僵直时间百分比均高于第1次电击后,第3、4、5次电击后的僵直时间百分比均高于第2次电击后,第4、5次电击后的僵直时间百分比均高于第3次电击后,第5次电击后的僵直时间百分比均高于第4次电击后,差异均有统计学意义(P<0.05)。2组小鼠第1、2、3、4、5次电击后的僵直时间百分比比较差异无统计学意义(P>0.05)。在唤起阶段,2组小鼠的僵直时间百分比比较差异无统计学意义(P>0.05)。在记忆检测阶段,实验组小鼠的僵直时间百分比显著低于对照组,差异有统计学意义(P<0.05)。结果见表1。
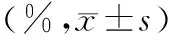
表1 2组小鼠场景性恐惧不同阶段僵直时间百分比比较Tab.1 Comparison of the percentage of freezing time of mice in different stages of contextual fear between the two groups
2.2 2组小鼠海马组织中pBRD4、GSDMD和MLKL蛋白相对表达量比较
实验组小鼠海马组织中pBRD4、GSDMD和MLKL蛋白相对表达量显著低于对照组,差异有统计学意义(P<0.05)。结果见图1和表2。

图1 2组小鼠海马组织中pBRD4、GSDMD和MLKL蛋白表达Fig.1 Expressions of pBRD4,GSDMD and MLKL protein in hippocampus of mice in the two groups
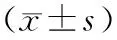
表2 2组小鼠海马组织中pBRD4、GSDMD和MLKL蛋白相对表达量比较Tab.2 Comparison of the relative expression levels of pBRD4,GSDMD and MLKL protein in hippocampus of mice between the two groups
2.3 2组小鼠海马CA1、CA3、DG区小胶质细胞数量比较
实验组小鼠海马CA1、CA3和DG 区小胶质细胞数量均显著低于对照组,差异有统计学意义(P<0.05)。结果见表3和图2。
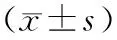
表3 2组小鼠海马CA1、CA3和DG区小胶质细胞数量比较Tab.3 Comparison of the microglial numbers in hippocampal CA1,CA3 and DG of mice between the two groups
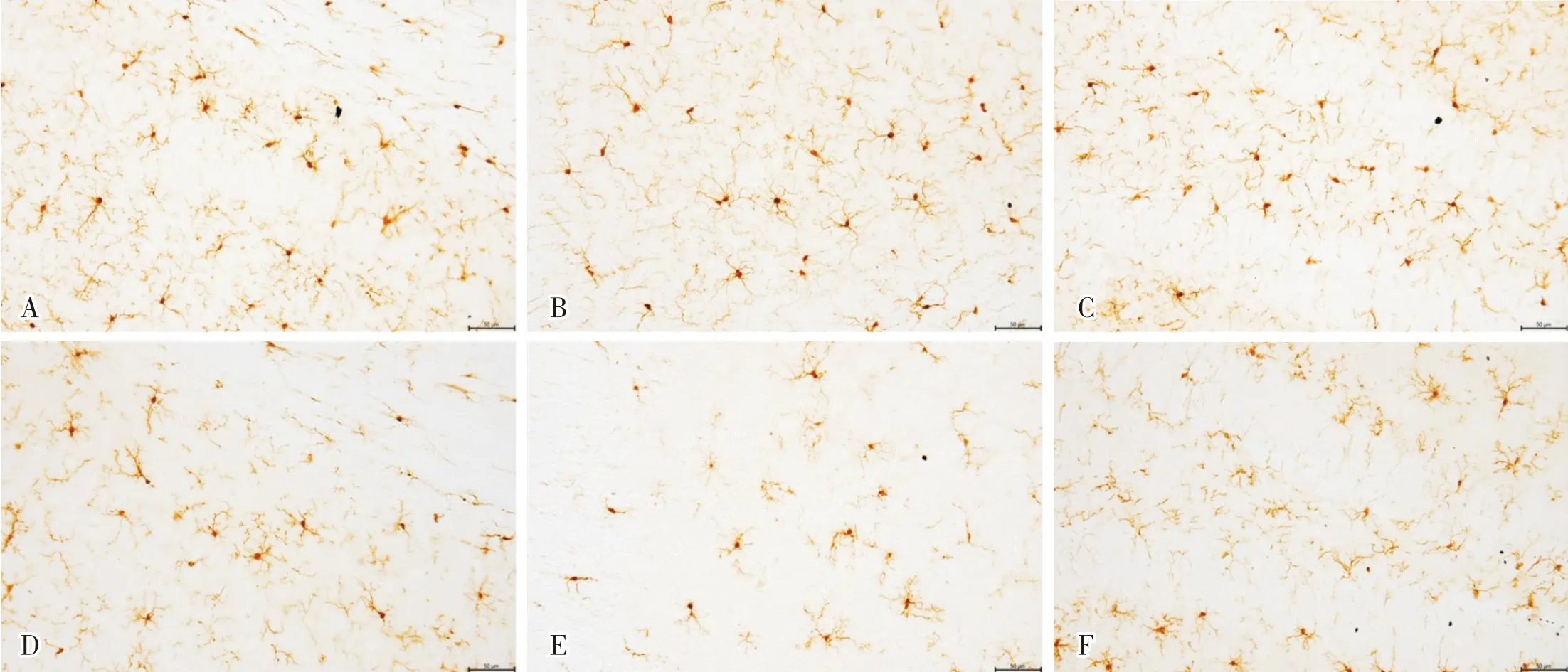
A:对照组小鼠海马CA1区小胶质细胞;B:对照组小鼠海马CA3区小胶质细胞;C:对照组小鼠海马DG区小胶质细胞;
3 讨论
PTSD是与创伤经历有关的精神类疾病,对个人、家庭及社会发展可造成严重影响[19]。然而,目前尚无治疗PTSD的有效方法。研究发现,已巩固的记忆被提取激活后会重新进入不稳定状态,需经再次巩固才能转变为稳定记忆,这个过程即为记忆再巩固[20]。而被重新激活形成的不稳定记忆更容易被干扰和修改[21]。因此,寻找能够干预、破坏被激活的遥远记忆再巩固过程以治疗恐惧记忆的有效方法,为临床PTSD患者的治疗提供潜在的靶点,具有重要的临床意义。
神经炎症与PTSD的发生发展密切相关,而小胶质细胞作为神经炎症的主要参与者和脑内应对PTSD的主要免疫细胞,其分泌的炎症细胞因子肿瘤坏死因子-α可损伤恐惧记忆的消退,而小胶质细胞抑制剂米诺环素通过抑制小胶质细胞的激活可促进记忆的消退[22]。也有研究表明,小胶质细胞抑制剂PLX3397治疗可促进小鼠的遥远线索性恐惧记忆的消退[13]。此外,抑制或清除小胶质细胞可缓解小鼠PTSD相关行为[11]。以上研究提示,小胶质细胞在恐惧记忆中具有重要作用。既往研究显示,多种蛋白分子参与调控小胶质细胞的激活,表观遗传调控在其中发挥着重要作用[23]。pBRD4[24]、GSDMD[25]和MLKL[26]为调控炎症反应的重要因子,它们与小胶质细胞互相影响,小胶质细胞的激活会导致pBRD4、GSDMD、MLKL增加,引起细胞的焦亡、坏死等,从而引起炎症的级联放大;而pBRD4、GSDMD、MLKL的增加反过来又会进一步促进小胶质细胞产生更多的炎症因子,进一步加重炎症反应[27-29]。有研究显示,BRD4作为一种表观遗传调控因子,可通过促进GSDMD介导的小胶质细胞焦亡诱发级联放大的炎症反应而加剧缺血性卒中病情[30];此外,BRD4还可通过调节MLKL的表达而促进细胞程序性坏死的过程[31]。
PLX3397是一种新型的口服小分子酪氨酸激酶抑制剂,对集落刺激因子1受体具有选择性抑制作用,同时也是一种小胶质细胞抑制剂[32]。研究表明,PLX3397与药物成瘾、癫痫[33]、帕金森病[34]、抑郁症[35]等多种神经系统疾病有关。但PLX3397在PTSD治疗中的作用尚不明确。目前,PLX3397已作为一种用于治疗癌症的药物进入了临床前期研究,如果能证明其对PTSD也有一定的治疗作用,则有可能将其用于PTSD的治疗,为PTSD的治疗带来希望,同时也可减轻PTSD患者的家庭和社会经济负担。有研究表明,在对正常小鼠进行线索性恐惧条件化前5 d,连续给予BRD4蛋白抑制剂JQ1腹腔注射,损伤了小鼠遥远线索性恐惧记忆的消退[36];同时,JQ1可通过抑制神经炎症缓解大鼠的PTSD样行为和恐惧记忆[37]。此外,小胶质细胞焦亡和坏死性凋亡可诱发级联放大的炎症反应,加重疾病病情[28-29];GSDMD和MLKL分别是细胞焦亡和坏死性凋亡的关键因子[38-39]。基于此,推测小胶质细胞抑制剂PLX3397也有可能会影响pBRD4、GSDMD 和MLKL的表达,故本研究采用场景性恐惧条件化小鼠模型来探讨小胶质细胞抑制剂PLX3397对遥远场景性恐惧记忆再巩固的影响及可能机制,以期为PTSD的药物治疗提供参考。
“近期记忆”通常被定义为编码后24 h之内的记忆[40];14 d或更久之前编码的记忆被定义为“遥远记忆”[41]。故本研究在恐惧条件化第16天进行遥远恐惧记忆的唤起。本研究结果显示,在场景性恐惧条件化训练阶段,2组小鼠的僵直时间百分比均随足底电击次数的增加而逐渐升高,但2组小鼠第1、2、3、4、5次电击后的僵直时间百分比比较差异无统计学意义,提示2组小鼠模型构建成功;而且2组小鼠在唤起阶段的僵直时间百分比比较差异无统计学意义,提示PLX3397干预并不影响小鼠遥远恐惧记忆的激活;在恐惧记忆唤起后24 h进行记忆检测发现,实验组小鼠的僵直时间百分比显著低于对照组,提示PLX3397干预损伤了小鼠遥远恐惧记忆的再巩固。
研究发现,抑制小胶质细胞的激活可促进恐惧记忆消退[13];抑制或清除小胶质细胞可缓解小鼠PTSD相关行为[11]。本研究结果显示,实验组小鼠海马CA1、CA3和DG 区小胶质细胞的数量均显著低于对照组;这一结果与PLX3397作为一种小胶质细胞抑制剂的药理学作用是一致的[42];结合记忆检测结果,推测PLX3397干预对小鼠遥远恐惧记忆再巩固的损伤作用可能是通过抑制小胶质细胞的激活来实现的。另外,ZHOU等[30]、SONG等[43]研究显示,小胶质细胞抑制剂米诺环素可抑制调控炎症反应的重要分子pBRD4、GSDMD和MLKL的表达。本研究使用小胶质细胞抑制剂PLX3397干预后,实验组小鼠海马组织中pBRD4、GSDMD和MLKL蛋白相对表达量显著低于对照组,这一结果与ZHOU等[30]、SONG等[43]的研究结果一致,提示PLX3397可能通过抑制pBRD4、GSDMD和MLKL的表达来损伤遥远场景性恐惧记忆的再巩固。
4 结论
小胶质细胞在恐惧记忆的获得、消退中具有重要作用,但其在遥远场景性恐惧记忆再巩固中的作用尚不清楚。小胶质细胞抑制剂Pexidartinib能够损伤遥远场景性恐惧记忆的再巩固,其作用可能与其抑制小胶质细胞的激活及下调pBRD4、GSDMD和MLKL的表达有关。但Pexidartinib的具体作用机制以及小胶质细胞是否与pBRD4、GSDMD和MLKL存在共表达等有待进一步探索。
