不同精粗比对牦牛粪便菌群结构的影响
2023-12-08聂洪辛李毓敏庞凯悦柴沙驼申迪曾子铭廖扬王迅薛斌刘书杰王书祥杨英魁
聂洪辛,李毓敏,庞凯悦,柴沙驼,4,申迪,曾子铭,廖扬,王迅,薛斌,刘书杰,王书祥,4*,杨英魁,4*
(1. 青海大学畜牧兽医科学院,青海 西宁 810016;2. 青海省高原放牧家畜动物营养与饲料科学重点实验室,青海 西宁 810016;3. 青海省牦牛工程技术研究中心,青海 西宁 810016;4. 农业农村部青藏高原放牧牦牛藏羊动物营养与饲草料重点实验室,青海 西宁 810016)
牦牛被称作“高原之舟”,是青藏高原特有牛种[1]。我国现有牦牛1400 万头左右,约占世界牦牛总数的95%以上,主要分布在青海、西藏、甘肃等高海拔地区,其中青海490 万头左右,约占全国牦牛总数的40%,居全国首位[2-4]。目前牦牛的饲养方式仍以长年放牧为主,致使牦牛对营养物质摄入不足,而通过调整饲粮中精粗比可以满足牦牛的营养需要[5]。在饲粮精粗比正常情况下,肠道内的菌群可以和宿主及外部环境建立动态的生态平衡,但当饲粮中精料过高或过低时[6-7],则可能导致肠道菌群发生紊乱[8-9]。肠道菌群能够抵抗外源致病因子的入侵,协助宿主免疫系统消灭外病原微生物,在维持肠道健康方面发挥着重要作用。健康的反刍动物肠道菌群中多以厚壁菌门、拟杆菌门、放线菌门、变形菌门为优势菌门,而优势菌属的差异较大[10]。反刍动物的肠道菌群大多集中在结肠,对粪便菌群和结肠内容物菌群的结构比较后发现,粪便菌群与肠道菌群有许多相似之处[11-13],所以粪便菌群状况可以间接地反映出肠道菌群的基本情况。因此,本试验拟采用16S rDNA 高通量测序,研究不同精粗比饲粮对牦牛粪便中微生物菌群结构的影响,旨在为牦牛的合理饲养提供理论依据。
1 材料与方法
1.1 试验设计与饲养管理
试验于2019 年9-12 月在青海省贵南县老扎西养殖基地进行。选取24 头体重相近、健康的3 岁公牦牛随机分成2 组,分别饲喂低精粗比饲粮(35∶65, C35组)和高精粗比饲粮(65∶35, C65组),每组3 个重复。预试期15 d,正试期90 d,共计105 d。参考我国肉牛饲养标准(NY/T815-2004)进行试验饲粮设计[14],8:00 和17:00 进行饲喂,试验期间所有牦牛自由饮水。试验饲粮组成及营养成分占比见表1。
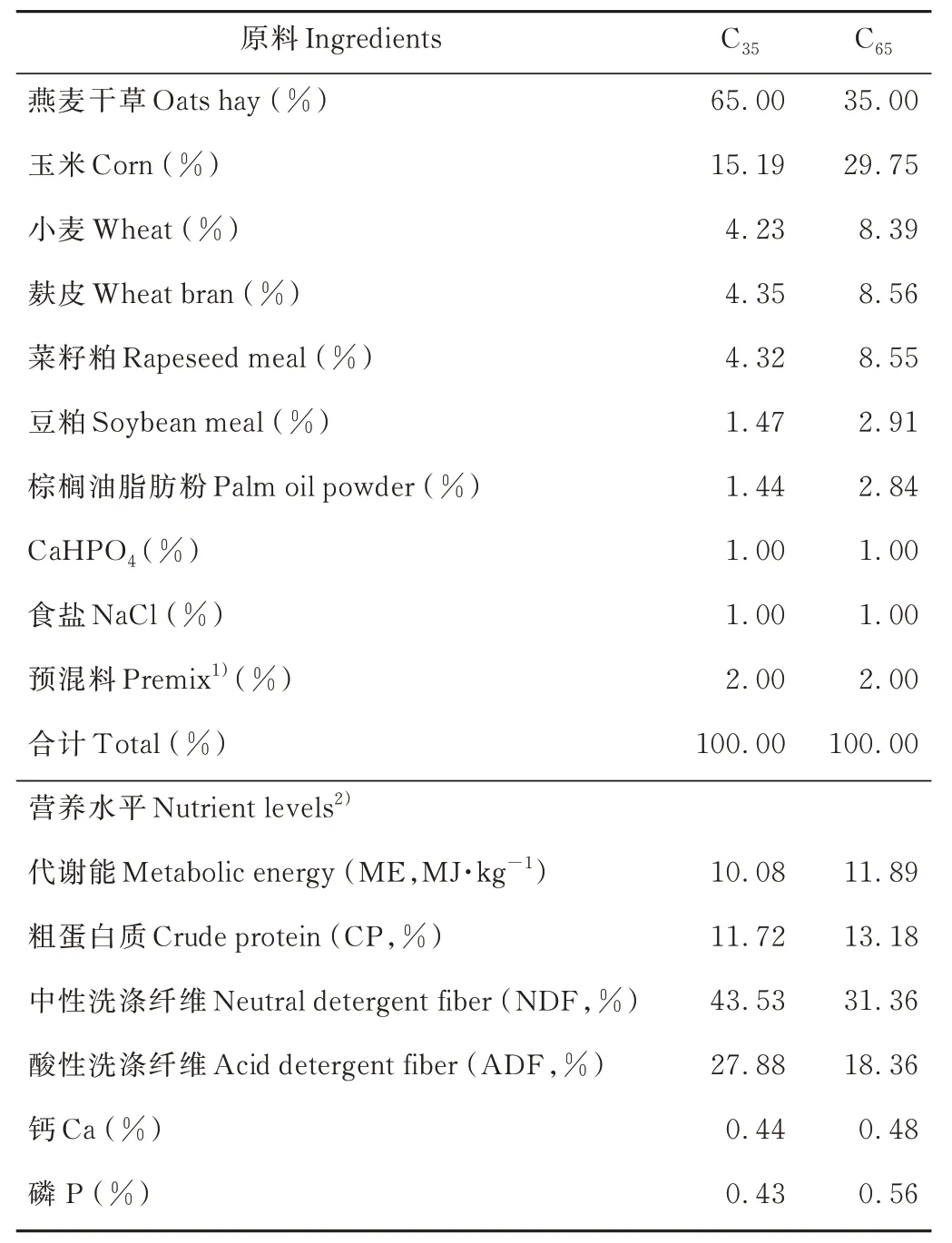
表1 试验饲粮组成及营养水平Table 1 Composition and nutrient levels of experimental diets
1.2 样品采集
在饲养试验结束后从两组中各随机抽取6 头牦牛收集粪便。用直肠粪便提取法收集粪便样品置于2 mL 冻存管并暂存于液氮中,带回实验室-80 ℃保存待测。
1.3 DNA 提取、测序及分析
由北京奥维森基因科技有限公司对提取的样品进行16S rDNA 高通量测序。采用十六烷基三甲基溴化铵法(cetyl trimethyl ammonium bromide, CTAB)[15],又称西曲溴铵法,从粪便样本中提取DNA。使用条形码特异引物515F(5′-GTGCCAGCMGCCGCGG-3′)和806R(5′-GTGCCAGCMGCCGCGG-3′)来扩增16S rRNA 基因的不同区域(16S V3-V4)。使用TruSeq DNA PCR-Free Libraray Preparation Kit 建库试剂盒(美国Illumina 公司)进行文库构建,并经过Qubit 和PCR(qPCR)定量和检验合格后,使用Illumina NovaSeq 6000 进行上机测序。测序平台得到的原始数据利用Trimmomatic v0.36 软件、Pear v0.9.6 软件进行质控和过滤,把相似性大于97%的优质序列筛选出来,计算操作分类单元(operational taxonomic unit,OTU),最后对OTU 聚类、物种分类、多样性指数和群落结构进行统计分析。
1.4 数据处理
采用SPSS 27.0 软件进行单因素方差分析(oneway ANOVA),同时用LSD 法进行差异显著性比较,P<0.05 为差异显著,P>0.05 为差异不显著,结果均以平均值和均值标准误差(standard error of mean,SEM)表示。
2 结果与分析
2.1 不同精粗比饲粮对牦牛粪便菌群丰富度与多样性的影响
2 组共产生1702 个OTU,其中C35组产生254 个OTU,C65组产生175 个OTU,两组共有的OTU 数目为1273 个,占总OTU 数目的74.79%(图1)。随着测序深度的增加,C35与C65组的粪便细菌稀释曲线呈逐渐平缓的趋势(图2),这表明测序程度可以覆盖样品中大多数微生物菌群。通过Alpha 多样性分析可知(表2),C35组的物种数、Chao1 指数与Shannon 指数显著高于C65组(P<0.05)。通过主坐标分析(principal coordinates analysis, PCoA)可知(图3),C35组与C65组牦牛粪便菌群结构具有明显差异。

图1 OTU 韦恩图Fig.1 OTU venn diagram
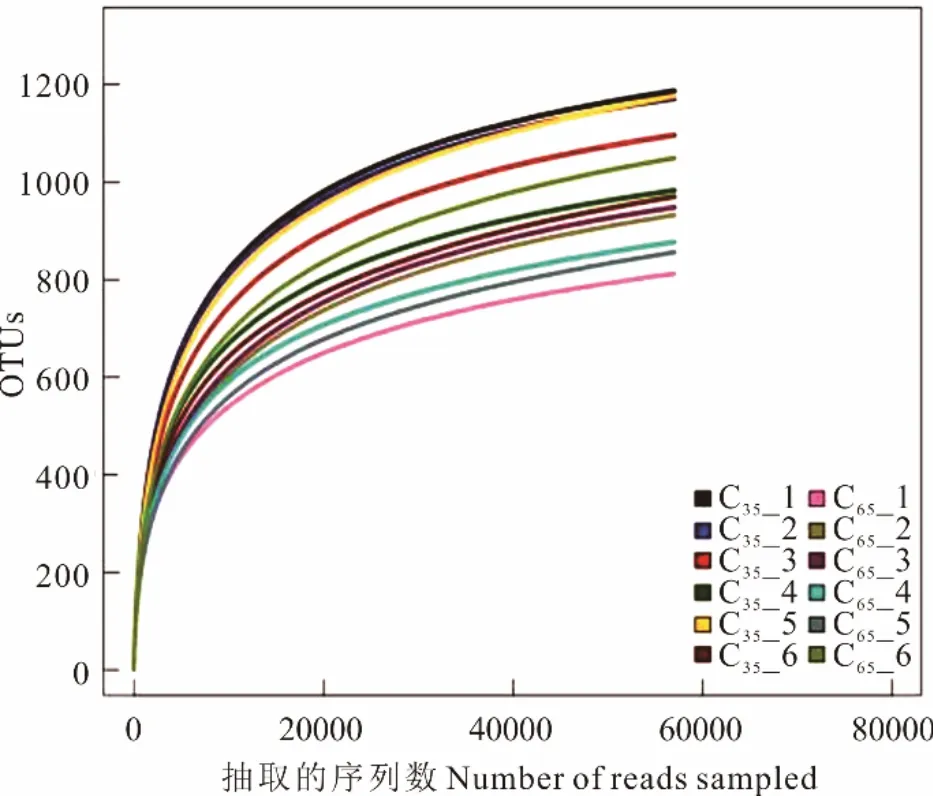
图2 粪便细菌稀释曲线Fig.2 Fecal bacterial dilution curve

图3 细菌区系主坐标分析Fig.3 PCoA of bacterial flora
2.2 不同精粗比饲粮对牦牛粪便菌群组成门水平的影响
在门水平(表3)上,牦牛粪便中主要的细菌门有厚壁菌门、拟杆菌门、放线菌门。其中,C35组牦牛粪便中髌细菌门和蓝藻菌门极显著高于C65组(P<0.01),放线菌门显著高于C65组(P<0.05);C65组牦牛粪便中拟杆菌门、螺旋体门显著高于C35组(P<0.05);其他菌门组间无显著差异。

表3 不同精粗比对牦牛粪便菌群组成的影响Table 3 Effects of different concentrate to forage ratio on microflora composition of yak feces
2.3 不同精粗比饲粮对牦牛粪便菌群组成属水平的影响
在属水平上,牦牛粪便中主要的细菌属是UCG-005(表4)。其中,C35组牦牛粪便中毛螺菌科_NK3A20群显著高于C65组(P<0.05);C35组牦牛粪便中未培养的属、瘤胃球菌属极显著高于C65组(P<0.01),C65组未培养细菌属、拟普雷沃氏菌属、密螺旋体属显著高于C35组(P<0.05);其他菌属组间无显著差异。
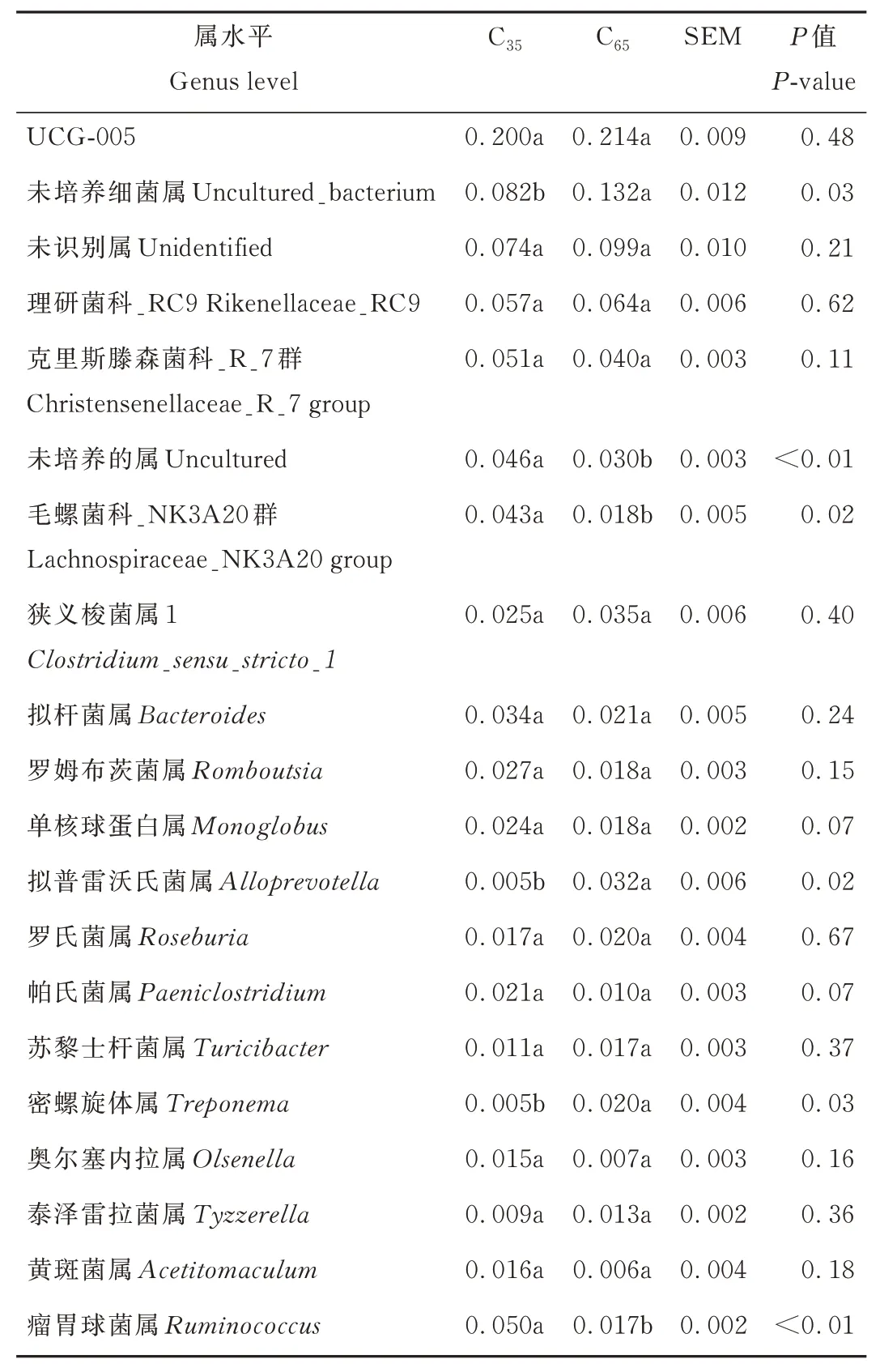
表4 不同精粗比饲粮对牦牛粪便菌群组成的影响Table 4 Effects of different concentrate to forage ratio on bacterial community composition of yak feces
2.4 不同精粗比饲粮对牦牛粪便菌群代谢途径及功能的影响
在KEGG2 水平上,粪便样本中有20 个相对丰度值高的基因家族(相对丰度>0.10%)。在这20 个基因家族中,C65组复制和修复、翻译、核苷酸代谢、其他次生代谢物的合成、细胞生长和死亡的基因家族相对丰度极显著高于C35组(P<0.01)(表5)。

表5 不同精粗比饲粮对牦牛粪便菌群KEGG 二级代谢通路的影响Table 5 Effects of diets with different concentrate to forage ratios on KEGG secondary metabolic pathway of fecal bacteria in yaks
3 讨论
3.1 不同精粗比饲粮对牦牛粪便细菌丰富度与多样性的影响
16S rDNA 高通量测序技术能够快速准确地对牦牛粪便菌群结构变化进行分析,其中Alpha 多样性分析可以测定微生物群落的丰富度与多样性,需要测定的指标包括Chao1 指数和Shannon 指数。Chao1 指数越大则说明菌群丰富度越高,Shannon 指数越大则说明菌群多样性越高[16]。刘飞鸿[17]研究了不同精粗比对肥胖空怀母牛肠道菌群多样性的影响,结果表明:低精料组母牛肠道菌群多样性显著高于高精料组。Pang 等[18]研究发现,随着饲粮精粗比的提高,牦牛粪便微生物菌群的丰富度和多样性呈显著性降低。在本试验中,Chao1 指数与Shannon 指数随精料的增加而显著降低,与上述研究结果一致,说明饲喂高精粗比饲粮(65∶35)会降低牦牛粪便菌群的丰富度与多样性。
3.2 不同精粗比饲粮对牦牛粪便细菌结构的影响
对于反刍动物微生物细菌多样性及结构特性,已有研究证明厚壁菌门及拟杆菌门在反刍动物瘤胃和粪便微生物中处于优势菌门[19-21],其原因是在反刍动物饲粮中,粗饲料占比通常达70%及以上,是瘤胃微生物的主要营养来源,而拟杆菌门与厚壁菌门在反刍动物胃肠道粗纤维的消化过程中发挥着重要作用。放线菌门或变形菌门的丰度值次于拟杆菌门与厚壁菌门[22-23]。本研究发现,C35组与C65组牦牛粪便微生物菌群中厚壁菌门的相对丰度占整个菌门的72.08%,拟杆菌门的相对丰度占整个菌门的21.44%,而放线菌门的相对丰度占整个菌门的1.97%,结果与上述一致。厚壁菌门主要参与结构性碳水化合物的降解,而拟杆菌门是非纤维物质降解过程中最重要的菌门,这两种菌在反刍动物营养代谢中起着至关重要的作用[24-25]。本研究发现,C65组牦牛粪便中拟杆菌门显著高于C35组,表明饲喂高精粗比饲粮促进了牦牛粪便中非纤维降解菌的增殖。本研究结果表明,C65组牦牛粪便中螺旋体门丰度显著高于C35组,其原因为螺旋体门是产酸菌,主要以碳水化合物为营养来源,能将碳水化合物转化为简单的挥发性脂肪酸[26]。本研究发现,C35组牦牛粪便中髌细菌门极显著高于C65组。但目前对该菌的作用还不了解[27],有待进一步研究。蓝藻菌门为化能自养菌,其以二氧化碳为碳源,通过氧化氮、磷等营养元素为自身提供能量,来合成有机物质[28-29]。本研究发现,C35组牦牛粪便中蓝藻菌门极显著高于C65组。而反刍动物主要以粗饲料为食,粪便富集蓝藻菌门可能与饲粮组成有关。放线菌门隶属于革兰氏阳性菌,大多是腐生菌,可引起肠道疾病[30]。在本研究中,C35组牦牛粪便中放线菌门的相对丰度显著高于C65组,表明饲喂高精粗比饲粮(65∶35)可能会影响肠道健康。
反刍动物粪便中发现数量最多的细菌属是瘤胃球菌科[31-32]。但在本试验中,牦牛粪便中的细菌是以UCG-005 属为主,这与Caporaso 等[31]和Meale 等[32]的结果有差异,可能是由于牦牛品种的特殊性、饲粮精粗比、饲养环境不同导致。本研究发现,C35组牦牛粪便中瘤胃球菌属的丰度极显著高于C65组。而反刍动物胃肠道中的瘤胃球菌属通过分解宿主消化系统的纤维素来获取营养,瘤胃球菌属与纤维素酶和半纤维素酶[33-34]通过协同作用将饲粮中的纤维转化为宿主所需的营养素。结果表明,饲喂低精粗比饲粮可提高牦牛粪便中瘤胃球菌属丰度值。毛螺菌科能够降解饲料中的纤维素和半纤维素,并参与机体能量代谢[35-36]。本研究中,C35组牦牛粪便中毛螺菌科_NK3A20 群菌属的丰度显著高于C65组,表明饲粮中精饲料的提高会降低牦牛粪便中毛螺菌科的丰度值。在本试验中,C65组牦牛粪便中密螺旋体属显著高于C35组。但目前对密螺旋体属的作用尚不清楚。拟普雷沃氏菌属会产生大量的琥珀酸及乙酸,有利于维持肠道稳态[37]。在本试验中,C65组牦牛粪便中拟普雷沃氏菌属显著高于C35组,这表明饲喂高精粗比饲粮更有利于牦牛的肠道健康。
3.3 不同精粗比饲粮对牦牛粪便菌群代谢途径及功能的影响
通过PICRUSt 软件可以预测微生物菌群的代谢通路,对牦牛粪便微生物菌群进行KEGG 通路的功能性注释后可以得出,功能通路主要富集于碳水化合物代谢、辅助因子和维生素代谢、氨基酸代谢、萜类和多酮类代谢、复制和修复、能量代谢,这些通路对反刍动物胃肠道微生物群落的生长繁殖起到了重要作用[38]。能量是饲料的重要组成部分,碳水化合物是牦牛的主要能量来源[39],氨基酸对牦牛体内的生理生化功能起调节作用,可促进其生长,改善生产性能[40],并且氨基酸代谢与饲粮组成紧密相关[41]。由此可以看出,在牦牛的生长过程中,碳水化合物代谢与氨基酸代谢尤为重要。核苷酸代谢多数以辅酶或辅助因子形式存在,可以参与动植物的能量代谢[42]。本试验发现,C65组核苷酸代谢、复制和修复、翻译、其他次生代谢物的合成、细胞生长和死亡的基因家族相对丰度极显著高于C35组。本研究推测,饲粮中精粗比为65∶35 有助于牦牛能量代谢通路的上调。
4 结论
通过研究不同精粗比饲粮对牦牛粪便微生物菌群结构的影响得出,饲粮中精粗比会影响牦牛粪便菌群的多样性与丰富度。且饲喂精粗比为65∶35 的饲粮可以促进牦牛粪便中非纤维降解菌的增殖,提高拟普雷沃氏菌属的丰度值,但抑制毛螺菌科的生长。
