沙子空心李离体快繁体系建立及组培苗遗传变异检测
2023-12-08李蕊蕊吴茂宏任菲宏张曼莹闫艺心
李蕊蕊,吴茂宏,任菲宏,王 贵,张曼莹,闫艺心,乔 光
(1 贵州大学生命科学学院/农业生物工程研究院/山地植物资源保护与种质创新教育部重点实验室,贵阳,550025;2 铜仁市林业科学院,贵州铜仁,554300;3 铜仁市农业科学院,贵州铜仁,554300)
沙子空心李(PrunussalicinaLindl. ‘Shazikongxinli’)产自贵州省沿河土家族自治县,是该县地方特色水果,其成熟果实肉核分离,色绿酥脆,酸甜可口,被消费者誉为“李中茅台”,2006年获得国家地理标志产品保护,沙子空心李产业已成为沿河土家族自治县脱贫攻坚和乡村振兴的重点农业特色产业[1-2]。目前,沿河土家族自治县沙子空心李产业存在着因采用传统的扦插繁殖及分株繁殖导致品种退化、栽种新苗存活率低等迫切需要解决的生产问题。利用离体培养技术可以短期内生产大量优质苗,在苹果[3]、火龙果[4]、草莓[5]、香蕉[6]和葡萄[7]等果树生产中广泛应用。有研究指出,随着组培材料继代增殖次数的增加,组培苗极易产生遗传变异,种苗优良种性难以保持[8]。因此,实施离体快繁时需要对组培苗遗传变异进行检测[9-10]。本研究建立了沙子空心李离体快繁培养体系,并利用ISSR和SSR分子标记对增殖苗进行遗传变异检测,旨在为工厂化繁育优质种苗提供技术支撑,解决目前沙子空心李产业发展欠缺优质种苗的问题。
1 材料与方法
1.1 材料来源材料采自贵州省沿河土家族自治县十二盘村沙子空心李种植基地,于2021年12月至2022年1月选取长势强、无病害成年树上带有健壮饱满休眠芽的枝条为外植体。
1.2 材料消毒将采集的枝条进行修剪,剪成长1~2 cm、含休眠芽的茎段,在流动自来水下冲洗15 min,无菌水漂洗5次后用无菌纱布擦尽多余水分,放入超净工作台。在超净工作台上,对茎段用75%酒精浸泡消毒30 s,无菌水漂洗3次(震荡洗涤),用0.1%HgCl2消毒不同时间(6、8、10、12、14 min),无菌水漂洗5次,取无菌滤纸吸干表面水分,剪去茎段两端0.3~0.4 cm,剥去芽外鳞片,接种于MS+6-BA 0.5 mg/L+NAA 0.2 mg/L+蔗糖30 g/L+琼脂7.5 g/L初代培养基中。0.1%HgCl2不同消毒时间每个处理接种30个休眠芽,重复3次。培养7 d后,检查外植体污染情况、褐变情况和萌发情况。污染率=(污染外植体数/接种外植体数)×100%;褐变率=(褐化外植体数/接种外植体数)×100%;萌发率=(萌发外植体数/接种外植体数)×100%。
1.3 增殖培养基筛选待休眠芽萌发至1~2 cm时,将其从基部斜切下来,选取长势基本一致的萌发苗接种于不同植物生长调节剂配方的增殖培养基上。增殖培养基以MS为基础培养基,以6-BA(A)、NAA(B)、GA3(C)为试验因子,各因子3个水平,采用L9(33)正交设计(表1)。每处理接种20个萌发苗,重复3次。培养40 d后,观察组培苗生长情况,统计增殖系数。增殖系数=增殖苗株数/接种组培苗株数。
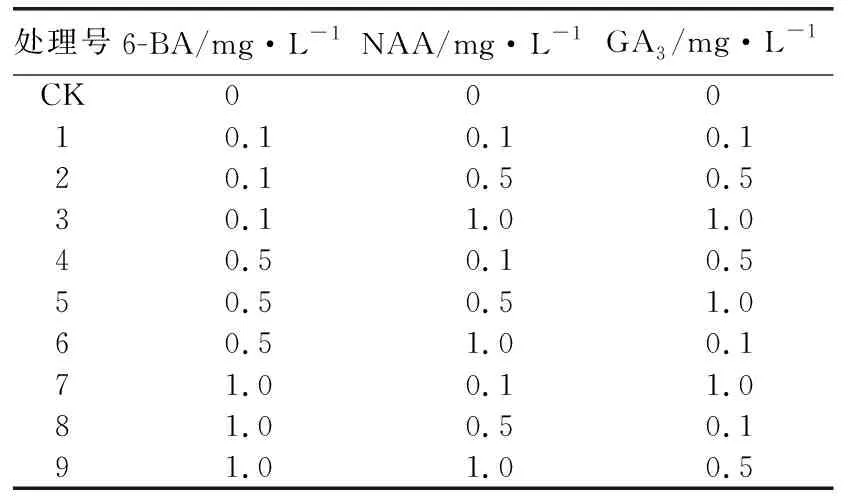
表1 沙子空心李增殖培养基筛选采用L9(33)正交设计的植物生长调节剂组合处理
1.4 生根培养基筛选以1/2MS为基础培养基,以不同质量浓度IBA(0.1、0.5、1.0 mg/L)及NAA(0、0.2、0.5 mg/L)组合成9种生根培养基处理。每种处理接种4株组培苗,重复5次。培养50 d后,统计生根率、平均生根数、平均根长及植株长势。生根率=生根植株数/接种组培苗总数×100%;平均生根数=总根数/植株总数;平均根长=所有根的长度和/植株根总数。
1.5 移栽选取株高2~3 cm并带有3~6条不定根的健壮组培苗,连瓶置于温室内炼苗5 d,然后打开瓶盖露置2 d,再取出组培苗,洗净根部附着的培养基,移栽到草炭∶珍珠岩=1∶1(体积比)的灭菌营养土中。移栽30 d后,观察植株长势,并统计成活率。成活率=(成活数/移栽数)×100%
1.6 遗传变异的ISSR检测继代第1代至第5代组培苗每代随机选取3株幼苗,分别用新型植物基因组DNA提取试剂盒(天根生化科技有限公司)提取叶片DNA,用0.1%(m/V)琼脂糖凝胶电泳检测DNA质量,于-20 ℃保存。以每代组培苗DNA为模板,选取21条ISSR引物(序列见表2),进行PCR扩增,琼脂糖凝胶电泳后统计条带数,进行ISSR遗传变异检测。PCR引物、反应体系及程序参考田田[8]。

表2 沙子空心李组培苗遗传变异ISSR检测所用引物及序列
1.7 遗传变异的SSR检测以每代组培苗DNA为模板,选取22对引物(引物1~12参考欧昱岑[11],引物13~22参考李兴婷[12],序列见表3)进行PCR扩增,聚丙烯酰胺电泳统计条带数,进行SSR遗传变异检测。SSR-PCR反应体系为10 μL,含0.5 μL引物(10 mmol/μL),1.0 μL DNA(40~50 ng/μL),5.0 μL 预混液(天根生化科技有限公司2×Tap Plus Master Mix),3.5 μL ddH2O。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,退火(温度依引物而定)30 s,72 ℃延伸60 s,40个循环;72 ℃延伸10 min;4 ℃保存。
6%聚丙烯酰胺凝胶总体积25 mL,各组分依次加入40% PAGE原液3.25 mL、10×TBE缓冲液2.5 mL、尿素10.5 g、ddH2O补足25 mL,待其溶解后用滤纸过滤出杂质,同时加入10%APS原液100 μL及TEMED 19 μL,摇晃混匀后灌胶、凝胶。聚丙烯酰胺电泳步骤参考梅利那[13]。
1.8 数据分析采用SPSS 21.0统计分析软件进行邓肯氏新复极差法差异显著性检验(α=0.05)。
2 结果与分析
2.1 不同消毒时间对休眠芽萌发的影响由表4可知,随着0.1%HgCl2消毒时间从6 min增加至14 min,沙子空心李茎段污染率逐渐降低,最低达22.22%;褐化率逐渐升高,最高达到63.33%;萌发率先升后降,消毒14 min时最低,仅为14.45%。消毒时间为10 min时,休眠芽污染率(34.44%)和褐化率(23.33%)居中,萌发率最高,新梢呈嫩绿色、长势良好,叶片舒展(见图1A)。因此,0.1%HgCl2消毒10 min是建立沙子空心李休眠芽无菌系的最佳消毒时间。

表4 不同消毒时间沙子空心李茎段外植体的组培效果
2.2 植物生长调节剂配比对增殖培养的影响
由表5可见,处理9的增殖系数最高为7.15,但此时增殖苗整体呈玻璃化,叶片脆且易断。处理3和处理6也出现玻璃化现象。处理1、处理2和处理3的增殖芽较少,部分出现无增殖芽的现象。处理4的增殖系数为5.15,增殖苗叶片呈绿色,茎干较粗且植株健壮(见图1B、C)。因此,适宜沙子空心李组培苗增殖的培养基为MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+GA30.5 mg/L+蔗糖30 g/L+琼脂7.5 g/L。
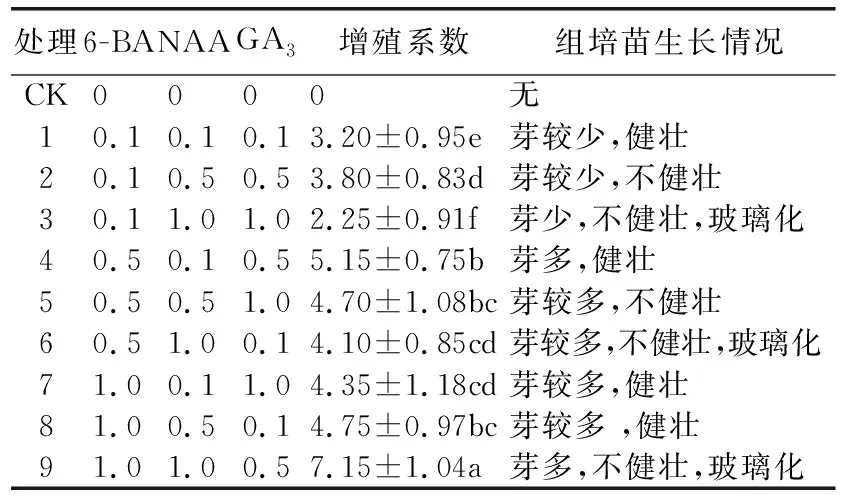
表5 植物生长调节剂配比对沙子空心李组培苗增殖的影响
2.3 植物生长调节剂配比对生根培养的影响由表6可见,组培苗在5号培养基(1/2MS+IBA 0.5 mg/L+NAA 0.2 mg/L+蔗糖30 g/L+琼脂7 g/L)中生根率最高(65%),平均生根数最多(6.38条),平均根长最长(9.35 cm),植株生长最好,叶片大且呈翠绿色,茎干粗壮(见图1D),主根粗壮须根多(见图1E)。当NAA浓度达到0.5 mg/L时(处理3、处理6和处理9)对组培苗生根有一定抑制作用,且植株长势较弱生长慢,呈矮小状。
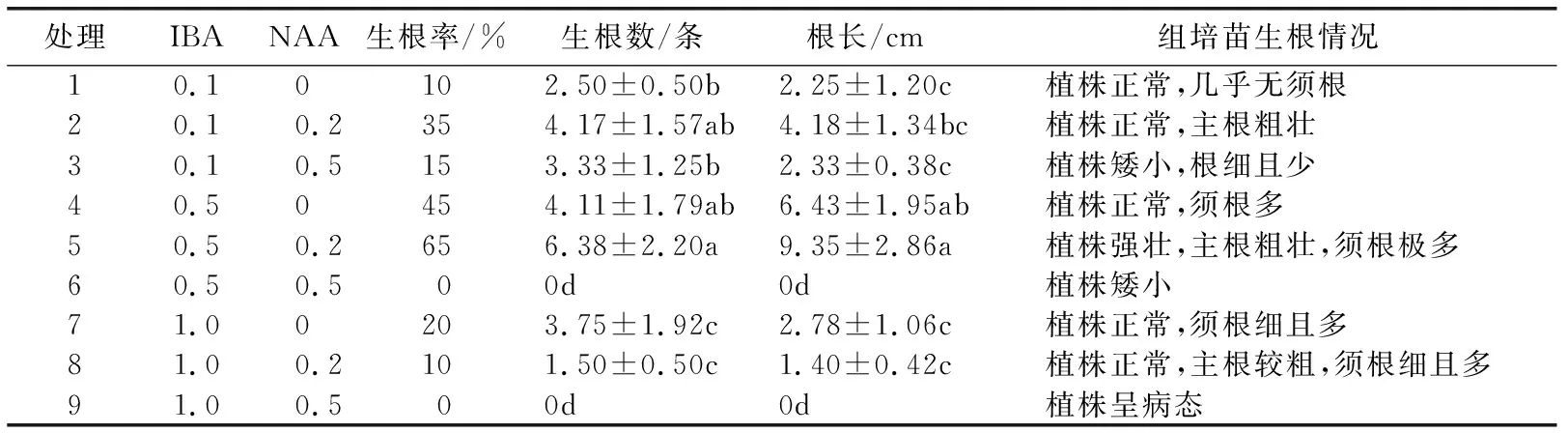
表6 植物生长调节剂配比对沙子空心李组培苗生根的影响
2.4 移栽成活率将植株健壮且根系生长良好的组培苗炼苗移栽(50株),30 d后成活率达74%,且长势较好(见图1F)。
2.5 ISSR遗传变异检测利用21条ISSR引物,对继代1~5代的沙子空心李幼苗叶片DNA进行PCR扩增后,共扩增出98条清晰的谱带,不同引物扩增出的谱带数为3~7条,平均扩增4.7条,DNA长度在250~2 000 bp之间,98条带全部为单态带。表明,在所用ISSR引物检测范围内沙子空心李增殖继代1~5次均未发生遗传变异。部分引物扩增的谱带见图2。
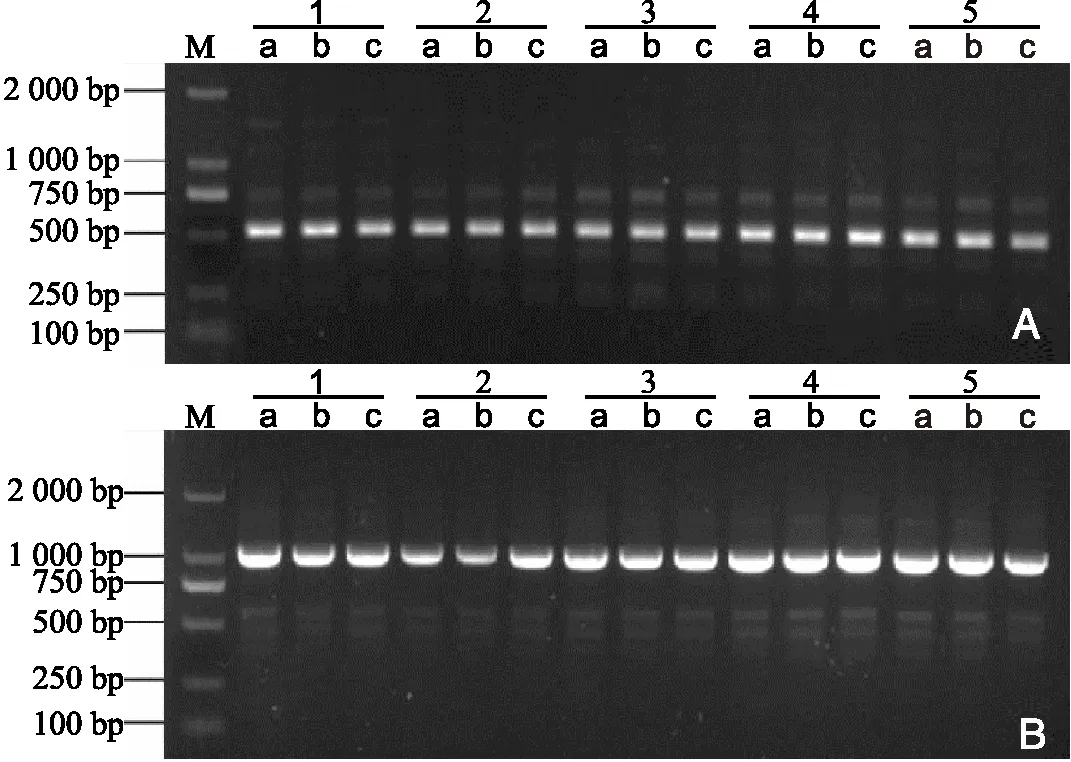
注:A:引物811;B:引物873。M为相对分子质量标记,1~5为随机抽取的第1代至第5代组培苗,a、b、c为每代组培苗的3个重复。图3同。图2 不同继代次数组培苗遗传变异的ISSR检测
2.6 SSR遗传变异检测利用22对SSR引物对沙子空心李增殖继代1~5代的组培苗叶片DNA进行扩增,共扩增出57条清晰的谱带,各引物扩增出的谱带数为2~5条,平均每个扩增2.6条,DNA长度在100~500 bp之间,57条带全部为单态带。表明,在所用SSR引物检测范围内沙子空心李在增殖继代5次内组培苗未发生遗传变异。部分引物扩增出的谱带见图3。
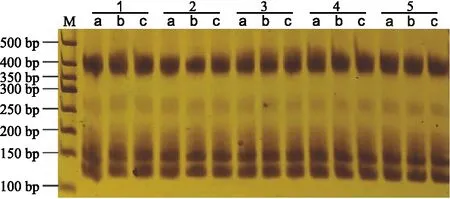
图3 不同继代次数组培苗遗传变异的SSR检测(引物CPSCT18)
3 讨论与结论
沙子空心李是贵州省特有的地方品种。目前沿河土家族自治县沙子镇繁育空心李多采用扦插及分株的方法。扦插繁殖,短期成活率高,产苗量大,但扦插苗无主根,根系较浅,不易长时间存活,且长期扦插繁殖导致了品种退化。由于缺乏规范的苗木生产技术,仅靠传统的扦插繁殖难以满足产业发展的需求[14]。沙子空心李树容易萌发根蘖苗,可利用其进行分株繁殖,此法虽能保持种性,但繁殖速度慢,不适合大量繁殖。植物离体培养能够有效地缩短繁殖周期,稳定地遗传优良性状,为产业发展提供优质种质材料[15]。离体培养过程中外植体消毒极为重要,消毒时间过长会导致材料活力弱、褐化、死亡严重,影响萌发;时间过短,则消毒不彻底,会导致外植体接种后未萌发就污染,成活率低。对于木质化程度高的枝条茎段,通过延长消毒时间可将表面真菌等很好地除去,但内生菌污染会很严重[16]。本研究以沙子空心李休眠芽为外植体,用0.1% HgCl2消毒10 min,配合萌发后切下新芽转移至新培养基,有效减少了茎段木质部内生菌污染新生芽的情况发生,萌发率达到42.22%,萌发出的芽长势好且叶片舒展呈嫩绿色。
陈曦等[17]在欧洲李增殖培养基中加入6-BA 0.7 mg/L、NAA 0.3 mg/L,增殖系数达到2.8。韩晓莹等[18]以贵州酥李茎段为研究对象,发现增殖培养基中加入KT 1.0 mg/L、IBA 0.1 mg/L及GA31.0 mg/L,增殖苗长势好,植株健壮,增殖系数为3.5。浦艳吉等[19]研究欧洲李离体培养时,在增殖培养基中加入6-BA 0.5 mg/L及GA30.5 mg/L,增殖系数仅为2.06。本研究采用正交设计进行增殖培养植物生长调节剂(6-BA、NAA、GA3)配比筛选,结果表明增殖培养基为MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+GA30.5 mg/L时,增殖系数可达5.15,增殖苗叶片呈绿色,茎干较粗,长势较好。研究还发现,NAA为1 mg/L时,沙子空心李组培苗出现玻璃化现象。由此推测,较高浓度的生长素会导致沙子空心李组培苗玻璃化。
李晶等[20]在君迁子生根培养基中加入IBA 1.0 mg/L,生根率达58.14%。高壮壮等[21]在探索优化蝴蝶兰组培快繁技术体系时发现,幼苗生根最适培养基为1/2MS+NAA 0.2 mg/L,生根率为73.7%。本研究用不同浓度配比的IBA及NAA筛选最佳生根培养基,发现IBA对组培苗的生根作用显著,NAA起辅助作用,但若NAA浓度提高到0.5 mg/L时,植株呈矮小黄化现象,这与增殖实验中的结果保持一致,故沙子空心李离体培养过程中应谨慎控制NAA浓度。适宜沙子空心李组培苗生根的培养基为1/2MS+IBA 0.5 mg/L+NAA 0.2 mg/L+蔗糖30 g/L+琼脂7 g/L,平均生根数达6.38条,平均根长为9.35 cm,组培苗叶片宽大呈翠绿色,长势极好,主根粗壮,须根极多,有利于后续的炼苗移栽。
在植物组织培养过程中易发生体细胞无性系变异(变异率可达30%~40%),这不利于保持无性系繁殖后代的优良种性[22-23],因此组培增殖苗投入生产前需要进行遗传变异检测,以确保优良种性未变异。ISSR和SSR分子标记在植物基因组中具有丰富、稳定的多态性,常用来进行遗传多样性研究、亲缘关系分析和遗传变异检测[24-26]。本研究采用ISSR及SSR两种分子标记方法,对沙子空心李组培增殖苗进行遗传变异检测,通过21条ISSR引物和22对SSR引物的扩增检测,发现继代5代内所有组培增殖苗DNA片段无论从带型大小及谱带的强弱、数目均一致。表明沙子空心李继代5次的组培增殖苗遗传物质稳定,能保持其优良母株的遗传特性。
本研究建立的沙子空心李离体快繁体系可有效地缩短繁殖周期,稳定地遗传优良性状,为开展沙子空心李工厂化育苗提供了技术支撑。
