蜂糖李采后病原菌分离鉴定及香芹酚对病原菌室内毒力测试
2023-12-08罗冬兰王小岗瞿光凡巴良杰
罗冬兰,王小岗,瞿光凡,巴良杰
(贵阳学院,贵阳,550005)
李(PrunussalicinaLindl),属于蔷薇科(Rosaceae)李属(Prunus)多年生核果类树种。近年来,贵州的李种植面积逐渐增加[1-2],其栽培品种较多,主要有蜂糖李、四月李、玫瑰李、姜黄李、脆红李、青脆李、布朗李、空心李、地方李等[3]。其中,蜂糖李果大甘甜,核小肉多,果面包裹天然蜡粉,质地酥脆爽口,果肉致密且香味浓郁,品质极优,市场售价高,经济价值高[4]。蜂糖李采收于高温多雨季节,且果实含糖量高,采后呼吸代谢强,果实贮藏过程易受机械损伤和病原微生物侵染,易造成严重的经济损失[5-6]。目前,国内外研究报道的李病害主要为褐腐病、炭疽病、黑霉病、黑斑病[3,7-9,10]。其中,美澳型褐腐病菌(Moniliniafructicola)、藤仓镰刀菌(Fusariumfujikuroi)、互隔交链孢霉(Alternariaalternata)[11]、胶孢炭疽复合群(Colletotrichumgloeosporioidesspecies complex)和暹罗炭疽复合群(C.siamensespecies complex)[12]是李果实采后主要致病菌。此外,瞿光凡等[13]发现,引起脆红李采后腐烂的病原菌为灰葡萄孢菌(Botrytiscinerea)和链格孢菌(Alternariaalternata)。王友升等[14]对“安哥诺”“黑琥珀”两个李品种果实采后贮藏期病果进行分离鉴定,获得李果实在贮藏期内的主要病原菌为串珠状赤霉(Gibberellamoniliformis)、链格孢菌(Alternariaalternata)、草酸青霉(Penicilliumoxalicum)和塔宾曲霉(Aspergillustubingensis)。但关于蜂糖李采后病原菌研究未见相关报道。
香芹酚(carvacrol,CV)是天然植物精油中具有活性成分的一种单萜酚,具有广谱抑菌性、安全性高、无污染等特性,被广泛应用于果蔬采后保鲜[15]。已有大量研究表明,香芹酚可通过破坏真菌细胞膜、细胞壁以及能量代谢平衡,影响膜脂代谢和能量代谢途径,从而发挥抗菌作用[16-17];此外,香芹酚还可通过抑制真菌DNA、RNA、脂类和蛋白质等生物合成、相关基因表达及阻遏真菌产毒基因表达,使相关代谢调控紊乱,最终使真菌细胞因不能正常进行生理代谢而凋亡[18-19]。
本研究通过对贮藏期蜂糖李病果病原菌进行分离鉴定,并进一步探究不同浓度香芹酚对病原菌的体外抑制效果及进行室内毒力评价,以期为蜂糖李采后病害防控提供参考。
1 材料与方法
1.1 材料与试剂
蜂糖李果实:2023年6月采摘于安顺市镇宁布依族苗族自治县六马镇,七八成成熟。采后常温放置至果面品质劣变,果面逐渐有丝状物质且其生长面积逐渐扩大,最终腐烂发病(见图1),再进行果面似菌物质分离鉴定。香芹酚(纯度99%,分子量150):江西海瑞天然植物有限公司。引物ITS1和ITS4、DNA Marker C、DNA提取试剂盒、双蒸水(ddH2O):生工生物工程(上海)股份有限公司。马铃薯葡萄糖琼脂培养基(potato dextroseagar,PDA):上海博微生物科技有限公司。

图1 蜂糖李采后常温状态下自然发病状况
1.2 仪器与设备
ChemiDoc免染型蛋白印迹成像系统:成都百乐科技有限公司。CX21 光学显微镜:日本奥林斯有限公司。LRH-250F生化培养箱:上海一恒科学仪器有限公司。YM-50立式压力蒸汽灭菌器:上海三申医疗器械有限公司。SW-CJ-1D型超净工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 病原菌分离与纯化 采用组织分离法对采后自然发病蜂糖李果实进行病原菌分离纯化。首先将所有在无菌超净工作台上用到的金属工具统一120 ℃高温灭菌20 min,再进行下一步试验。将病果置于75%酒精中浸泡30 s后取出,立即用无菌水冲洗3次并置于超净工作台中,待其自然晾干。用手术刀切取病健交界处组织放于PDA培养基中,于(28±0.5) ℃恒温培养箱中培养,待平板上长出不同的菌落形态时,进行不同种菌落形态纯化,通常分离频率约3次,可根据菌落生长状况进行多次分离,直至得到单一菌落。纯化菌株部分冻存,其余用于试验。
1.3.2 病原菌形态学鉴定 将纯化菌株以菌饼方式重新接种至新培养基,置于(28±0.5)℃恒温培养,并观察菌株生长状况以及菌落特征,拍照记录。结合菌株在光学显微镜下菌丝、孢子梗及分生孢子的形态结构进行种属初步鉴定。
1.3.3 病原菌致病性检测 选取光泽度好、硬度适中、成熟健康无病虫害及无机械损伤的果实,分别进行有伤(利用美工刀小刀片轻划果实表面,形成大小约4 mm长的十字小口,再用孔径为5 mm的打孔器,去除果皮,最后形成大小约5 mm的圆形伤口)和无伤接种法接种分离菌株后,观察果实发病情况,以检测分离菌株是否致病;经过人工将分离菌株转导(利用直径为5 mm的打孔器取若干菌饼,最后将菌饼接种至果实表面)至果实果皮,引发果实快速发病并出现不同程度发病现象,以检测分离菌株致病性强弱。对挑选好的蜂糖李果实,用蒸馏水快速清洗表面1次,再75%酒精擦拭消毒,用无菌水冲洗3次后,置于超净工作台中,自然晾干,用直径为5 mm无菌打孔器取菌饼接种,每种分离菌株重复3个果。接种后果实置于(25±0.5) ℃、相对湿度85%~95%的培养箱中培养,每天定时记录发病情况。待果实发病后,再次进行病原菌分离纯化,若与接种病原菌一致,则进行后续试验。
1.3.4 病原菌ITS标记鉴定 取适量菌丝体于无菌研钵中,用液氮研磨至粉末状待用。利用北京索莱宝真菌基因组DNA提取试剂盒进行病原菌基因组总DNA提取。采用真菌通用引物 ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和 ITS4(5’-TCCTCCGCTTATTGATATGC-3’)进行病原菌rDNA-ITS序列扩增。制作成50 μL反应体系,该体系需包含2×Taq PCR Master Mix 25 μL,DNA模板1 μL,10 mmoL/L ITS1 2 μL,10 mmoL/L ITS4 2 μL,ddH2O 20 μL。聚合酶链式反应(poly-merase chain reaction,PCR)扩增程序:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃终延伸10 min。对PCR产物进行测序,将测序结果在NCBI数据库进行BLAST比对分析,获取同源性高的菌株序列,采用MEGA 7软件以邻接法构建系统发育树,并结合病原菌形态特征对其进行最终鉴定。
1.3.5 香芹酚对病原菌室内毒力测定 采用菌丝生长速率法进行测定。分别称取不同质量香芹酚加入到灭菌PDA培养基中,充分摇匀,使每个平板PDA培养基中香芹酚浓度分别为100、150、200、250和300 μg/mL,对照(CK)不加香芹酚,待培养基冷却后备用。在无菌超净工作台上,用直径5 mm灭菌打孔器打取菌饼,接种到PDA平板中央。每个浓度重复3次。于(28±0.5) ℃恒温培养箱中培养。定期观察,待对照(CK)平板菌落长满平板时,采用十字交叉法测量菌落直径并记录数据。抑菌率的计算公式如下:抑菌率/%=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-菌饼直径)×100。采用Excel 2021软件以香芹酚浓度对数值为横坐标,抑菌率为纵坐标,计算毒力方程。在Graph Pad prism 8 软件中,将抑菌率转变为概率值后作为纵坐标,将质量浓度作为横坐标,计算出半最大有效浓度(half-maximal effective concentration,EC50)。
2 结果与分析
2.1 病原菌形态学鉴定
从蜂糖李采后自然发病果实上分离的菌株,根据其在PDA培养基上的生长形态和在显微镜下孢子梗以及分生孢子形态特征(见图2),可分为5种。其中,PL-1菌株,其菌落整体为浅棕色、中心部分呈现淡黄色,随着菌落直径扩大,颜色逐渐变淡,菌落边缘处紫灰色较为明显且菌丝短而稀疏。PL-2菌株,菌丝生长茂盛,菌丝较长、似棉花状;菌落呈米白色,随着生长时间增长,菌落会分泌似水珠液体。PL-3菌株,菌落较为稀疏且无规律性间隔,菌丝短而绒,菌落中间灰白色、外围呈现灰绿色。PL-4菌株,菌落分布较为规律且均匀,菌丝呈现灰米白色,随着菌落直径不断扩大,菌丝颜色逐渐变淡,菌丝由米白色变成浅灰色。PL-5菌株,菌落分布较为均匀,主要以圆形态均匀分布在培养皿中,呈现灰白色菌丝,菌丝极短似“粉末”状。

图2 蜂糖李采后自然发病果实各分离菌株的形态特征(菌落形态、孢子梗以及孢子形态)
2.2 病原菌致病性检测
从图3可以看出,与其他4株菌相比,PL-1和PL-3创伤接种,48 h(2 d)后蜂糖李发病明显,其中PL-1果实表面出现灰白色绒毛状菌丝,菌丝发达、质地干燥易挑;但是,该菌无伤接种后第6天蜂糖李果实局部病变。由此可推断,PL-1在伤口处发病较快,但是对无损伤的健康果实致病力较弱。PL-2致病力较弱,有伤接种48 h(2 d)后逐渐发病,在第4天时果实发病症状明显且蜂糖李果实表皮开始破裂;无伤接种,在第6天果实局部褐变发病。PL-3经过创伤接种后果实发病,且发病与正常果实发病症状一致,即果皮裂开并伴有水渍;无伤接种果实也发病,但发病较为迟缓。PL-4创伤接种后,菌丝颜色和菌落特征和培养皿上一致,且随着果实发病果皮裂开,果实逐渐变软;无伤接种致病一致,但发病迟缓。PL-5无伤接种与创伤接种发病症状一致,创伤接种发病更快,接种部位出现凹陷并产生褐斑,且病斑面积随培养时间加长而增大。综上,蜂糖李采后贮藏过程中,完整无损的果面对果实整体具有一定保护作用,若被病原菌侵染发病较为迟缓,一旦果皮有伤口或划痕将导致果实被外源病原菌快速侵染且发病较快,不利于果实贮藏。
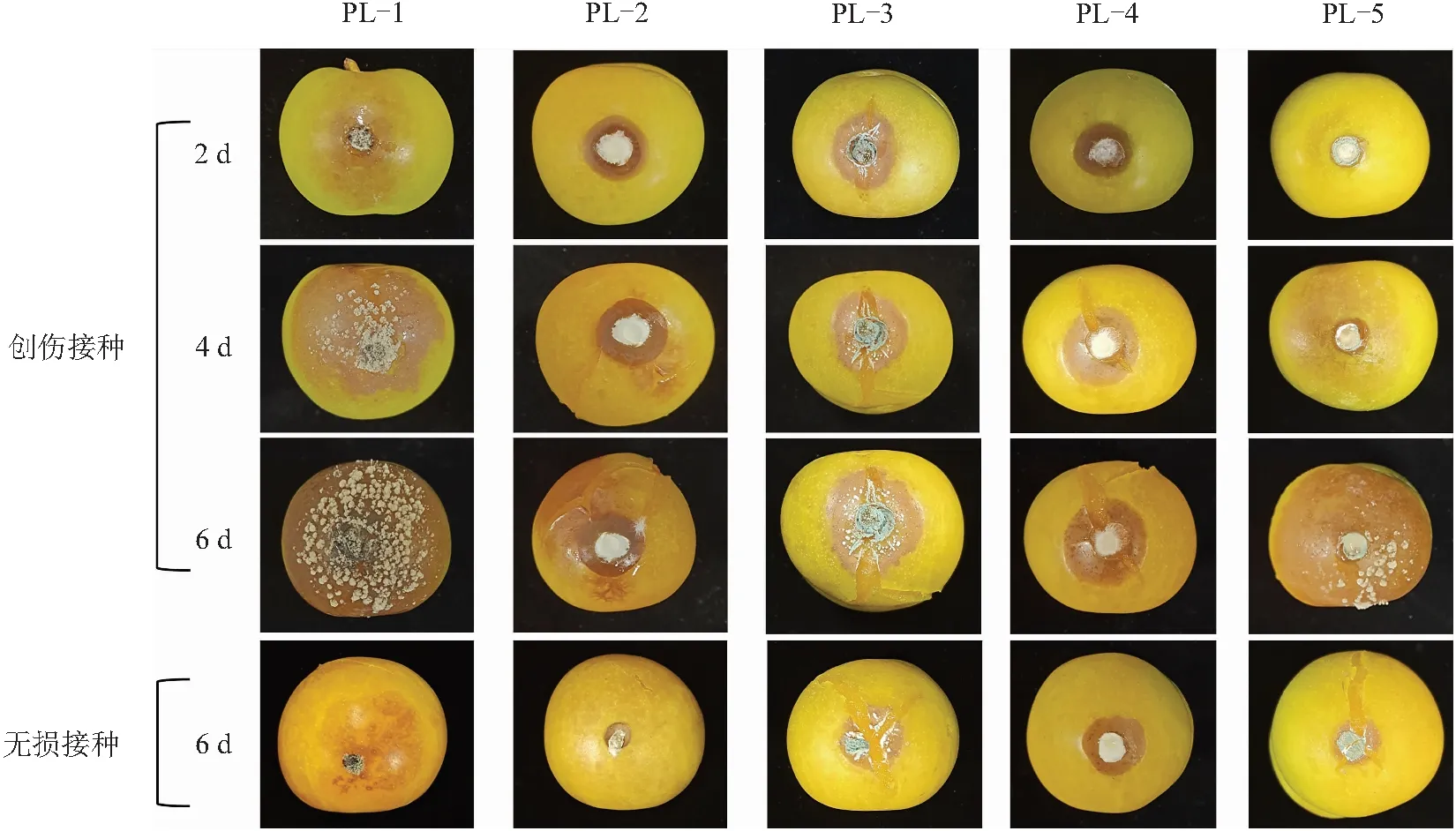
图3 蜂糖李采后自然发病果实分离菌株在健康果实上创伤或无损接种后的致病性
2.3 病原菌ITS鉴定
分离菌株用ITS基因通用引物扩增后,对PCR产物测序得到菌株核酸序列,在NCBI数据库上进行BLAST,选取同源性较高的菌株序列用MEGA 7的Neighbor-Joining(NJ)法构建系统发育树。结果表明,菌株PL-1与Moniliniapolystroma(基因登录号:NR_154198.1)同源性100%,菌株PL-2与Bjerkanderaecuadorensis(基因登录号:NR_174062.1)同源性99%,菌株PL-3与Penicilliumexpansum(基因登录号:NR_077154.1)同源性100%,菌株PL-4与Flavodonambrosius(基因登录号:NR_154000.1)同源性100%(如图4-A所示)。菌株PL-5与Penicilliumitalicum(基因登录号:NR_163528.1)同源性100%(如图4-B所示)。结合形态学特征,判定引起蜂糖李采后腐烂的主要病原菌分别为多子座链核盘菌M.polystroma(PL-1)、烟管属真菌B.ecuadorensis(PL-2)、扩展青霉P.expansum(PL-3)、黄囊孔菌F.ambrosius(PL-4)以及意大利青霉P.italicum(PL-5)。

图4 蜂糖李采后自然发病果实分离菌株基于ITS序列构建的系统发育树
2.4 香芹酚对蜂糖李采后病原菌室内毒力
从表1可以看出,当香芹酚浓度在100~300 μg/mL范围内时,对蜂糖李采后各病原菌的抑菌率分别为6.73%~80.21%、22.70%~60.66%、20.11%~80.07%、70.09%~91.19%以及65.61%~85.74%。其中,扩展青霉P.expansum对香芹酚较为敏感,而黄囊孔菌F.ambrosius对香芹酚较为迟钝;300 μg/mL香芹酚对多子座链核盘菌M.polystroma和烟管属真菌B.ecuadorensis菌丝生长的抑菌率差异无显著性(p>0.05),其余菌之间均存在显著性差异(p<0.05)。从毒力回归方程及EC50可知,扩展青霉P.expansum对香芹酚的敏感性最高,EC50为52.4 μg/mL,其他依次为意大利青霉P.italicum、烟管属真菌B.ecuadorensis、多子座链核盘菌M.polystroma、黄囊孔菌F.ambrosius,EC50分别为55.8、169.9、212.1和227.5 μg/mL。
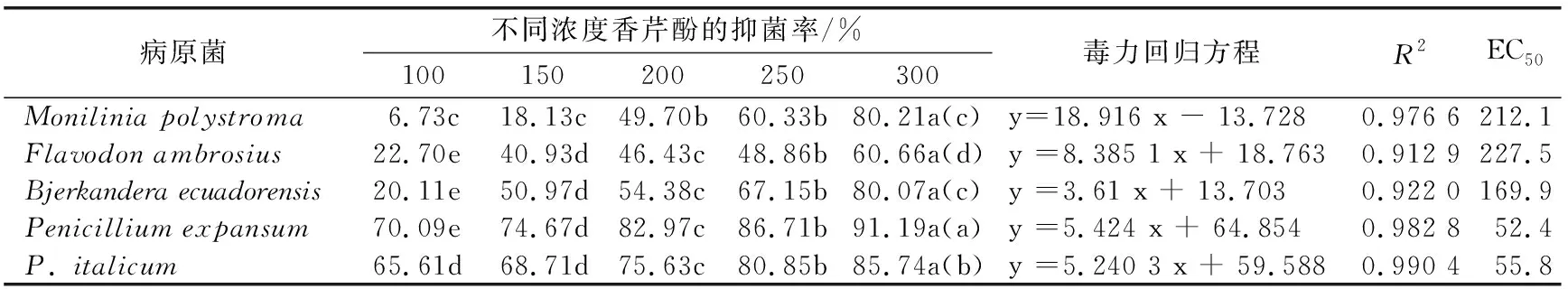
表1 香芹酚对蜂糖李采后病原菌菌丝生长的体外抑制效果及毒力回归方程
3 讨论
蜂糖李是李属的一种呼吸跃变型果实,多在夏季高温季节采收,果实含水量高、皮薄,易受微生物侵染而腐烂变质,从而造成巨大经济损失[20]。本研究从蜂糖李采后自然贮藏发病果实中分离鉴定出5株病原菌。其中,多子座链核盘菌M.polystroma最早发现于欧洲,随后在意大利的梨、葡萄和苹果中相继被发现报道[21-24],Spitaler等[25]研究发现该菌还引起木瓜发生褐腐病,李志伟等[26]研究发现在桃果实生长发育期至成熟期和采后贮运期该菌均可侵染而引发褐腐病。扩展青霉P.expansum和意大利青霉P.italicum能够引起新鲜核桃和柑桔发霉软烂,发生青(绿)霉病,是果蔬常见的病原菌,严重影响果蔬品质[27-29]。李树成等[30]从采后翠冠梨果实中分离鉴定获得扩展青霉P.expansum是引起采后翠冠梨果实腐烂的主要病原菌之一。肖媛[31]鉴定出沙糖桔酸腐病的致病菌是意大利青霉P.italicum。烟管属真菌B.ecuadorensis和黄囊孔菌F.ambrosius首次在蜂糖李果实中被发现。
多子座链核盘菌M.polystroma引起蜂糖李发生褐腐病。Goncalves等[32]研究发现用4.5%Copernicia cerifera蜡(巴西棕榈蜡)对李果实进行涂膜,显著降低了贮藏期李褐腐病的发生,有效维持了果实品质。凡先芳等[33]研究发现,将1-甲基环丙烯(1-methylcyclopropene,1-MCP)结合戊唑醇在适宜浓度下处理青脆李,能够显著控制贮藏期褐腐病的发生。本研究发现,在体外,香芹酚能够抑制M.polystroma菌丝生长,且随浓度呈现依赖性效应,当香芹酚浓度为300 μg/mL时,抑菌率可达80.21%。
通过对扩展青霉P.expansum抑制研究发现,70 mg/mL银杏黄酮能较好地抑制扩展青霉生长[34]。咪鲜胺能够提高细胞膜通透性,抑制P.italicum生长发育[35]。在研究中,随着香芹酚浓度增加,P.expansum和P.italicum菌落生长均呈药剂依赖性效应,300 μg/mL香芹酚对2株菌的抑菌率达91.19%和85.74%,能够较好地抑制病原菌菌丝生长。有研究表明,香芹酚能够有效抑制炭疽菌生长发育,损伤冲绳炭疽菌(Colletotrichumokinawense)菌丝形态并对其可溶性蛋白和呼吸能量代谢等具有一定影响,有效抑制真菌病原菌的菌丝生长[36];香芹酚处理降低杨梅果实腐烂指数,抑制杨梅致病菌霉菌和酵母菌生长[37]。100 μl/L的反式-2-己烯醛能较好抑制青霉生长,显著降低扩展青霉P.expansum对猕猴桃果实硬度、可滴定酸、维生素C的影响,极显著降低了染菌果实腐烂率,较好地保持了果实品质[38]。反式肉桂醛通过损伤意大利青霉Pitalicum细胞膜,导致核酸、蛋白质、钾离子等细胞内容物质泄漏,破坏线粒体正常功能,引发线粒体介导的细胞凋亡,从而达到良好的抑菌效果[39]。
烟管属真菌B.ecuadorensis和黄囊孔菌.ambrosius侵染蜂糖李果实后,病斑不断扩大,严重时果皮裂开并伴有水渍,导致采后蜂糖李果实软化褐变并腐烂衰败。体外试验表明,香芹酚对这2株菌具有明显抑菌能力,300 μg/mL香芹酚的抑菌率分别为80.07%和60.66%,EC50分别为169.9和227.5 μg/mL,B.ecuadorensis对香芹酚较为敏感。在其他果实病原菌研究中,未见有关B.ecuadorensis和F.ambrosius的报道。
4 结论
采用组织分离法、致病性检测、形态学鉴定结合分子生物学鉴定,明确引起蜂糖李采后贮藏期腐烂的病原菌包括扩展青霉Penicilliumexpansum、意大利青霉P.italicum、多子座链核盘菌Moniliniapolystroma、黄囊孔菌Flavodonambrosius和烟管属真菌Bjerkanderaecuadorensis。采用菌丝生长速率法测定发现,香芹酚对这5株病原菌具有较好的抑制效果,当香芹酚浓度为300 μg/mL时,对5株菌抑菌率的依次为91.19%、85.74%、80.21%、60.66%和80.07%,其EC50依次为52.4、55.8、212.1、227.5和169.9 μg/mL。因此,天然植物精油香芹酚可作为蜂糖李采后贮藏期病害防控的一种有效防治药剂。
