利用小RNA测序鉴定江西奉新猕猴桃病毒种类
2023-12-08王赛博张凯东熊桂红李庚花涂贵庆蒋军喜
王赛博,张凯东,刘 冰,熊桂红,李庚花,涂贵庆,蒋军喜
(1 江西农业大学农学院,南昌,330045;2 江西省奉新县农业局,江西奉新,330700)
猕猴桃属于猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)多年生落叶藤本果树,是当今国内外竞相发展的新兴特色水果之一[1]。江西省奉新县是我国猕猴桃生产大县之一,近年来,猕猴桃病毒病开始上升为主要病害,成为影响猕猴桃质量和产量的重要因素[2]。全世界已报道侵染猕猴桃的病毒共19种,在我国已发现的有11种,包括α-线性病毒科(Alphaflexiviridae)马铃薯X病毒属(Potexvirus)的马铃薯X病毒(PotatovirusX,PVX);β-线性病毒科(Betaflexiviridae)发状病毒属(Capillovirus)的苹果茎沟病毒(Applestemgroovingvirus,ASGV),葡萄病毒属(Vitivirus)的猕猴桃病毒A(ActinidiavirusA,AcVA)、猕猴桃病毒B(ActinidiavirusB,AcVB)、猕猴桃病毒C(ActinidiavirusC,AcVC),柑桔病毒属(Citrivirus)的柑桔叶斑驳病毒(Citrusleafblotchvirus,CLBV);无花果花叶病毒科(Fimoviridae)欧洲山梣环斑病毒属(Emaravirus)的猕猴桃褪绿环斑相关病毒(Actinidiachloroticringspotsassociatedvirus,AcCRaV)、猕猴桃山梣病毒2(Actinidiaemaravirus2,AcEV-2);雀麦花叶病毒科(Bromoviridae)黄瓜花叶病毒属(Cucumovirus)的黄瓜花叶病毒(Cucumbermosaicvirus,CMV)、长线形病毒科(Closteroviridae)未分属(Unassigned)的猕猴桃病毒1(Actinidiavirus1,AcV-1)和番茄斑萎病毒科(Tospoviridae)番茄斑萎病毒属(Tospovirus)的番茄坏死环斑相关病毒(Tomatonecroticspotassociatedvirus,TNSaV)[3-4]。目前,对引起奉新猕猴桃病毒病的病毒种类尚不清楚。小RNA深度测序技术是鉴定植物病毒的主要方法之一,现已成功应用于番茄、葡萄和西番莲等作物的毒原鉴定[5-7]。本研究拟采用小RNA深度测序技术并通过RT-PCR和测序验证,对奉新猕猴桃疑似病毒病样本进行检测,以明确其病毒种类。
1 材料与方法
1.1 样品采集2020年5月从江西省奉新县山口万亩猕猴桃种植基地、果优水果种植农民专业合作社、新西蓝生态农业科技有限责任公司3个主要猕猴桃种植区共采集23份疑似病毒病叶片样品,样品采集后迅速带回实验室于-80 ℃冰箱保存。
1.2 小RNA深度测序建库和测序委托生工生物工程(上海)股份有限公司进行。将全部23份疑似病毒病叶片样品混合,利用Eastep® Super总RNA提取试剂盒提取样品总RNA,使用小RNA样品制备试剂盒构建小RNA文库,并使用HiSeq 4000二代测序仪进行深度测序,得到原始序列(raw reads),单端测序读长为50 nt。应用Cutadapt软件结合质量分数预处理方法对原始序列进行质量控制,质量控制后剩余的序列即为高质量序列(clean reads),再应用SPAdes软件对高质量序列进行拼接,将拼接结果与NT数据库(https://www.ncbi.nlm.nih.gov/genome/viruses/)进行比对,挑选出其中的病毒序列。
1.3 猕猴桃病毒的RT-PCR验证对在小RNA测序中检测到的病毒,分别设计其特异性引物进行RT-PCR验证,引物信息见表1。提取各样品总RNA,利用GoScriptTM逆转录系统试剂盒(美国Promega公司)反转录合成cDNA,以cDNA为模板进行PCR扩增。PCR扩增总体系25 μL,包括上游和下游引物各1 μL,2×Taq PCR预混液12.5 μL,ddH2O 8.5 μL,cDNA 2 μL。PCR扩增条件为:94 ℃预变性3 min;94 ℃变性30 s,54~60 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃补平10 min。回收RT-PCR产物,克隆到pEASY-T3载体中,并采用蓝白斑和菌落PCR鉴定阳性克隆。将阳性克隆送至生工生物工程(上海)股份有限公司进行序列测定。使用DNAStar软件(USA)进行序列分析,通过NCBI数据库中的BLAST程序进行核苷酸序列同源性搜索。

表1 用于不同猕猴桃病毒RT-PCR扩增的引物信息[2]
2 结果与分析
2.1 病叶典型症状猕猴桃疑似病毒病叶片症状包括脉明、褪绿、黄化、斑驳、皱缩和畸形等,少部分病叶表现其中的一种症状类型,大部分病叶则表现复合症状(见图1);感病植株的果实普遍偏小,呈现畸形。

图1 江西奉新猕猴桃疑似病毒病叶片症状
2.2 小RNA测序结果从混合样品中获得22 647 028条长度为150 nt的原始序列,样品原始序列条数大于1 000万条,达到分析要求。对原始序列进行质量控制,过滤掉3’端接头序列、Phred质量分数值小于20的低质量序列、含N序列、含poly A尾巴序列、长度小于10 nt的过短序列及长度大于45 nt的过长序列后,获得16 687 474条高质量序列,其长度分布图如图2。其中所占比例最高的序列是长度为24 nt的小RNA序列,占比为15.4%。
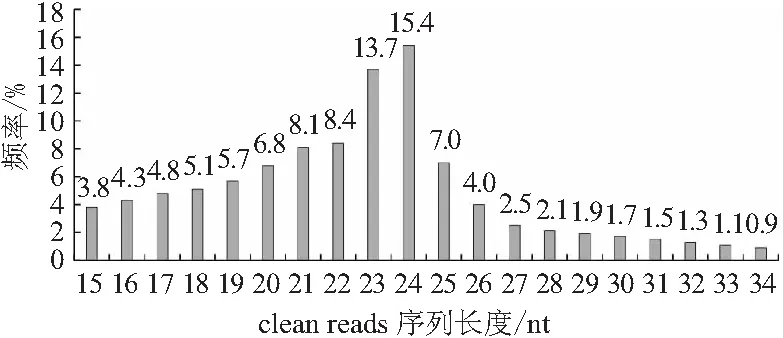
图2 江西奉新猕猴桃疑似病毒病叶片样品小RNA深度测序所得高质量序列的长度分布
筛选长度18~30 nt的clean reads序列进行序列拼接组装,在NT数据库中对拼接结果进行比对和统计。在混合样品中得到461个contigs,总长为100 939 nt,平均长219 nt,最长为1388 nt。其中,比对到病毒的contigs有65个,共鉴定到4种病毒,分别是AcVA、AcVB、AcCRaV和CLBV(见表2)。

表2 江西奉新猕猴桃疑似病毒病叶片样品小RNA深度测序所得clean reads序列拼接组装比对到病毒的情况
2.3 RT-PCR验证使用4对特征引物分别对所有样品进行4种病毒(AcVA、AcVB、AcCRaV和CLBV)的RT-PCR扩增。结果表明,除第6号症状轻微样品外,从其余22份病样中均可扩增出目的条带(见图3)。将PCR扩增产物克隆测序后,获得长度分别为597 bp、420 bp、477 bp和425 bp的序列。通过在NCBI中进行BLAST搜索,发现这4个序列与AcVA、AcVB、AcCRaV和CLBV 4种病毒对应序列的一致性分别为99.59%、99.38%、99.77%和100%。由此表明小RNA测序结果具有可靠性。在23份供试样品中,4种病毒检出率依次为87.0%、56.5%、65.2%和60.9%。
3 讨论
利用小RNA深度测序技术对采自奉新县山口、农合、新西蓝三个猕猴桃基地的23份疑似猕猴桃病毒病混合叶片样品进行毒原检测,共检测出AcVA、AcVB、AcCRaV和CLBV 4种病毒。针对这4种病毒,对每份疑似病毒病叶片样品进行RT-PCR检测,至少检测出1种病毒的样品有22份,检出最多的为AcVA,其检出率高达87.0%,多数样品中存在2~4种病毒的复合侵染,复合侵染率达81.8%。由此可认为,奉新县猕猴桃病毒病的毒原有AcVA、AcVB、AcCRaV和CLBV 4种,AcVA为优势种,病毒复合侵染发生普遍。BLOUIN等[3]归纳认为,在猕猴桃上,AcVA和AcVB易造成叶片脉明,AcCRaV会产生斑驳或环斑,CLBV严重感染时叶片黄化坏死等。本试验结果与此一致。
小RNA深度测序技术是植物毒原鉴定的主要方法之一。该技术从叶片总RNA中分离出18~30 nt范围内的小RNA,两端加上特定接头后反转录形成cDNA,利用测序仪对DNA片段进行单向末端直接测序和表达定量,从而解析相应靶序列。由于基因组存在大量重复序列,在这种区域产生的reads大多是24 nt,因此小RNA测序数据中数量最多的是24 nt的reads。小RNA深度测序技术具有灵敏度高,测序通量大,利于区分同家族或相似序列的不同小RNA分子等优势。如:姜军等[8]通过小RNA深度测序技术鉴定出河南地区西瓜病毒种类,陈玲等[9]利用该技术明确了北京地区樱桃种质资源中的病毒病毒原。这表明了小RNA深度测序技术在植物病毒病毒原鉴定中的准确性和可靠性。
此前,一些学者对我国陕西、四川和湖北等地的猕猴桃病毒病的毒原进行了检测,结果表明陕西猕猴桃病毒病的毒原主要为AcVA、AcVB、AcCRaV、CLBV和CMV[10-12],四川猕猴桃病毒病的毒原主要为AcVA、AcCRaV、CLBV和AcV-1[13-15],在湖北猕猴桃样品中检测到AcVA、AcVB、AcCRaV、CLBV、AcV-1和猕猴桃种传潜隐病毒(Actinidiaseed-bornelatentvirus,ASbLV)[4]。结合本研究结果,表明AcVA、AcVB、AcCRaV和CLBV在我国猕猴桃种植区发生具有普遍性。分析认为,由于猕猴桃主要通过嫁接繁殖,且蚜虫和叶蝉等害虫时有发生,近年来奉新县从四川蒲江、苍溪等地频繁引进苗木,因此促成了奉新猕猴桃病毒病的传播蔓延。为有效防控奉新猕猴桃病毒病的发生,应重点做好使用无病接穗、苗木和加强虫害防控等工作。
