铁调素对造影剂相关急性肾损伤的预测价值*
2023-12-07李添姚琴程元
李添, 姚琴, 程元△
攀枝花市中心医院 1肾内科, 2老年科(四川攀枝花 617000)
碘化的静脉造影剂被用于许多对比增强成像技术,范围从计算机体层摄影术到血管造影术,随着造影技术的不断发展和改良,造影剂越来越多地被使用,但造影剂的不良反应——造影剂相关急性肾损伤(contrast induced acute kidney injury,CI-AKI)却不能避免。特别是高龄、有严重基础疾病的患者,CI-AKI已经成为医源性急性肾损伤(AKI)的第3大原因,占所有AKI发生率的12%[1-2],目前关于造影剂诱发肾病的发生率几乎没有共识,既往的研究报道中,CI-AKI的发生率从1%~33%不等。也有研究报道CI-AKI发病率7%~11%,部分取决于CI-AKI的诊断标准及研究人群[3-4]。关于CI-AKI定义目前尚未达成共识,很多研究采用的是造影剂使用后72 h血清肌酐(serum creatinine,Scr)升高超过25%基础值或绝对值升高超过44 μmol/L,并排除其他肾脏损害因素。但Scr并非预警急性肾功能改变的可信指标,它受年龄、性别、营养状况、肌肉含量、肌肉代谢水平以及炎症、容量状态等诸多因素影响[5]。当肾功能出现一定程度下降,Scr仍可维持于正常范围,且多数患者在造影后48 h内Scr并无明显变化,其峰值常在造影后3~5 d出现,7~10 d内恢复至基础水平。因此Scr不能及时、准确地反映肾功能损伤程度,故而临床上急需一种更加敏感、可靠的生物标志物取代Scr,成为早期预测CI-AKI的指标。铁调素(hepcidin,Hepc)作为维持机体铁代谢稳态的重要调节因子,主要由肝细胞产生,通过结合到转铁蛋白受体来稳定胞内铁,并在近端小管被滤过和重吸收。相关研究[6]证实,铁调素与糖尿病、冠心病、急性肾损伤、慢性肾脏病等疾病的发生、发展密切相关。本研究通过分析发生CI-AKI的相关危险因素,探讨铁调素对CI-AKI的预测价值,利于CI-AKI的早期诊断和治疗, 现报告如下。
1 资料与方法
1.1 一般资料 纳入2019年6月至2022年6月在我院应用含碘造影剂进行影像学检查的203例患者作为研究对象。纳入标准:自愿签署知情同意书;20~60岁, 男女不限。排除标准:含碘造影剂过敏史; 慢性肾脏病2~5期的患者; 严重肝肾功能不全; 妊娠期妇女。本研究经我院伦理委员会批准, 所有患者以及家属均知情同意。
1.2 方法 实验分组:在造影检查前和造影后72 h通过测量血清Scr对CI-AKI的发生进行评估。CI-AKI定义为与造影前基础值相比, 患者造影后72 h Scr升高>25%或绝对值增加>44 μmol/L,根据患者在应用造影剂后是否发生CI-AKI分为CI-AKI组和N-CI-AKI组两组。
造影方法: 所有患者均接受低渗透性对比剂碘帕醇。所有患者在应用含碘造影剂前后静脉滴注生理盐水, 在应用含碘造影剂24 h之前,停用肾毒性药物[非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)、利尿剂、二甲双胍、血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体抑制剂(angiotensin converting enzyme inhibitors/angiotensin Ⅱ receptor inhibitors,ACEI/ARB)],所有患者收缩压维持在90~140 mmHg,所有患者均使用他汀类药物。
数据收集:(1)人口学资料:性别、年龄、体重指数等;(2)病史和合并症:糖尿病、高血压、冠心病、慢性肾脏病等;(3)记录患者进行含碘造影剂检查前接受的药物治疗方案,包括抗生素的种类、美托洛尔等;(4)记录患者造影前Scr以及肾小球滤过率(glomerular filtration rate,eGFR); (5)所有患者在应用造影剂前、 造影后24 h以及造影后48 h留取血液标本,用离心肌以 3 000 r/min 离心 5 min,取上清液,置于 -80℃冰箱保存备用, 采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测患者血清肾损伤分子-1(kidney injury molecule-1,KIM-1)以及胱抑素C(cystatin C,CysC)表达水平,采用免疫透射乳胶凝集法检测患者血清Hepc、中性粒细胞明胶酶相关的脂质钙蛋白(neutrophil gelatinase related lipocalpain,NGAL)表达水平。

2 结果
2.1 两组患者一般临床资料比较 203例入组患者平均年龄为(45.1±6.8)岁,男133例(65.5%),女70例(34.5%),按检查后是否发生CI-AKI分为N-CI-AKI组162例(79.8%)和CI-AKI组41例(20.2%)。CI-AKI组中慢性肾脏病、糖尿病、抗生素使用以及美托洛尔使用患者所占的比例明显高于N-CI-AKI组(P<0.05),两组患者年龄、性别、体质指数、吸烟、高血压、冠心病、造影前Scr、造影前eGFR以及造影剂注射剂量比较,差异均无统计学意义(P>0.05),见表1。

表1 两组患者一般临床资料比较
2.2 两组患者血清生物标志物比较 与造影前基础值比较,CI-AKI组患者造影后24 h血清Hepc、NGAL、CysC以及KIM-1表达水平均明显升高(P<0.05),造影后48 h血清Hepc、CysC以及KIM-1表达水平明显下降,与造影前基础值比较差异无统计学意义(P>0.05)。两组患者造影前以及造影后48 h 血清Hepc、CysC以及KIM-1表达水平比较差异均无统计学意义(P>0.05);两组患者造影前血清NGAL表达水平比较差异无统计学意义(P>0.05);CI-AKI组患者造影后24 h Hepc、NGAL、CysC、KIM-1以及造影后48 h NGAL表达明显高于N-CI-AKI组(P<0.05),见表2。

表2 两组患者血清生物标志物比较
2.3 预测CI-AKI的多因素logistic回归分析 将是否发生CI-AKI作为因变量,将表1、2中有统计学意义的指标:慢性肾脏病(是=1, 否=0)、糖尿病(是=1, 否=0)、抗生素使用(是=1, 否=0)、美托洛尔使用(是=1, 否=0)、造影后24 h Hepc(实际值)、造影后24 h NGAL(实际值)、造影后48 h NGAL(实际值)、造影后24 h CysC(实际值)以及造影后24 h KIM-1(实际值) 作为自变量代入 logistic多因素回归模型进行分析,校正和控制混杂变量后,慢性肾脏病以及Hepc为静脉注射含碘造影剂后发生CI-AKI的独立预测因素(P<0.05),其中慢性肾脏病患者静脉注射含碘造影剂后发生CI-AKI的风险是非慢性肾脏病患者的3.567倍(OR=3.567,95%CI:1.324~7.634,P=0.021),患者造影后24 h后血清Hepc每升高1 ng/mL,发生CI-AKI的风险增加1.587倍(OR=2.587, 95%CI:1.598~4.327,P=0.007),见表3。

表3 预测CI-AKI的多因素logistic回归分析
2.4 慢性肾脏病和Hepc预测CI-AKI的ROC曲线分析 慢性肾脏病预测CI-AKI的ROC曲线下面积(AUC)为0.732(95%CI:0.714~0.834),造影后24 h Hepc预测CI-AKI的AUC为0.825(95%CI:0.763~0.924),最佳诊断截点为5.1 ng/mL,两者联合预测的AUC为0.936(95%CI:0.887~0.985),其敏感度和特异度分别为95.6%和93.4%,总体准确度为94.6%,见图1。
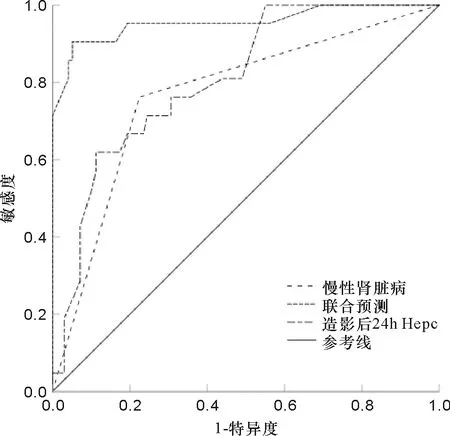
图1 慢性肾脏病和Hepc预测CI-AKI的ROC曲线
2.5 慢性肾脏病和Hepc预测CI-AKI的决策曲线分析 以慢性肾脏病和Hepc预测CI-AKI的净受益率为纵坐标,高风险阈值为横坐标,对2个独立预测指标进行决策曲线分析。结果显示,在大多数合理阈值概率范围内,2个独立预测指标预测和Hepc预测检查后是否发生CI-AKI均具有良好的净获益,并且联合预测的总体净效益高于单一指标的净效益,见图2。

图2 慢性肾脏病和Hepc预测CI-AKI的决策曲线
3 讨论
近年来,随着造影剂在放射诊断和心血管内科介入治疗中的广泛应用,由造影剂所引起的 CI-AKI 逐渐受到关注,CI-AKI不仅延长患者住院时间、增加医疗费用,甚至可能进展至不可逆性肾功能损害,显著增加死亡风险,目前尚无有效的方法治疗CI-AKI,重点在于预防。本研究尝试探讨发生CI-AKI的相关危险因素。
CI-AKI 的发病与预先存在的慢性肾脏病密切相关。原因在于造影剂不仅对肾小管具有直接毒性作用,而且还能导致血流动力学改变,造成肾髓质缺血缺氧,肾功能正常患者可通过代偿机制维持肾小球稳定的血流量,而慢性肾脏病患者因损失大量功能正常的肾单位,面临碘化造影剂时,残余肾无法维持正常的肾血流量,肾小球功能极易衰退恶化[7-8], 国外研究发现[9-10],肾功能正常的患者极少发生CI-AKI,CI-AKI的发病率随 eGFR 降低而升高。本研究发现,CI-AKI组慢性肾脏病患者所占比例显著高于N-CI-AKI组,多因素分析也显示,慢性肾脏病患者静脉注射含碘造影剂后发生CI-AKI的风险是非慢性肾脏病患者的3.567倍。
相关研究显示[11-13],KIM-1、CysC和NGAL为早期诊断和预测CI-AKI的可靠生物标物,有报道,应用KIM-1、CysC和NGAL可较Scr提前1~2 d诊断AKI,其敏感度、特异度和准确度均明显优于SCr等内源性指标[14]。本研究以上3个指标单因素分析均有统计学意义,但多因素分析却未得到满意结果,其可能原因与本研究样本量较小有关。机体在炎性反应或氧化应激的条件下,会发生铁介导的肾损伤, Hepc是铁代谢稳态的调节激素,其基因表达受铁负荷、氧化应激或炎症的影响,当机体发生炎性反应和氧化应激损伤时, Hepc和 NGAL等多种铁代谢调节激素表达明显上调,增加肾小管对铁的重吸收作用,以减少铁超载诱发的肾损伤发生[15-17]。因此, Hepc可作为早期预测肾损伤的标志物,对肾损伤有保护作用,并且与炎性反应指标存在一致性,与eGFR呈负相关[18]。Qiu等[19]对22例AKI患者和22例无AKI患者进行了研究,结果显示,那些发展为AKI的患者,其尿和血清中有更高的Hepc水平,提示Hepc可能是体外循环后AKI的第1个临床有用的生物标志物;此外,由于Hepc和Scr在注射造影剂后随时间变化情况不同,Hepc于造影后4、8、12 h明显升高,24 h后升至峰值,48 h降至造影前水平,而Scr在注射造影剂后48 h才开始升高,72 h达峰值。因此,笔者认为Hepc能更早提示肾功能变化,其敏感度较Scr更佳。本研究多因素结果显示,Hepc为静脉注射含碘造影剂后发生CI-AKI的独立预测因素,患者检查后24 h内血清Hepc每升高1 ng/mL,发生CI-AKI的风险增加1.587倍,提示相较于检查后24 h内血清KIM-1、CysC和NGAL,血清Hepc表达水平更能早期准确地反映患者肾功能损伤的情况,因此其预测CI-AKI发生的敏感度和准确度均高于血清KIM-1、CysC和NGAL。
此外,为进一步验证慢性肾脏病和Hepc的预测价值,本研究进行了ROC分析和决策曲线分析。结果显示,两者用于预测CI-AKI的发生均具有较高的价值和净收益,并且联合预测的价值和净收益最高。
综上所述,慢性肾脏病患者发生CI-AKI的风险显著高于肾功能正常人群,造影后24 h内血清Hepc表达水平可作为早期预测CI-AKI的可靠生物标志物,当Hepc≥5.1 ng/mL时患者发生CI-AKI的风险较大,但其确切作用仍需要的大样本临床研究证实。
利益相关声明:本文所有作者均声明不存在任何利益冲突。
作者贡献说明:李添、程元负责构思并实施研究项目、收集和处理原始数据、撰写论文及修改;姚琴负责数据分析、论文审阅;程元负责指导研究项目的实施、联络样本资源、论文审阅。
