GSDMD 单域抗体的筛选及功能探究
2023-12-07高秋雲孙亚楠马振毅
高秋雲,孙亚楠,马振毅
(天津医科大学基础医学院生物化学与分子生物学系,天津 300070)
细胞焦亡(pyroptosis)是一种程序性细胞死亡方式,其特定的细胞形态特征是形成气泡样囊泡,细胞体积增大,细胞器变形,细胞核变小,导致细胞膜破裂[1]。细胞焦亡在细胞增殖、微生物感染、肿瘤的发生和转移以及细胞死亡过程中发挥重要作用[2]。GSDMD 是目前研究最多,机制研究相对完整的一种焦亡相关蛋白[3],含有N 端结构域(GSDMD-NT)和C 端结构域(GSDMD-CT)[4],主要表达于免疫细胞和小肠黏膜上皮细胞表面[5]。由于GSDMD 是焦亡的执行蛋白[6],理论上可以通过调控GSDMD 的功能来操控焦亡过程。
单域抗体(sdAb)又称纳米体(nanobody),相对分子质量为15 000~20 000 Da。它由4 个框架区(FR1~FR4)和3 个互补决定区(CDR1、CDR2、CDR3)组成,其中CDR3 是主要特异性抗原识别的区段[7]。与传统抗体相比,sdAb 具有分子量小、特异性强、高亲和力和跨膜运输等特性,能够靶向细胞内抗原,在疾病的诊断和治疗方面具有广阔的应用前景[8]。基于此,笔者试图通过筛选抗GSDMD 的sdAb,来调控GSDMD 介导的焦亡,为临床上控制焦亡相关疾病的进展提供新思路。
1 材料与方法
1.1 实验材料 细胞系:人源单核细胞THP-1、胚肾细胞293T、宫颈癌细胞HeLa、骨肉瘤细胞U2OS、结肠癌细胞HT29、淋巴瘤细胞U937、非小细胞肺癌细胞A549 均为本实验室保存;DMEM、胎牛血清购自Biological Industries 公司;原位邻位连接(isPLA)相关试剂购自Sigma-Aldrich;Protein G Sepharose 4 Fast Flow,Glutathione Sepharose 4B 和Ni2+NTA agarose beads 均购自Cytiva;白细胞介素(IL)-1β ELISA 检测试剂盒购自碧云天;LDH 检测试剂盒购自索莱宝。
1.2 实验方法
1.2.1 细胞培养 293T、HeLa、U2OS 和HT29 细胞用含有10%胎牛血清、100 U/mL 青霉素和100 μg/mL链霉素、非必需氨基酸的DMEM 培养液;THP-1、A549和U937 细胞用含有10%胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素、非必需氨基酸的RPMI-1640 培养液,于37℃,5% CO2的恒温培养箱培养。
1.2.2 isPLA 结合高通量测序筛选抗GSDMD 的sdAbs 将实验室前期构建的Flag-sdAb 文库和HA-GSDMD 以及阴性对照质粒共转染进HEK293T细胞中,48 h 后收集细胞,随后对收集的细胞进行PLA 实验,在isPLA 后,通过流式细胞仪分选红色荧光信号的细胞,将阳性细胞作为模板扩增CDR3区,构建sdAb 亚库,重复上述步骤进行3 轮筛选,最终将扩增CDR3 产物送至诺禾致源公司进行二代测序。实验方法参照相关文献[9]。
1.2.3 细胞isPLA 实验 将筛选到的CDR3 序列构建到带有3×Flag 的sdAb 骨架载体上,同阴性对照质粒一起分别和HA-GSDMD、GSDMD-NT、GSDMD-CT 共转入HEK293T 中。隔天将细胞铺至载玻片上,待细胞贴壁后进行PLA 实验,DAPI 染核后,封片,避光低温保存。实验方法参照相关文献[9]。
1.2.4 GST pull down 实验 分别将GSDMD 构建在GST 标签的原核表达载体上,筛选的sdAb 序列构建在His 标签的原核表达载体上,进行原核诱导表达,菌液中加入IPTG 至终浓度0.2 mmol/L,16℃诱导过夜。将菌液超声破碎后离心收集上清,分别加入GST珠子和Ni 珠,4℃摇床孵育2 h。孵育结束后,将珠子用新鲜裂解液洗涤3 次,将His 标签蛋白使用50 mmol/L咪唑洗杂后,用300 mmol/L 咪唑将His 标签蛋白洗脱下来。将洗脱下来的His 标签蛋白加入到结合了GST 标签蛋白的珠子中,4℃摇床孵育2 h。结合结束后,使用裂解液洗去非特异结合蛋白并将样品进行考马斯亮蓝染色。
1.2.5 Co-IP 实验 分别将带有HA 标签的GSDMD 和带有Flag 标签的sdAb Con、sdAb #3、sdAb#26 共转到HEK293T 细胞中,48 h 后收集细胞并在冰上超声裂解,向离心后的样品中加入少量Protein G 珠子孵育2 h 以去除非特异结合。然后去掉Protein G 珠子,向只转染了HA-GSDMD 的样品中加入IgG 抗体,另外3组样品中加入Flag 抗体,4℃摇床过夜孵育。第2 天,向每组样品中加入Protein G 珠子,4℃摇床孵育2 h,孵育结束后收集珠子并煮样,再进行Western 印迹检测。
1.2.6 等温滴定量热实验 首先在大肠杆菌BL21(DE3)中诱导表达GST-GSDMD 和8×His-SUMOTEV site-sdAb #26,将GST-GSDMD 结合GST 珠子后使用10 mmol/L 还原性谷胱甘肽洗脱。8×His-SUMO-sdAb 和Ni 珠结合后,加入TEV 酶切过夜,得到纯化的sdAb。使用10 000 Da 的超滤管将所有纯化好的蛋白溶于50 mmol/L Tris,pH 7.5,200 mmol/L NaCl 溶液中。启动MicroCal VP-ITC 仪器,在加样池加入10 μmol/L 的GST 或GST-GSDMD,在滴定池加入300 μmol/L 的sdAb Con 或sdAb #26 进行测定,使用MicroCalPEAQ-ITC 分析软件计算出解离常数,并使用Origin 7.0 做出拟合曲线。
1.2.7 sdAb 纯化 将重组质粒GST-TEV sitesdAb-ETA-3×Flag 转化进入大肠杆菌BL21(DE3)中,当菌液OD 值达到0.8 时,加入IPTG至终浓度0.2 mmol/L,16℃诱导过夜。摇菌结束后离心收集菌体,将菌体冰上超声后,12 000 r/min 离心30 min 收集上清。在上清中加入GST 珠子,4℃摇床孵育2 h 后收集珠子,取少量珠子煮沸进行考马斯亮蓝,与BSA进行对比,估算出原珠子中含有的蛋白量,以sdAb:TEV=10∶1 的比例向珠子中加入TEV酶,4℃过夜收集去除了GST 标签的sdAb。
1.2.8 细胞上清中LDH 释放量检测 将THP-1 细胞铺入96 孔板中,并将纯化好的sdAb Con、sdAb#26 加入细胞中过夜,12 h 后用1 μg/mL LPS 预处理4 h,再用10 μmol/L nigericin 处理1 h 后,收集检测细胞上清中LDH 的释放量,检测方法参照试剂盒说明书进行。
1.2.9 ELISA 检测细胞上清IL-1β 蛋白水平 将THP-1 细胞铺入24 孔板中,过夜贴壁后,将纯化的sdAb Con、sdAb #26 加入细胞中过夜,12 h 后用1 μg/mL LPS 预处理4 h,再用10 μmol/L nigericin 处理1 h 后,收集细胞上清培养液检测IL-1β 浓度,检测方法参照试剂盒说明书进行。
1.2.10 Western 印迹实验 提取各组细胞蛋白,按常规步骤进行Western 印迹分析,一抗:GSDMD(1∶1 000)、FLAG(1∶5 000)、HA(1∶1 000)、ACTB(1∶5 000)。4℃孵育过夜,室温二抗孵育1 h,显影并曝光。
1.3 统计学处理 所有数据为3 次独立实验,符合正态分布的计量资料使用均值±标准差表示,数据分析采用双因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 GSDMD sdAb 的筛选 isPLA 后,流式分选出红色荧光信号的阳性细胞,对照组为带有HA 标签的空载体和sdAb 文库(图1A)。将阳性细胞作为模板通过聚合酶链反应,扩增CDR3 区,片段大小为325 bp(图1B)。经3 轮筛选后,将富集的CDR3 区进行序列测定,得到如表1 所列的CDR3 氨基酸序列。接下来,通过PRODIGY 网站预测候选sdAb 和GSDMD 相互作用的亲和力,选出两条亲和力较强的sdAb #3 和#26 进行验证。

图1 通过isPLA-seq 筛选GSDMD 单域抗体Fig 1 Single-domain antibodies against GSDMD screening by isPLA-seq

表1 由isPLA-seq 筛选得到的抗GSDMD 单域抗体CDR3 序列Tab 1 The CDR3 sequences of the anti-GSDMD sdAb obtained by isPLA-seq screening
2.2 GSDMD 的sdAb #3 和sdAb #26 与GSDMD特异性结合 由细胞isPLA 实验结果可知,sdAb #3和#26 与GSDMD 全长及GSDMD-CT 产生了相互作用,而不和GSDMD-NT 互相作用(图2A、2B)。为了进一步验证这两条sdAb 与GSDMD 的结合是否为直接相互作用,笔者通过使用含有GST 标签的GSDMD 与His 标签的sdAb 进行pull down 实验。结果显示,在GST 标记GSDMD 中检测到His 标记的sdAb,与isPLA 数据一致(图2C)。接着,将带有Flag 标签的sdAb 和带有HA 标签的GSDMD 共转进293T 细胞中,通过Co-IP 实验,再次证实sdAb#3 和sdAb #26 分别和GSDMD 相互作用(图2D)。最后,通过ITC 实验测定了GST-GSDMD 和sdAb#26 之间的解离常数(dissociation constant,Kd)为(3.78±0.42)μmol/L,而GST-GSDMD 和sdAb Con 以及GST 和sdAb#26 之间都不发生互相作用(图2E)。
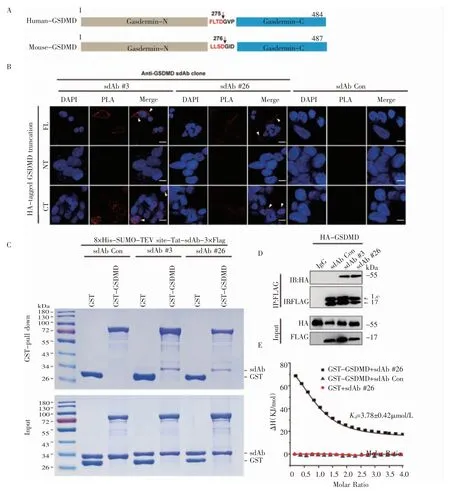
图2 抗GSDMD 的sdAb#3 和sdAb#26 与GSDMD 直接结合Fig 2 GSDMD-resistant sdAb#3 and sdAb#26 binding directly to GSDMD
2.3 GSDMD 的sdAb #26 促进GSDMD 介导的焦亡 Western 印迹检测GSDMD 在不同细胞类型中的蛋白表达情况,结果显示,HeLa 和THP-1 细胞高表达GSDMD 蛋白,U2OS 细胞不表达GSDMD 蛋白(图3A)。用sdAb #26 过夜预处理再用LPS/nigericin诱导后,显微镜下观察在高表达GSDMD 的HeLa 和THP-1 细胞中,与加入sdAb Con 的细胞相比,细胞焦亡表型明显增多,细胞肿胀膨大,并且有许多气泡状突出物(图3B,箭头所示),而在不表达GSDMD的U2OS 细胞中则没有观察到此表型(图3B)。此外,用上述同样条件处理THP-1 细胞,培养液上清中的IL-1β 和LDH 含量显著增加(图3C、3D)。通过Western 印迹检测GSDMD 和GSDMD-NT 蛋白含量的变化。结果表明,与对照组相比,加入sdAb#26 的THP-1 细胞中GSDMD-NT 产生水平显著增加(图3E)。
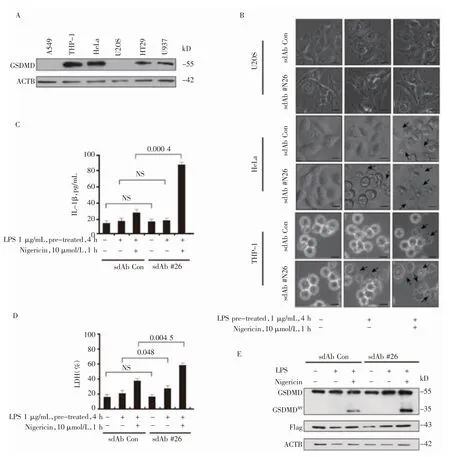
图3 sdAb#26 促进由GSDMD 介导的细胞焦亡Fig 3 sdAb#26 promotes pyroptosis mediated by GSDMD
3 讨论
GSDMD 是焦亡的执行蛋白之一,调控生理和病理状态下机体的稳态。本研究通过isPLA 结合高通量测序技术筛选出抗GSDMD 的sdAb,验证筛选出的sdAb #3 和#26 能与GSDMD-CT 特异性结合,并初步探究此sdAb #26 能促进GSDMD 介导的细胞焦亡。细胞焦亡主要通过两种途径发生:一种是依赖caspase-1 的经典途径,另一种是依赖caspase-4、5、11 的非经典途径[10]。当细菌、病毒入侵宿主时,细胞内的模式识别受体感受到这些刺激后,激活caspase,使其对GSDMD 进行切割活化,产生具有活性的GSDMD-NT,其与细胞质膜内侧的磷酸肌苷结合,在细胞膜上进行打孔,使细胞破裂,释放细胞炎性因子[11]。通常认为,GSDMD-NT 和GSDMD-CT 之间能够形成自我抑制的非活性形式,但最近有文献报道,切割后的GSDMD-CT 通过与GSDMD-NT 形成大的疏水相互作用,阻止GSDMD-NT 在孔形成时发生构象变化,这可能也是调控GSDMD-NT 介导焦亡的策略之一[12]。本文筛选得到的sdAb #3 和#26 能够与GSDMD-CT 结合,促进细胞焦亡的发生,可能是该sdAb 与GSDMD-CT 结合后解除了对GSDMD-NT 的抑制,最终使细胞膜上打孔,促进细胞焦亡。
已有研究认为,革兰阴性菌脂多糖成分在细胞内直接激活caspase-4、5、11,这些被激活的caspase会切割GSDMD,引起细胞发生焦亡[13]。另有报道认为,当机体被HIV 感染时,体内的CARD-8 炎性小体可以识别HIV 蛋白酶,从而引起HIV 蛋白酶对CARD-8 炎性小体进行切割,进而激活caspase-1 和GSDMD,使感染HIV 的细胞发生焦亡,减少HIV 在体内的复制和传播[14]。可见,焦亡对于一些特定细菌和病毒感染后的机体具有一定的保护作用,因此通过开发促焦亡作用的sdAb 可能给HIV 等病原微生物感染的治疗提供新策略。目前研究也证实,焦亡可作为肿瘤抑制途径,发挥抗肿瘤作用[15]。如2-(萘甲酰基)乙基三甲基碘化铵(α-NETA)通过GSDMD/caspase-4 途径诱导上皮性卵巢癌细胞焦亡,显著降低了小鼠上皮性卵巢癌的进展[16]。此外,在部分肿瘤细胞中诱导焦亡导致T 细胞依赖性肿瘤消退,同时伴随着T 细胞、NK 细胞、M1 巨噬细胞群的增加以及调节性T 细胞、M2 巨噬细胞、中性粒细胞和髓系衍生抑制细胞群的减少,提示焦亡与细胞毒性淋巴细胞可相互促进,通过正反馈环路促进抗肿瘤免疫作用[17]。另外,目前肿瘤的治疗大多通过化疗,其次免疫检查点阻断也广泛应用于肿瘤的治疗,而肿瘤抗原的缺乏以及不能有效并快速启动体内的适应性免疫是免疫治疗效果较差的重要原因[18]。但焦亡的细胞会释放肿瘤抗原以及启动体内的适应性免疫,这使得如何有效并快速诱导肿瘤细胞焦亡成为了研究热点[19]。然而,焦亡也是一把双刃剑,大量正常细胞发生焦亡可导致过度的炎症,IL-1β、IL-18 的释放又可激活免疫细胞向感染部位聚集,大量炎性细胞浸润,再次加剧炎症因子释放,导致内脏器官衰竭或细胞因子释放综合征的发生,从而危及生命[12]。
综上所述,本文利用isPLA 结合高通量测序的方法成功筛选到GSDMD 的sdAb,并在细胞内验证了其促进焦亡的功能,为GSDMD sdAb 的临床转化研究提供了新思路。
