胸腔压力波动对OSAHS 动物模型血压的影响
2023-12-07李伯君裴祥陈政杰梁柯欣刘珊赵晓赟
李伯君,裴祥,陈政杰,梁柯欣,刘珊,赵晓赟,
(1.天津大学胸科医院呼吸与危重症医学科,天津 300222;2.天津医科大学胸科临床学院,天津 300270;3.天津市心血管病研究所,天津 300222)
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是指是睡眠时完全性或部分性上呼吸道阻塞引起的反复发作的呼吸暂停和低通气[1]。患者可出现逐渐加重的间歇性低氧血症和(或)高碳酸血症及间歇性胸腔压力波动,可引发高血压、冠心病、认知障碍以及代谢和内分泌异常等一系列疾病,加重家庭及社会经济负担,已成为一个值得全社会关注、亟待解决的公共卫生问题。
与OSAHS 相关联的高血压称为阻塞性睡眠呼吸暂停相关性高血压,是一个不可忽视的高血压类型[2]。关于OSAHS 型高血压的发病机制尚不完全清楚,其中,关于OSAHS 发生间歇性气道阻塞和间歇性胸腔压力波动对高血压影响的研究相对较少,故有必要对二者的关系进行进一步研究。既往OSAHS动物模型研究中,制备动物模型的关键均为使动物同时发生“间歇性血氧饱和度降低、间歇性的呼吸力学改变”,所得到的结果因影响因素过多而存在争议。本动物研究在排除间歇性低氧血症这一病生理改变影响因素后,单独研究间歇性胸腔压力波动这一呼吸力学因素与高血压的相互关系,取得了良好的效果,现汇报如下。
1 材料与方法
1.1 实验动物 选取18 只新西兰长耳兔,雄性,健康,无呼吸道感染症状,平均体重2.2~2.7 kg,应用随机数字表法分为3组,对照组(A组)6 只,OSAHS模型组(B组)6 只,OSAHS 不伴低氧模型组(C组)6只。在实验过程中一旦发生动物死亡损耗,根据随机入组原则随时进行补充。
1.2 设备和材料 (1)哺乳类动物手术器械。(2)兔手术台。(3)小动物气管插管。(4)注射器若干(5 mL)。(5)胸内插管或粗穿刺针头。(6)动脉插管。(7)多道生理信号监测系统(成都仪器厂,型号RM6240E),含气流传感器、压力传感器、心电电极、耳夹式血氧饱和度传感器。(8)压力换能器。(9)便携式睡眠呼吸监测系统(美国邦德安佰,EmblattaX110)。(10)OSAHS动物模型的通气设备:间歇性气道阻塞通气调控系统(自主研发,发明专利号ZL201811564042.2,ZL201921606456.7),基于单片机系统控制、包含气道内径调节单元和驱动控制单元。
1.3 研究方法 (1)实验当天动物禁食禁水,用异氟烷气体吸入联合水合氯醛腹腔注射麻醉,麻醉满意后取仰卧位将兔固定于兔手术台上,剪去颈部、剑突和右侧胸部的毛。沿颈部正中切开皮肤,用止血钳钝性分离气管,在甲状软骨以下剪开气管,插入Y 形气管插管,用棉线将气管插管结扎固定,将通气装置的气道内径调节单元连接至气管插管上,通过装置的驱动控制单元实现对上气道开闭程度、频率、单次持续时间等进行精确调节和智能化控制,模拟睡眠呼吸暂停和低通气。(2)行胸腔测压导管置入术:将胸内套管尾端的塑料套管连至压力换能器(套管内不充灌生理盐水)。在兔右胸腋前线4~5肋骨之间,沿肋骨上缘做一长2 cm 的皮肤切口,用止血钳把插入点处的表层肌肉稍稍分离。将胸内插管的箭头形尖端从肋间插入胸膜腔后(此时可记录到曲线向零线下移位并随呼吸运动升高和降低,说明已插入胸膜腔内),迅速旋转90°并向外牵引,使箭头形尖端的后缘紧贴胸廓内壁,将插管的长方形固定片同肋骨方向垂直,旋紧固定旋钮,胸膜腔将保持密封而不致漏气。将穿刺针头尾端的塑料套管连至压力换能器(套管内不充灌生理盐水),再将穿刺针头沿肋骨上缘顺肋骨方向斜插入胸膜腔,用胶布将针尾固定在胸部皮肤上,以防针头移位或滑出。(3)分离颈动脉,行颈动脉置管术,将动脉插管与多导生理信号采集系统的压力传感器相连接,直接测量血压、心率,并完成记录。(4)连接便携式睡眠呼吸监测系统,以脑电图和肌电图判断动物是否入睡,当动物处于睡眠状态后将3组进行不同设置,A组设置为气道完全开放;B组、C组设置呼吸暂停低通气指数(AHI)为22[3],气道内径调节至50%以下,根据SpO2数值进一步调节;最终使A组睡眠正常,无呼吸暂停及反常呼吸运动,口唇无发绀,监测SpO2≥95%;B组、C组有呼吸暂停及反常呼吸运动,伴口唇发绀,监测SpO2≤90%以下,便携式多导睡眠监测(PSG)符合OSAHS 诊断标准;在C组气管插管处放置吸氧管逐渐提高其吸氧浓度使其SpO2≥95%,提示模型建立成功。(5)对3组动物行PSG 监测4 h,通过多导生理信号采集系统的压力传感器同步监测3组胸腔压力变化,同时采集记录实验过程中每个小时实验动物的收缩压、舒张压及心率数值,见图1、2。

图1 应用新西兰长耳兔进行实验Fig 1 Experiments with New Zealand long-eared rabbit

图2 应用多导生理信号采集系统采集相关数据Fig 2 The application of multi-channel physiological signal acquisition system to collect relevant data
1.4 统计学处理 采用SPSS 22.0 统计软件包进行数据处理,符合正态分布的计量资料以表示,两组间比较采用t 检验,组间多重比较用单因素方差分析及LSD-t 方法;非正态分布的计量资料采用中位数表示,组间比较采用秩和检验;P<0.05 为差异有统计学意义。
2 结果
4 h 的实验过程中,A组与C组均未发生低氧血症,两组SpO2比较差异无统计学意义,B组发生了较为明显的低氧血症,与其他两组差异有统计学意义。经过4 h 实验后,B组胸腔负压低于其他两组,C组胸腔负压低于A组,同时高于B组(P<0.05);B组心率快于其他两组动物,C组心率快于A组,同时慢于B组(P<0.05);B组舒张压和收缩压均高于其他两组动物,C组舒张压和收缩压高于A组,同时均低于B组(均P<0.05),见表1。3组在实验进行的4 h 中,各个时间点的心率、收缩压、舒张压均有显著差异,见图3、4、5。
表1 3组实验动物4 h 后胸腔压力、心率及血压数值()Tab 1 Thoracic pressure,heart rate and blood pressure after 4 hours in 3 groups of experimental animals()

表1 3组实验动物4 h 后胸腔压力、心率及血压数值()Tab 1 Thoracic pressure,heart rate and blood pressure after 4 hours in 3 groups of experimental animals()
注:a与A组比较,b与B组比较,P<0.05;1 mmHg=0.133 kPa
组别例数SpO2(%)胸腔压力(cmH2O)心率(次/min)收缩压(mmHg)舒张压(mmHg)A组697.83±0.75-4.48±0.23272.17±6.43128.50±2.8892.83±1.83 B组686.00±1.26a-7.35±0.33a327.83±9.02a144.33±4.23a110.50±5.75a C组696.17±4.53b-6.13±0.39ab303.33±9.31ab133.50±3.08ab102.67±3.20ab F 32.49116.6966.9133.0630.18 P 0.000.000.000.000.00
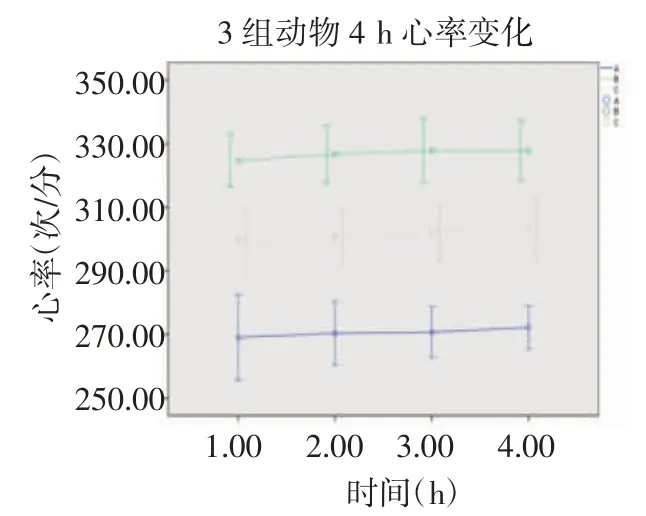
图3 3组动物4 h 心率变化Fig 3 Changes of heart rate ofter 4 hours in 3 groups
3 讨论
OSAHS 于1965 年首次被认识到是一种在睡眠期间发生的以咽部肌肉塌陷导致上气道部分或完全阻塞为特点的呼吸紊乱性疾病[4]。OSAHS 主要表现为睡眠时打鼾并伴有呼吸暂停和呼吸表浅,反复发生低氧血症、高碳酸血症和睡眠结构紊乱,导致白天嗜睡,心脑血管并发症乃至多器官损害,严重影响患者的生活质量和寿命。资料显示,OSAHS 在成年人中患病率为2%~4%,为多种疾患特别是心血管系统疾患的独立危险因素[5]。研究证实,OSAHS与包括高血压、冠心病、心律失常、心力衰竭等在内的心血管疾病之间具有显著相关性[6]。
OSAHS 相关性高血压一直是呼吸睡眠障碍研究领域的热点。目前研究认为气道阻塞引起呼吸暂停及低通气,产生间歇性缺氧,引起自主神经功能紊乱,造成一系列病理生理学改变导致高血压的发生[7]。早在1992 年,Fletcher 等[8]就报道将大鼠暴露于间歇性低氧环境可使其发生高血压,而对照组血压无明显改变。本研究中B组造模成功后出现反常呼吸运动,伴口唇发绀,SpO2下降,实验4 h 后与A组相比血压升高,心率增快,与既往研究结论相符。C组因补氧治疗未发生低氧血症,但在实验4 h 后仍发生血压升高伴心率增快,但程度轻于B组。关于OSAHS 型高血压的发病机制尚不完全清楚,可能的原因主要包括:(1)反复发生睡眠呼吸暂停和低通气可以导致低氧血症和高碳酸血症,从而刺激中枢和外周化学感受器导致交感神经兴奋性增加,使心率加快和血压升高,外周血管收缩,心脏后负荷进一步增大[9]。其中,颈动脉体是探测动脉血氧水平的主要化学感受器,在低氧血症、动脉血流减少等条件下,颈动脉体被激活使其化学反射增强,表现为交感神经激活,加剧了呼吸障碍和自主神经功能障碍,最终导致包括高血压等心血管事件的发生和加重[10]。(2)OSAHS 导致的低通气和呼吸暂停引发的间歇性低氧激活体内肾素-血管紧张素-醛固酮系统(RAAS),使醛固酮激素水平增加,导致水钠潴留,进而诱发高血压的发生[11]。(3)OSAHS 引起间歇性低氧血症导致凝血功能异常、一氧化氮生物利用度下降、促炎症因子释放等病理改变,进而导致血管内皮功能障碍,引发以高血压为代表的心血管疾病[12]。同时,引起高血压的原因还包括炎症、氧化应激、内分泌及代谢异常及胸腔内压力改变等一系列因素[13]。
本研究观察到C组虽然通过氧气吸入补氧治疗而未发生明显低氧血症,但同样出现胸腔负压增大并伴有血压升高、心率增快,只是变化程度小于B组。说明即使在未发生明显间歇性低氧血症的情况下,间歇性胸腔负压增加这一呼吸力学的改变即可引起高血压的发生。其中可能的机制为:呼吸暂停导致上呼吸道的塌陷,气流完全或部分停止,对阻塞的气道的每次强制吸气都会产生胸腔内负压,胸腔负压的增加会导致心脏内部和外部压力差增大,左心室透壁压(即左心室后负荷)增大;同时胸腔负压增加引起内脏血管扩张、静脉回流增加,进而导致右心室负荷过重;这些都引起了高血压的发生[14]。此外,胸腔压力间歇性改变、回心血量波动同样会刺激主动脉体和颈动脉窦压力感受器,引起交感神经兴奋,导致高血压的发生[15]。近期,Sun 等[16]一项对887 例OSAHS 患者的研究证实:补氧治疗仅可用于改善低氧血症和抑郁症状,对于降低AHI、改善高血压症状则效果较差;相反,应用持续气道正压通气同时纠正低氧血症、增加胸腔压力治疗则起到了较好的疗效。说明尽管OSAHS 引起的间歇性低氧血症是导致OSAHS 相关性高血压的重要原因,但OSAHS 引起的间歇性胸腔压力改变也是OSAHS 相关性高血压发生的重要影响因素,而且在致病过程中二者很可能存在叠加效应,这也是C组血压升高程度低于B组的原因所在。
关于本次动物实验研究的几点经验:(1)动物模型制备。上气道阻塞或腭咽肌群肌肉功能障碍导致的呼吸力学异常是OSAHS 产生的解剖学基础。根据实验研究的目的不同,国内外学者尝试了多种建模方法,但均不能同时模拟出人OSAHS 过程中出现的间歇性低氧血症和(或)高碳酸血症、胸腔压力波动和血流动力学改变、以及缺氧和压力波动时所致微觉醒引起的睡眠结构紊乱这3 个重要特征。目前应用最为普遍的OSAHS 动物模型是在电磁阀控制的间歇低氧箱内实现间歇性的低氧环境,模拟呼吸暂停时的间歇性低氧状态[17];但该过程的片面之处在于实验动物没有发生实质性的呼吸道阻塞,也就没有胸腔压力波动和呼吸力学、血流动力学的相应改变,且间断性缺氧的标准目前尚不统一,导致不同研究者的实验方案的重复性和可比性都较差。本研究以雄性新西兰长耳兔为研究对象,实验中应用OSAHS 动物模型的通气设备,成功使实验动物发生间歇性胸腔压力变化及间歇性低氧,在不同个体上实现统一的AHI 和胸腔压力波动,该动物模型制备容易操作、稳定性、可靠性高,易于重复,同时更加接近人OSAHS 的发病特征,并可在短时间内复制大量均一性的动物疾病模型,保证了研究的顺利完成,具有重要的科研价值。(2)实验动物的数量。受各方面条件的制约,本研究实验动物数量偏少,有可能会对实验结果造成一定的影响,在后续的研究中应进一步加大样本数量以获得更为准确的研究数据。
综上,笔者认为OSAHS 导致间歇性胸腔压力波动这一呼吸力学因素是OSAHS 相关性高血压的重要影响因素,其与间歇性低氧血症协同发挥作用产生了一系列病生理改变最终引起高血压,需要在未来的研究中对这一因素给予更多的重视,为下一步临床研究提供理论依据。
