Erastin 和BIBR1532 联合应用对胃癌细胞增殖的影响
2023-12-07杨秋慧郝名英刘思琪黄欣宇耿鑫
杨秋慧,郝名英,刘思琪,黄欣宇,耿鑫
(天津医科大学基础医学院生物化学与分子生物学系,天津 300070)
胃癌是常见的消化道恶性肿瘤之一,在我国的发病率和致死率仍呈现上升趋势,严重影响到国人的生命健康[1-2]。手术切除是早期胃癌的主要治疗方式,中期胃癌的治疗采用包括传统放化疗、靶向治疗和免疫治疗在内的综合治疗方法。靶向治疗联合化疗已成为晚期胃癌的一线治疗方案,但胃癌靶向药物的选择相对有限[3-4]。因此需要探索个性化治疗策略和更深层的分子机制来满足胃癌的治疗需求。
铁死亡是由氧化剂和抗氧化剂之间的氧化还原失衡引起的,由产生自由基和脂质氧化产物的多种氧化还原酶的活性或表达异常驱动的一种细胞死亡形式[5]。Erastin 可以诱导铁死亡并抑制肿瘤生长[6]。铁死亡可通过外源性和内源性两种途径激活,内在途径通过阻断细胞内抗氧化酶[如谷胱甘肽过氧化物酶(GPX4)]而被激活[7]。GPX4 是一种在其活性位点具有硒代半胱氨酸的硒蛋白,是铁死亡的关键调节因子[8-9]。抑制GPX4 会导致脂质过氧化,并可诱导铁死亡,从而抑制肿瘤细胞增殖[10]。GPX4 功能的丧失导致耐药细胞发生铁死亡,并防止小鼠肿瘤复发[11]。由于GPX4 在脂质过氧化过程中的关键作用,GPX4 已被确定为基于铁死亡的一个有希望的肿瘤治疗靶点[12]。
端粒由DNA 序列TTAGGG/AATCCC 的串联重复序列组成,位于真核生物线性染色体末端,保护天然DNA 末端不被识别为DNA 损伤[13]。端粒酶是一种特殊的核糖核蛋白逆转录酶,可以维持端粒的长度和稳定性[14]。端粒和端粒酶在各种肿瘤的异常细胞增殖、转移、干细胞维持和永生化中发挥重要作用。因此,设计靶向端粒酶和端粒的药物具有重要意义[15]。
本研究旨在探究Erastin 和BIBR1532(端粒酶抑制剂)联合应用对胃癌细胞增殖的影响。
1 材料与方法
1.1 主要试剂和仪器 人胃腺癌细胞BG823、DMEM 培养基、胎牛血清、胰蛋白酶(美国Biological Industries 公司);SLC7A11 抗体(A2413,武汉爱博泰克生物科技有限公司);GPX4 抗体(A1933,武汉爱博泰克生物科技有限公司);hTERT 抗体(ab32020,美国abcam 公司);GAPDH 抗体(10494-1-AP,Proteintech);HPR 标记羊抗兔抗体(SA00001-2,Proteintech);HPR 标记羊抗鼠抗体(SA00001-1,Proteintech);BCA 蛋白定量试剂盒(PC0020,北京索莱宝科技有限公司);多聚甲醛固定液(E672002-0500,上海生工生物);CCK8(C3007,中国碧云天生物技术有限公司);PVDF 膜(EZWB05-ISEQ00010-1,德国Merck Millipore 公司);Erastin(571203-78-6)、BIBR1532(321674-73-1),均购自美国MCE 公司。CO2恒温培养箱购自美国赛默飞公司;酶标仪购自美国Thermo Fisher Scientific 公司;低温高速离心机购自德国Eppendorf 公司;垂直电泳系统购自美国Biorad 公司;-80℃冰箱购自美国Thermo Fisher Scientific 有限公司;超净工作台购自江苏通净净化设备有限公司;纯水机购自德国Merck Millipore公司。
1.2 方法
1.2.1 在TIMER2.0 和GEPIA2.0 数据库中分析GPX4 在胃癌中的表达情况 TIMER2.0(http://timer.cistrome.org/)由3 个主要部分组成:免疫、探索和估计。免疫组件包含4 个模块,允许用户研究TCGA 队列中估计的免疫浸润与基因表达、体细胞突变、体细胞拷贝数改变和临床结果之间的关联。探索组件有4 个模块,允许用户在TCGA 中找到与肿瘤之间的关联[16]。本文通过此数据库分析不同肿瘤类型中GPX4 mRNA 表达情况,在Gene_DE 的选项中输入基因名GPX4 并分析其在乳腺癌组织和正常乳腺组织中mRNA 的表达情况。
GEPIA2.0(http://gepia2.cancer-pku.cn/#index)是基于TCGA 和GTEx 数据的基因表达谱交互式分析工具,包括差异表达分析、图谱绘制、相关性分析、患者生存分析、相似基因检测和降维分析[17]。本文在GEPIA2.0 数据库中获得GPX4 基因与正常组织的差异基因表达分析,其中|log2FC|>1,P<0.01。同时运用此数据库分析了GPX4 mRNA 表达水平与胃癌患者预后的关系,P<0.05 具有统计学意义。
1.2.2 细胞培养及传代 BG823 细胞用含有10%FBS 的DMEM 培养基培养,培养基中含1%青-链霉素,置于5%CO2、37℃培养箱中培养,待细胞融合至90%左右,用0.25%胰蛋白酶消化细胞并传代。
1.2.3 药物配置 10 mg Erastin 溶于1.828 mL DMSO 中,配制为10 mmol/L 储存液。10 mg BIBR1532溶于3.02 mL DMSO 中,配制为10 mmol/L 储存液。细胞培养液将其稀释为实验所需浓度。
1.2.3 Western 印迹实验 取对数生长期BG823 接种于6 孔板,细胞贴壁后加药处理48 h,将RIPA、磷酸蛋白酶抑制剂、蛋白酶抑制剂以100∶2∶1 配置裂解液,提取细胞总蛋白。使用BCA 试剂盒检测蛋白浓度。配置12%的分离胶,在12%SDS-PAGE 凝胶上电泳分离等量的蛋白质提取物,电泳后将蛋白转印到PVDF 膜,在封闭缓冲液中孵育2 h,随后加入特异性一抗(GAPDH 1∶10 000,SLC7A11 1∶1 000,GPX4 1∶1 000,TERT 1∶1 000),4℃孵育过夜,TBST 漂洗3 次,每次10 min,加入二抗(1∶10 000)室温孵育2 h,TBST 漂洗3 次使用化学发光试剂进行检测。将目的蛋白与内参的灰度比值作为蛋白的相对表达丰度。
1.2.4 CCK-8 实验 取对数生长期BG823 细胞接种于96 孔板,每组设立6 个复孔,细胞贴壁后加药处理48 h,药物处理结束后更换含10%FBS 的DMEM 培养基。连续检测4 d 细胞增殖情况,每天给细胞更换新鲜的培养基100 μL 并加入10 μL CCK-8 溶液,敷箱内避光孵育1 h,用酶标仪检测细胞在450 nm 处的吸光值并绘制其生长曲线。
1.2.5 克隆形成实验 取对数生长期的BG823 细胞接种于六孔板,细胞贴壁后加药持续培养两周,去除培养液,PBS 清洗,4%的多聚甲醛固定,然后加入结晶紫染液,常温放置10 min,PBS 清洗后拍照,记录实验结果。
1.2.6 端粒酶活性检测实验 每个实验组1×106个细胞,PBS 洗涤后将细胞重新悬浮在100 μL CHAPS裂解液中,冰上裂解40 min,4℃,16 000×g,离心40 min,取1 μL 产物用于后续PCR。PCR 产物在12%非变性聚丙烯酰胺凝胶(加入核酸染料)上分离,通过UVP 成像系统观察。荧光密度通过Image J定量分析。
1.3 统计学处理 GraphPad Prism 9.0 进行数据分析和作图。所有实验均已重复3 次,数据符合正态分布,采用t 检验进行差异分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 GPX4 是胃癌的致癌基因 本研究在TIMER2.0数据库中比较GPX4 mRNA 在胃癌组织(n=415)和正常胃黏膜组织(n=35)的差异表达,结果显示GPX4 在胃癌组织中的表达明显高于正常胃黏膜组织(P<0.01)(图1A)。同时也通过GEPIA2.0 数据库比较了胃癌组织和相应的正常胃黏膜组织中GPX4 mRNA 的表达差异,胃癌组织(n=408)中GPX4 mRNA 明显高于正常胃黏膜组织(n=211)(图1B)。GEPIA2.0 数据库分析结果表明GPX4 高表达的胃癌患者生存时间缩短(HR=1.5,P=0.021)(图1C)。
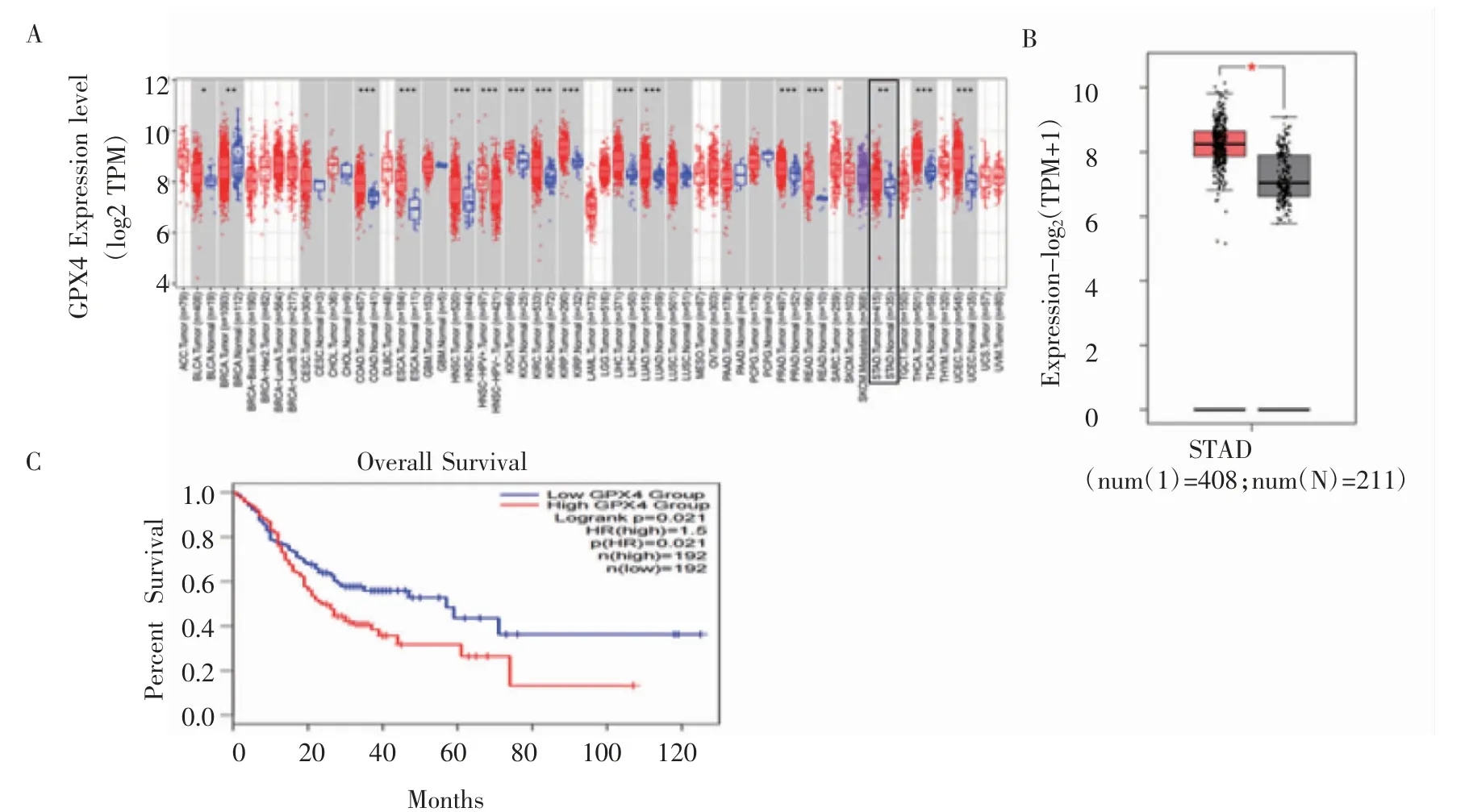
图1 GPX4 是胃癌的致癌基因Fig 1 GPX4 is a oncogenic gene in GC
2.2 GPX4 直接结合蛋白的预测分析 STRING 蛋白相互作用网络分析显示,GPX4 蛋白相互作用网络包括TERT、SLC7A11、PINX1、HSP90AA1、DKC1、S LC3A2、SMARCA4、PIF1、CTNNB1、WRAP53、SMG6、RUVBL1(图2)。
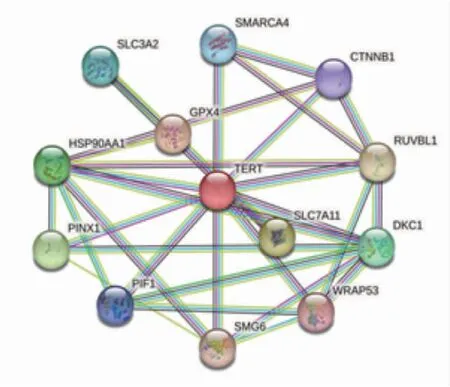
图2 STRING 数据库分析GPX4 蛋白相互作用网络Fig 2 The GPX4 protein interaction network was analyzed by STRING database
2.3 Erastin 对GPX4、端粒酶活性及TERT 蛋白表达量的影响 Western 印迹实验结果显示,与对照组相比,10、20 μmol/L Erastin 处理后BG823 细胞内SLC7A11、GPX4 蛋白表达量均明显降低(t=7.435、6.832、7.329、7.117,均P<0.01),TERT 蛋白表达量也出现降低(t=3.599、8.144,均P<0.05),见图3A。TRAP实验结果显示,与对照组相比,10、20 μmol/L Erastin处理后细胞内端粒酶活性降低(t=34.29、14.28,均P<0.001),见图3B。
2.4 Erastin 及BIBR1532 对端粒酶活性及TERT 蛋白表达量的影响 TRAP 实验结果显示,与对照组相比,20、50、75 μmol/L BIBR1532 处理细胞48 h 后端粒酶活性均降低(t=10.03、29.79、18.86,均P<0.001),见图4,其中75 μmol/L BIBR1532 对端粒酶活性抑制能力最强,75 μmol/L BIBR1532 与10、20 μmol/L Erastin 联合使用后端粒酶活性降低更明显(t=9.931,P<0.001;t=2.543,ns),见图5。Western 印迹结果显示,与对照组相比,10、20 μmol/L Erastin 及75 μmol/L BIBR1532 处理后TERT 蛋白表达量均降低(t=3.745、6.592、8.248,均P<0.05),Erastin 和BIBR1532 联合处理细胞后TERT 蛋白表达量降低更明显(t=4.918、4.483,均P<0.05),见图6。

图4 BIBR1532 处理后BG823 细胞内端粒酶活性Fig 4 Telomerase activity of BG823 cells after BIBR1532 treatment

图6 Erastin 及BIBR1532 处理后BG823 细胞内hTERT 蛋白表达情况Fig 6 hTERT protein expression of BG823 cells after Erastin and BIBR1532 treatment
2.5 Erastin 与BIBR1532 联合使用对细胞生长增殖能力的影响 克隆形成实验和CCK8 实验结果显示,与对照组相比,10 μmol/L Erastin 和75 μmol/L BIBR1532处理后细胞生长增殖能力减弱(t=8.662、4.943、27.88、18.95,P<0.01)。两种药物联合使用后细胞增殖能力进一步减弱(t=4.157、25.46,P<0.05),见图7。

图7 Erastin 及BIBR1532 处理后各组细胞生长增殖情况Fig 7 Growth and proliferation of cells in each group after treatment with Erastin and BIBR1532
3 讨论
晚期胃癌患者可以明显受益于化疗,包括阿霉素、铂类药物、5-氟尿嘧啶、长春新碱、紫杉醇以及靶向治疗药物。然而,原发性耐药或获得性耐药最终会导致胃癌患者治疗失败和不良愈后[18-20]。因此,迫切需要开发有效的胃癌治疗方法。本研究证实GPX4 在胃癌组织中高表达,并与胃癌患者不良预后相关,提示GPX4 可能是胃癌的致癌基因。已有研究报道GPX4在肿瘤中的表达增加与肿瘤的发生和转移显著相关[21]。弥漫性大B 细胞淋巴瘤和肾细胞癌特别容易受到GPX4 调节的铁死亡的影响。早期的研究发现耐药肿瘤细胞具有GPX4 依赖性,GPX4 功能的丧失导致耐药细胞铁死亡[11]。
铁死亡是一种铁依赖性的调节性细胞死亡,由脂质过氧化物的积累引起,抗氧化酶GPX4 有助于清除毒性脂质过氧化物,抑制GPX4 可以促进铁死亡发生[22]。氧化还原环境的改变使肿瘤细胞更容易发生铁死亡,因此肿瘤细胞更容易依赖GPX4[23-24]。Erastin 是一种经典的铁死亡激动剂,通过抑制系统Xc-的功能,从而导致GSH 耗竭和GPX4 失活,最终引起铁死亡[25]。本研究证实了Erastin 可以抑制胃癌细胞中GPX4 表达,诱导铁死亡发生,使胃癌细胞增殖能力减弱。Erastin 诱导的铁死亡涉及一系列独特的形态学、生物化学和遗传特征,与凋亡、坏死和自噬不同[26]。研究报道抑制半胱氨酸的摄入和GPX4 失活都会导致脂质过氧化物增多,从而造成细胞死亡[27]。另有研究表明丹参酮ⅡA 引发的胃癌细胞铁死亡为胃癌干预提供了新证据[28]。诱导铁死亡可能有助于发现新的肿瘤治疗策略[29]。
端粒是真核细胞染色体末端TTAGGG 核苷酸的串联重复序列。它们能够保持染色体完整性和基因组稳定性[13]。端粒缩短会导致细胞衰老或凋亡[30-31]。由于染色体端粒缩短,绕过细胞凋亡的持续细胞分裂可能导致基因组不稳定和肿瘤发生[32]。端粒酶是一种RNA 依赖性DNA 聚合酶,通过在染色体末端添加TTAGGG 延长端粒[33]。由于TERT 基因催化亚基受到严格的转录抑制,故大多数正常人体细胞缺乏端粒酶活性。然而在高达90%的人类恶性肿瘤中观察到TERT 表达和端粒酶激活,TERT 由于在肿瘤发生过程中的关键作用以及在肿瘤细胞中的普遍特异性表达而成为理想的抗癌靶点[15]。越来越多的证据表明TERT 参与细胞氧化还原代谢的调节,但TERT 和铁死亡之间的联系机制尚未可知。研究表明在小鼠肺上皮细胞中TERT 通过SLC7A11 调节铁死亡[34]。STRING 数据库预测结果显示GPX4 可能与TRET存在相互作用。Erastin 在抑制GPX4 表达造成胃癌细胞铁死亡的过程中,会抑制端粒酶活性和TERT 蛋白表达量,但其具体作用机制还有待探究。BIBR1532是一种非核苷酸小分子化合物,通过与TERT 活性位点非竞争性结合选择性抑制端粒酶活性[35]。临床前研究表明,BIBR1532 在体内和体外均可促进肿瘤细胞生长停滞并增加细胞化学敏感性[36-37]。本研究发现BIBR1532 降低胃癌细胞端粒酶活性、TERT 蛋白表达量以及胃癌细胞增殖能力。有研究表明BIBR1532 会诱导乳腺癌细胞G2 期阻滞,从而促进细胞凋亡[36]。因此笔者认为端粒酶活性降低、TERT蛋白表达量下调可能降低了胃癌细胞增殖能力。与单独使用Erastin 相比,Erastin 和BIBR1532 联合应用使得胃癌细胞端粒酶活性和表达量进一步降低,导致胃癌细胞生长增殖能力进一步降低。
综上所述,GPX4 在胃癌组织中高表达,Erastin抑制胃癌细胞GPX4 表达的同时会降低端粒酶活性和TERT 蛋白表达量,导致细胞生长增殖能力减弱。联合使用Erastin 和端粒酶抑制剂BIBR1532,会导致胃癌细胞端粒酶活性和TERT 蛋白表达量进一步降低,细胞生长增殖进一步被抑制。
