线粒体自噬探讨5-Fu 心肌毒性及黄芪甲苷的干预机制
2023-12-06周湘忠杨书凤李玉捷陈立军魏刚
周湘忠 杨书凤 李玉捷 陈立军 魏刚
自噬是一种以包裹降解物形成自噬体输送到溶酶体进行消化的细胞内降解过程,起到细胞器更新、满足代谢需求以及保持细胞稳定的作用[1]。线粒体是细胞内氧化磷酸化的主要场所,可生成腺苷三磷酸(adenosine triphosphate,ATP),参与细胞增殖、衰老、稳态及凋亡等过程[2]。当机体处于缺血缺氧、氧化应激、营养物质缺乏等情况时,线粒体自噬则会被启动。5-氟尿嘧啶(5-fluorouocil,5-Fu)为抗代谢类化疗药物,其多应用治疗消化道肿瘤,特别是对只能进行药物化疗的老年患者具有重要治疗意义。有研究指出[3]5-Fu 体内的代谢产物F-cltrate 可应用于线粒体阻断三羧酸循环,降低ATP 的生成,使得线粒体膜通透性发生变化,最终导致线粒体功能异常。黄芪甲苷(Astragaloside Ⅳ,AS-Ⅳ)是黄芪的主要成分,现代药理学研究证明[4]AS-Ⅳ通过保护线粒体、抑制凋亡、减轻钙超载、保持内皮细胞自稳态、良好的抗脂质过氧化及清除氧自由基等途径参与心肌细胞的保护。但目前有关线粒体自噬途径的干预机制鲜少见研究报道。本研究从线粒体自噬角度探讨AS-Ⅳ对5-Fu 诱导心肌毒性的干预机制,现报道如下。
1 材料与方法
1.1 主要试剂、药物与仪器
氟尿嘧啶注射液(天津金耀氨基酸有限公司);AS-Ⅳ(Med Chem Express,纯度为98.0%);兔源LC3Ⅱ一抗(美国Proteintech Group 公司);Beclin1、Parkin、PINK1、LAMP 一抗(沈阳万类生物有限公司);LC3 一抗及辣根过氧化物酶标记的山羊抗兔二抗IgG(美国Cell Signaling Technology公司);美国Sigma-Aldrich Chemical Company];TUNEL 原位细胞凋亡检测试剂盒(美国ROCHE);线粒体ATP 及膜电位检测试剂盒(上海碧云天有限公司);细胞计数试剂盒-8(Cell Counting Kit-8,CCK-8,同仁化学研究所);多功能酶标仪(美国Bio-Rad 公司),光学显微镜及荧光显微镜(日本Nikon 公司),透射电镜(日本日立公司),凝胶成像分析系统(美国Bio-Rad 公司)。
1.2 实验细胞、培养
选8 周龄雄性SD 大鼠(200±20 g)20 只,由北京维通利华实验动物公司提供,许可证号:SCXK(京)2019-0006。通过腹膜内注射氨基甲酸乙酯麻醉大鼠,无菌条件下取出心室肌组织,用冷PBS灌注3 min 后切成小块。采用0.25%胰酶溶液反复消化小块,并应用10%胎牛血清的培养基终止消化,随后将细胞悬浮液过滤离心1 min。将获得的心肌细胞用含有10%胎牛血清的DMEM 培养基进行常规培养,细胞板置于37℃、5% CO2的培养箱内,当细胞生长、融合至≥80%时,采用0.25%胰酶消化传代,取对数生长期细胞开展后续研究。
1.3 细胞分组
将细胞分成5 组:A 组、B 组、C 组、D 组、E 组。其中,除A 组外其余四组均加入80 μL 5-Fu溶液构建5-Fu 心肌毒性模型,C 组、D 组、E 组均加入40 μmol/L AS-Ⅳ,另D 组、E 组分别加入线粒体自噬抑制剂1 μmol/L Mdivi-1 及激动剂0.1 μmol/L RAPA 进行处理。最后所有组均加入等量体积DMEM 和20%生理盐水进行培养。
1.4 CCK-8 检测细胞活力
采用细胞计数仪计数所制备细胞悬液中的细胞数目,接种于96 孔板,每孔100 μL,使每孔细胞数目至1×105个后,置于培养箱中常规培养12 h。各组按分组干预后,斜贴孔壁每孔加入10 μL 的CCK-8 溶液,继续在培养箱中孵育1.5 h,采用酶标仪检测450 nm 处的吸光度,评估细胞活力。
1.5 TUNEL 染色检测心肌细胞凋亡情况
细胞经爬片处理后,去除培养基,用PBS洗2 遍,爬片经固定、破膜、通透后,根据试剂盒说明书进行操作,室温孵育10 min 进行平衡处理,将配制好的TdT 孵育缓冲液37℃避光孵育1 h,利用4′,6-二脒基-2-苯基吲哚进行核染色,加抗荧光淬灭封片剂封片,荧光显微镜下观察心肌细胞凋亡情况。
1.6 线粒体ATP 检测心肌线粒体功能损伤情况
采用1.5 mL 离心管收集细胞,每管加入100 μL 热蒸馏水,在95℃热水浴中超声震碎。细胞悬液置于沸水浴10 min,取出涡旋混匀30 s。4℃下1 500 r/min 离心5 min,取上清液,按照线粒体ATP试剂盒说明书检测各组ATP 含量。
1.7 膜电位观察线粒体功能改变
利用阳离子荧光染料JC-1 进行线粒体膜电位检测,将细胞接种于24 孔板,细胞处理后,将细胞与JC-1 工作液在37℃避光孵育30 min,随后PBS洗2 次,荧光显微镜观察红色及绿色荧光,如膜电位较高时为红色,而膜电位降低为绿色,红绿荧光比值反映膜电位情况。
1.8 LC3Ⅱ免疫荧光染色检测线粒体自噬活性
各组按分组干预后,给予细胞固定、通透、封闭、一抗孵育、FITC 标记荧光二抗孵育、DAPI 染核后,于显微镜上观察。采用Image J软件进行阳性标记计数。
1.9 实时荧光定量聚合酶链反应(Real-time fluorescence quantitative polymerase chain reaction technology,RT-PCR)检测PINK1/Parkin 基因变化
使用1.5 mL 离心管收集细胞,每管加入1 mL Trizol 裂解液,提取总RNA,根据逆转录试剂盒说明书将总RNA 逆转为cDNA。将合成的cDNA 加入引物建立扩增体系,按RT-PCR 试剂盒说明书进行扩增,扩增条件:95℃,15 s,60℃,60 s,72℃,40 s,进 行35 个循环。采 用2-ΔΔCt方法处 理数据,并以GAPDH 作为内参计算各组PINK1、Parkin、Beclin1、LAMP、LC3 mRNA 水平。
1.10 蛋白质印迹(Western blot)检测PINK1/Parkin 通路蛋白表达
使用1.5 mL 离心管收集心肌细胞,每管加入RIPA 裂解液提取总蛋白。使用BCA 法定量、SDS-PAGE 电泳分离、转膜,4℃过夜孵育PINK1、Parkin、Beclin1、LAMP、COX-Ⅳ抗体(稀释度均为1∶500)及LC3 抗体(稀释度为1∶1 000),次日洗膜后以辣根过氧化物酶标记山羊抗兔IgG 抗体(稀释度为1∶1 000)继续孵育90 min。扫描胶片,采用Image J 软件进行相对定量分析,各目的蛋白以COX-Ⅳ(内参蛋白)校正。
1.11 统计学方法
2 结果
2.1 各组心肌细胞功能改变情况
CCK-8 检测结果显示,细胞存活率比较,A 组>D 组>C 组>E 组>B 组(P<0.05);TUNEL 染色检测结果显示,细胞凋亡率比较,E 组>B 组>C 组>D 组>A 组(P<0.05)。见表1。
表1 各组心肌细胞功能改变情况()Table 1 Changes of cardiomyocyte function in each group()
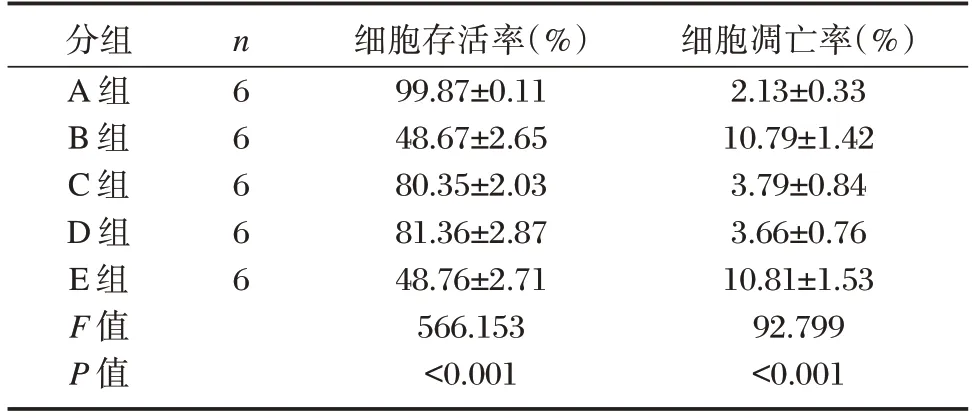
表1 各组心肌细胞功能改变情况()Table 1 Changes of cardiomyocyte function in each group()
2.2 各组线粒体功能改变情况
各组ATP 含量、膜电位比较,A 组>D 组>C 组>B 组>E 组(P<0.05)。见表2。
表2 各组线粒体功能改变情况()Table 2 Changes of mitochondrial function in each group()
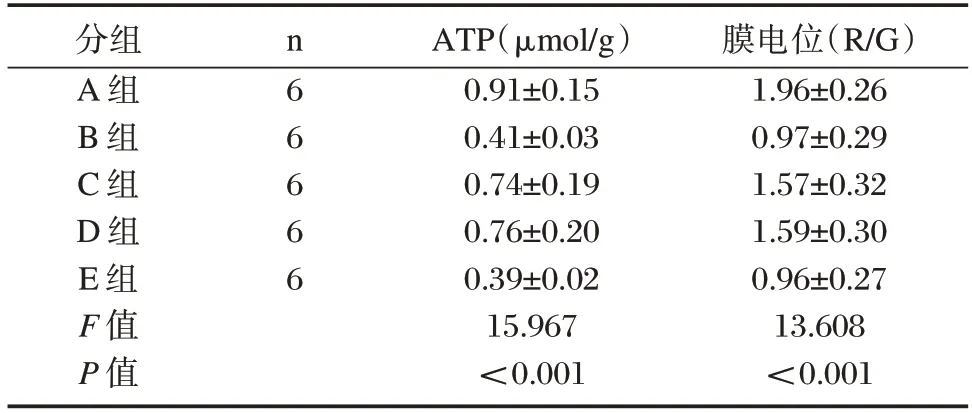
表2 各组线粒体功能改变情况()Table 2 Changes of mitochondrial function in each group()
2.3 各组细胞LC3Ⅱ表达水平比较
各组LC3Ⅱ表达水平比较,E 组>B 组>C 组>D组>A 组(F=38.130,P<0.05)。图1。
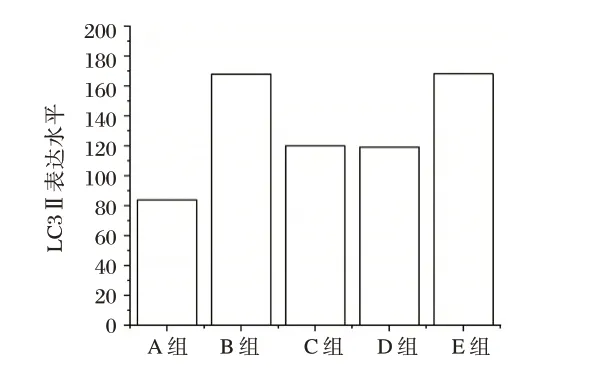
图1 各组心肌细胞LC3Ⅱ表达水平Fig. 1 LC3Ⅱexpression level of cardiomyocytes in each group
2.4 各组细胞PINK1/Parkin 通路相关mRNA 表达水平
各组Beclin1、PINK1、Parkin、LAMP及LC3Ⅱ/ⅠmRNA 相对表达量比较,E 组>B 组>C 组>D 组>A组(P<0.05)。见表3。
表3 各组细胞PINK1/Parkin 通路相关mRNA 表达水平()Table 3 mRNA expression levels related to PINK1/Parkin pathway in cells of each group()
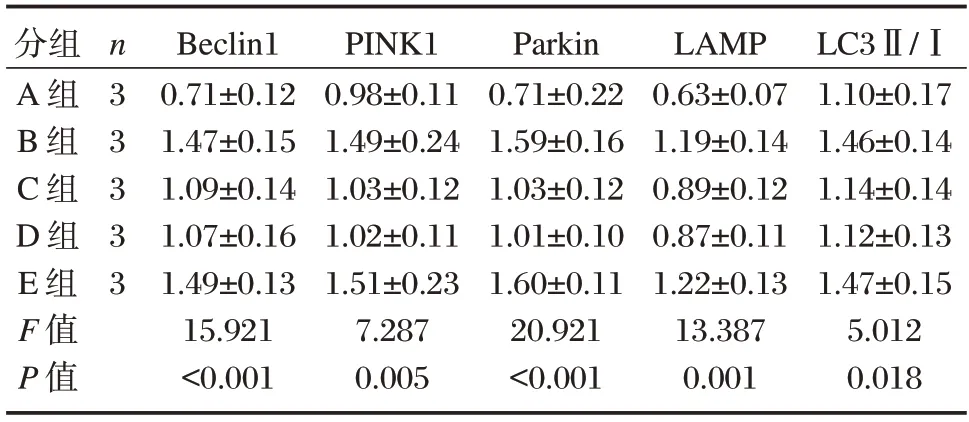
表3 各组细胞PINK1/Parkin 通路相关mRNA 表达水平()Table 3 mRNA expression levels related to PINK1/Parkin pathway in cells of each group()
2.5 各组PINK1/Parkin 通路相关蛋白表达比较
各 组Beclin1、PINK1、Parkin、LAMP 及LC3Ⅱ/ⅠmRNA 相对表达量比较,E 组>B 组>C 组>D组>A 组(F=16.824、8.167、23.291、14.622、6.571,P<0.05)。见图2。
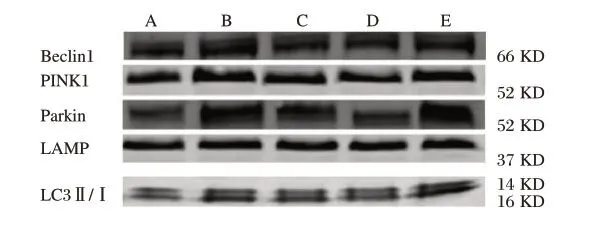
图2 各组PINK1/Parkin 通路相关蛋白表达Fig. 2 Expression of PINK1/Parkin pathway-related proteins in each group
3 讨论
心脏损伤是化疗药物的严重副作用之一,因此明确化疗药物心脏毒性的发生机制,对于降低化疗药物的不良影响以及治疗效果的改善具有重要意义。5-FU 已广泛应用于癌症治疗,但5-FU 所导致的心肌毒性发生率较高,可达20%~100%。本研究结果显示,与A 组相比,B 组的细胞活力、线粒体ATP 水平、膜电位均降低,凋亡率、LC3Ⅱ水平均升高,提示5-FU 可诱导心肌线粒体损伤,与既往研究[5]相符。5-Fu 导致的心肌毒性发病机制是多方面的,而线粒体损伤是一种机制假说,线粒体损伤会积累有缺陷的细胞器,导致线粒体自噬被启动[6]。自噬的激活通常被认为具有心脏保护性,但过度自噬会造成心肌损伤以及细胞凋亡[7]。黄芪具有益卫固表、补气健脾作用,其在临床已被应用于高龄、慢性疾病以及术后放化疗等患者[8]。AS-Ⅳ是黄芪的主要成分之一,研究表明[8]AS-Ⅳ通过激活一氧化氮合成酶产生一氧化氮,从而激活cGMP/PKG 信号通路,进一步使糖原合成酶激酶-3 失活,抑制线粒体通透性转换孔开放,发挥心肌线粒体保护作用。本研究结果显示,经AS-Ⅳ干预后,心肌细胞活力、线粒体ATP 水平、膜电位均高于B 组,凋亡率、LC3Ⅱ水平均低于B 组,提示AS-Ⅳ可减轻5-Fu 诱导的心肌线粒体损伤,与前期动物实验研究一致。因线粒体自噬抑制剂Mdivi-1与AS-Ⅳ作用类似,而线粒体自噬激动剂RAPA 增强了自噬的作用。本研究结果显示,与B 组相比,D 组的细胞活力、线粒体ATP 水平、膜电位均更高,凋亡率、LC3Ⅱ水平均更低,与AS-Ⅳ干预结果相似;而与C 组相比,E 组的细胞活力、线粒体ATP 水平、膜电位均降低,凋亡率、LC3Ⅱ水平均升高,表明过度的自噬会造成心肌损伤以及细胞凋亡。
PINK1/Parkin 信号通路与多种心血管疾病的发生发展密切相关[9]。既往研究表示[10-11]抑制线粒体自噬后可明显减少升主动脉缩窄引起的心肌纤维化。本研究结果显示,E 组的PINK1/Parkin 信号通路相关蛋白及基因表达升高,表明线粒体自噬参与了5-Fu 诱导的心肌毒性,而且线粒体可呈现自噬过度状态。当自噬激活时,LC3-Ⅰ与磷脂酰乙醇共价结合后形成LC3-Ⅱ,定位于自噬体膜,故LC3-Ⅱ/LC3-Ⅰ比值可反映自噬水平[12]。再灌注阶段自噬的激活与Beclin1 密切相关,Beclin1的表达受活性氧的诱导及抗凋亡蛋白Bcl-2 的负性调节,活性氧的积累会磷酸化Bcl-2 导致其从Bcelin1 复合体上分离出来,进一步激活自噬,故再灌注阶段自噬的激活会导致细胞损伤及凋亡的增高[13]。正常情况下的PINK1 表达极低,当线粒体损伤时会阻碍PINK1 进入线粒体内的过程,使其积累在线粒体外膜TOM 复合物上,PINK1 的积累可造成引起泛素和Mfn2 磷酸化,并随后募集E3 连接酶Parkin。Parkin 磷酸化可激活周围泛素化的蛋白,通过与LC3 特异性结合,最终激活PINK1/Parkin 介导的线粒体自噬[14]。此外,LAMP为溶酶体膜蛋白,可用于监测自噬体与溶酶体融合状态[15]。本研究结果显示,AS-Ⅳ干预后,Beclin1、PINK1、Parkin、LAMP 及LC3Ⅱ/Ⅰ蛋白及基因表达均降低,证实AS-Ⅳ可通过抑制线粒体自噬PINK1/Parkin 通路过度激活,维持自噬稳定状态,进而对心肌线粒体数量与质量的内稳态起到维持作用。
综上,AS-Ⅳ可能通过抑制线粒体自噬PINK1/Parkin 通路过度激活,减轻5-Fu 诱导的心肌线粒体损伤,为AS-Ⅳ治疗心肌损伤提供理论依据。
